Похожие презентации:
Щелочно-земельные металлы
1. Щелочно-земельные металлы
2.
Ве - амфотерный «сладкий»(1797г. Вокелен, 1828 Вёлер);
Mg – «магнезия»
(1808г. Дэви, 1829г. Бюсси);
Сa, Sr, Ba - «калькс», «стронциан»,
«тяжёлый» 1808г. Дэви;
Ra – «луч» 1898г. М. и П. Кюри.
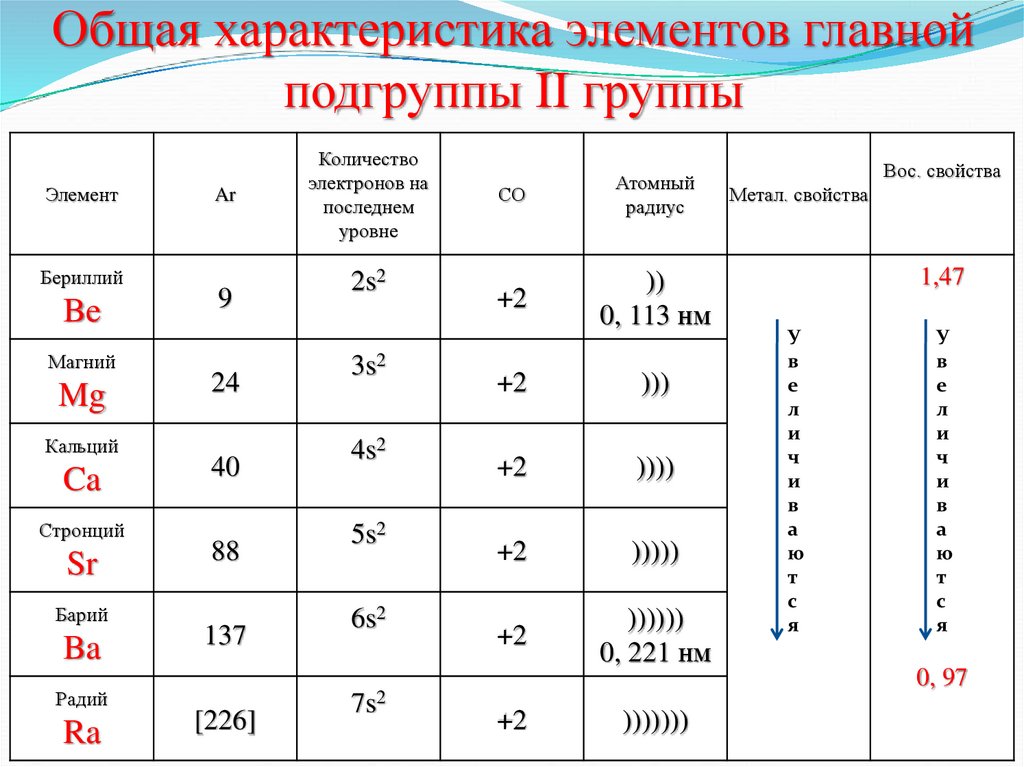
3. Общая характеристика элементов главной подгруппы II группы
ЭлементБериллий
Be
Магний
Mg
Кальций
Ca
Стронций
Sr
Барий
Ba
Радий
Ra
Ar
9
24
40
88
137
[226]
Количество
электронов на
последнем
уровне
2s2
3s2
4s2
5s2
6s2
7s2
СО
Атомный
радиус
+2
))
0, 113 нм
+2
)))
+2
))))
+2
)))))
+2
))))))
0, 221 нм
Вос. свойства
Метал. свойства
1,47
У
в
е
л
и
ч
и
в
а
ю
т
с
я
У
в
е
л
и
ч
и
в
а
ю
т
с
я
0, 97
+2
)))))))
4. Общая характеристика элементов главной подгруппы II группы
Одинаковое строение внешнегоэлектронного слоя – ns2
Элементы проявляют СО = 0; +2
Атомы элементов являются сильными
восстановителями;
С увеличением № элементов увеличивается
атомный радиус, увеличивается число
электронных слоев, возрастают
восстановительные свойства сверху вниз.
5.
Ca – твердый, пластичныйMg – относительно мягкий,
пластичный, ковкий
Be – светло-серый,
твердый, хрупкий
Sr – ковкий
6. Физические свойства ЩЗ металлов
ПлотностьТемпература
плавления
Температура
кипения
Li – 0,53
Be – 1,85
Li – 179
Be – 1283
Be – 2470
Na – 0,97
Mg – 1,74
Na – 897
Mg – 650
Mg – 1103
K – 0,86
Ca – 1,5
K – 63,5
Ca – 850
Ca – 1490
Rb – 1,53
Sr – 2,6
Rb – 39
Sr – 770
Sr – 1357
Cs – 1,87
Ba – 3,5
Cs – 28,5
Ba – 710
Ba – 1634
7. Химические свойства
8.
9. Химические свойства оксидов
BeO – амфотерный оксидMgO
CaO
SrO
BaO
Основные
оксиды
10.
1. С кислотами, образуя соль и воду:ВеO + 2HCl = ВеCl2 + H2O
2. Со щелочами, образуя соль и воду:
ВеO + 2KOH = K2ВеO2 + H2O
ВеO + 2KOH + H2O = K2(Ве(OН)4)
С водой амфотерные оксиды не реагируют!!!
11.
1. Взаимодействие с кислотами, собразованием соли и воды:
MgO + 2HCl = MgCl2 + H2O
2. С кислотными оксидами, образуя соли:
CaO + N2O5 = Ca(NO3)2
3. С водой:
СаO + H2O = Сa(OH)2
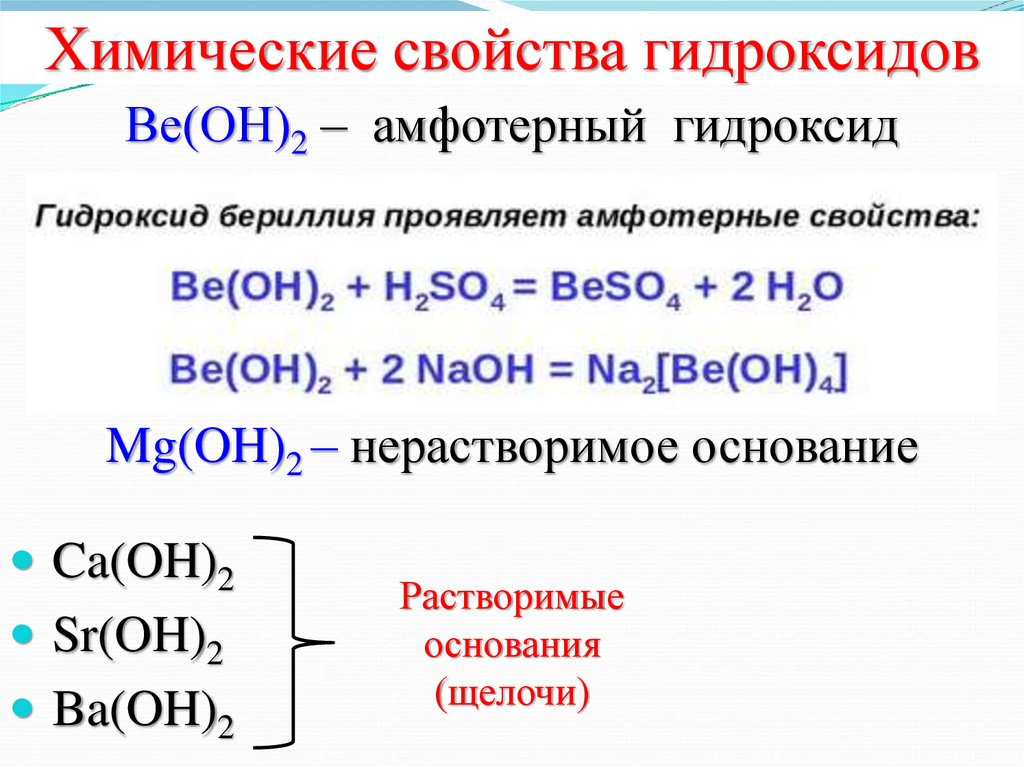
12. Химические свойства гидроксидов
Ве(ОН)2 – амфотерный гидроксидMg(OH)2 – нерастворимое основание
Ca(OH)2
Sr(OH)2
Ba(OH)2
Растворимые
основания
(щелочи)
13. Химические свойства
1. Изменяют окраску индикатора:Сa(OH)2 + фенолфталеин → малиновая окраска
Сa(OH)2 + лакмус → синяя окраска
Сa(OH)2 + метиловый оранжевый → желтый
2. Взаимодействие с кислотными оксидами:
Сa(OH)2 + CO2 = СаCO3 + H2O
3. Взаимодействие с кислотами:
Сa(OH)2 + 2HCl → СaCl2 + 2H2O
4. Взаимодействуют с растворами солей:
2FeCl3 + 3Сa(OH)2 → 2Fe(OH)3↓ + 3СaCl2













 Химия
Химия








