Похожие презентации:
Кислород. Сера
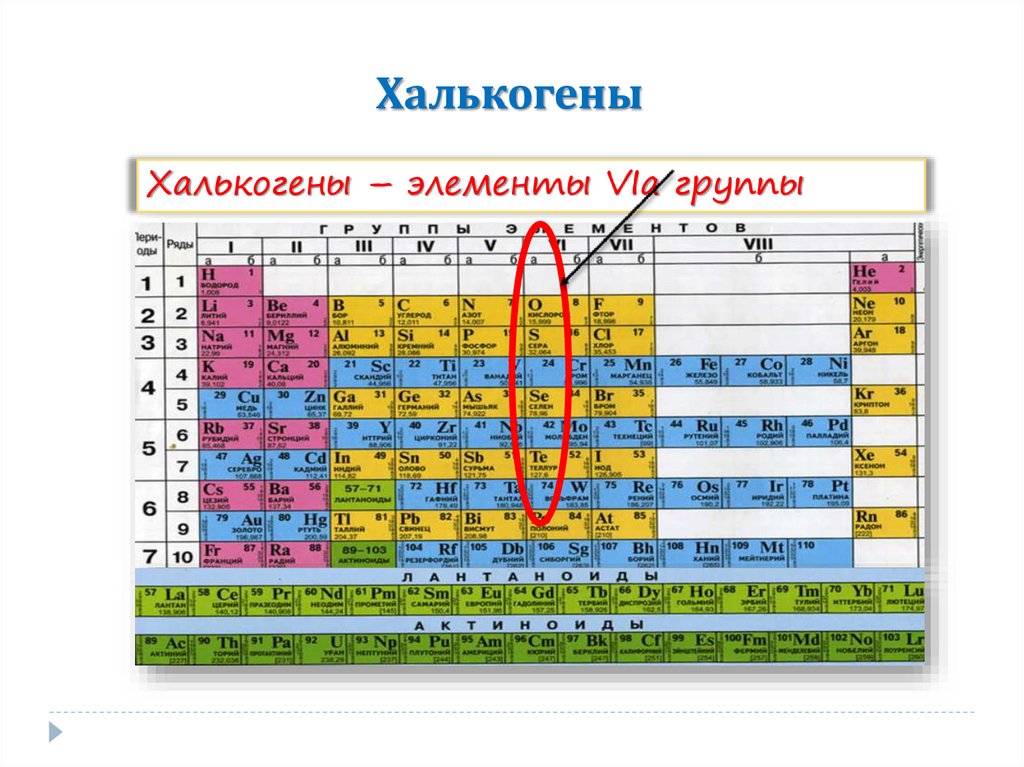
1. Халькогены
Халькогены – элементы VIа группы2. Строение атомов и степени окисления
Халькогены – элементы главной подгруппы VI группы.На внешнем энергетическом уровне они содержат по 6 электронов.
У атомов всех халькогенов, кроме кислорода, в возбужденном состоянии увеличивается
количество неспаренных электронов, поэтому они могут проявлять степени окисления
+4 и +6.
O: 2s22p4
S, Se, Te: ns2 np4 nd0
+6
SO3, H2SO4
+4
SO2, H2SO3
+2
SCl2
+2
OF2
+1
O2F2
0
O2, O3
0 S
-1
H2O2, Na2O2
-1 FeS2
-2
O2-
-2 H2S, S2-
3. Простые вещества
Способы получения кислорода и серы1) В промышленности
Кислород для промышленных нужд выделяют из воздуха, часть кислорода получают
электролизом воды.
эл.ток
2H2O
2H2 + O2
Серу получают из самородков, а также путем переработки сульфидных руд и сероводорода.
2) В лаборатории
Кислород в лаборатории можно получить при разложении:
а) нитратов: 2KNO3 → 2KNO2 + O2
б) хлоратов: 2KClO3










 Химия
Химия








