Похожие презентации:
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
1. Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ. Озон,
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИРОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«ВЯТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Институт химии и экологии
Кафедра фундаментальной химии и методики обучения химии
Кислород. Строение молекулы кислорода.
Получение кислорода. Взаимодействие с
кислородом простых и сложных веществ.
Озон, фотохимия озона, разрушение
озонового слоя в атмосфере.
Выполнил: студент группы ХМб-4501
Мартынов Михаил1
2.
23. Нахождение халькогенов в природе
• Кислорода в земной коре примерно 47,4% (1-еместо по распространению в земной коре), в
атмосфере – 20,95%.
3
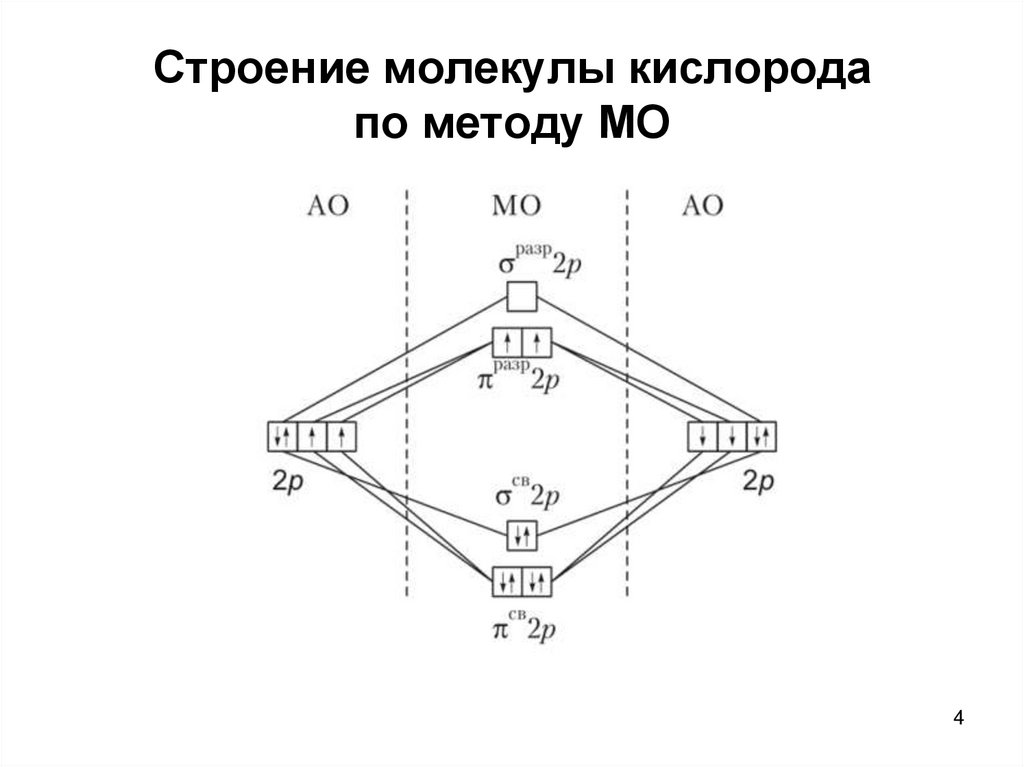
4. Строение молекулы кислорода по методу МО
45. Строение молекулы кислорода по методу МО
• Величина парамагнетизма молекулыкислорода отвечает наличию двух
непарных электронов: КК (σ2sсв)2
(σ2sразр)2 (σ2рz св)2 (π2рх,y св)4 (π2рy разр)1
(π2рх разр)1
• В молекуле О2 на 8 связывающих
электронов приходится 4 разрыхляющих,
поэтому порядок связи в ней равен 2
5
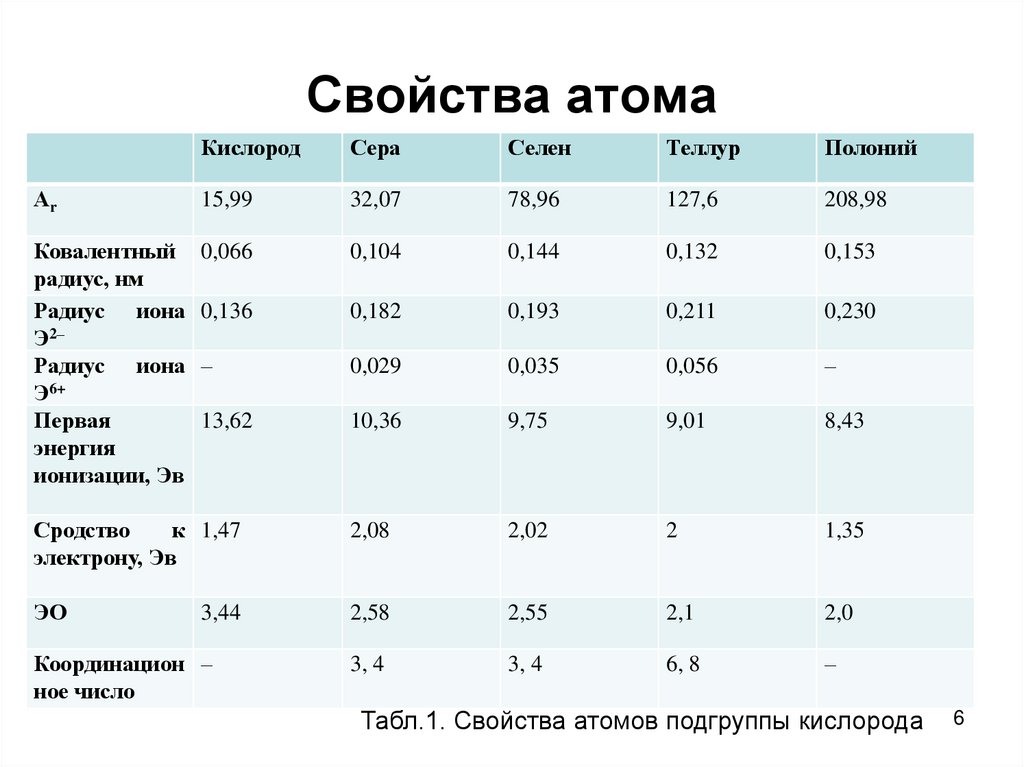
6. Свойства атома
КислородСера
Селен
Теллур
Полоний
Аr
15,99
32,07
78,96
127,6
208,98
Ковалентный
радиус, нм
Радиус иона
Э2–
Радиус иона
Э6+
Первая
энергия
ионизации, Эв
0,066
0,104
0,144
0,132
0,153
0,136
0,182
0,193
0,211
0,230
–
0,029
0,035
0,056
–
13,62
10,36
9,75
9,01
8,43
Сродство
к 1,47
электрону, Эв
2,08
2,02
2
1,35
ЭО
2,58
2,55
2,1
2,0
3, 4
3, 4
6, 8
–
3,44
Координацион –
ное число
Табл.1. Свойства атомов подгруппы кислорода
6
7. Изотопы кислорода
• Кислород – 3 стабильных изотопа: 16О (99,759%), 17О(0,037%) и 18О (0,204%). Искусственно получены 14О, 15О, 19О,
период полураспада которых исчисляется десятками секунд
7
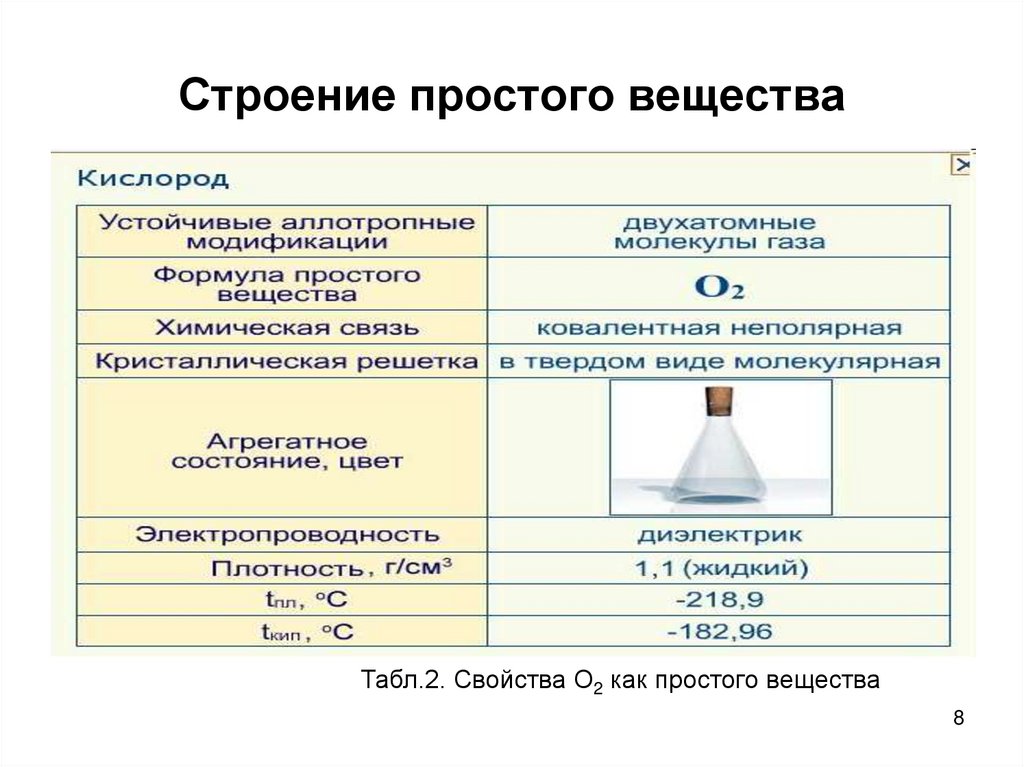
8. Строение простого вещества
Табл.2. Свойства О2 как простого вещества8
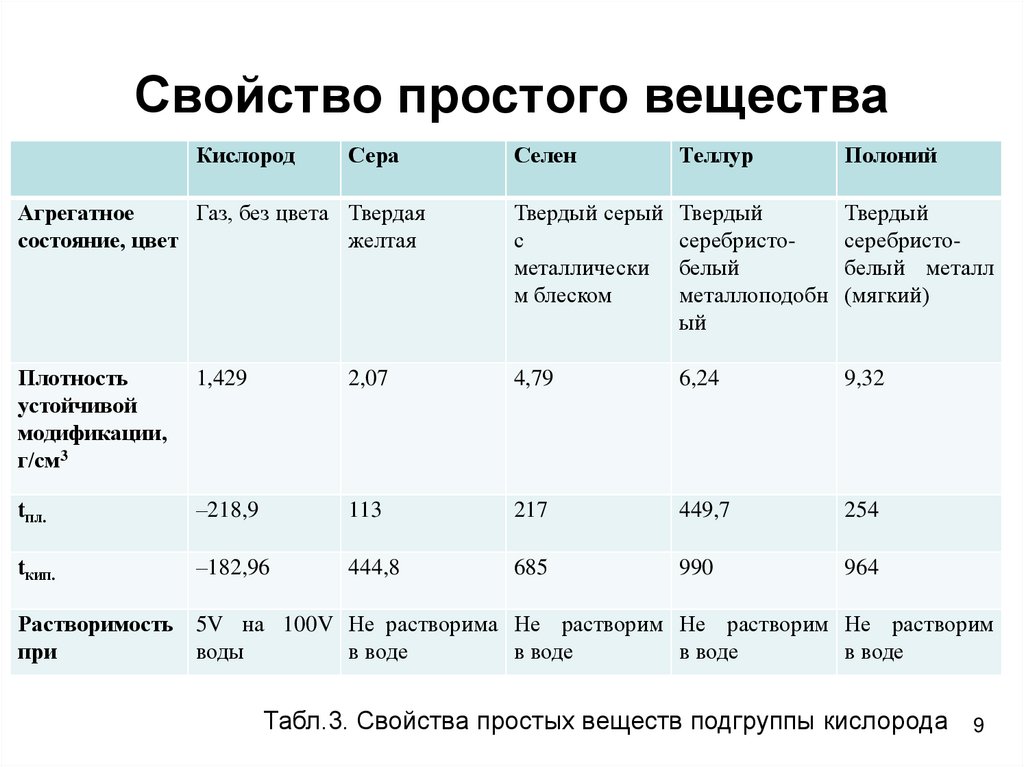
9. Свойство простого вещества
КислородСера
Селен
Теллур
Полоний
Агрегатное
Газ, без цвета Твердая
состояние, цвет
желтая
Твердый серый
с
металлически
м блеском
Твердый
серебристобелый
металлоподобн
ый
Твердый
серебристобелый металл
(мягкий)
Плотность
устойчивой
модификации,
г/см3
1,429
2,07
4,79
6,24
9,32
tпл.
–218,9
113
217
449,7
254
tкип.
–182,96
444,8
685
990
964
Растворимость 5V на 100V Не растворима Не растворим Не растворим Не растворим
при
воды
в воде
в воде
в воде
в воде
Табл.3. Свойства простых веществ подгруппы кислорода
9
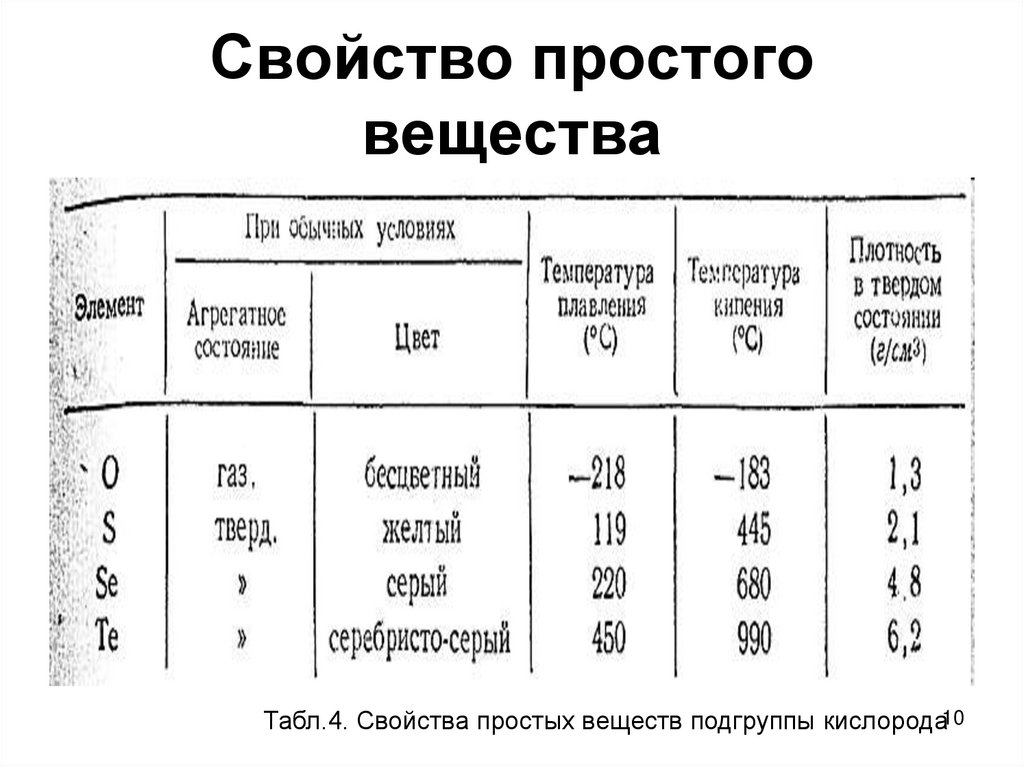
10. Свойство простого вещества
Табл.4. Свойства простых веществ подгруппы кислорода1011. Получение кислорода Промышленные способы получения
• из атмосферного воздуха• Кислород получают ректификацией
жидкого воздуха.
• tкип(О2) = –183оС;
tкип(N2) = –196оС
11
Рис.1. Жидкий кислород
Рис.2. Жидкий азот
12. Лабораторные способы получения кислорода
Термическое разложении богатыхкислородом веществ:
• 2KMnO4 t K2MnO4 + MnO2 + O2
• 2KNO3 t 2KNO2 + O2
• 2KClO3 МnO2 2KCl + 3O2 (при нагревании)
• 2HgO t 2Hg + O2
• 2H2O2 МnO2 2H2O + O2 (при нагревании)
12
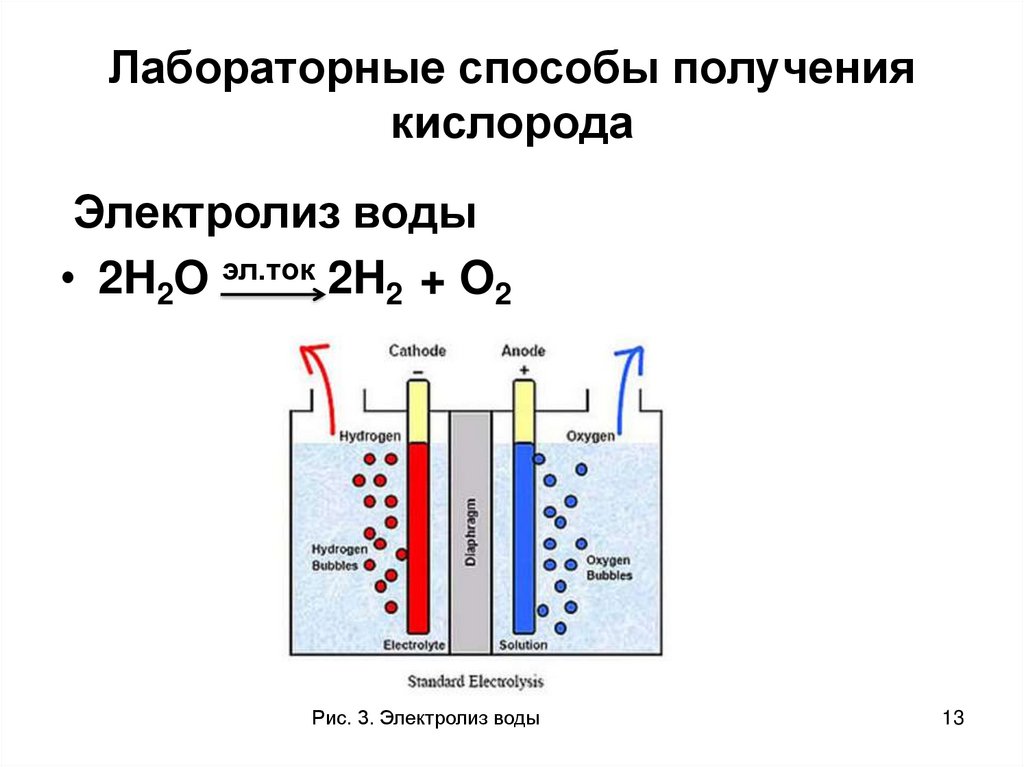
13. Лабораторные способы получения кислорода
Электролиз воды• 2H2O эл.ток 2H2 + O2
Рис. 3. Электролиз воды
13
14. Химические свойства простых веществ Окислительные свойства простых веществ
• 1) Реакции с простыми веществами:• а) O2 с неметаллами (водород, азот, фосфор, углерод и
др.)
В ходе реакции азота и кислорода поглощается
тепловая энергия (теплота) 180,5 кДж
O2 + N2 ⇄ 2NO - Q (t ≈ 2000 °C (или ϟ), р, kat = Pt, MnO2)
Сера взаимодействует с кислородом при 250°С:
S + O2 = SO2
Горение фосфора с образованием оксида фосфора (V)
начинается при 60 °С:
4Р + 5О2 = 2Р2О5
Графит реагирует с кислородом при 700-800 °С:
14
С + О2 = СО2
15. Химические свойства простых веществ Окислительные свойства простых веществ
• 1) Реакции с простыми веществами:• а) O3 с неметаллами (водород, азот, углерод и др.)
Озон не реагирует с молекулярным азотом при
комнатной температуре, но при 295°С вступает с ним в
реакцию:
N2+O3=N2O+O2
Озон реагирует с углеродом при нормальной
температуре с образованием диоксида углерода:
2C+2O3=2CO2+O2
Озон реагирует с водородом с образованием воды и
кислорода
O3+H2=H2O+O2
15
16. Окислительные свойства простых веществ
• б) с металлами (кислород с литием, натрием,калием, железом, сера с железом, алюминием)
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
4Al + 3O2 → 2Al2O3;
3Fe + 2O2 → Fe3O4
2Ag + O3 → Ag2O + O2 (в отличие от кислорода)
К + О3 → КО3 (озонит калия)
NaO3 и LiO3 могут быть получены действием CsO3 в
жидком NH3 на ионообменные смолы, содержащие
ионы Na+ или Li+
СsO3+Na+=Cs++NaO3
16
17. Окислительные свойства простых веществ
2) Реакции со сложными веществами
2Fe(OH)2 + O2 → 2FeO(OH)2↓
4Fe + 3O2 + 6H2O → 4Fe(OH)3↓
2Mn(OH)2 + O2 + 2H2O → 2Mn(OH)4
4NH3 + 3O2 = 2N2 + 6H2O
2H2S + 3О2 → 2H2О + 2SО2(избыток О2)
2H2S + О2 → 2S + 2H2О(недостаток О2)
17
18. Окислительные свойства простых веществ
• 2) Реакции со сложными веществами4О3 + 4КОН → 4КО3 + О2 + 2Н2О (рубидий, цезий)
Из раствора иодида калия озон выделяет иод:
O3 + 2KI + H2O → I2↓ + O2↑ + 2KOH
(качественная реакция на озон)
Озон может быть использован для
удаления железа и марганца из воды (жесткость) с
образованием осадка (соответственно гидроксида
железа(III) и диоксигидрата марганца), который
может быть отделён фильтрованием:
18
19. Окислительные свойства простых веществ
В газовой фазе озон взаимодействуетс сероводородом с образованием диоксида
серы:
H2S + О3 → H2О + SО2
В водном растворе проходят две
конкурирующие реакции с сероводородом,
одна с образованием элементарной серы,
другая с образованием серной кислоты:
H2S + О3 → H2О + S+О2
19
3H2S + 4О3 → 3H2SО4
20. Восстановительные свойства кислорода
2021. Жидкий кислород
Рис.3. Жидкий кислород. Хранение21
22. Озон
• Озон (от греч. «озо» пахнуть) – синий газ с резкимзапахом, жидкий озон – темно-синий, твердый –
черный. tпл = –192,7°C, tкип. = –111,9°C. Он
взрывчат, особенно в жидком и твердом
состоянии. Растворимость озона в воде
значительно больше, чем кислорода: 100 объемов
воды при 0°C растворяют 49 объемов озона
• Озон получают (лабораторно) из кислорода
действием тихих электрических разрядов в
приборах озонаторах: 3О2 = 2О3 – 285 кДж
22
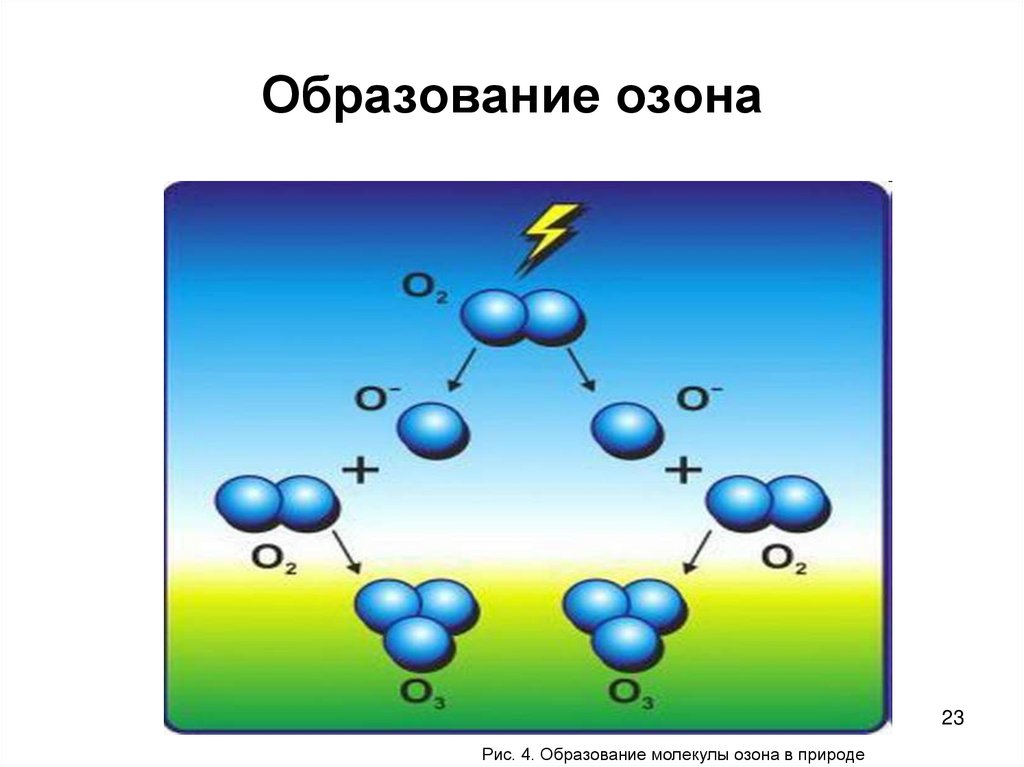
23. Образование озона
23Рис. 4. Образование молекулы озона в природе
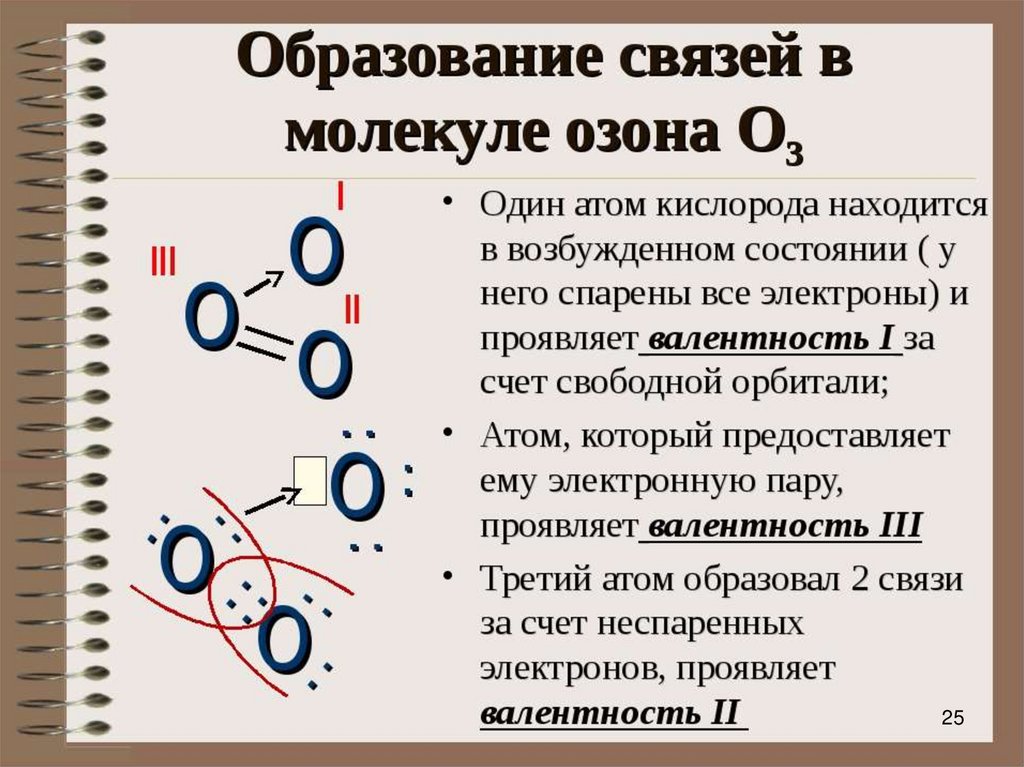
24. Образование молекулы озона
• Центральный атом связан с крайними атомамидвумя ковалентными связями. Дополнительно
образуется трёхцентровая связь, электронная
плотность которой распределена между всеми тремя
атомами.
Рис. 4.1. Образование молекулы озона в природе
24
25.
2526. Фотохимия озона
• Для видимого света и для излучения вближней ультрафиолетовой области
кислород практически прозрачен,
однако в дальней ультрафиолетовой
области (160-240 нм) кислород сильно
поглощает свет.
26
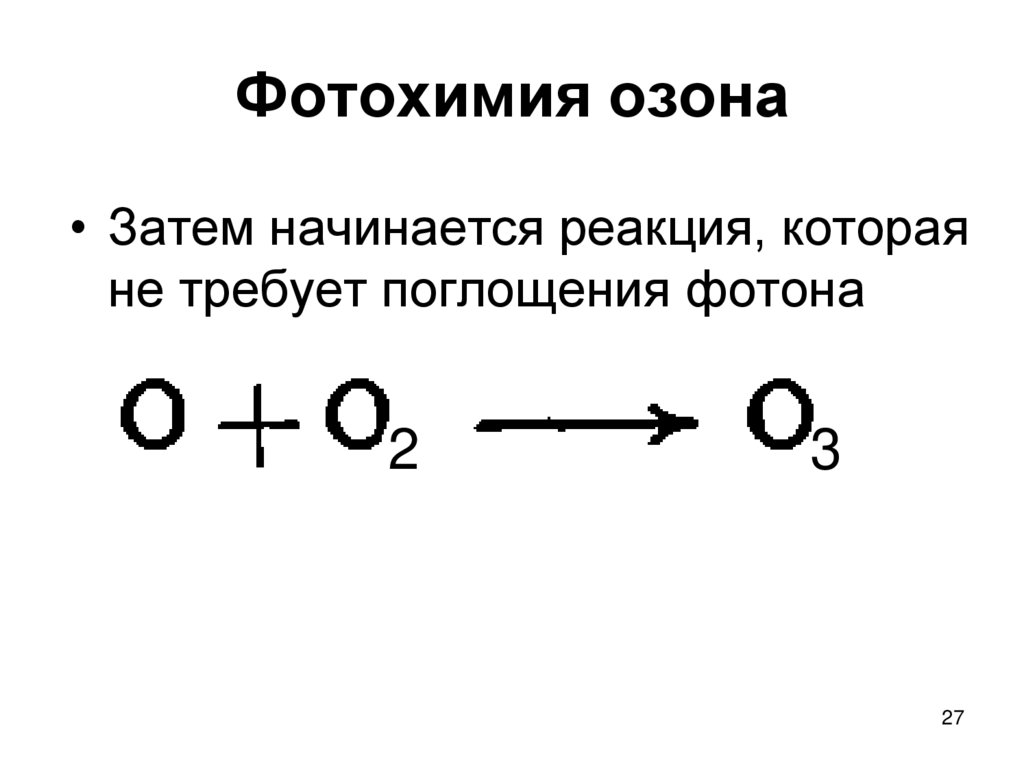
27. Фотохимия озона
• Затем начинается реакция, котораяне требует поглощения фотона
2
3
27
28. Фотохимия озона
• Таким образом, в результатепоглощения одного фотона образуются
две молекулы озона Оз. Вместе с тем
молекулы озона могут распадаться в
результате фотохимической реакции
при соединении с атомами кислорода. В
этом случае идет следующая реакция:
28
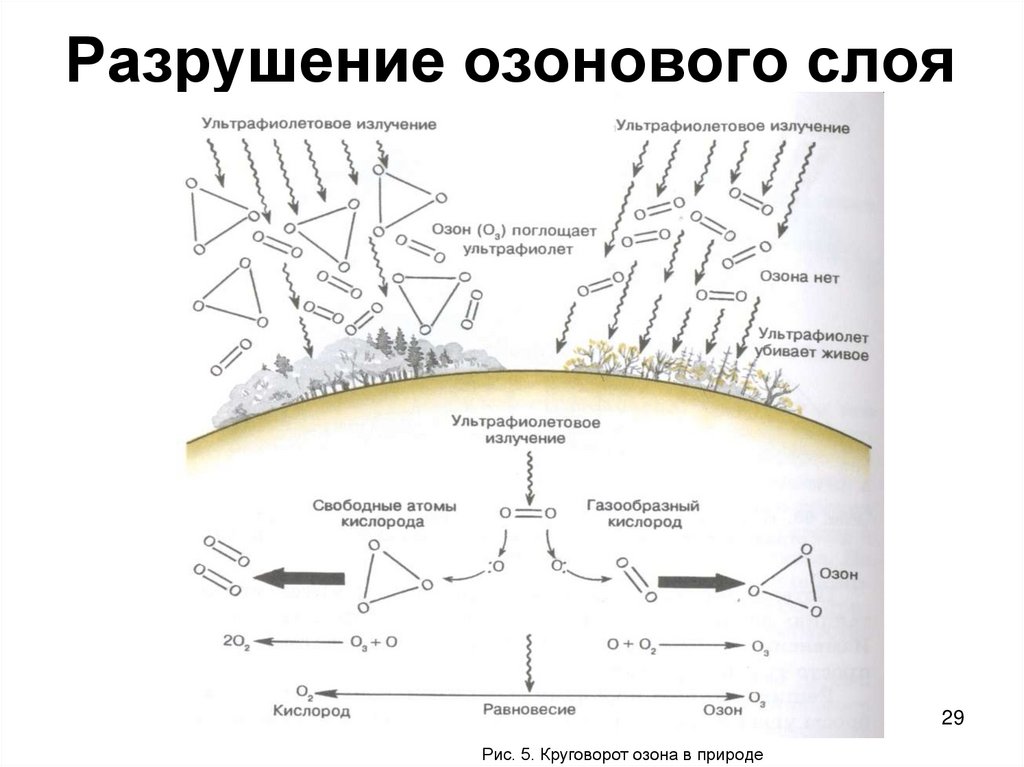
29. Разрушение озонового слоя
29Рис. 5. Круговорот озона в природе
30. Разрушение озонового слоя
• Геофизическое и биологическоезначение озонового слоя определяется
тем, что озон поглощает излучение в
ближней ультрафиолетовой области (с
длиной волны 240-360 нм). При этом
протекает следующая фотохимическая
реакция:
3
2
30
31.
31Рис. 6. Защитный озоновый слой





















 Химия
Химия








