Похожие презентации:
Ферменты: ингибиторы и типы ингибирования. Тема 8
1.
Ферменты: ингибиторы итипы ингибирования
2.
Ингибиторы–
вещества,
снижающие активность ферментов
3.
4.
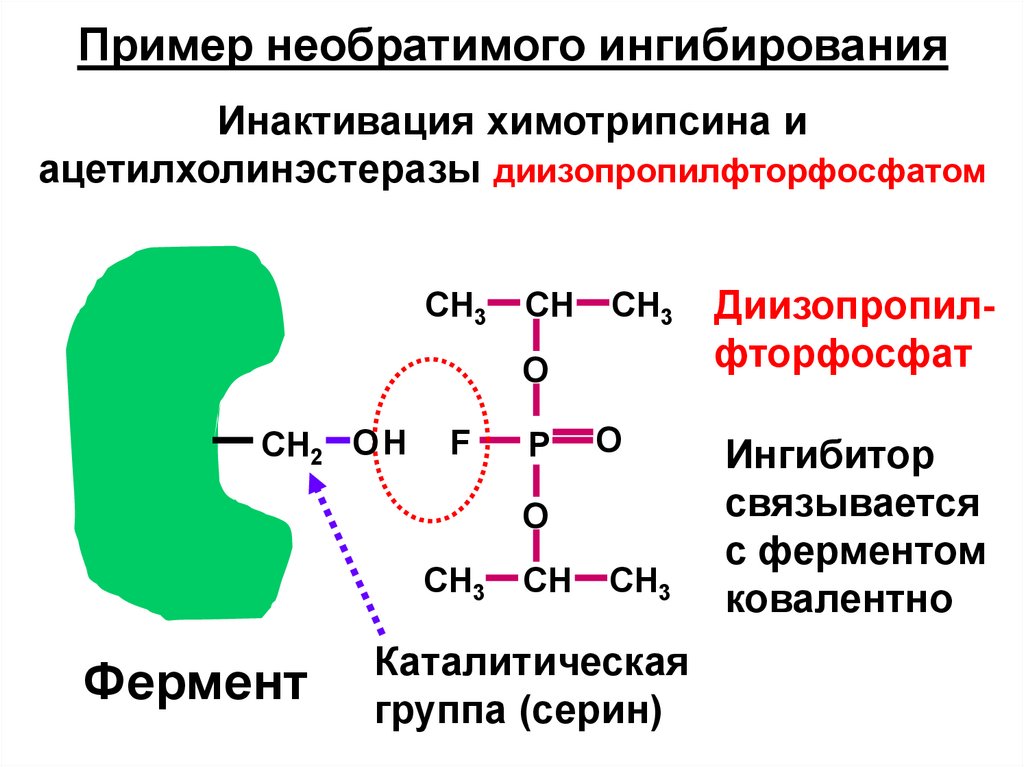
Пример необратимого ингибированияИнактивация химотрипсина и
ацетилхолинэстеразы диизопропилфторфосфатом
CH3
CH
CH3
O
CH2 O Н
F
P
O
O
CH3
Фермент
CH
CH3
Каталитическая
группа (серин)
Диизопропилфторфосфат
Ингибитор
связывается
с ферментом
ковалентно
5.
6.
7.
8.
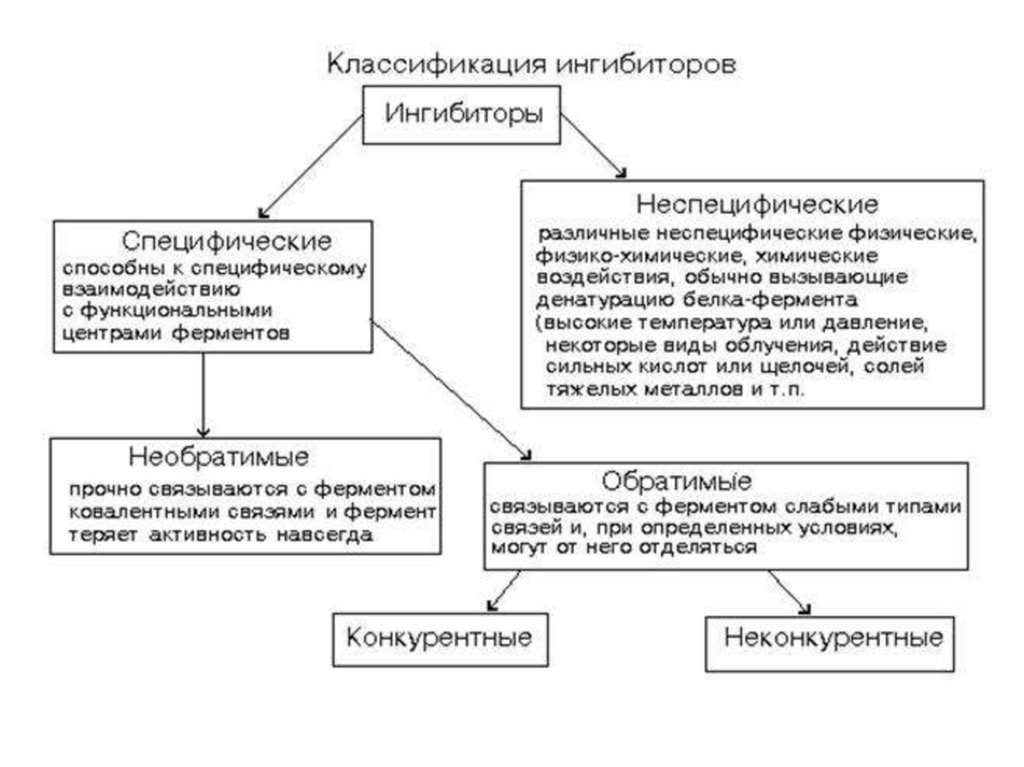
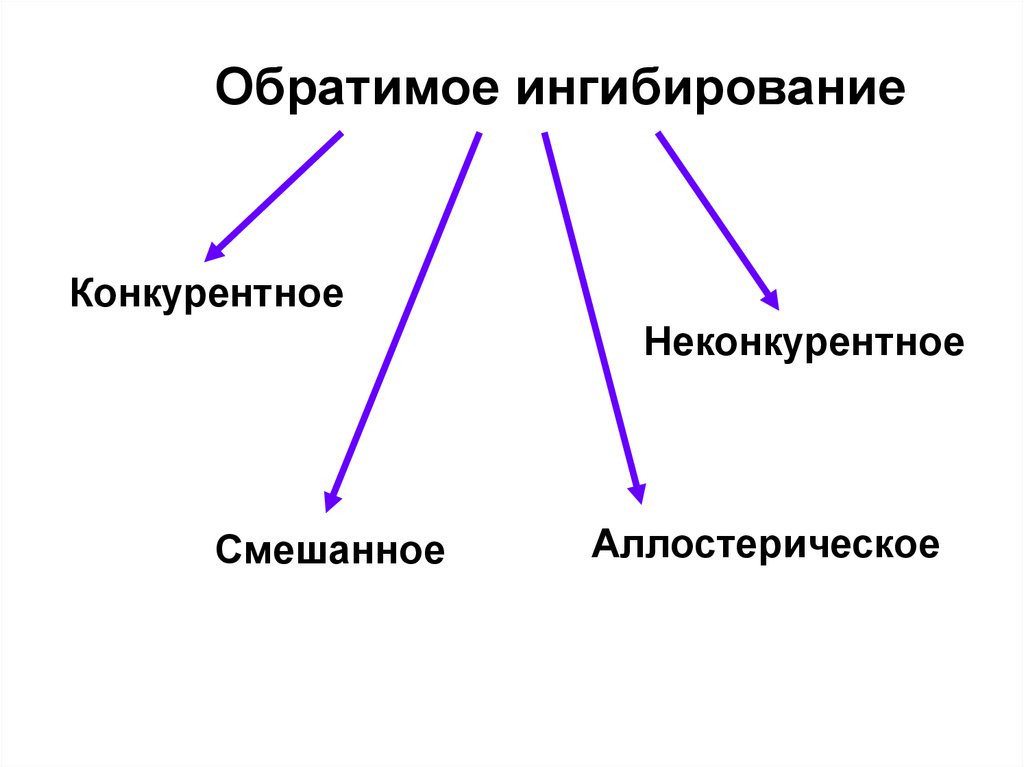
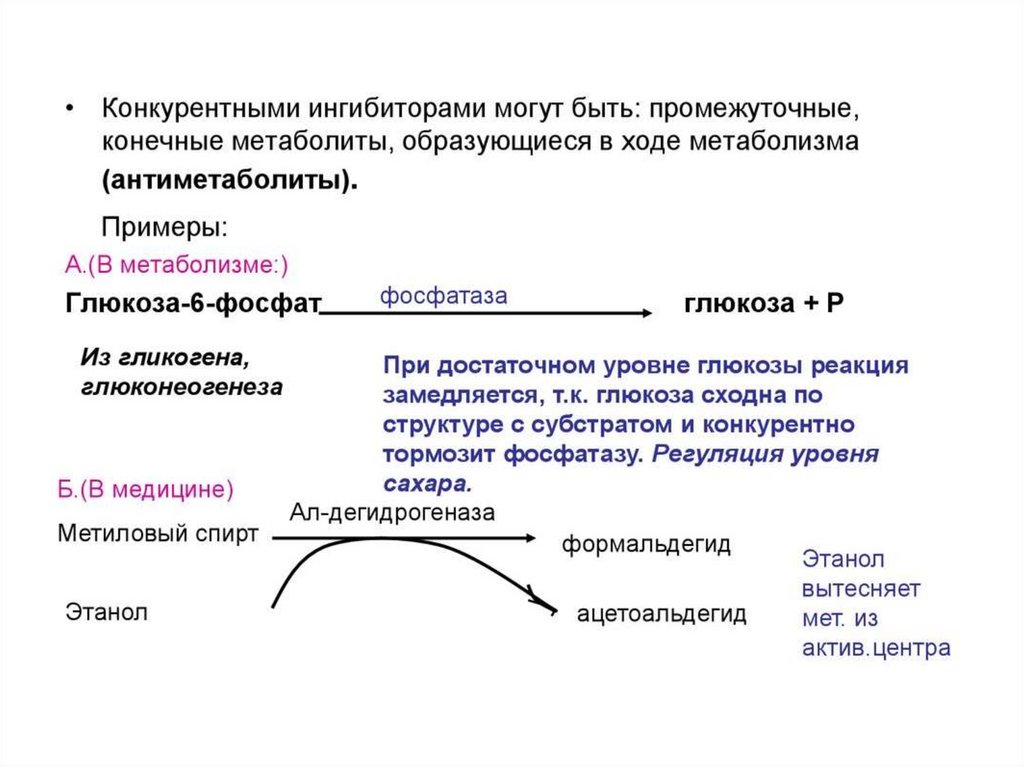
Обратимое ингибированиеКонкурентное
Неконкурентное
Смешанное
Аллостерическое
9.
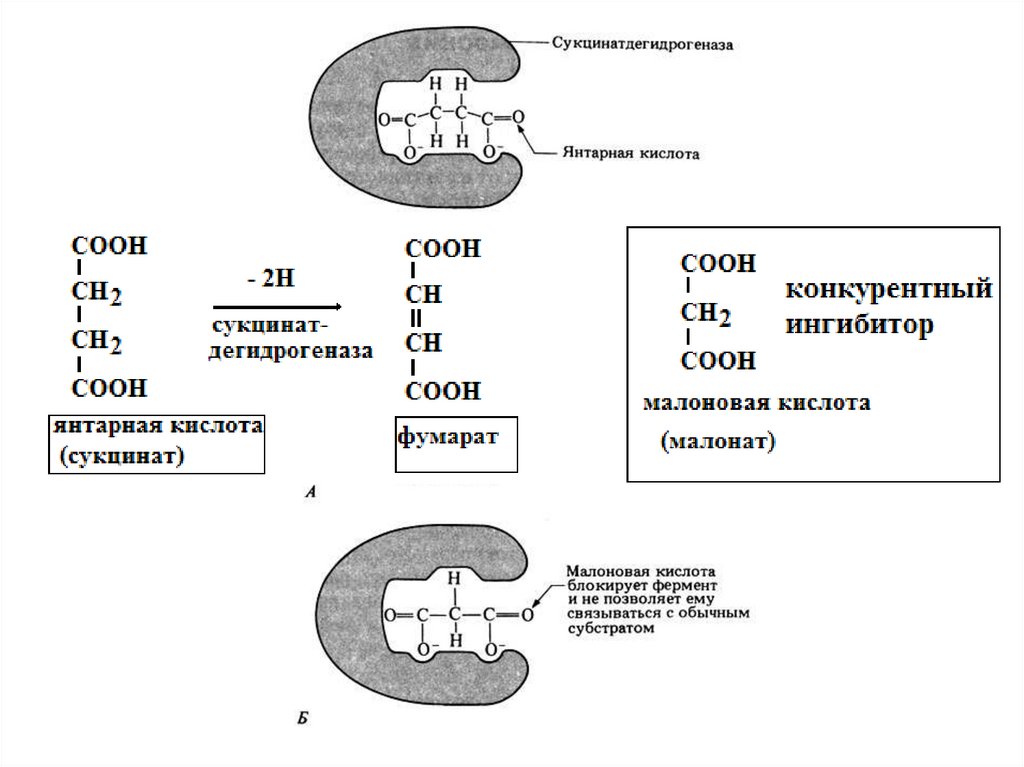
Конкурентное ингибированиеБез ингибитора
В присутствии ингибитора
Ингибитор
Субстрат
Фермент
Фермент
Субстрат
Фермент-субстратный
Ингибитор
занимает
активный
комплекс образуется
Активный центр
центр
и
препятствует связыванию субстрата. Ферментсубстратный комплекс не образуется.
10.
11.
12.
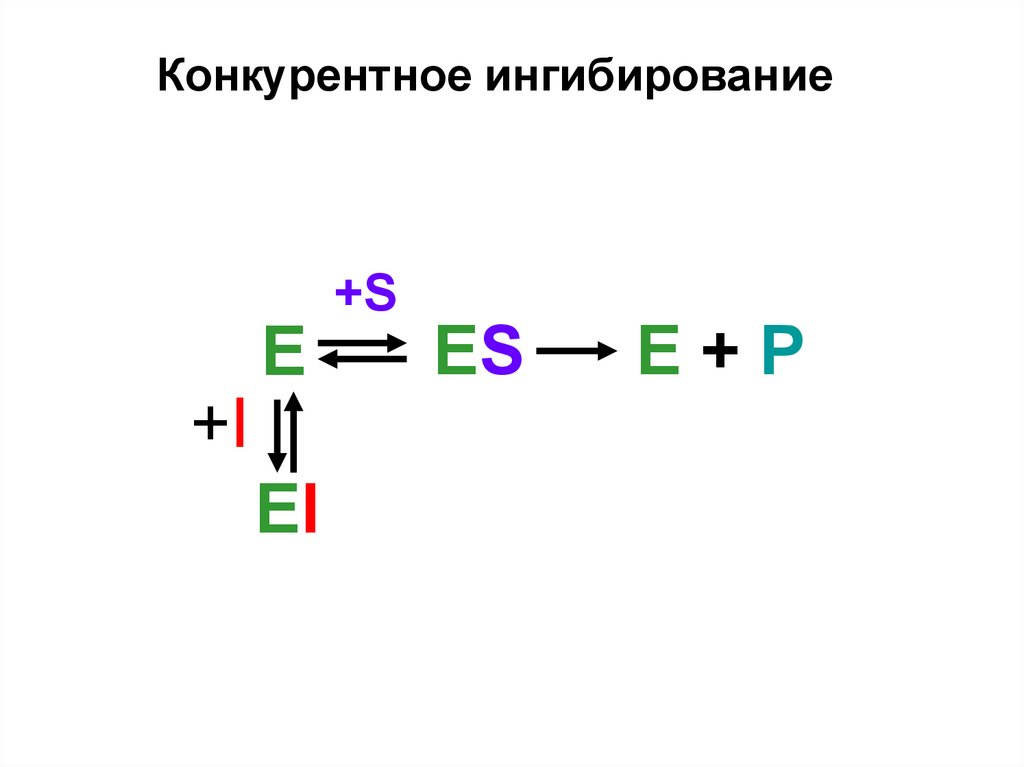
Конкурентное ингибирование+S
E
+I
EI
ES
E+P
13.
Неконкурентное ингибированиеИнгибитор
Фермент
Субстрат
Активныйкомплекс
центр
Фермент-субстратный
образуется,
но из-за изменения конформации активного
центра снижается скорость реакции
14.
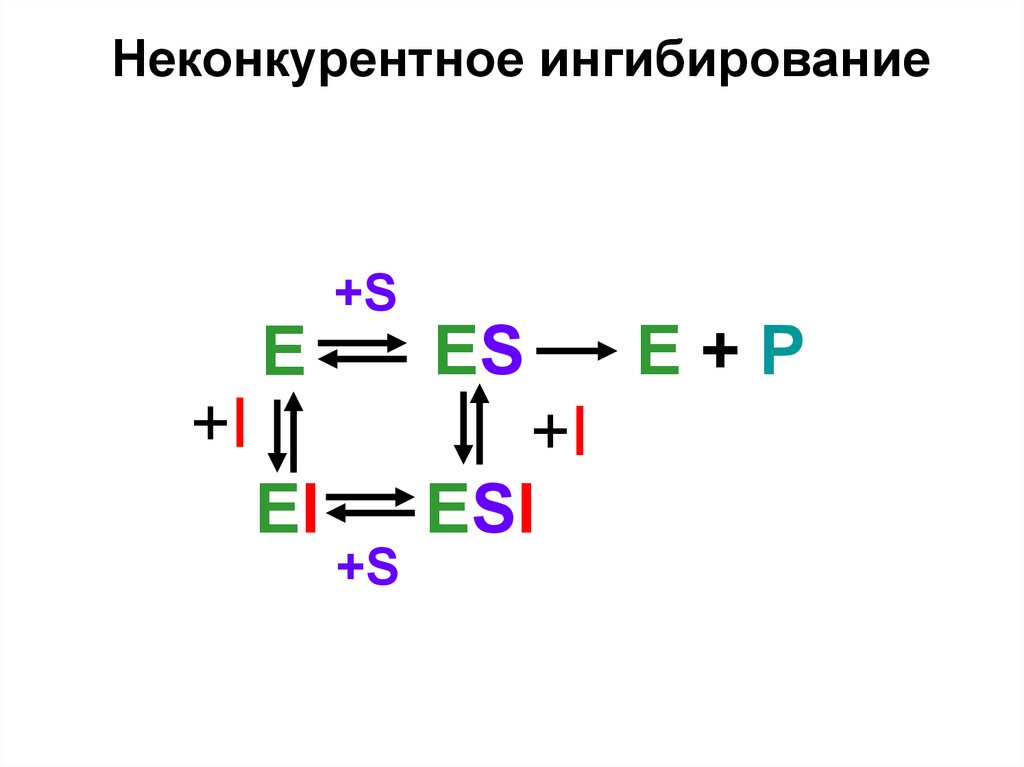
Неконкурентное ингибирование+S
E
ES
EI
+I
ESI
+I
+S
E+P
15.
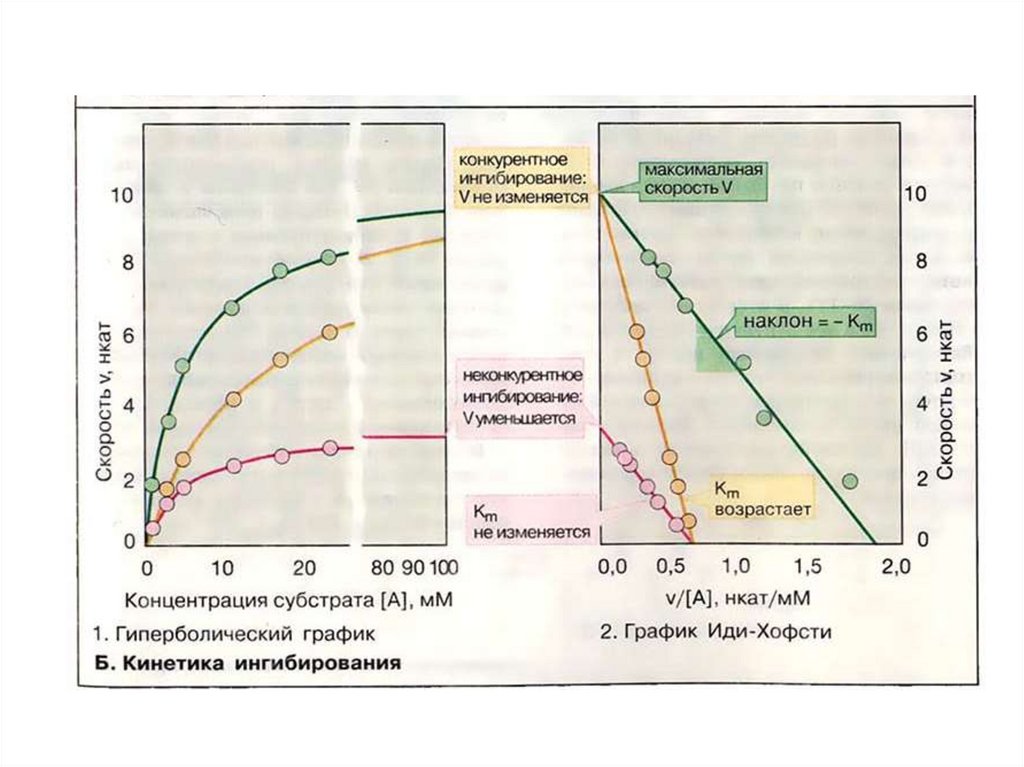
НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это ситуация, когдаингибитор и субстрат не имеют структурного сходства и ингибитор не
влияет на образование F-S-комплекса; образуется тройной ESI комплекс. Такие ингибиторы влияют на каталитическое превращение
субстрата. Они могут связываются как непосредственно с
каталитическими группами активного центра фермента, так и вне
активного центра фермента. Но в любом случае они влияют на
конформацию активного центра.
В
качестве
неконкурентного
ингибитора выступают ЦИАНИДЫ.
Они прочно связываются с ионами
железа цитохромоксидазы. Этот
фермент является одним из
компонентов дыхательной цепи.
Блокирование дыхательной цепи
приводит к мгновенной гибели
организме. Действие можно снять
только
с
помощью
РЕАКТИВАТОРОВ.
Цитохром
соксида́за
(цитохромоксидаза)
или
цитохром
с-кислородоксидоредуктаза,
2 белок - R - Fe2+ + ½ О2 ↔ 2 белок - R - Fe3+ + ½ О
16.
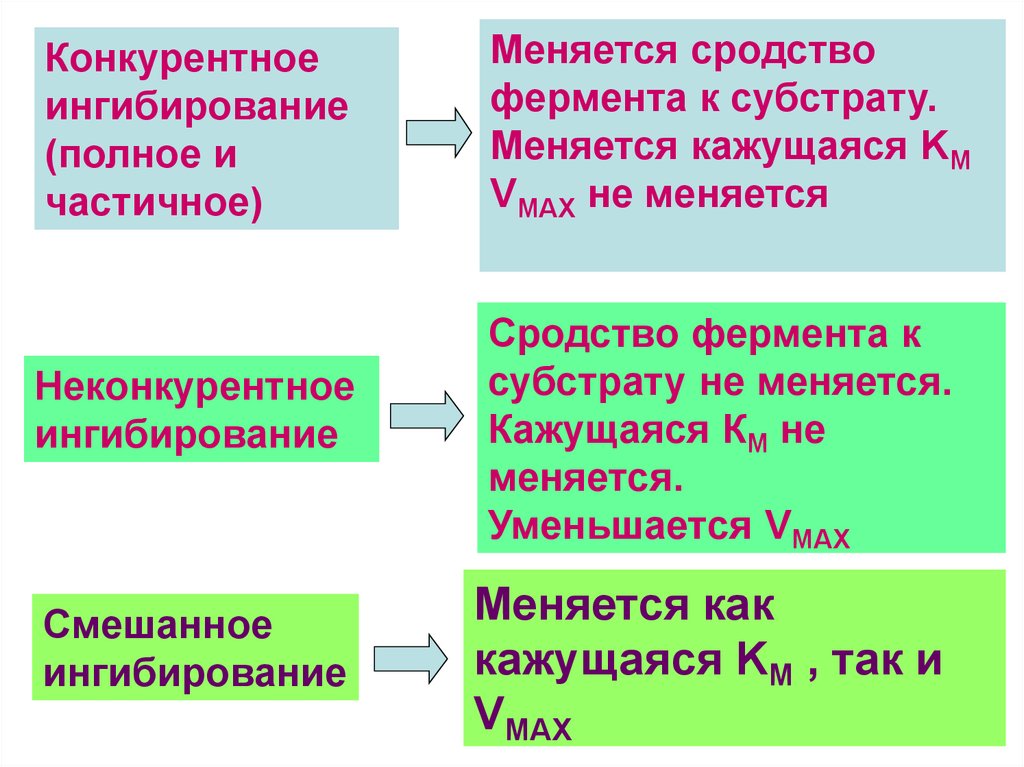
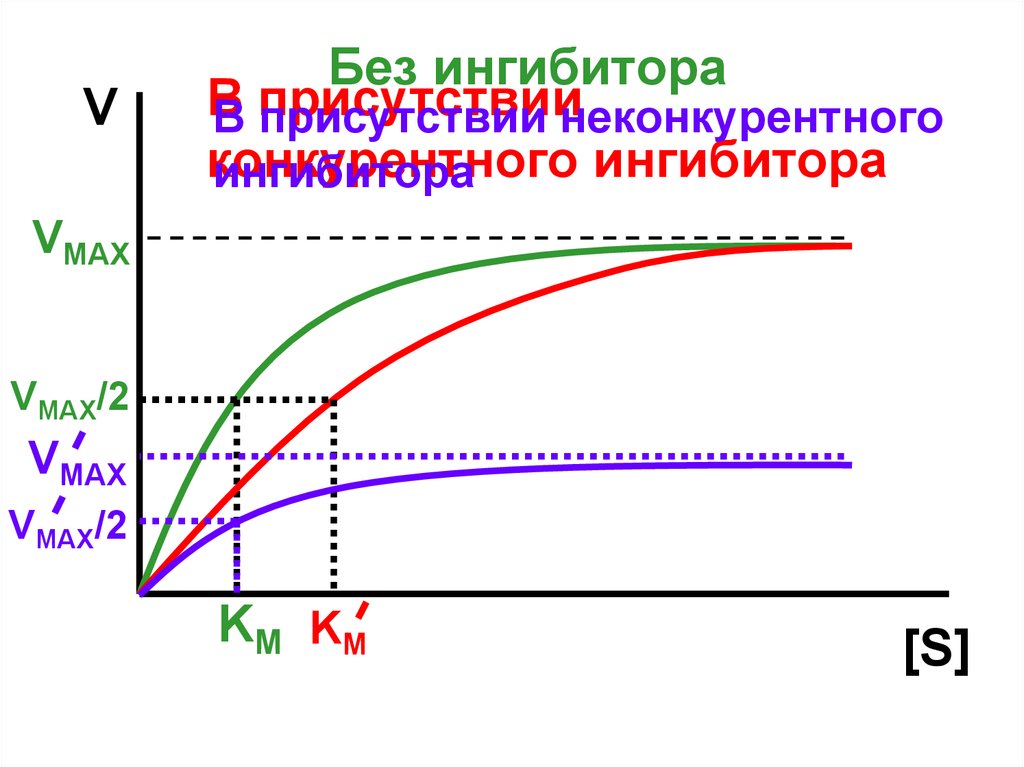
Конкурентноеингибирование
(полное и
частичное)
Неконкурентное
ингибирование
Смешанное
ингибирование
Меняется сродство
фермента к субстрату.
Меняется кажущаяся KM
VMAX не меняется
Сродство фермента к
субстрату не меняется.
Кажущаяся КМ не
меняется.
Уменьшается VMAX
Меняется как
кажущаяся KM , так и
VMAX
17.
18.
VБез ингибитора
В
В присутствии
присутствии неконкурентного
конкурентного
ингибитора
ингибитора
VMAX
VMAX/2
VMAX
VMAX/2
K M KM
[S]
19.
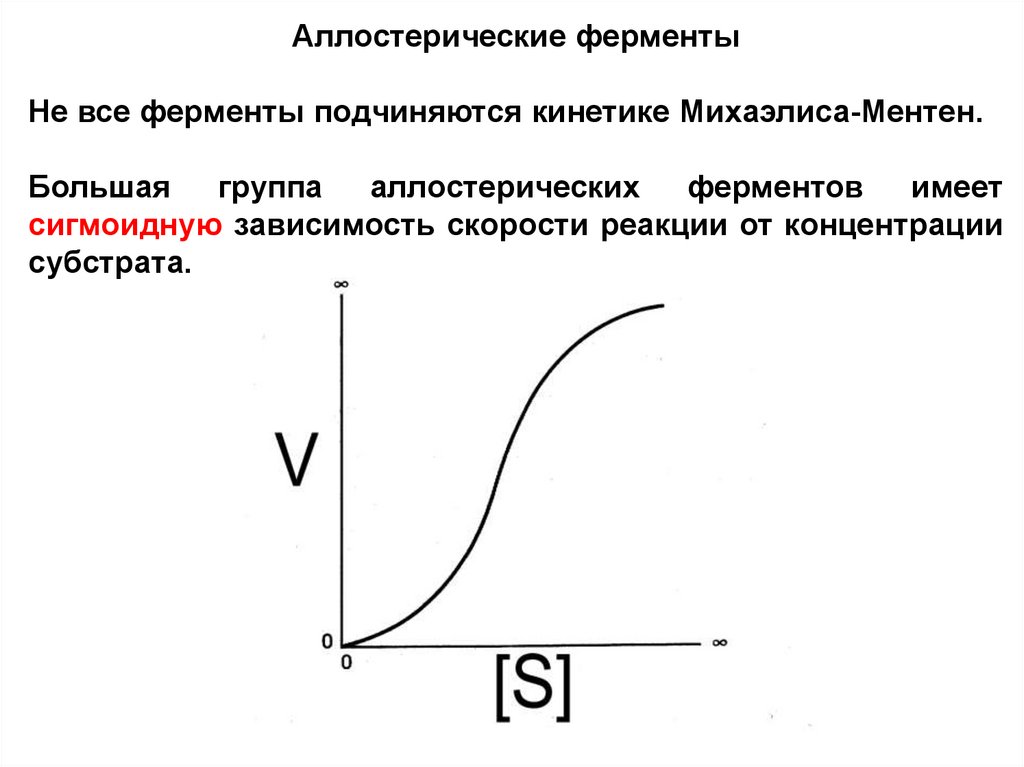
Аллостерические ферментыНе все ферменты подчиняются кинетике Михаэлиса-Ментен.
Большая
группа
аллостерических
ферментов
имеет
сигмоидную зависимость скорости реакции от концентрации
субстрата.
20.
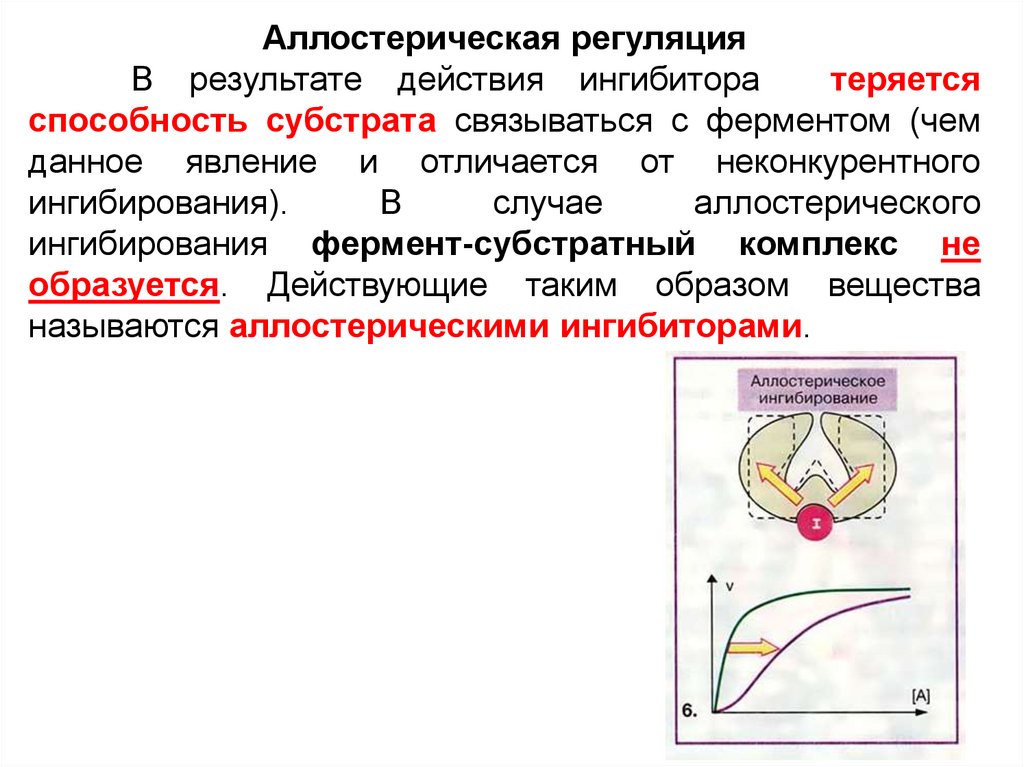
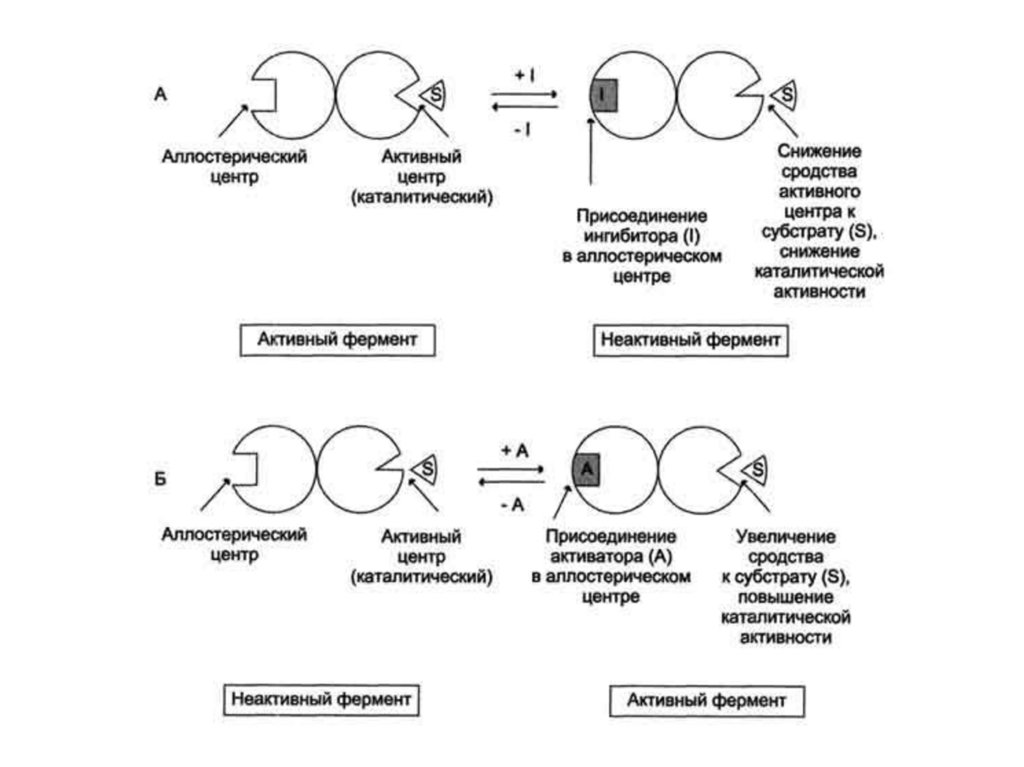
Аллостерическая регуляцияВ результате действия ингибитора
теряется
способность субстрата связываться с ферментом (чем
данное явление и отличается от неконкурентного
ингибирования).
В
случае
аллостерического
ингибирования фермент-субстратный комплекс не
образуется. Действующие таким образом вещества
называются аллостерическими ингибиторами.
21.
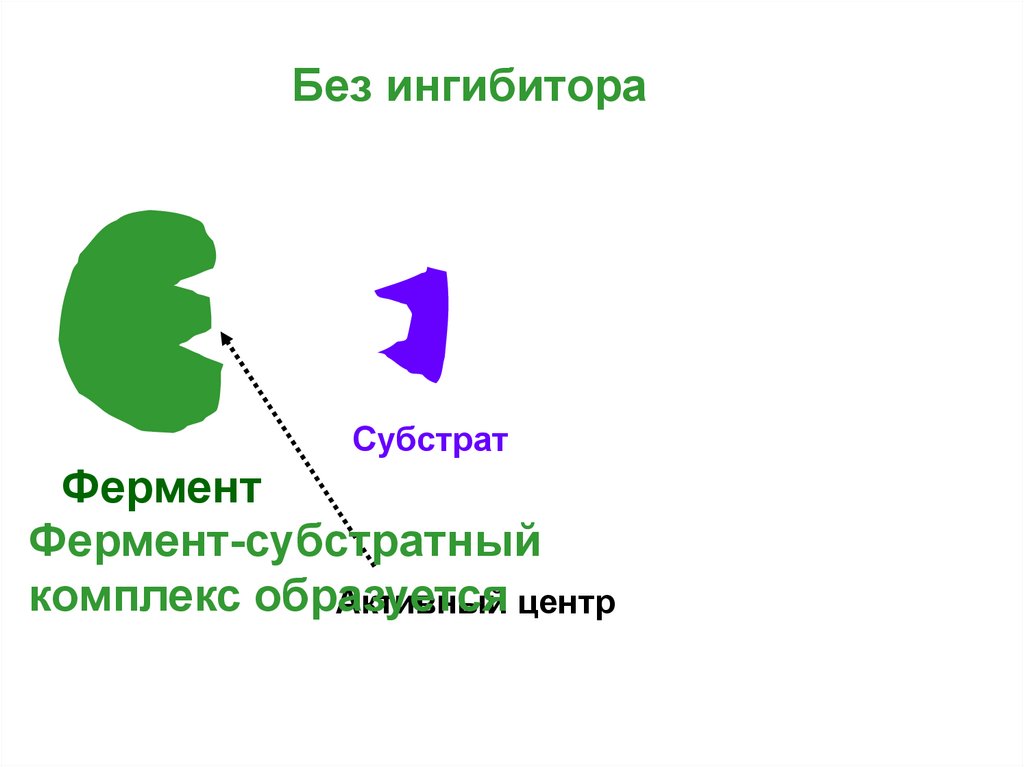
Без ингибитораСубстрат
Фермент
Фермент-субстратный
комплекс образуется
Активный центр
22.
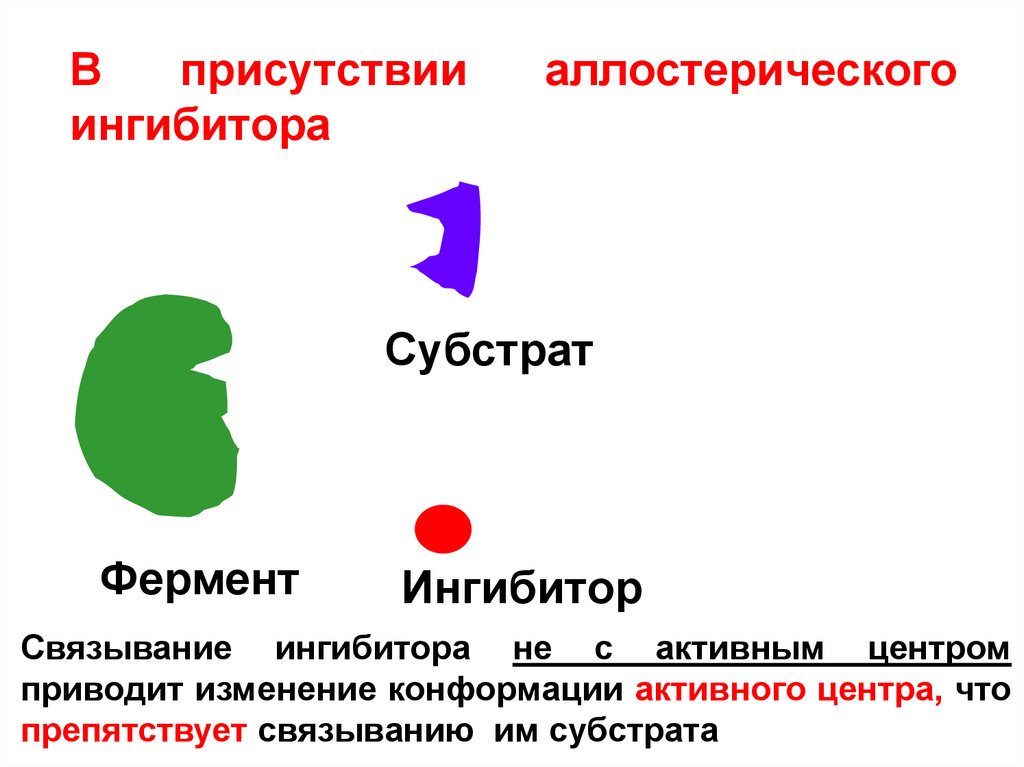
Вприсутствии
ингибитора
аллостерического
Субстрат
Фермент
Ингибитор
Связывание ингибитора не с активным центром
приводит изменение конформации активного центра, что
препятствует связыванию им субстрата
23.
24.
25.
26.
27.
28.
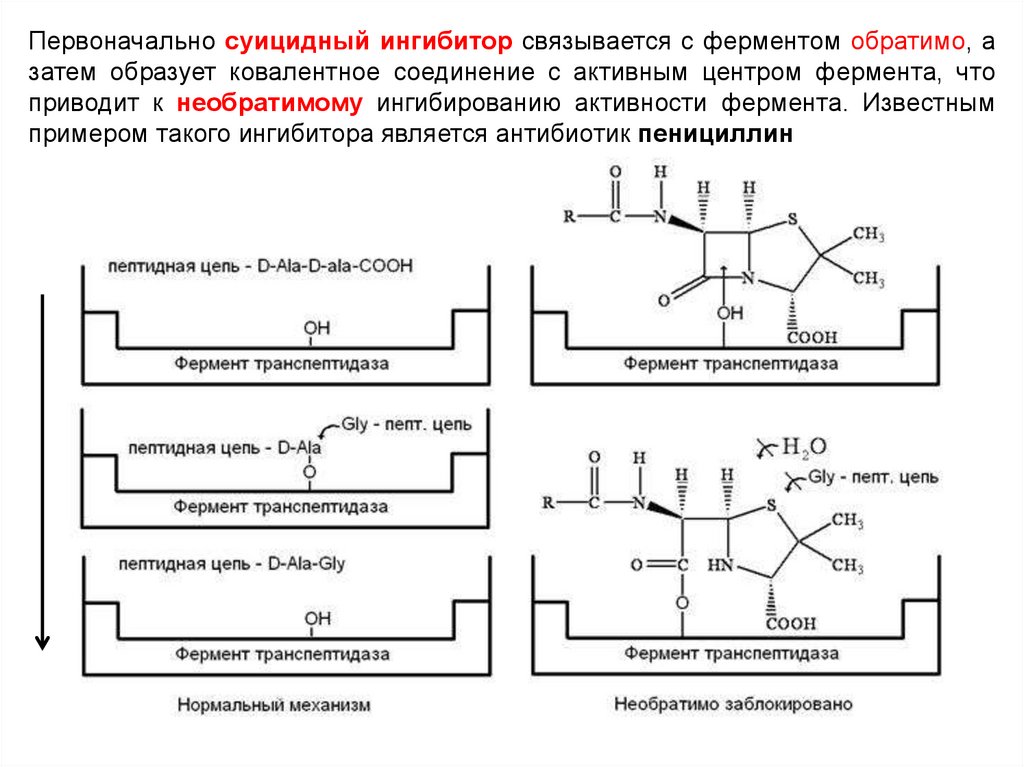
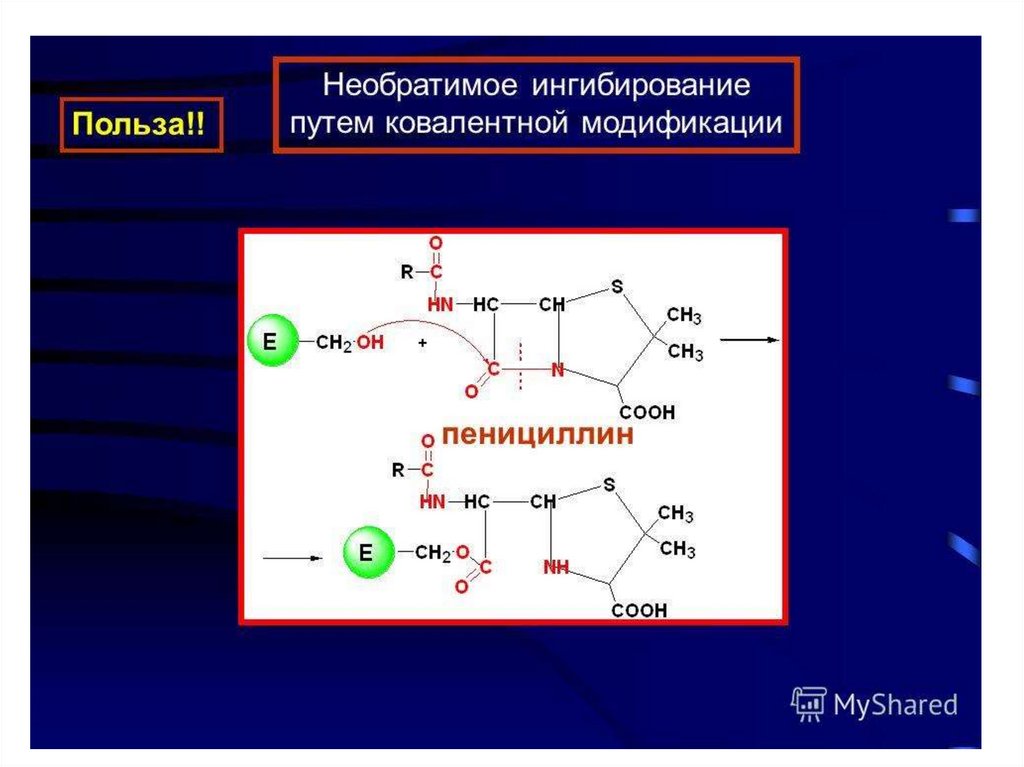
Первоначально суицидный ингибитор связывается с ферментом обратимо, азатем образует ковалентное соединение с активным центром фермента, что
приводит к необратимому ингибированию активности фермента. Известным
примером такого ингибитора является антибиотик пенициллин


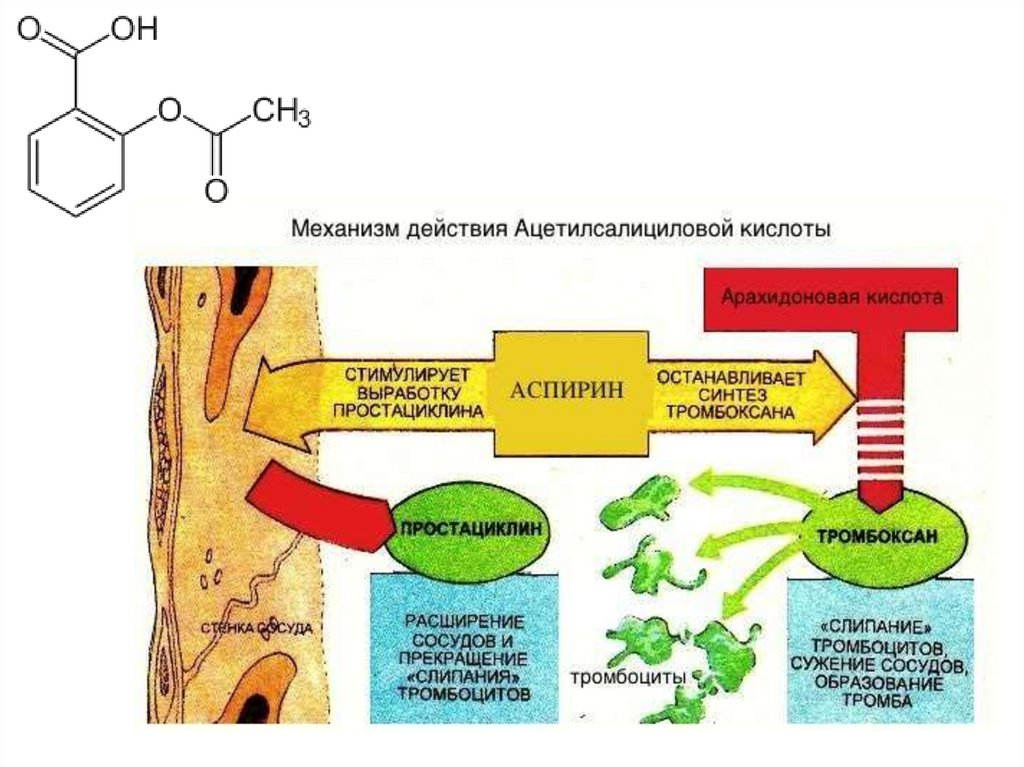
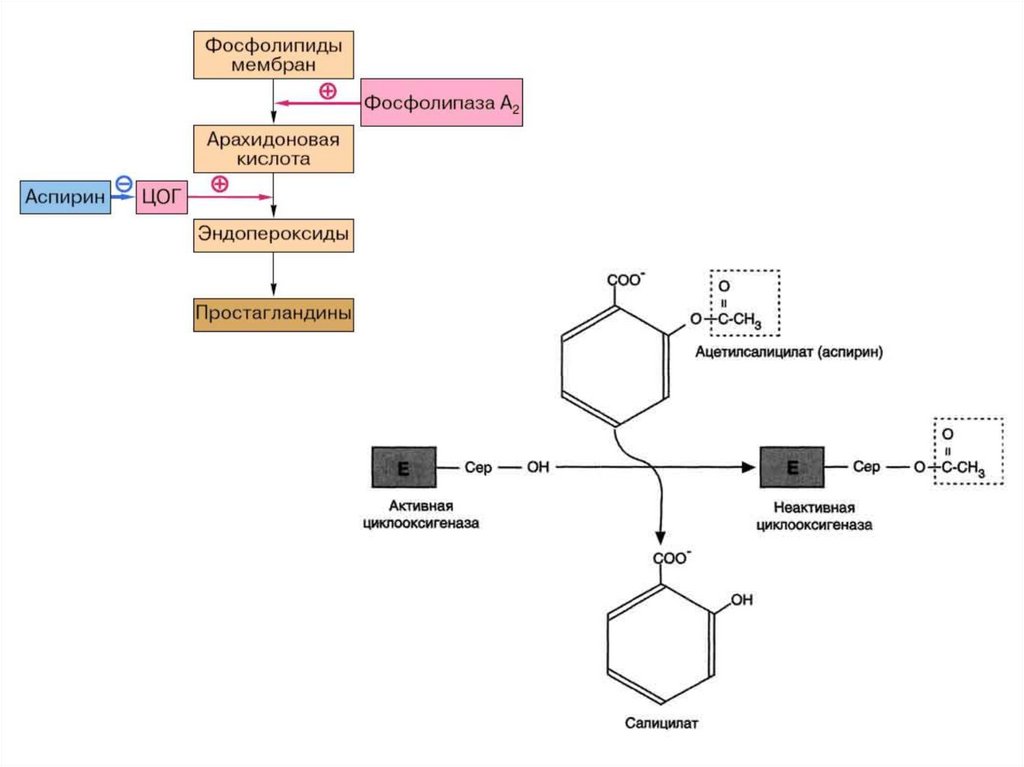





 Биология
Биология Химия
Химия