Похожие презентации:
Ферменты. Уравнение Михаэлиса-Ментен
1. ФЕРМЕНТЫ. УРАВНЕНИЕ МИХАЭЛИСА-МЕНТЕН Выполнила: Евстратова Я. В. ПущГЕНИ 2016.
12. ФЕРМЕНТЫ (энзимы)
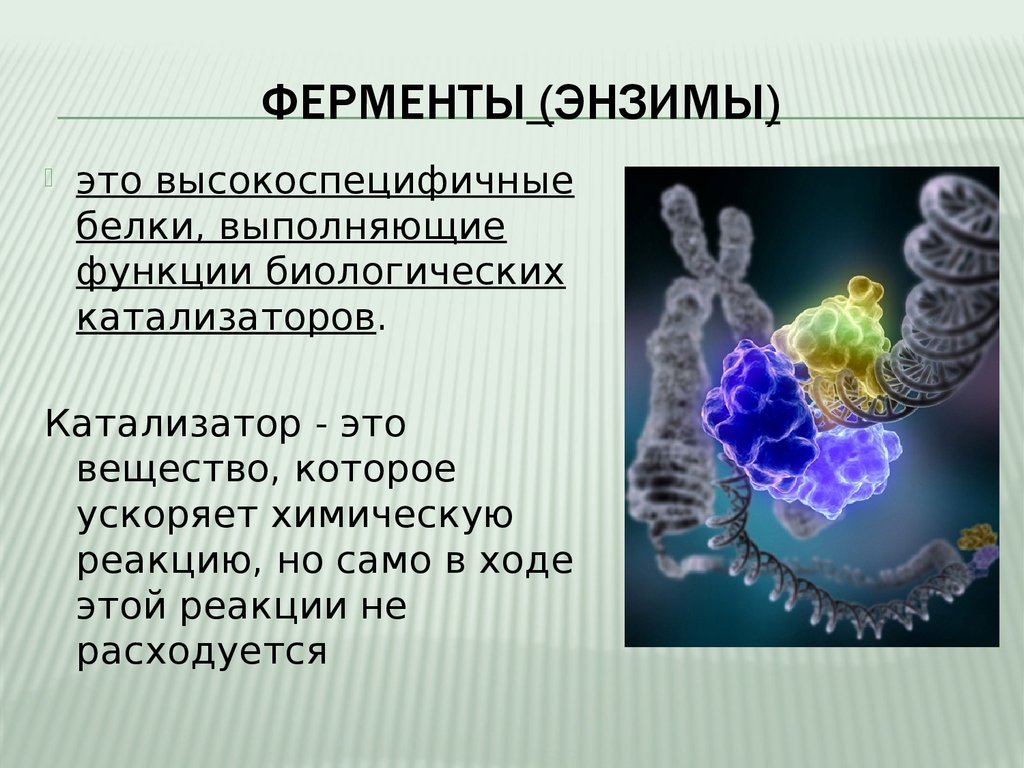
ФЕРМЕНТЫ (ЭНЗИМЫ)это высокоспецифичные
белки, выполняющие
функции биологических
катализаторов.
Катализатор - это
вещество, которое
ускоряет химическую
реакцию, но само в ходе
этой реакции не
расходуется
3. Классификация ферментов
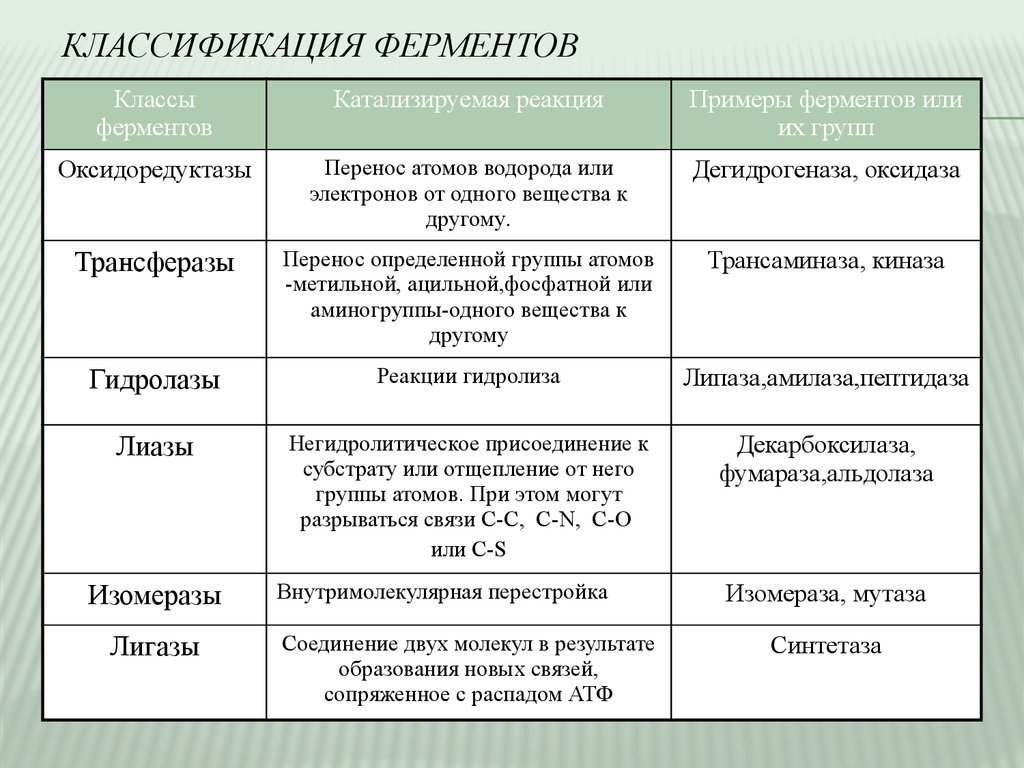
КЛАССИФИКАЦИЯ ФЕРМЕНТОВКлассы
ферментов
Катализируемая реакция
Примеры ферментов или
их групп
Оксидоредуктазы
Перенос атомов водорода или
электронов от одного вещества к
другому.
Дегидрогеназа, оксидаза
Трансферазы
Перенос определенной группы атомов
-метильной, ацильной,фосфатной или
аминогруппы-одного вещества к
другому
Трансаминаза, киназа
Гидролазы
Реакции гидролиза
Липаза,амилаза,пептидаза
Лиазы
Негидролитическое присоединение к
субстрату или отщепление от него
группы атомов. При этом могут
разрываться связи С-С, C-N, C-O
или C-S
Декарбоксилаза,
фумараза,альдолаза
Изомеразы
Лигазы
Внутримолекулярная перестройка
Соединение двух молекул в результате
образования новых связей,
сопряженное с распадом АТФ
Изомераза, мутаза
Синтетаза
4.
Строение ферментовСвязь может быть
ковалентной или
нековалентной
белок
Апофермент;
Белок~кофактор
неактивен
или менее активен
Холофермент
(оптимальная каталитическая
активность)
кофактор
(Неорганический ион
или органическое соединение
Некоторые ферменты требуют два или три различных кофактора
5.
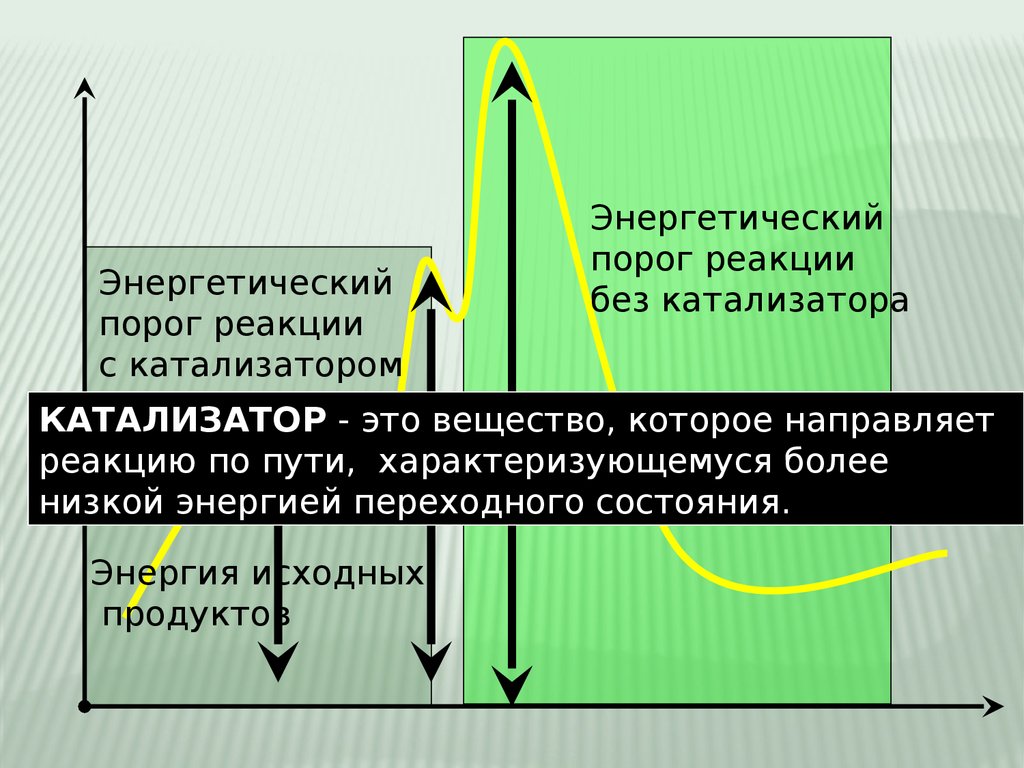
Энергетическийпорог реакции
с катализатором
Энергетический
порог реакции
без катализатора
КАТАЛИЗАТОР - это вещество, которое направляет
реакцию по пути, характеризующемуся более
низкой энергией переходного состояния.
Энергия исходных
продуктов
6.
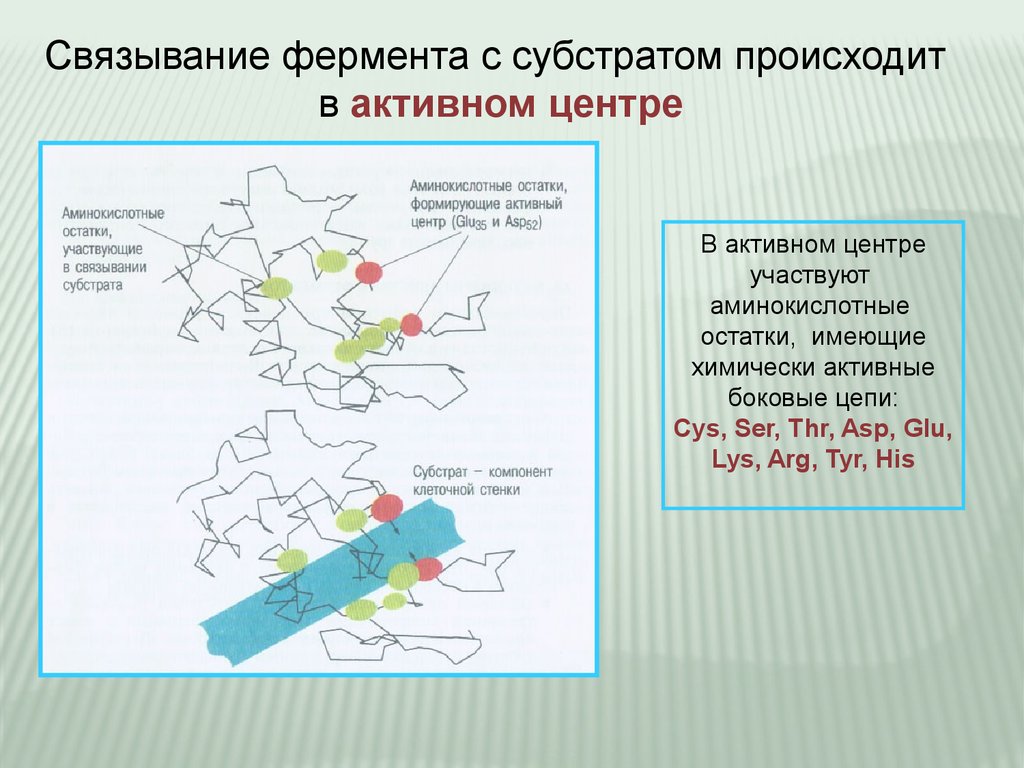
Связывание фермента с субстратом происходитв активном центре
В активном центре
участвуют
аминокислотные
остатки, имеющие
химически активные
боковые цепи:
Cys, Ser, Thr, Asp, Glu,
Lys, Arg, Tyr, His
7.
Типы взаимодействия «фермент - субстрат»«Ключ - замок»
«Перчатка - рука»
Жесткая матрица
Э. Фишер
Индуцированное
соответствие
Г. Кошланд
Высокая избирательность действия фермента
обеспечивается тем, что субстрат связывается
в активном центре фермента в нескольких точках
8.
Способы регуляции:1. Аллостерическая регуляция
2. Ковалентная модификация
3. Диссоциация неактивного
предшественника (зимогена),
на активный фермент
9.
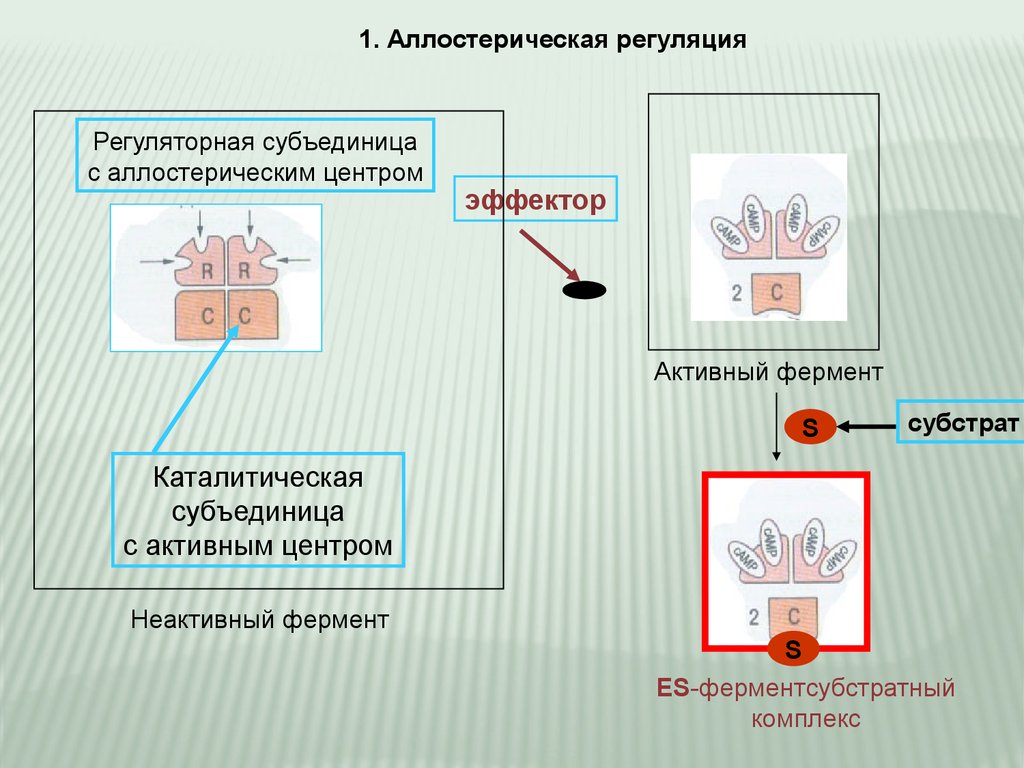
1. Аллостерическая регуляцияРегуляторная субъединица
с аллостерическим центром
эффектор
Активный фермент
S
субстрат
Каталитическая
субъединица
с активным центром
Неактивный фермент
S
ES-ферментсубстратный
комплекс
10.
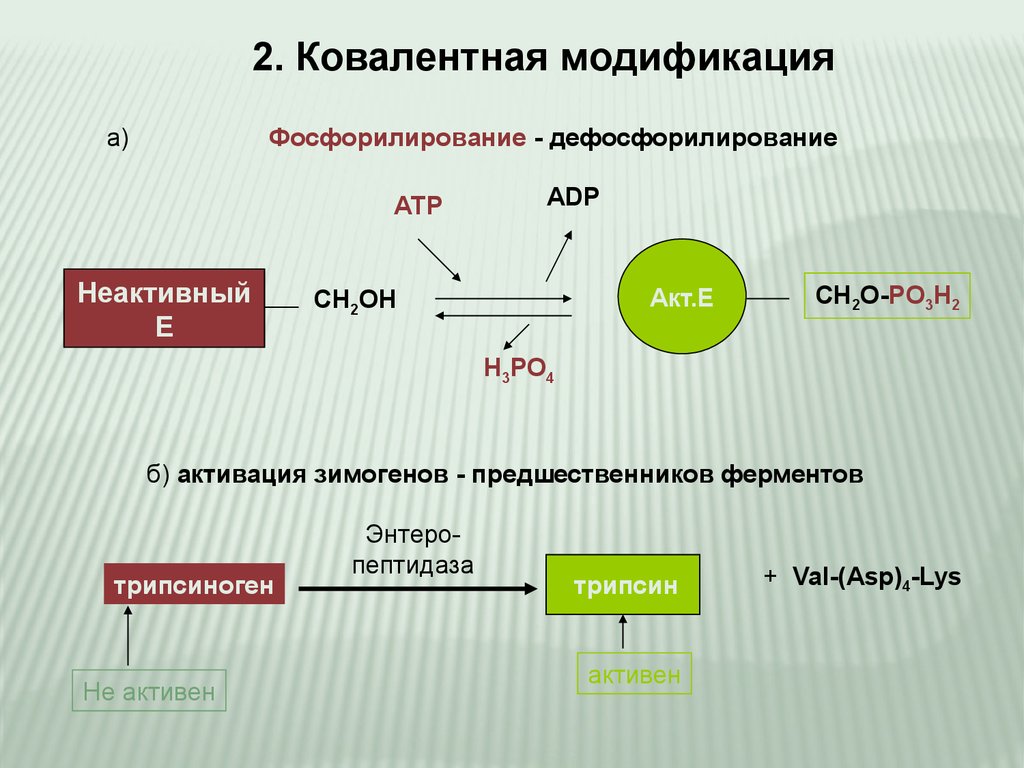
2. Ковалентная модификацияa)
Фосфорилирование - дефосфорилирование
АТР
Неактивный
Е
АDP
Акт.Е
СН2ОН
СН2О-РО3Н2
Н3РО4
б) активация зимогенов - предшественников ферментов
трипсиноген
Не активен
Энтеропептидаза
трипсин
активен
+ Val-(Asp)4-Lys
11.
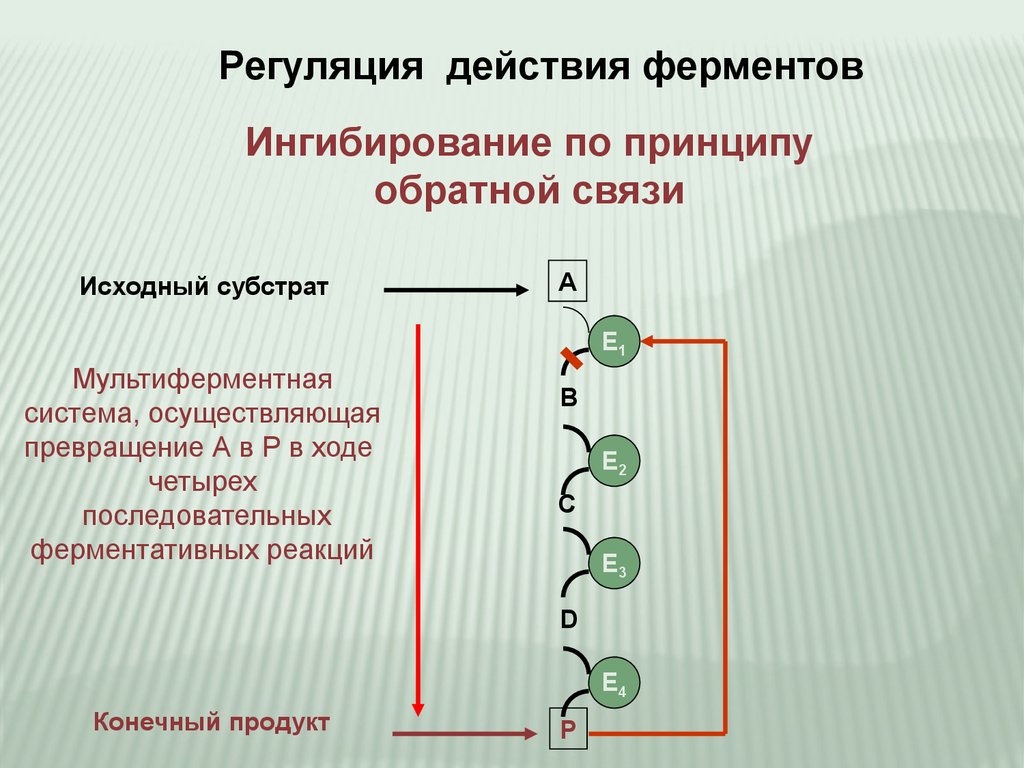
Регуляция действия ферментовИнгибирование по принципу
обратной связи
Исходный субстрат
A
E1
Мультиферментная
система, осуществляющая
превращение А в Р в ходе
четырех
последовательных
ферментативных реакций
B
E2
C
E3
D
E4
Конечный продукт
P
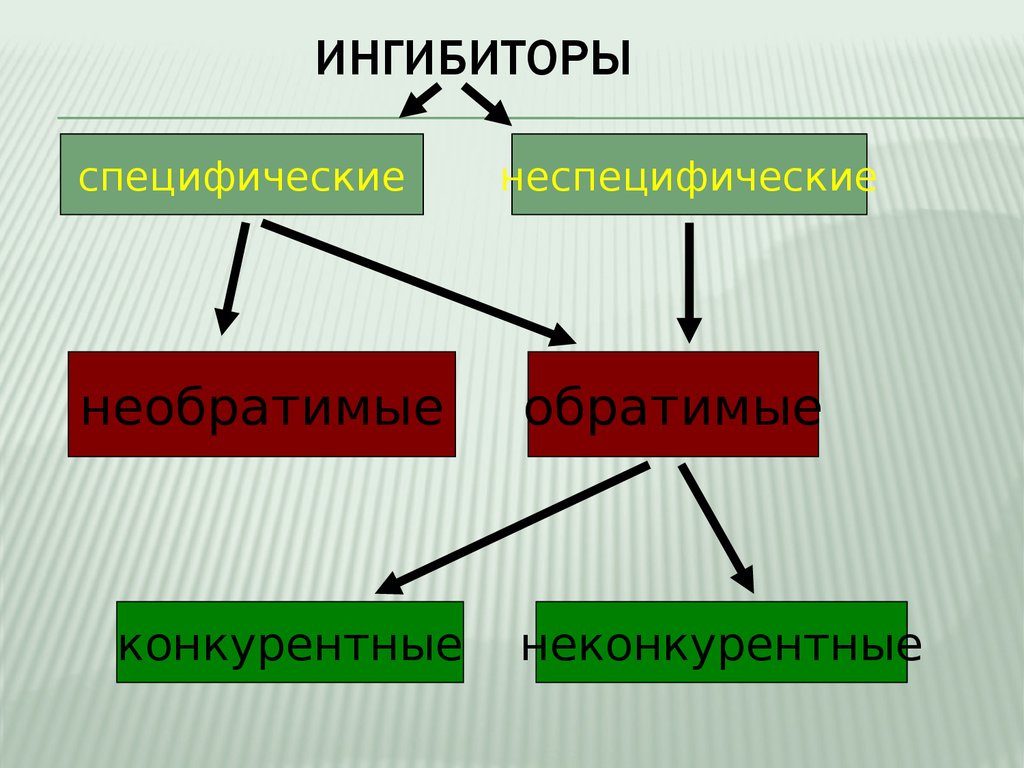
12. Ингибиторы
ИНГИБИТОРЫспецифические
необратимые
конкурентные
неспецифические
обратимые
неконкурентные
13.
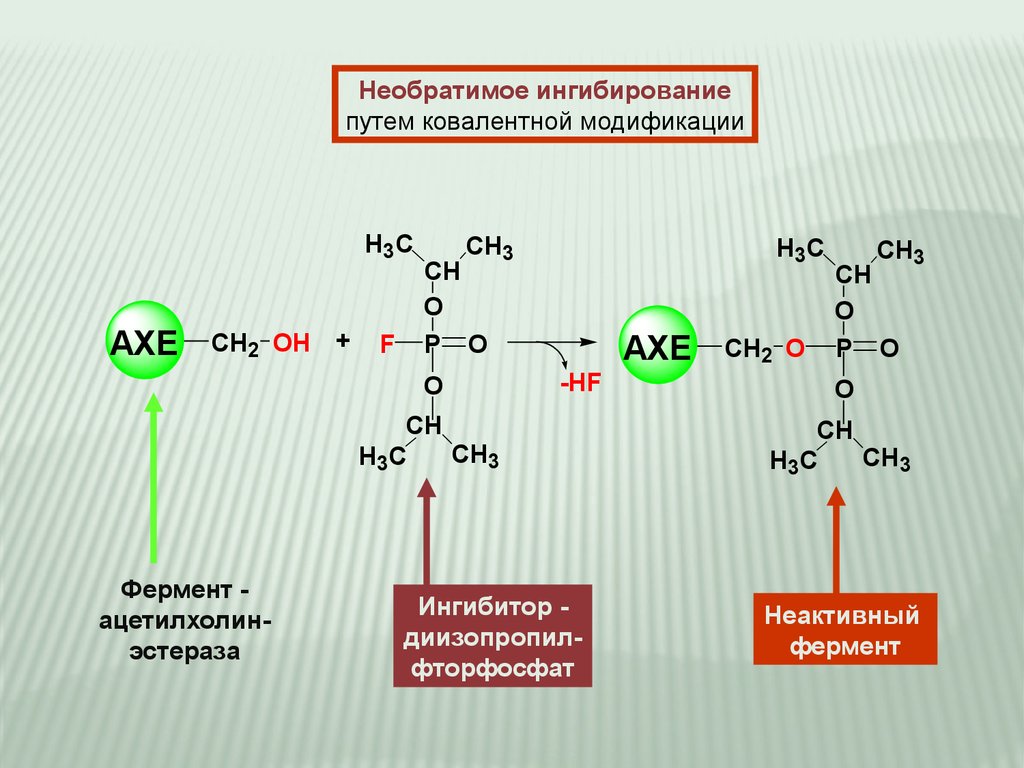
Необратимое ингибированиепутем ковалентной модификации
H3C
AXE
CH2 OH +
F
CH3
H3C
CH
O
P O
O
AXE
-HF
CH
CH3
H3C
Фермент ацетилхолинэстераза
Ингибитор диизопропилфторфосфат
CH2 O
CH3
CH
O
P O
O
CH
CH3
H3C
Неактивный
фермент
14.
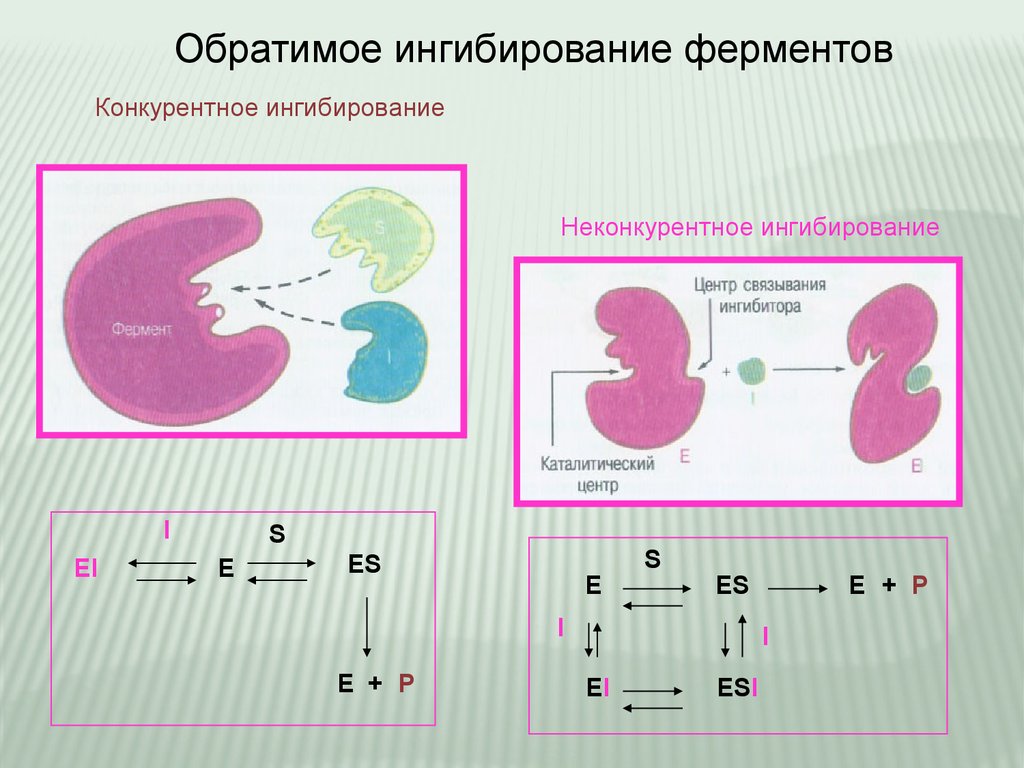
Обратимое ингибирование ферментовКонкурентное ингибирование
Неконкурентное ингибирование
I
EI
S
E
ES
E
S
ES
I
E + P
E + P
I
EI
ESI
15.
Иммобилизация фермента - закреплениена полимерном носителе (полистироле)
Иммобилизованный фермент не смешивается
с продуктами реакции, более устойчив к
денатурации
16.
Каждый фермент имеет определенный оптимум рНОтносительная
скорость
Активность ферментов
печени максимальна
при рН ~ 7,2
Активность пепсинафермента желудочного
сока максимальна при
рН~ 1 - 2
17.
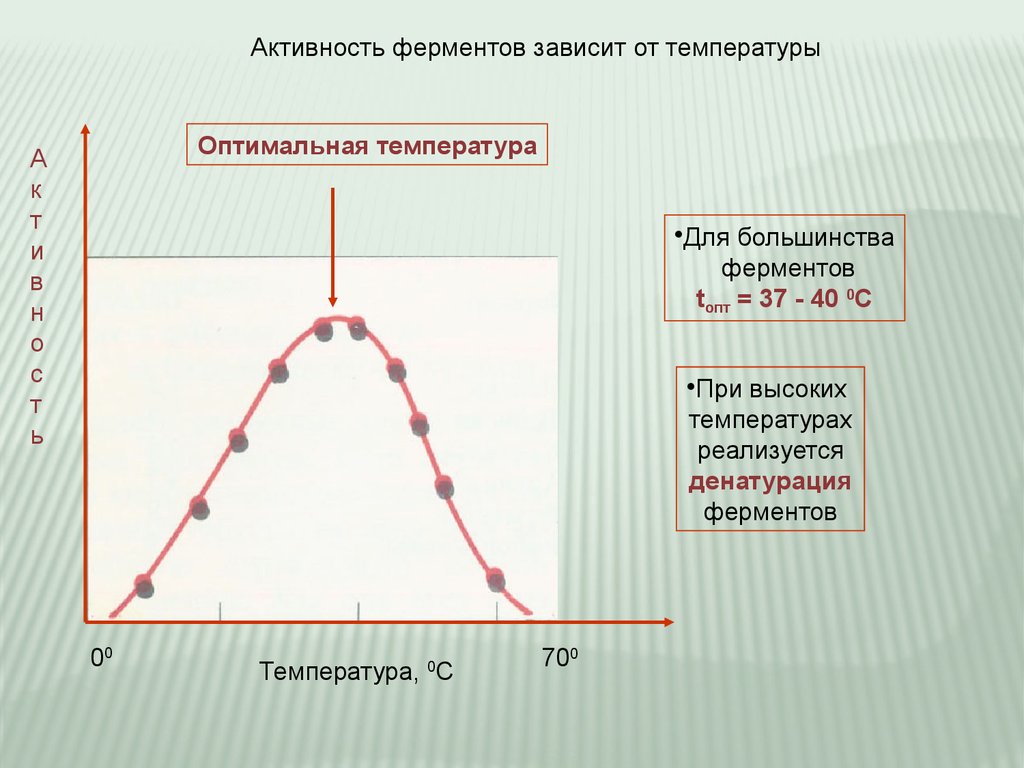
Активность ферментов зависит от температурыОптимальная температура
А
к
т
и
в
н
о
с
т
ь
•Для большинства
ферментов
tопт = 37 - 40 0С
•При высоких
температурах
реализуется
денатурация
ферментов
00
Температура, С
0
700
18.
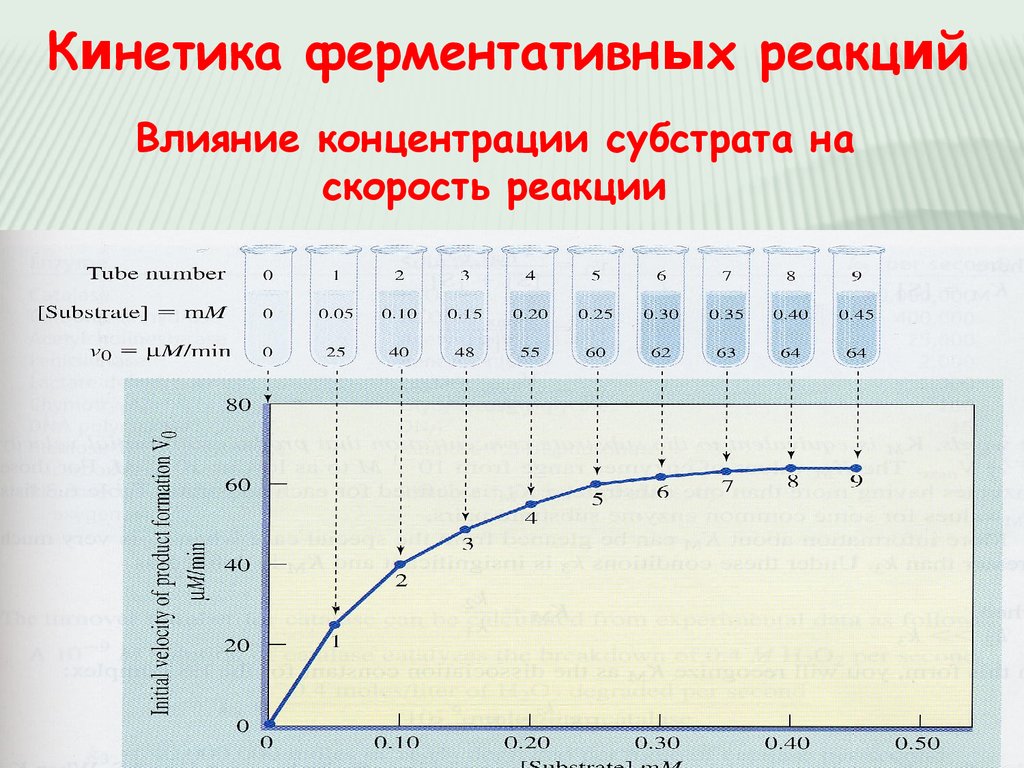
Кинетика ферментативных реакцийВлияние концентрации субстрата на
скорость реакции
19. Уравнение Михаэлиса-Ментен
УРАВНЕНИЕ МИХАЭЛИСА-МЕНТЕНВ чем его смысл? — Позволяет получить формальные
характеристики скорости ферментативной реакции вида
k2
k1
E S
k-1
ES
k-2
E P
Уравнение реакции превращения субстрата (S) в продукт (P),
катализируемой ферментом (E);
Уравнение Михаэлиса-Ментен описывает зависимость скорости реакции
от концентрации субстрата и, в частности, демонстриует явление
насыщения. Условия, при которых работает уравнение МихаэлисаМентен:
1)
2)
3)
Стационарная фаза реакции, т.е. [ES]=const, d[ES]/dt=0;
Измеряется начальная скорость; [S] [S0]
[E] = [E0] – [ES]
v
vmax
v max [ S ]
v
[S ] K m
Km
[S ]
20.
Анализ уравнения Михаэлиса -Ментен2
Vmax [S]
V0 =
Km + [S]
3
1
1. [S] << Km, тогда V ~ K [S]
2. [S] >> Km, тогда V0 ~ Vmax
3. Km = [S], тогда V0 = 1/2 Vmax
1
2
3
21. Смысл Km
СМЫСЛ KMKm
k 1 k 2
k1
Km выводится из констант скоростей
Km в условиях Михаэлиса-Ментен определяет
скорость распада фермент-субстратного комплекса
k1
k1 [ E ] S k 1 [ ES ]
при
равновесии,
E S
ES
k-1
Kd
[ E ] S k 1
[ ES ]
k1
Константа диссоциации
Маленькая Km означает сильное связывание;
высокая Km означает слабое связывание.
Km равна концентрации субстрата, при которой
скорость реакции равна половине максимальной
v=1/2vmax
22.
Спасибо за внимание22










 Биология
Биология Химия
Химия








