Похожие презентации:
Кислотно-основні рівноваги в біологічних системах. (Лекція 2)
1. Лекція № 2 Кислотно-основні рівноваги в біологічних системах доцент, к.х.н. Олена Олегівна Костирко
2.
Дипольні молекули води–
–
–
–
+ + +
+ – +
+ +
–
+
–
+
–
+
–
–
+
–
+
–
+
–
+
–
+ –
Кристал
NaCl
–
–
–
–
–
–
+ + +
+ – +
+
+
+
–
–
+
–
Гідратований
йон хлору
+
+
+
–
–
–
+
–
–
– + –
–
–
–
+
+
+
+
+
+
Гідратований йон натрію
Розчинення кристалу NaCl у воді
3.
Ступінь дисоціаціїконцентрація молекул, що розпались на іони;
загальна концентрація розчинених молекул.
Ступінь дисоціації зростає при розведенні розчину,
при підвищенні температури розчину.
4.
Константа дисоціації КдCH3COOH
+
H + CH3COO‾
5.
Закон розведення Оствальда: ступінь дисоціації слабкогобінарного електроліту зростає при розведенні розчину.
6.
a(X) = f·c(X)a(X)– активність йонів X;
f – коефіцієнт активності;
c(X) – молярна концентрація йонів X.
Для дуже розведених розчинів сильних електролітів f = 1,
тоді a (X) = c (X).
7.
Йоннасила
розчину
μ
-
кількісна
характеристика
електростатичної взаємодії йонів.
Дорівнює напівсумі добутків моляльності кожного з іонів (b(X))
на квадрат його елементарного заряду (Z2).
8. Дисоціація води
H+ + H2O ⇄ H3O+,катіон гідроксонію
Н2O ⇄ H+ + OH‾
Константа дисоціації води:
KдH
K д H 2O
= 1,8∙10-16 моль/л
2O
[H ] [OH ]
[H 2O]
( 298 K );
2H2O ⇄ H3O+ + OH‾.
9.
Молярна концентраціяn(X)
m(X)
c(X)
V(p ну) M(X) V(p ну)
1000 г / л
[ H 2 O]
55,56 моль / л
18г / моль
KдH
2O
[H ] [OH ]
[H 2O]
[H+]∙[OH‾] = 1,8∙10-16моль/л∙55,56моль/л = 1∙10-14 моль2/л2.
K H2O = [H+]∙[OH‾] = 10-14 моль2/л2
йонний добуток води
(298 K)
10.
[H ] [OH ] 10 14 10 7 моль/л.В чистій воді:
Водневий показник
pH = -lg[H+].
Гідроксидний показник
рОН = -lg[OH‾].
[H+]∙[OH‾] = 10-14 моль2/л2
pH + pOH = 14.
рН = 7 нейтральне середовище;
рН < 7 кисле середовище;
рН > 7 лужне середовище.
[Н+]
рН
10–1
10
10–3
10–4
10–5
10–6
10–7 10–8
10–9
10–10
10–11
10–12
10–13
10–14
1
2
3
4
5
6
7
9
10
11
12
13
14
–2
Збільшення кислотності
(ац)
8
Збільшення лужності
11.
Значення рН різних біологічних рідин і тканин організмуБіологічна рідина
Сироватка крові
Слина
Чистий шлунковий сік
Сеча
Спинномозкова рідина
Сік підшлункової залози
Вміст тонкого кишечнику
Жовч у протоках
Жовч у міхурі
Молоко
Водяниста волога ока (сльозова рідина)
Шкіра (внутрішньоклітинна рідина, різні шари)
Печінка (внутрішньоклітинна рідина)
купферовські клітини
клітини по периферії частинок
клітини в центрі частинок
рН (у нормі)
7,40 ± 0,05
6,35 – 6,85
0,9 – 1,1
4,8 – 7,5
7,40 ± 0,05
7,5 – 8,0
7,0 – 8,0
7,4 – 8,5
5,4 – 6,9
6,6 – 6,9
7,4 ± 0,1
6,2 – 7,5
6,4 – 6,5
7,1 – 7,4
6,7 – 6,9
Зміщення значення рН крові в кислий бік від нормальної
величини рН = 7,4 називається ацидозом,
а в лужний бік — алкалозом.
12.
Буферними називають розчини, які мають властивість доситьстійко зберігати сталість рН при розведенні, а також
протидіяти зміні рН при додаванні помірних кількостей
сильної кислоти або лугу
кислотні буфери (CH3COOH + CH3COONa);
основні буфери
(NH3·H2O + NH4Cl);
білкові амфолітні буфери.
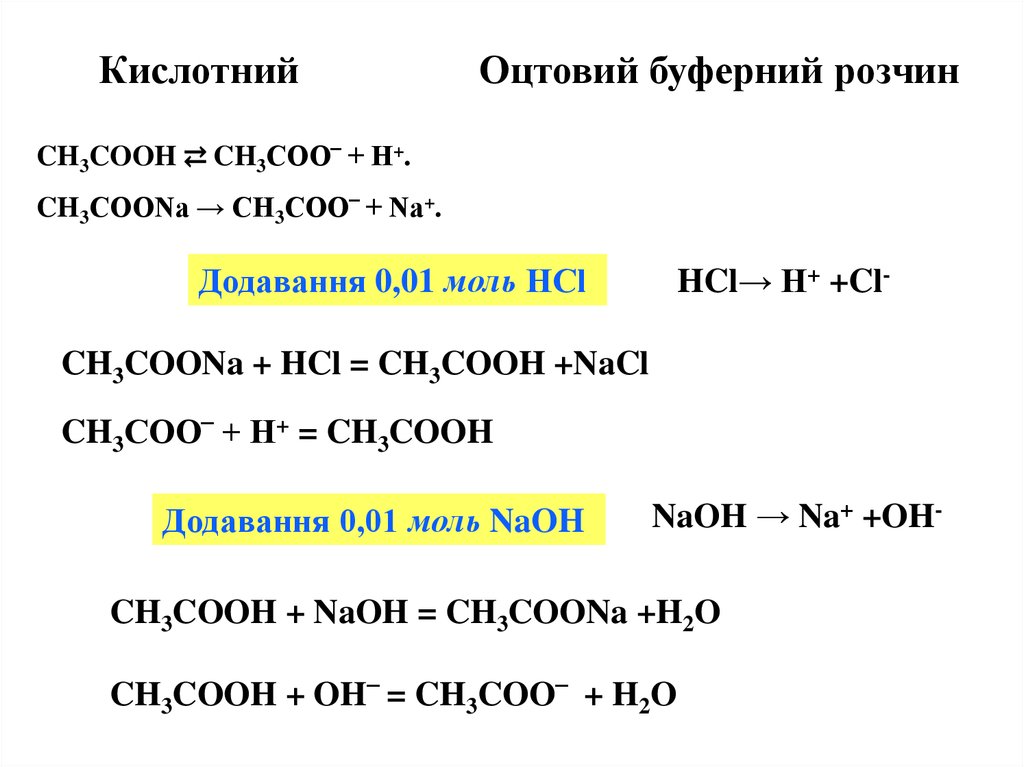
13. Кислотний Оцтовий буферний розчин
CH3COOH ⇄ CH3COO‾ + H+.CH3COONa → CH3COO‾ + Na+.
Додавання 0,01 моль НСl
HCl→ H+ +Cl-
CH3COONa + HCl = CH3COOH +NaCl
CH3COO‾ + H+ = CH3COOH
Додавання 0,01 моль NaOH
NaOH → Na+ +OH-
CH3COOH + NaOH = CH3COONa +H2O
CH3COOH + OH‾ = CH3COO‾ + H2O
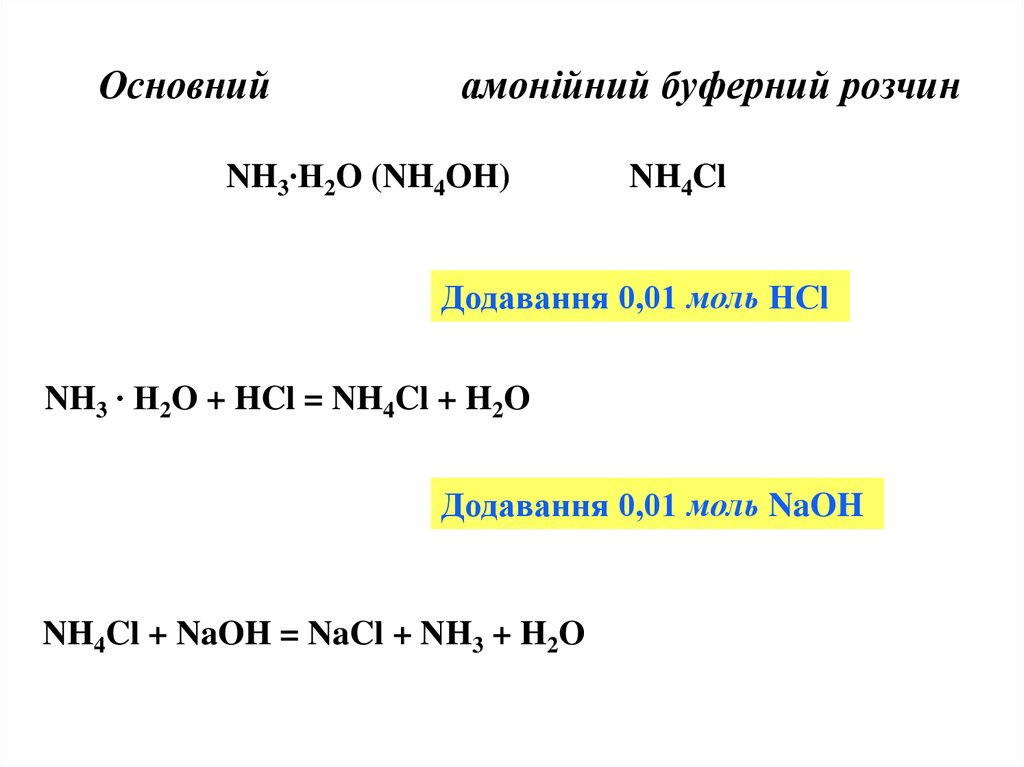
14. Основний амонійний буферний розчин
NH3∙H2O (NH4OH)NH4Cl
Додавання 0,01 моль НСl
NH3 ∙ H2O + HCl = NH4Cl + H2O
Додавання 0,01 моль NaOH
NH4Cl + NaOH = NaCl + NH3 + H2O
15.
рівняння Гендерсона-Гассельбаха для кислотного буферного розчину :рівняння Гендерсона-Гассельбаха для основного буферного розчину :
pКД = –lgKд
16.
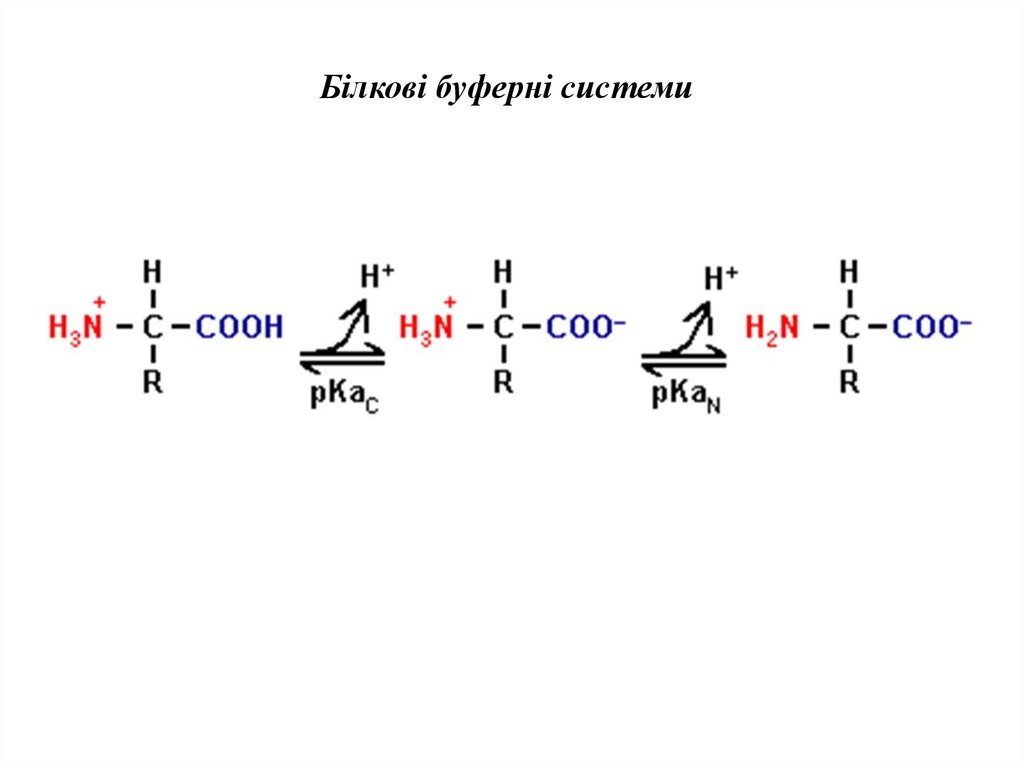
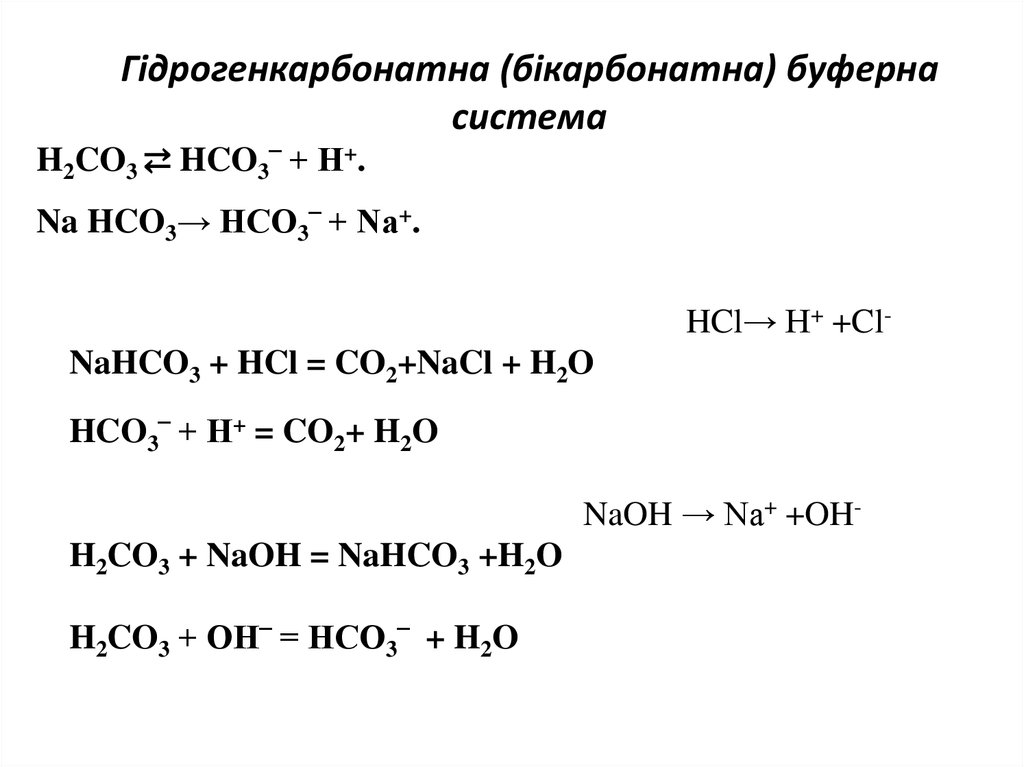
Білкові буферні системи17. Гідрогенкарбонатна (бікарбонатна) буферна система
H2CO3 ⇄ HCO3‾ + H+.Na HCO3→ HCO3‾ + Na+.
HCl→ H+ +ClNaHCO3 + HCl = CO2+NaCl + H2O
HCO3‾ + H+ = CO2+ H2O
NaOH → Na+ +OHH2CO3 + NaOH = NaHCO3 +H2O
H2CO3 + OH‾ = HCO3‾ + H2O
18.
СО2 + Н2О ⇄ Н2СО3 ⇄[ HCO3 ]
pH pK1 lg
[ H 2CO3 ]
[HCO3 ]
lg
[H 2CO3 ]
= 7,4 - 6,1 = 1,3
[HCO3 ]
[H 2CO3 ] =
19,95
HCO3 H
19. Фосфатна буферна система
NaH2PO4 → Na+ + H2PO4‾Na2HPO4 → 2Na+ + HPO42HCl→ H+ +ClNa2HPO4 + HCl = NaH2PO4 +H2O
HPO42‾ + H+ = H2PO4‾
NaOH → Na+ +OHNaH2PO4 + NaOH = Na2HPO4 +H2O
H2PO4‾ + OH‾ = HPO42‾ + H2O
20.
В клітині :КН2РО4 и К2НРО4.
В плазмі та позаклітинному просторі: NaH2PO4 и Na2HPO4.
[ HPO42 ]
pH pK 2 lg
[ H 2 PO4 ]
[HPO24 ]
= 3,98
[H 2 PO4 ]
[HPO24 ]
lg
7,4 6,8 0,6
[H 2 PO4 ]
21.
Гемоглобінова буферна система в еритроцитахHHb + O2 ⇄ HHbО2.
гемоглобін
оксигемоглобін
HHb ⇄ H+ + Hb‾
KtHb → Kt+ + Hb‾
HHbО2 ⇄ H+ + HbО2‾
KtHbО2 → Kt+ + HbО2‾.
[Hb ]
[Hb ]
pH pK HHb lg
8,2 lg
[HHb ]
[HHb ]
pH pKHHbO2
[HbO2 ]
[HbO2 ]
lg
6,95 lg
[HHbO 2 ]
[HHbO 2 ]
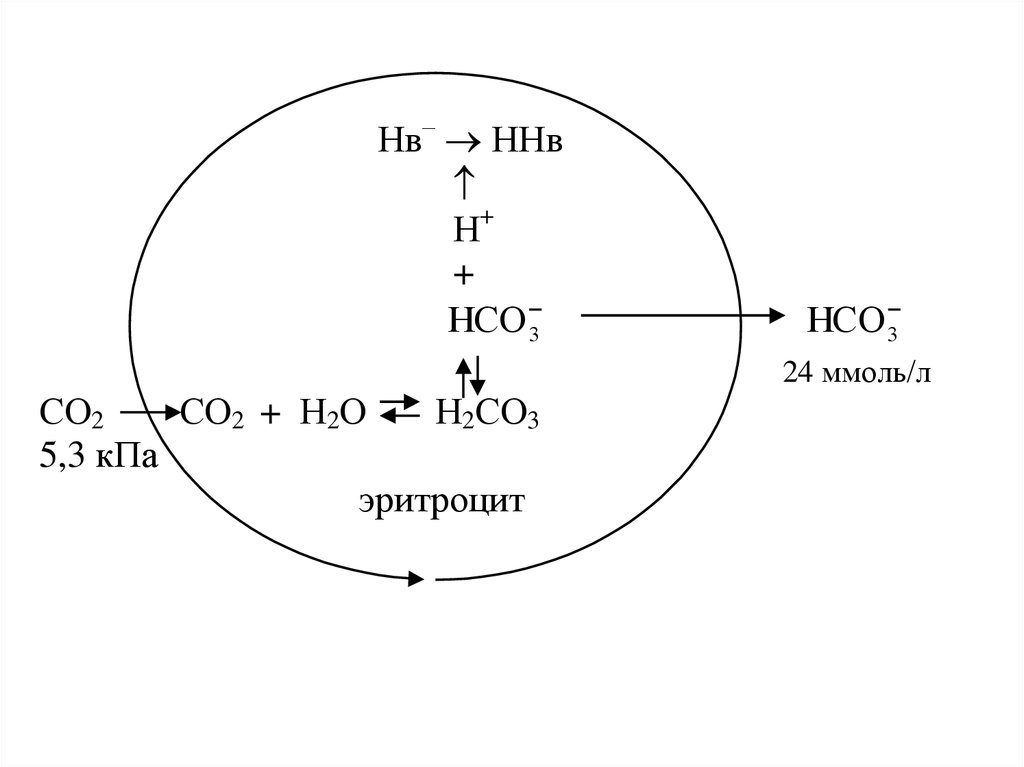
22.
Нв– ННвН+
+
HCO 3
HCO 3
24 ммоль/л
СО2
СО2 + Н2О
Н2СО3
5,3 кПа
эритроцит
23.
Буферна ємність (В) - кількість молей еквіваленту сильноїкислоти або сильної основи, які потрібно додати до одного
літра буферного розчину, щоб змінити його рН на одиницю.
24.
1. Максимальну буферну ємність мають буферні розчини, щомістять рівні концентрації слабкої кислоти і солі, або слабкої
основи і солі.
2. Буферна ємність розчину тим більша, чим вища
концентрація компонентів буферної суміші.
3. В міру додавання до буферного розчину кислоти або лугу
стійкість розчину до зміни рН поступово зменшується.













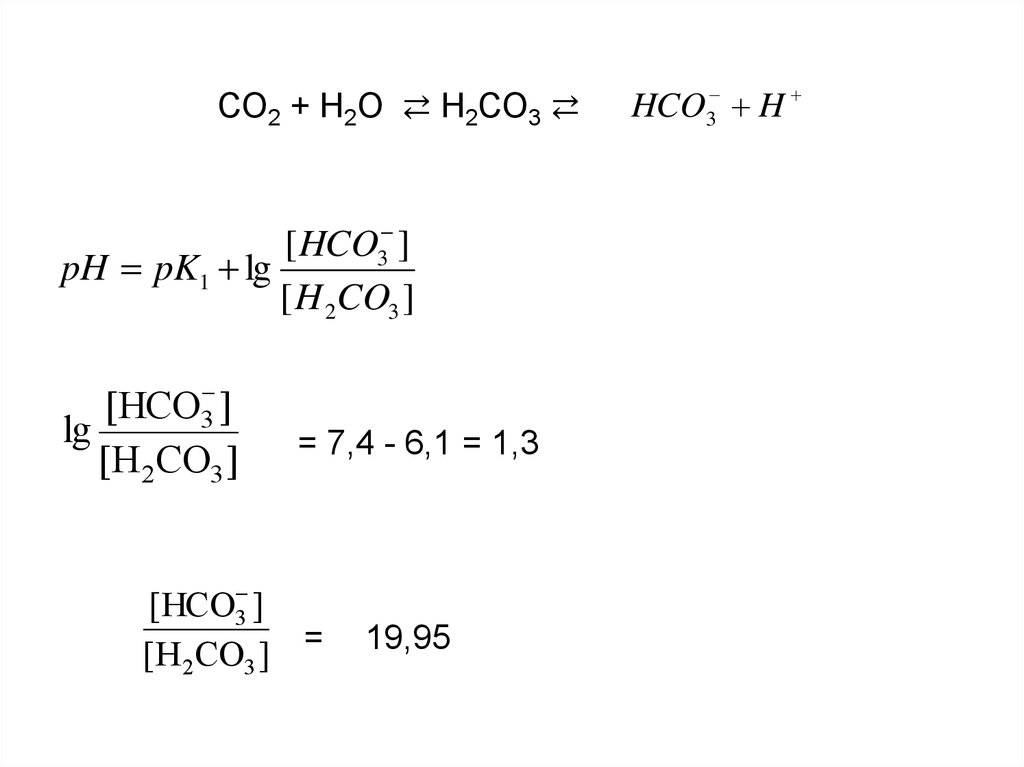





 Биология
Биология Химия
Химия








