Похожие презентации:
Основы молекулярно-кинетической теории
1.
ФИЗИКАЛЕЖНЕВА НИНА ВЯЧЕСЛАВОВНА
К.Т.Н., Д.П.Н., профессор
Legneva_nv@mail.ru
2.
Основымолекулярно-кинетической
теории
Молекулярно-кинетическая теория
(МКТ) – это учение, которое объясняет
тепловые явления в макроскопических
телах и внутренние свойства этих тел
движением и взаимодействием атомов,
молекул и ионов, из которых состоят
тела
3.
В основе МКТ строения вещества лежаттри положения:
Первое положение
• Вещество состоит из частиц
– молекул, атомов и ионов.
• В состав этих частиц входят
более мелкие элементарные
частицы
4.
Первое положение МКТМолекула – наименьшая устойчивая частица
данного вещества.
Молекула обладает основными химическими
свойствами вещества.
Молекула является пределом деления
вещества, то есть самой маленькой частью
вещества, которая способна сохранять
свойства этого вещества
Атом – это наименьшая частица данного
химического элемента.
5.
Второе положение МКТ• Частицы, из которых состоит
вещество, находятся в непрерывном
хаотическом (беспорядочном)
движении
6.
Третье положение МКТЧастицы вещества взаимодействуют
друг с другом – притягиваются и
отталкиваются
7. Основные понятия МКТ
Моль - количество вещества, содержащееодно и то же число частиц, названное
постоянной Авогадро
Молярная масса (М) – масса вещества, взятого
в количестве 1 моль (Кг/моль)
Масса одной молекулы
выражается формулой
8. Основные понятия МКТ
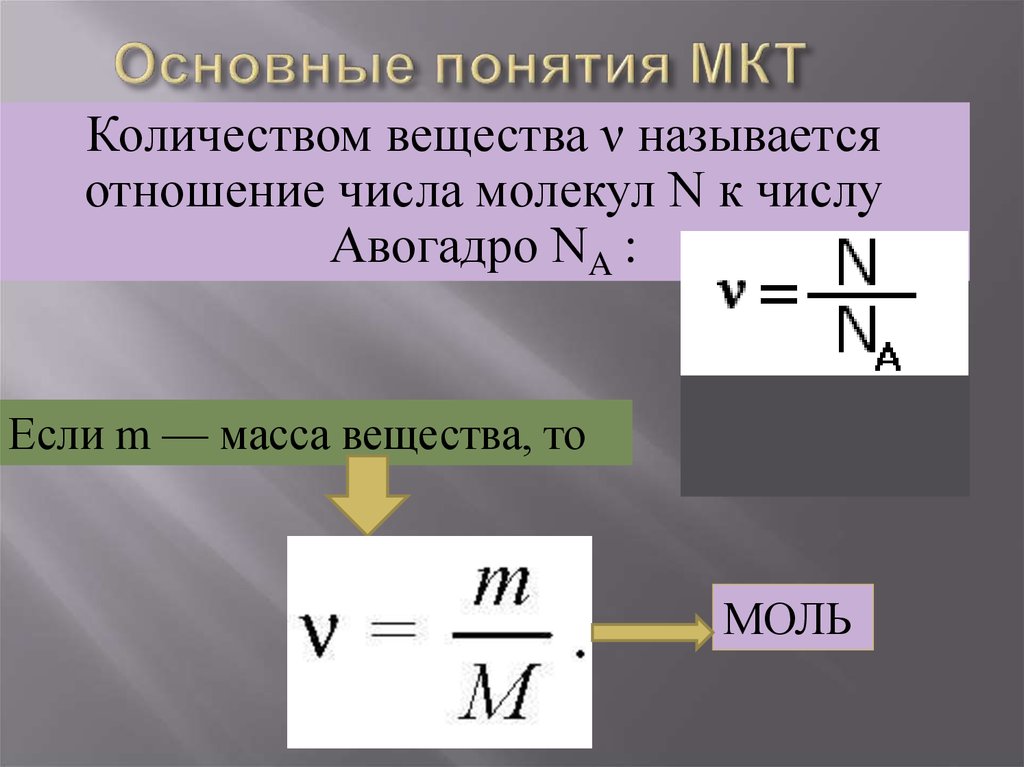
Количеством вещества ν называетсяотношение числа молекул N к числу
Авогадро NA :
Если m — масса вещества, то
МОЛЬ
9. Явления переноса
В термодинамическихсистемах возникают
особые необратимые
процессы, называемые
явлениями переноса, в
результате которых
происходит
пространственный
перенос энергии, массы,
импульса
•диффузия,
•теплопроводность
•внутреннее
трение (вязкость)
10. Явления переноса
1.Теплопроводность – это процесс переносатепловой энергии, обусловленный
хаотическим движением молекул
Перенос энергии в форме теплоты подчиняется
закону Фурье:
jE - плотность теплового потока
λ –теплопроводность
- градиент температуры
11. λ –теплопроводность (лямбда) (коэффициент теплопроводности )
отражает свойство вещества проводить тепловуюэнергию. Чем больше значение коэффициента
теплопроводности материала, тем лучше он
проводит тепло (Вт/(м²*К)
12. Тепловое сопротивление и изоляция
тепловое сопротивление,способность тела
(его поверхности или
какого-либо слоя)
препятствовать
распространению теплового
движения молекул.
Тепловое сопротивление
–величина обратная
коэффициенту
теплопередачи
м²К/вт
13. Явления переноса
2.Диффузия – это обусловленное тепловымдвижением молекул проникновение одних
веществ в объём, занятый другими веществами
Явление диффузии для
химически однородного газа
подчиняется закону Фука:
jm — плотность потока массы
D —коэффициент диффузии
dρ/dx — градиент плотности
14. Коэффициент диффузии
jm — плотность потока массыD —коэффициент диффузии
dρ/dx — градиент плотности
Коэффициент диффузии позволяет провести оценку
количества вещества, прошедшего через единицу площади
(квадратный метр) за единицу времени (секунду).
Единица измерения м²/с
Коэффициент диффузии определяется
свойствами среды и типом диффундирующих
частиц
15. Диффузия и осмос
В том случае, если диффундирующиевещества встречают на своем пути мембрану,
движение замедляется, а в некоторых случаях
прекращается. Диффузия воды по
направлению от своего большего к меньшему
химическому потенциалу через мембрану
носит название осмоса
16. Диффузия и осмос
Иначе говоря, осмос - это диффузия воды илидругого растворителя через полупроницаемую
перепонку, вызванная разностью
концентраций или разностью химических
потенциалов
17.
18.
19. Явления переноса
3.Внутреннее трение (вязкость) возникает вследствиепереноса импульса молекул между слоями
сила внутреннего
трения между двумя
слоями газа (жидкости)
подчиняется закону
Ньютона:
η - динамическая вязкость
dv/dx - градиент скорости,
S - площадь, на которую действует сила F
20. Вязкость жидкости
В реальнойжидкости
вследствие
взаимного
притяжения и
движения молекул
место внутреннее
трение
21. Вязкость жидкости
Оно проявляется как силасопротивления при
помешивании жидкости,
вызывает замедление
движущихся в ней тел
22. Вязкость жидкости
Сила внутреннего трения Fв возникающая вплоскости соприкосновения двух, скользящих
относительно друг друга, слоев жидкости,
пропорциональна площади соприкосновения
слоев и градиенту скорости
23.
Коэффициент вязкости η естьвеличина, численно равная силе
трения, возникающей между двумя
слоями текущей жидкости,
соприкасающимися на площади,
равной единице, при градиенте
скорости между ними тоже равном
единице.
Единица измерения коэффициента
вязкости:
24.
Вязкость жидкостей измеряютпутем наблюдения за их
течением в тонких трубках.
В основе измерений лежит
закон Пуазейля:
25.
26.
Измерение коэффициента вязкостиисследуемой жидкости
вискозиметром Оствальда
осуществляется путем сравнения с
известным коэффициентом
вязкости другой жидкости, взятой
в качестве эталонной.
27.
Идеальным газом называется газ, вкотором молекулы движутся свободно и
взаимодействуют между собой и со
стенками сосуда только при
столкновениях.
Модель идеального газа
удовлетворительно описывает
достаточно разреженные газы
28. Основное параметры газа
Р - давлениеV – объем
T-температура
уравнение Менделеева-Клапейрона
Универсальная
газовая постоянная
29. ГАЗОВЫЕ ЗАКОНЫ
Изобарный процессЗакон Гей- Люссака:
для газа постоянной массы
отношение объема к
температуре постоянно,
если давление газа не
меняется
30. ГАЗОВЫЕ ЗАКОНЫ
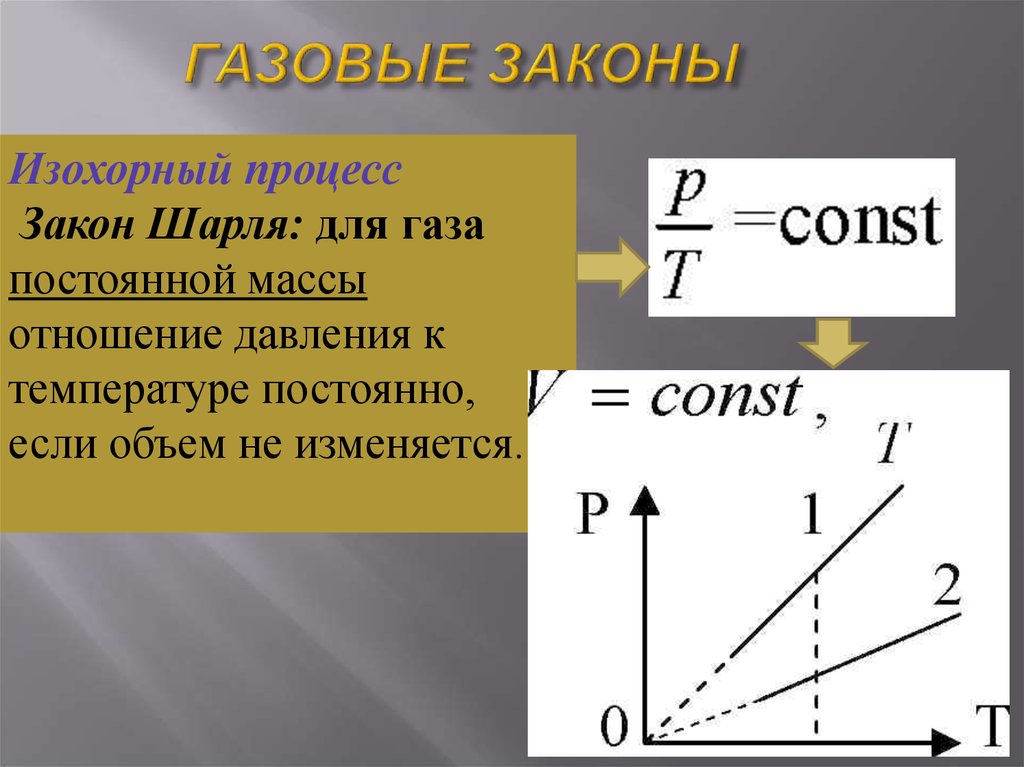
Изохорный процессЗакон Шарля: для газа
постоянной массы
отношение давления к
температуре постоянно,
если объем не изменяется.
31. ГАЗОВЫЕ ЗАКОНЫ
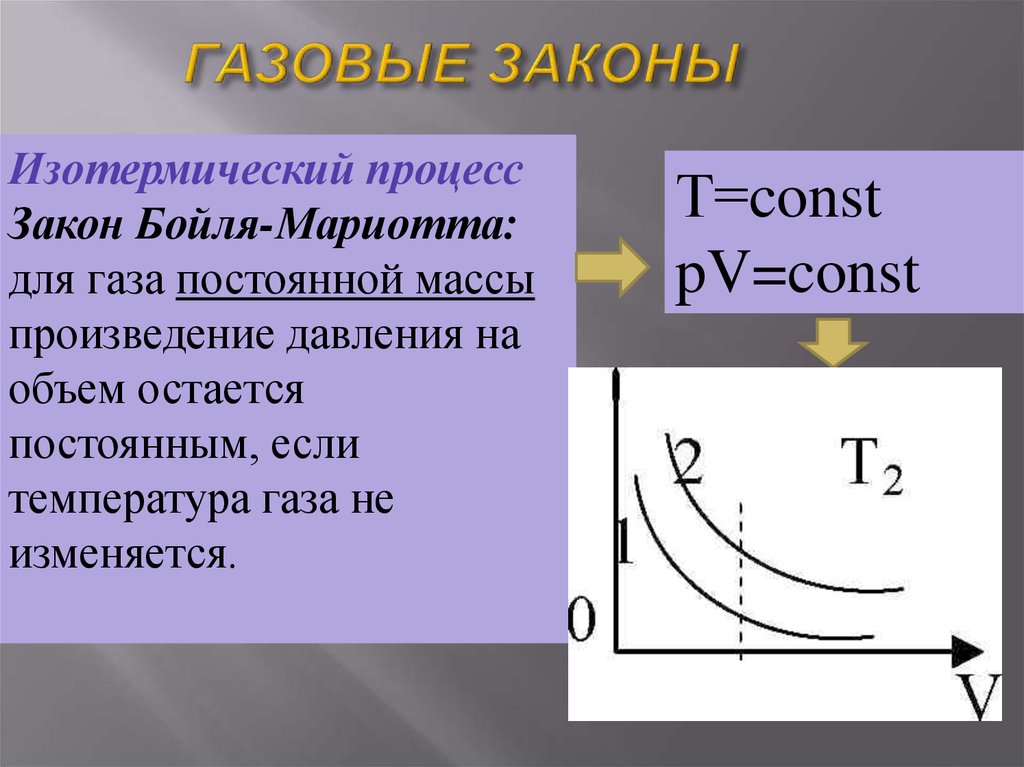
Изотермический процессЗакон Бойля-Мариотта:
для газа постоянной массы
произведение давления на
объем остается
постоянным, если
температура газа не
изменяется.
Т=const
pV=const
32.
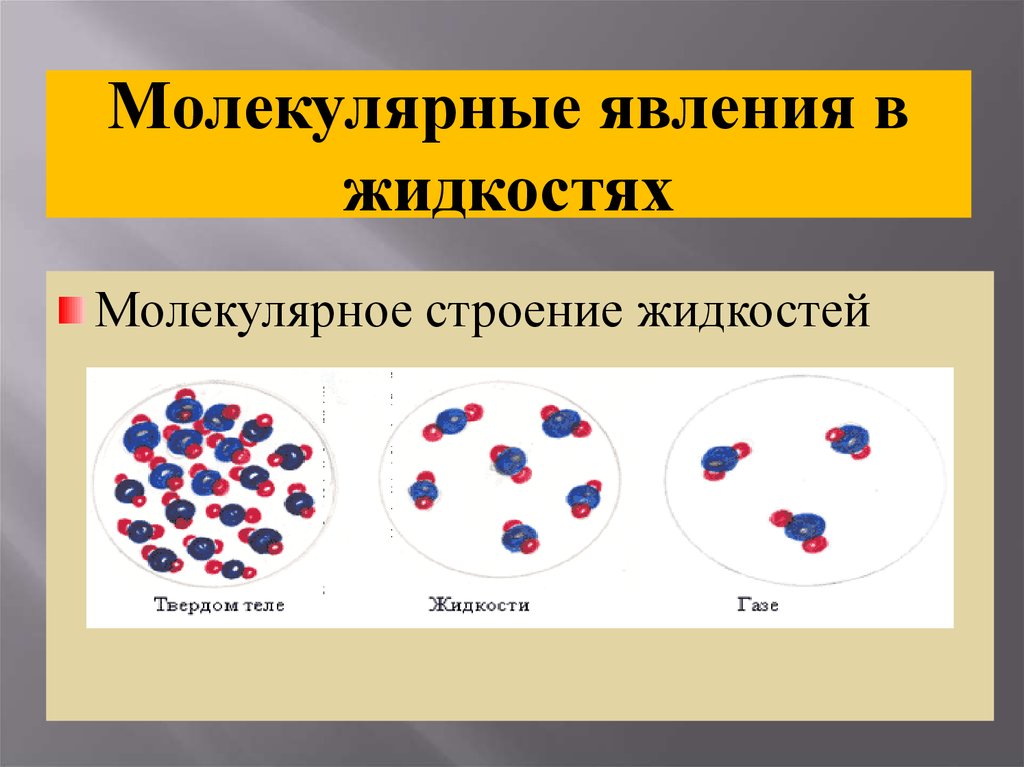
Молекулярные явления вжидкостях
Молекулярное строение жидкостей
33.
Молекулярное строениежидкостей
Молекулы жидкости расположены
близко друг к другу
притяжение между ними не так велико
и они могут скачками менять свое
положение, поэтому жидкость
сохраняет свой объем и принимает
форму сосуда.
Жидкости текучи; их трудно сжать.
34.
35. Поверхностное натяжение
36.
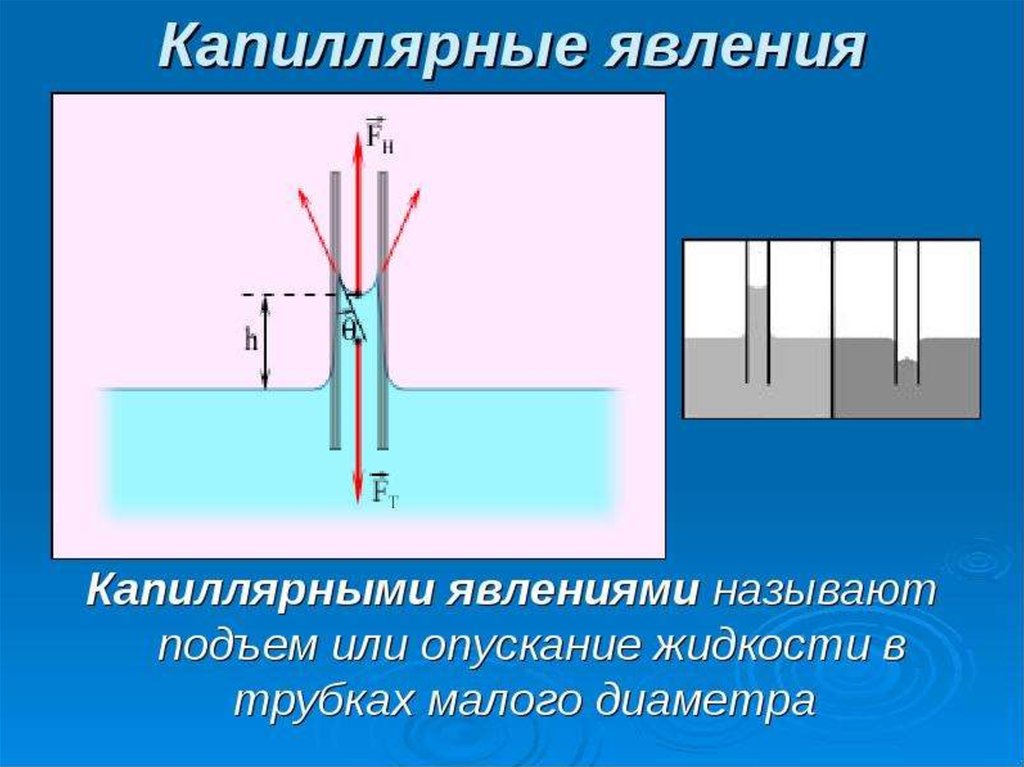
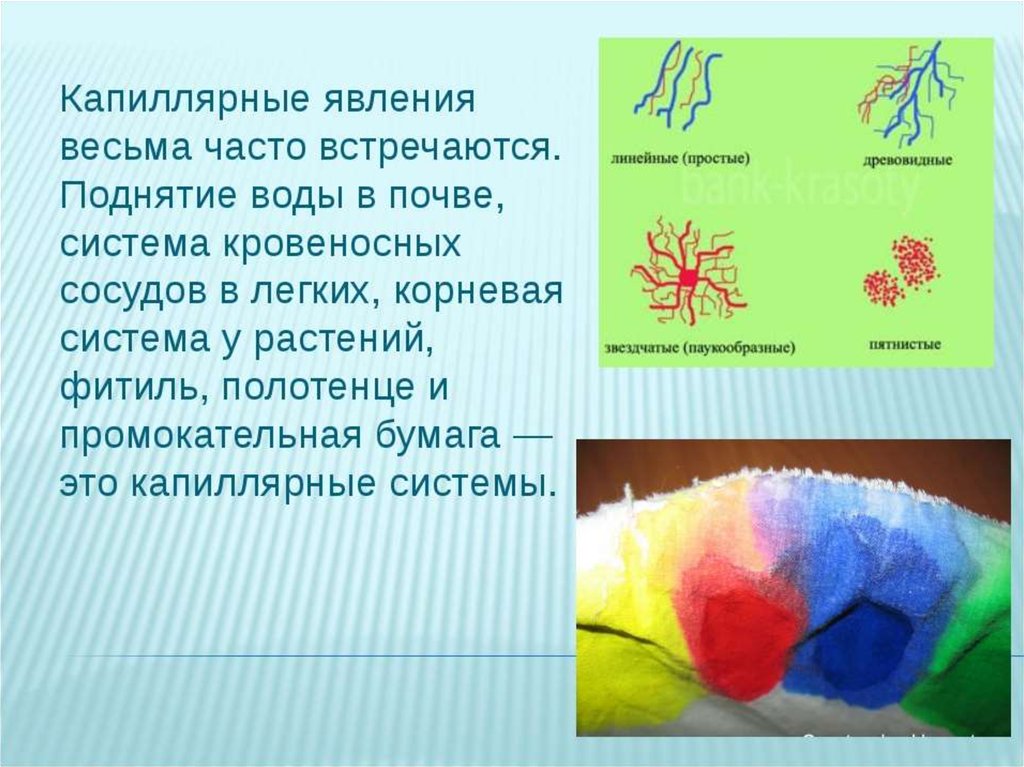
37. Капиллярные явления
38.
39.
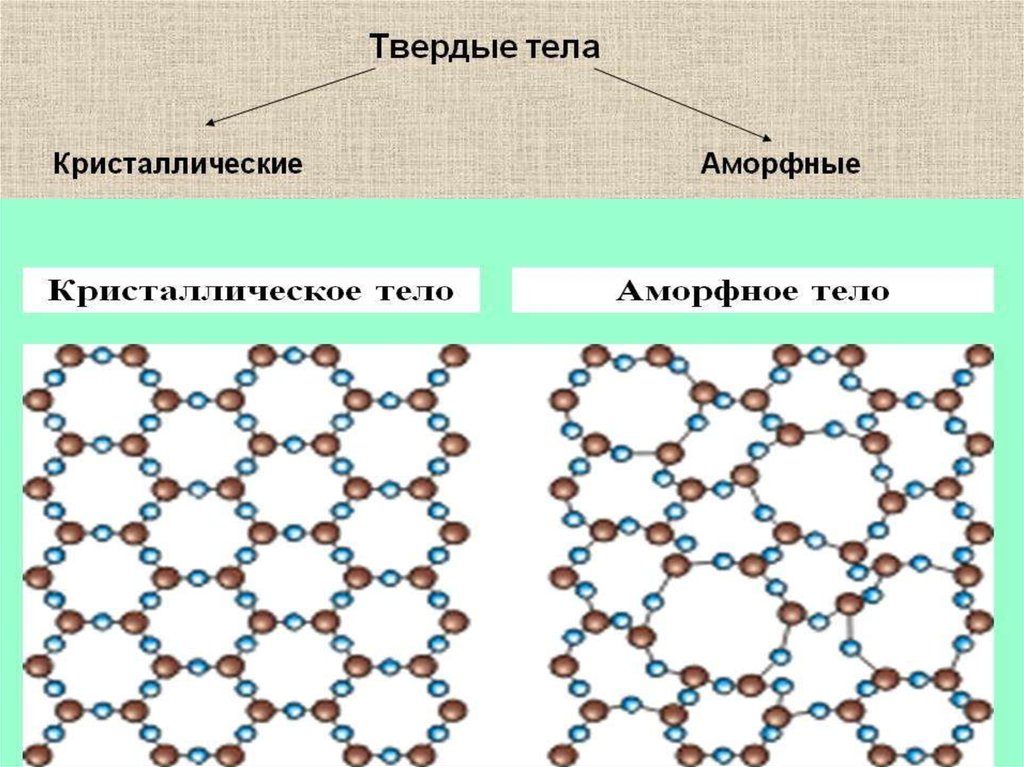
Молекулярные явления в твердых телах:межмолекулярное взаимодействие
40.
41.
42. Механические свойства твердых тел
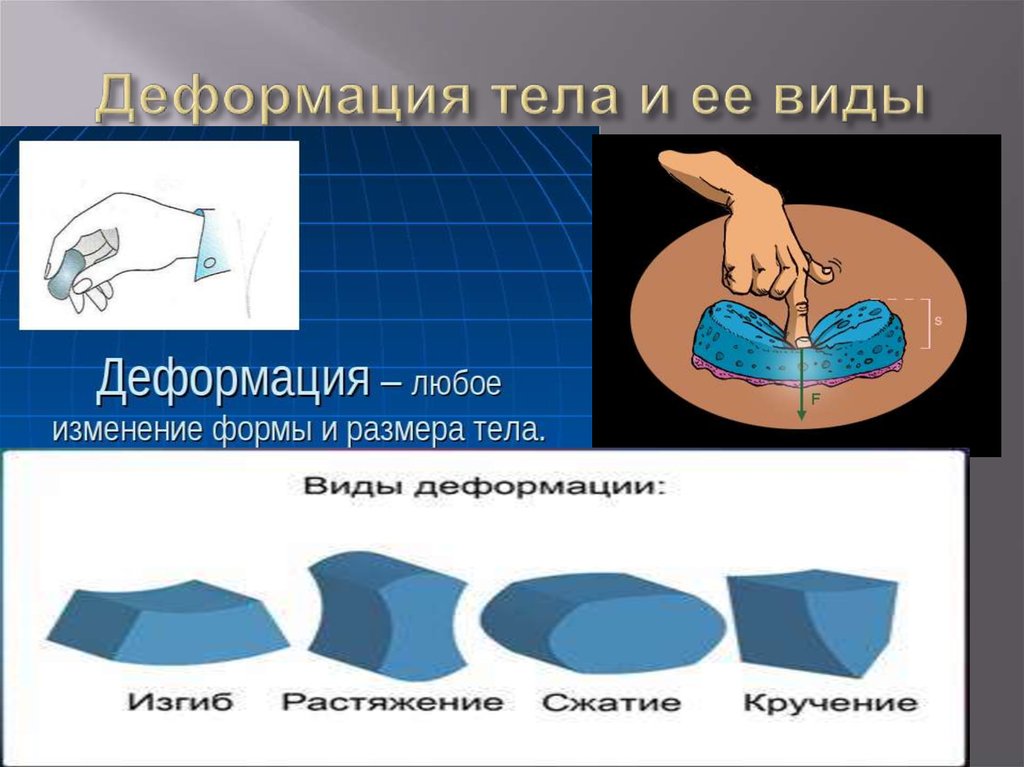
43. Деформация тела и ее виды
44.
Термодинамика рассматривает общиезакономерности превращения энергии в форме
тепла и работы между телами
45.
46.
47.
48.
49. Вечный двигатель первого рода
-устройство, способное бесконечносовершать работу без затрат топлива
или других энергетических
ресурсов. Согласно закону
сохранения энергии, все попытки
создать такой двигатель обречены на
провал
Невозможность осуществления вечного
двигателя первого рода постулируется в
термодинамике как первое начало
термодинамики.
50.
51.
52.
Энтропия замкнутойсистемы, т.е. системы,
которая не
обменивается с
окружением ни
энергией ни веществом,
постоянно возрастает
53.
54.
55.
Применение второго закона к биологическим системам вего классической формулировке приводит, как кажется на
первый взгляд, к парадоксальному выводу, что процессы
жизнедеятельности идут с нарушением принципов
термодинамики
Однако увеличение
энтропии в
необратимых
самопроизвольных
процессах происходит
в изолированных
системах, а
биологические
системы являются
открытыми
56. Илья Романович Пригожин
(25 января 1917,Москва — 28 мая
2003, Брюссель,
Бельгия) —
бельгийский физик
и физикохимик
российского
происхождения.
Лауреат
Нобелевской
премии по химии
1977 года,
56
57.
5758. Что такое синергетика
Древнее понятие «синергия»означает объединение
человеческой и божественной
энергии. Сегодня
«синергетика» трактуется как
наука, занимающаяся
изучением процессов
самоорганизации возникновения, поддержания,
устойчивости и распада
структур самой различной
природы.
58
59. Сущность второго закона термодинамики
Замкнутая (или изолированная) система (гдеотсутствуют обменные процессы со средой)
развивается в сторону возрастания энтропии
(хаоса). Наиболее вероятностное состояние
системы при этом – термодинамическое
равновесие со средой, что для организмов
равнозначно смерти.
59
60. законы физики, справедливы только для замкнутых систем!!!
Систем вероятностного типа способны обмениваться сосредой энергией, веществом и информацией и находиться
«состоянии устойчивого равновесия». Система как бы
«притягивается» к описанным состояниям и старается
«удержаться» в них как можно дольше
Данный стабильный период развития системы
продолжается до тех пор, пока внутренние и внешние
причины дестабилизации не будут угрожать ей
разрушением
60
61. Нестабильный период системы
Нестабильность (кризис) возникает тогда, когдасистема утрачивает свою продуктивность и
возникает необходимость изменения
действующих механизмов на более
совершенные.
При этом система перестает обеспечивать
самонастройку, и как бы сама усиливает
«раскачку», переходя в режим благоприятный для
работы радикальных природных механизмов,
способных обеспечить приспособительную
перестройку
61
62. Нестабильный период
В этом случае система находится в состояниикризиса – нестабильности. Её поведение рождает
множество возможных альтернатив, из которых
она сама выбирает одну
Идея нестабильности системы кладет
конец претензиям на абсолютный
контроль над какой либо сферой
реальности, любым возможным
мечтаниям об абсолютном
контролируемом обществе
Реальность вообще не контролируема в
смысле, который был провозглашен прежней
наукой!!!
62
63. Основные положения синергетики
синергетическая система может находиться вразные моменты времени в состоянии
адаптационного (стабильного) или
бифуркационного (нестабильного) развития,
что предопределяет пути управления системой
63
64. Основные положения синергетики
сложноорганизованнымсистемам нельзя
навязывать пути развития,
однако, ими можно эффективно управлять при
помощи слабых резонансных воздействий,
которые влияют на выбор того или иного пути
развития в моменты, когда развивающаяся
структура оказывается в состоянии бифуркации
64
65. Основные положения синергетики
жесткая устойчиваясистема уязвима перед
внешними
воздействиями
Неустойчивость путь к выживанию,
самообновлению,
развитию и
согласованию всех
ее составных
частей
Хаос является
конструктивным
механизмом
самоорганизации
сложных систем
65
66.
Постулат И.Р. Пригожина состоит в том, что общееизменение энтропии dS открытой системы может
происходить независимо либо за счет процессов обмена с
внешней средой (deS ), либо вследствие внутренних
необратимых процессов (diS ):
dS = deS + diS.
Для изолированных систем deS
= 0, и мы приходим к
классической формулировке
второго закона:
dS = diS = 0.


























































 Физика
Физика








