Похожие презентации:
Металлы Общая характеристика
1. Металлы Общая характеристика
Автор: к.х.н., доцентМартынова Т.В.
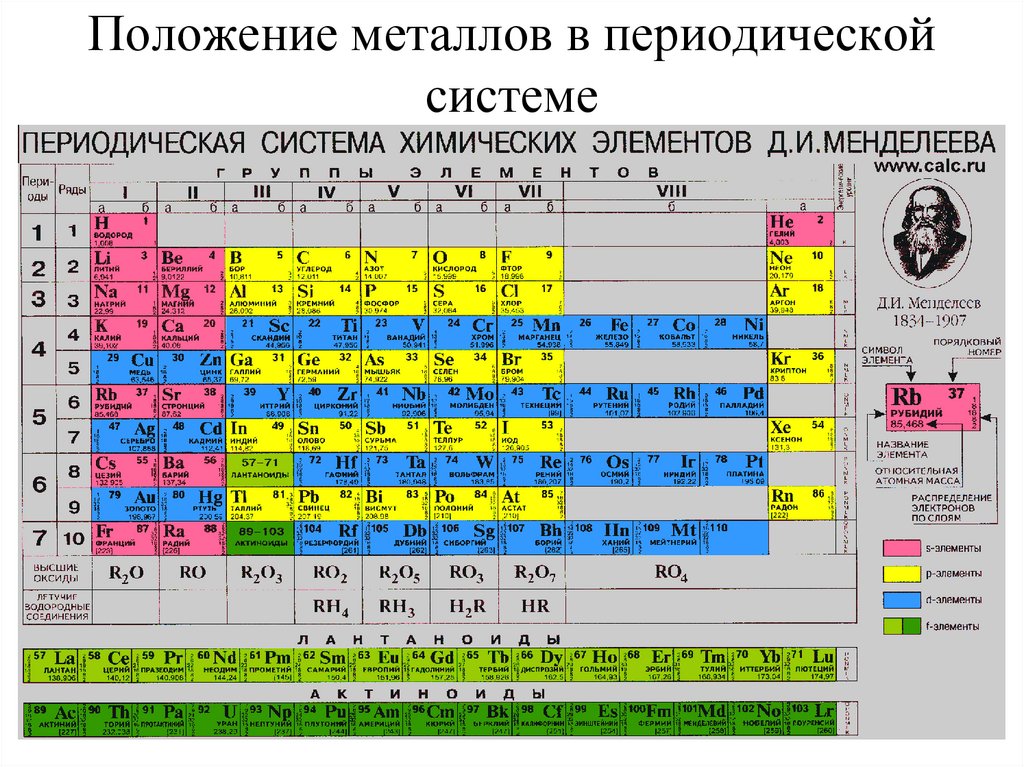
2. Положение металлов в периодической системе
3. Содержание металлов в земной коре
Al–7,5% по массе,
Fe – 4,7
Mn – 0,1
Cr – 0,033
Cu – 0,01
Au - 5·10-7.
4. Металлическая связь
• является делокализованной и ненаправленной,поскольку свободные е- принадлежат всему кристаллу
металла.
• В соответствии с методом МО при взаимодействии 2-х
одинаковых атомов образуются 2 МО – связывающая и
разрыхляющая. При большом числе атомов велико
число МО и число делокализованных е- на них. Энергии
орбиталей близки, что облегчает переход е- между
орбиталями. Совокупность занятых электронами
орбиталей - валентная зона, незаполненные уровни зона проводимости.
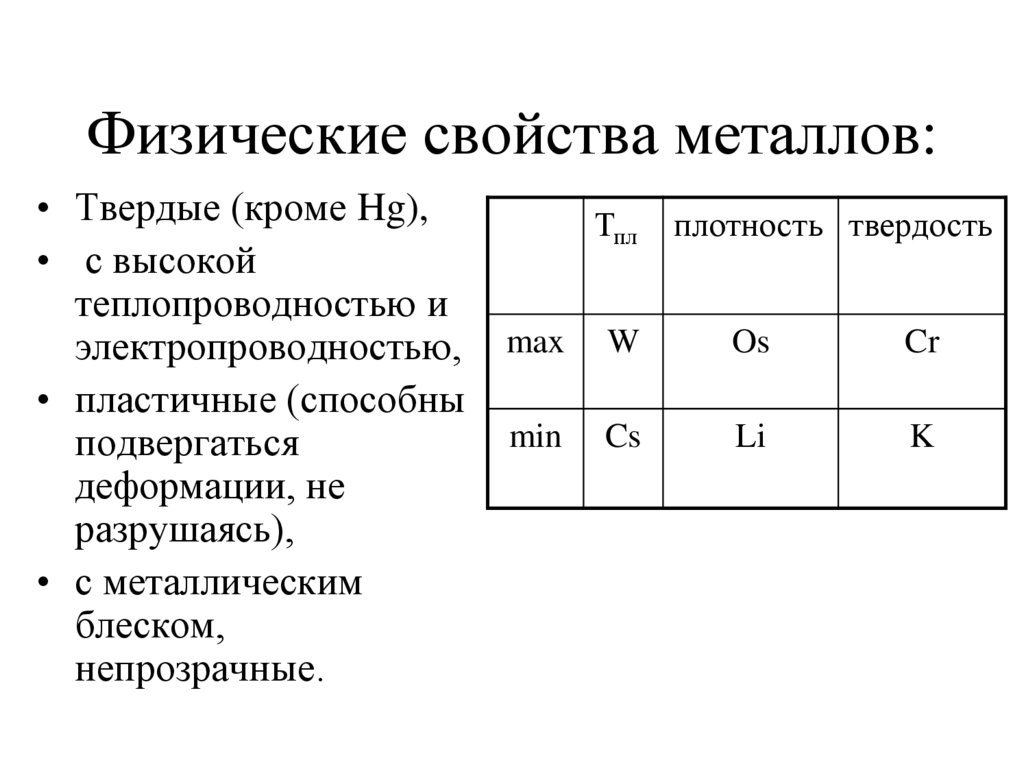
5. Физические свойства металлов:
• Твердые (кроме Hg),• с высокой
теплопроводностью и
электропроводностью,
• пластичные (способны
подвергаться
деформации, не
разрушаясь),
• с металлическим
блеском,
непрозрачные.
Тпл
плотность твердость
max
W
Os
Cr
min
Cs
Li
K
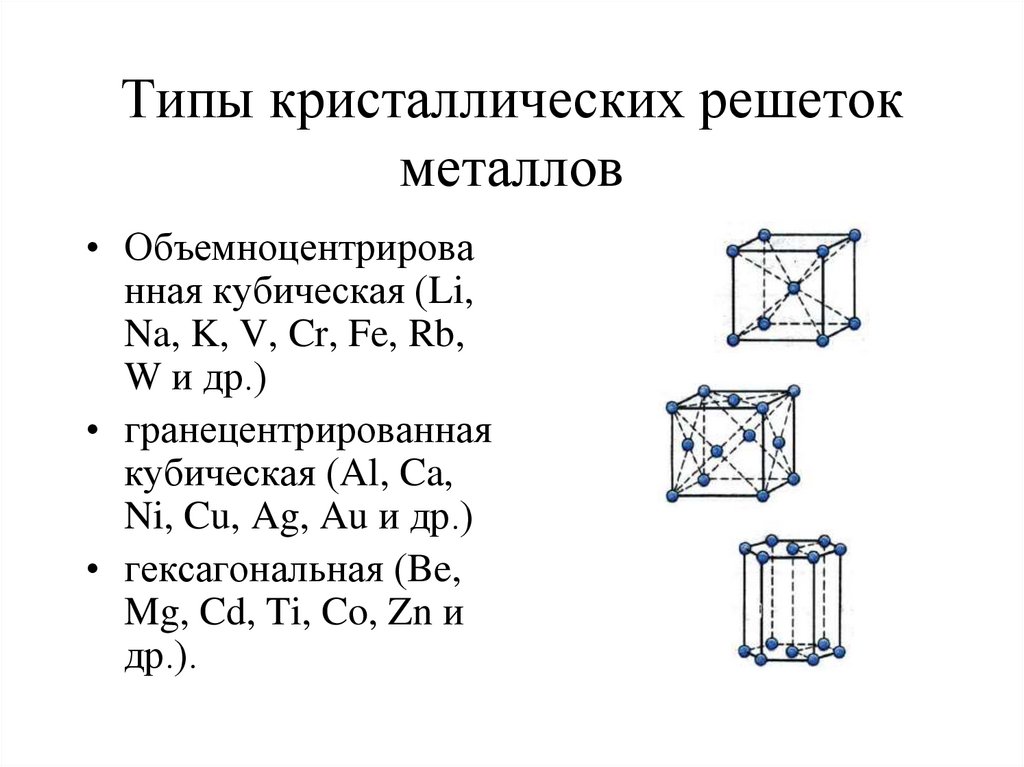
6. Типы кристаллических решеток металлов
• Объемноцентрированная кубическая (Li,
Na, K, V, Cr, Fe, Rb,
W и др.)
• гранецентрированная
кубическая (Al, Ca,
Ni, Cu, Ag, Au и др.)
• гексагональная (Be,
Mg, Cd, Ti, Co, Zn и
др.).
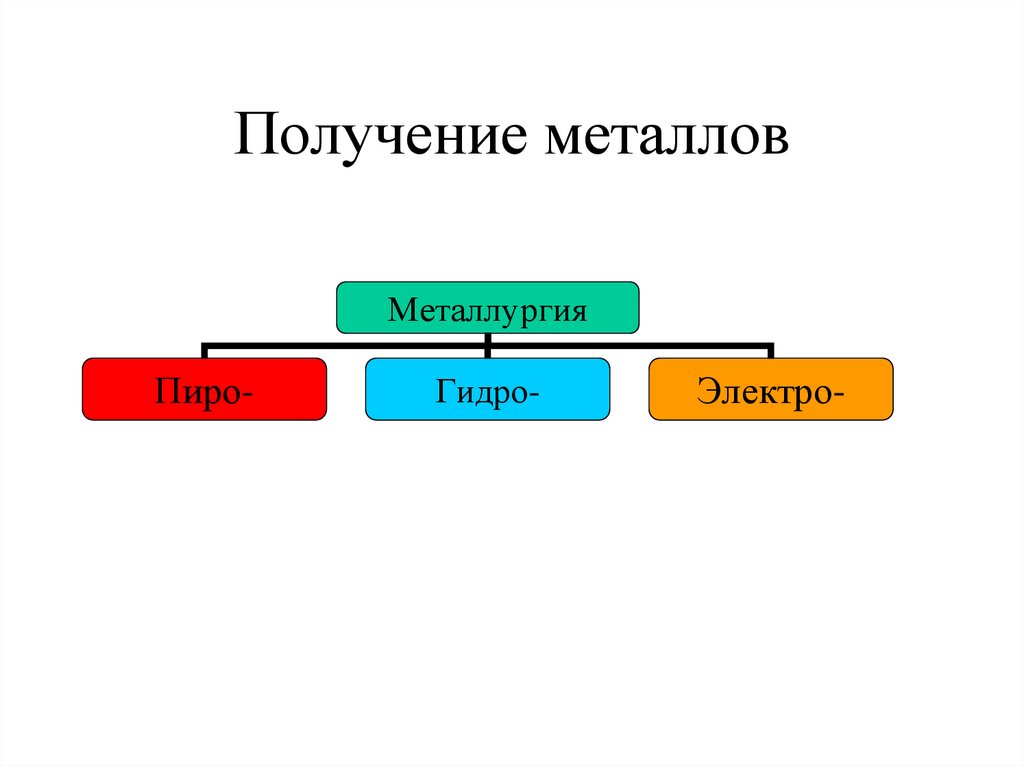
7. Получение металлов
МеталлургияПиро-
Гидро-
Электро-
8. Пирометаллургия
• - извлечение металлов из руд привысоких температурах:
• CuO+C=2Cu+CO↑
• Fe2O3+3CO =2Fe+3CO2
• 2ZnS+3O2=2ZnO+2SO2;
ZnO+C=Zn+CO
• Металлотермия
- восстановление металлов из руд с
помощью других металлов:
• а) алюмотермия:
Cr2O3+2Al=Al2O3+2Cr
• б) кальцийтермия:
2RbCl+Ca=CaCl2+2Rb
9. Гидрометаллургия
• - извлечение металлов из руд воднымирастворами реагентов с последующим
выделением из раствора:
4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH
2Na[Au(CN)2]+Zn=2Na[Zn(CN)2]+2Au
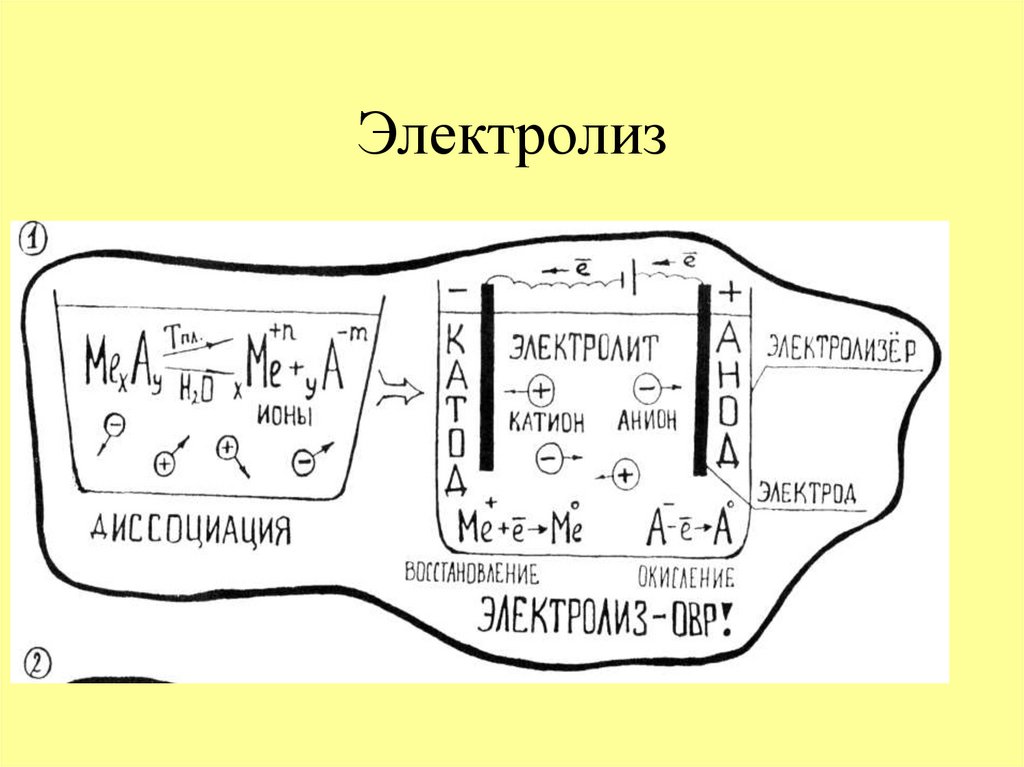
10. Электролиз
11. Общие химические свойства металлов
Ме - восстановители, способные отдавать1-2 е-, превращаясь в положительные ионы.
12. Взаимодействие с неметаллами
• 4Fe+3O2=2Fe2O3в-ль 2Fe0-6e-=2Fe3+
ок-ль O20+4e-=2O2• 2Na+H2=2NaH
в-ль Na0-e-=Na+
ок-ль H20+2e-=2H• 2Al+3Br2=2AlBr3
в-ль Al0-3e-=Al3+
ок-ль Br2+2e-=2Br • 3Sr+2P=Sr3P2
в-ль Sr0-2e-=Sr2+
ок-ль P0 +3e-=P3-
оксид железа (III)
6|2
4|3
гидрид натрия
1|2
2|1
бромид алюминия
3|2
2|3
фосфид стронция
2|3
3|2
низкая
энергия
ионизации у
Ме и высокое
сродство к
е- у НеМе
13. Восстановительные свойства металлов в растворах
характеризуются значением стандартного
электродного потенциала (положением в ряду
стандартных электродный потенциалов).
Металлы условно делятся на:
активные (Е0<-0,41 В),
средней активности (-0,41< Е0 <0 В),
малой активности (0 <Е0<0,8 В),
благородные (Е0>0,8 В).
14. Взаимодействие с водой
• Ме до Н →восстанавливают H2↑:• Активные металлы → гидроксиды:
2Li+2H2O=2LiOH+H2↑
Li0-e-=Li+
│2
2H++2e-=H2
│1
• Средней активности → оксиды (при высоких tо
образующиеся нерастворимые гидроксиды
разлагаются):
2Fe+3H2O=t Fe2O3+3H2↑
Fe0-3e-=Fe3+
│2
2H++2e-=H20 │3
• Ме, после Н - не взаимодействуют.
15. С растворами щелочей
взаимодействуют Ме, оксиды и гидроксидыкоторых обладают амфотерными свойствами:
Be, Al, Zn, Sn, Pb.
• Окислитель – H2O.
• Щелочь - среда, переводящая гидроксид в
комплексный ион – слабый электролит.
• 2Al+6H2O+6NaOH=2Na2[Al(OH)6]+3H2↑
2Al+6H2O+6OH-=2[Al(OH)6]3-+3H2↑
16. С кислотами - неокислителями
Ме, стоящие до Н → соль + H2↑ .• Zn+2HCl=ZnCl2+H2↑
Zn0-2e-=Zn2+ 2│1
2H++2e-=H2 2│1
17. С кислотами-окислителями взаимодействуют все Ме кроме Au и Pt
• 1) HNO3 : восстановление N5+ тем глубже, чемактивнее Ме и меньше концентрация к-ты:
3Cu+8HNO3(разб)=3Cu(NO3)2+2NO↑+4H2O
Cu0-2e-=Cu2+ 2|3
N+5+3e-=N+2
3|2
• 10Na+12HNO3(разб)=N2↑+10NaNO3+6H2O
Na0-e-=Na+
1|10
2N+5+10e-=N2 10|1
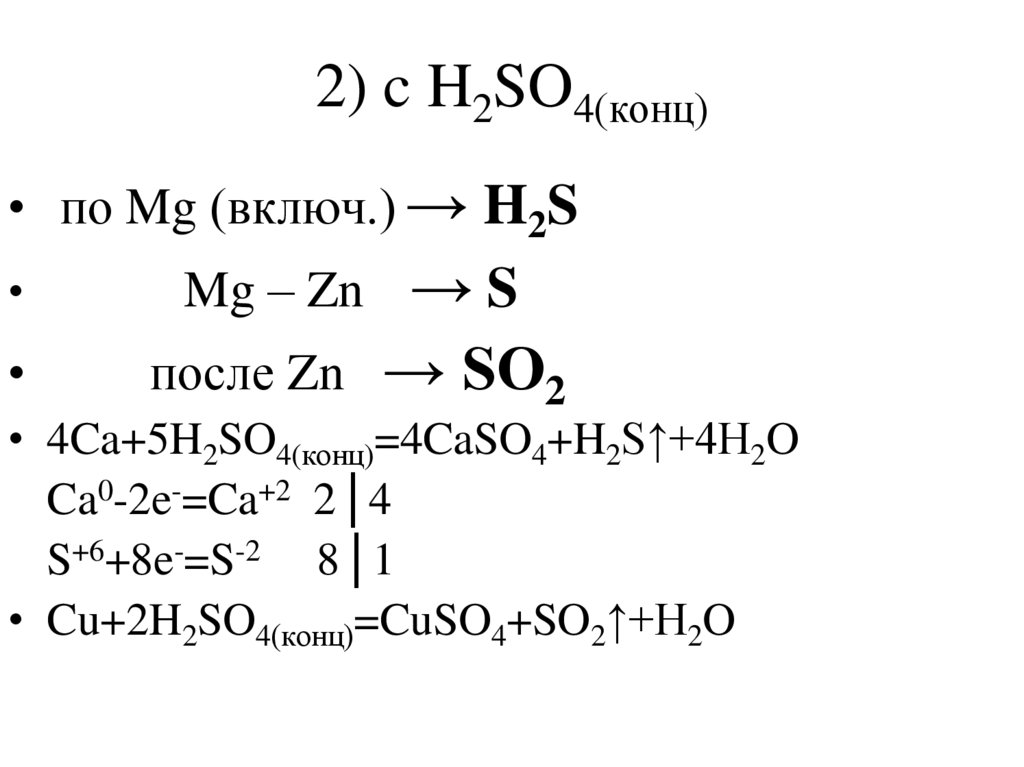
18. 2) c H2SO4(конц)
• по Mg (включ.) → H2S→S
после Zn → SO2
Mg – Zn
• 4Ca+5H2SO4(конц)=4CaSO4+H2S↑+4H2O
Ca0-2e-=Ca+2 2│4
S+6+8e-=S-2 8│1
• Cu+2H2SO4(конц)=CuSO4+SO2↑+H2O
19. С растворами солей
Ме, начиная с Mg, вытесняют правее стоящиеМе из растворов их солей:
• Zn+Pb(NO3)2=Pb+Zn(NO3)2
Zn0-2e-=Zn2+
Pb2++2e-=Pb0
20.
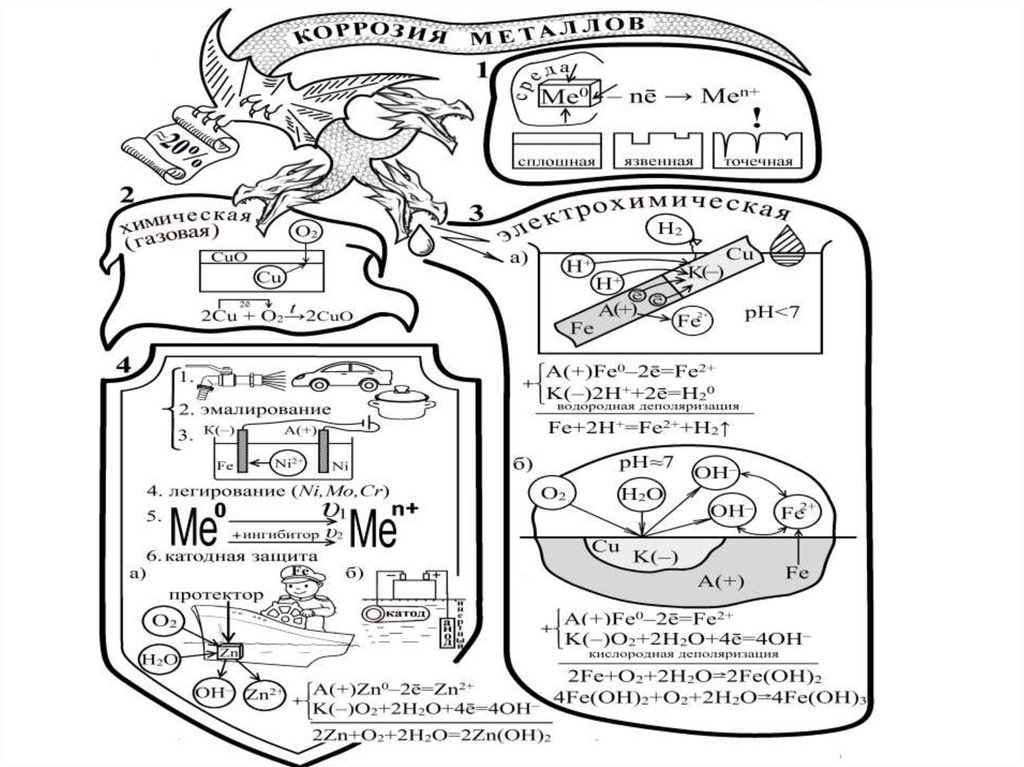
21. Коррозия металлов
- разрушение металлов под действием факторовокружающей среды.
Коррозия
Химическая
Электрохимическая
22. Химическая коррозия
- гетерогенный процесс, протекающий привысоких to, в атмосфере агрессивных газов
(газовая коррозия), или в среде жидких
неэлектролитов. Подвержены: арматура печей,
детали двигателей внутреннего сгорания,
лопатки турбин.
• Сплошная и плотная пленка продуктов коррозии,
химически стойкая, с коэффициентом объемного
расширения близким к коэффициенту объемного
расширения металла – защитная пленка.
23. Гетерогенная структура сплава
• 1 - беспорядочно ориентированные кристаллиты. 2 –шлаковые включения, 3- межкриталлитное вещество,
4 – интерметаллическое соединение, 5 – зона
твердого раствора, обедненная легирующим
компонентом, 6 – оксидная пленка с порой в ней.
24. Электрохимическая коррозия
- разрушение металла в среде электролита.• Поверхность Ме неоднородна (включения,
дефекты, грязь). В растворе электролита на
таких участках устанавливается, отличный от
основного металла потенциал.
• На поверхности Ме создается система
локальных, короткозамкнутых через Ме
гальванических элементов.
• Работа этих микроскопических элементов
сопровождается коррозионным разрушением
металла.
25. Модель гальвано-пары Fe-Cu в кислой и нейтральной средах:
• Fe (более активный металл, с более отрицательнымэлектродным потенциалом) - анод (-):
А(-)Fe – 2e- = Fe2+.
• Cu (менее активный металл) - катод (+) .
В кислой среде (пленка конденсата на металле в условиях
загрязнения атмосферы газами SO2, CO2, H2S) на катоде:
К(+) 2Н+ +2е- =Н2 (водородная деполяризация).
Fe+2H+ =Fe2+ + H2
В нейтральной среде (при достаточно чистой атмосфере)
восстанавливается растворенный в воде О2:
К(+) О2+2Н2О +4е- =4ОН-(кислородная деполяризация).
Fe+O2+2H2O=Fe(OH)2 ↓
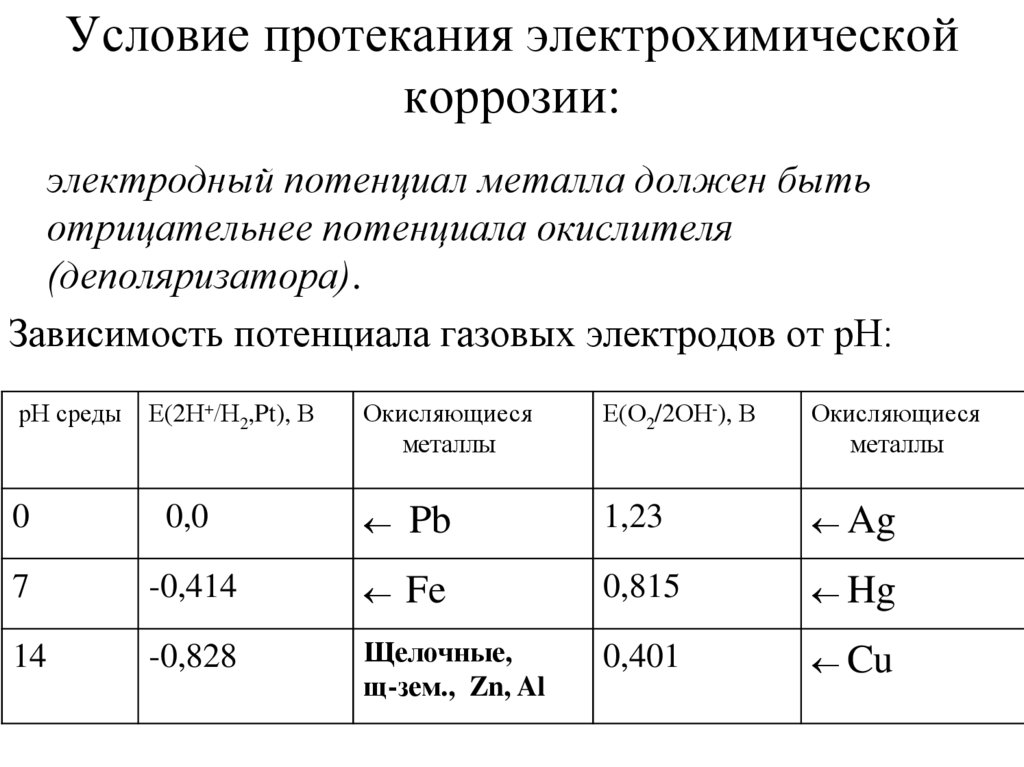
26. Условие протекания электрохимической коррозии:
электродный потенциал металла должен бытьотрицательнее потенциала окислителя
(деполяризатора).
Зависимость потенциала газовых электродов от рН:
pН среды
Е(2Н+/Н2,Pt), В
Окисляющиеся
металлы
Е(О2/2ОН-), В
Окисляющиеся
металлы
0
0,0
Pb
1,23
Ag
7
-0,414
Fe
0,815
Hg
14
-0,828
Щелочные,
щ-зем., Zn, Al
0,401
Cu
27. Пассивность металла
– состояние повышенной коррозионной устойчивости
металлов, которое не соответствует их
термодинамической устойчивости.
Fe,Cr, Al устойчивы в концентрированной HNO3,
Fe, Ni - в NaOH,
Al - на воздухе.
Причина – формирование хемосорбированного слоя
атомов кислорода на активных центрах поверхности
металла с возможной его трансформацией в фазовый
оксид.
У металлов с незавершенным d-слоем при смещении
потенциала положительнее потенциала коррозии
наблюдается переход в пассивное состояние.
28. Защита металлов от коррозии
• 1). Электрохимическая защита :а). Анодная защита – перевод
пассивирующихся металлов (Fe, Ni, Cr, Mo, Ti,
Zr) в пассивное состояние анодным током
высокой плотности.
б). Катодная защита – соединение изделия с
отрицательным полюсом источника тока, либо
защита протекторами из более активных
металлов (Mg, Zn, Al их сплавы)
29.
• 2) Легирование сплавов – введение в сплавыдобавок, повышающих химическую стойкость.
• 3) Изоляция поверхности металлов от
воздействия окружающей среды нанесением
различных покрытий (краски, лаки, смазки и др.)
• 4) Ингибирование среды – введение
ингибиторов - веществ, которые, адсорбируясь
на активных центрах поверхности, понижают
скорость коррозии Ме.





















 Химия
Химия








