Похожие презентации:
Металлы. Общая характеристика
1.
ГлавнаяПоложение в
ПСХЭ
Строение
атомов
Изменение
свойств
Металлическая
связь
Физические
свойства
Аллотропия
Кроссворд
4/19/16
Металлы
Строение, физические свойства
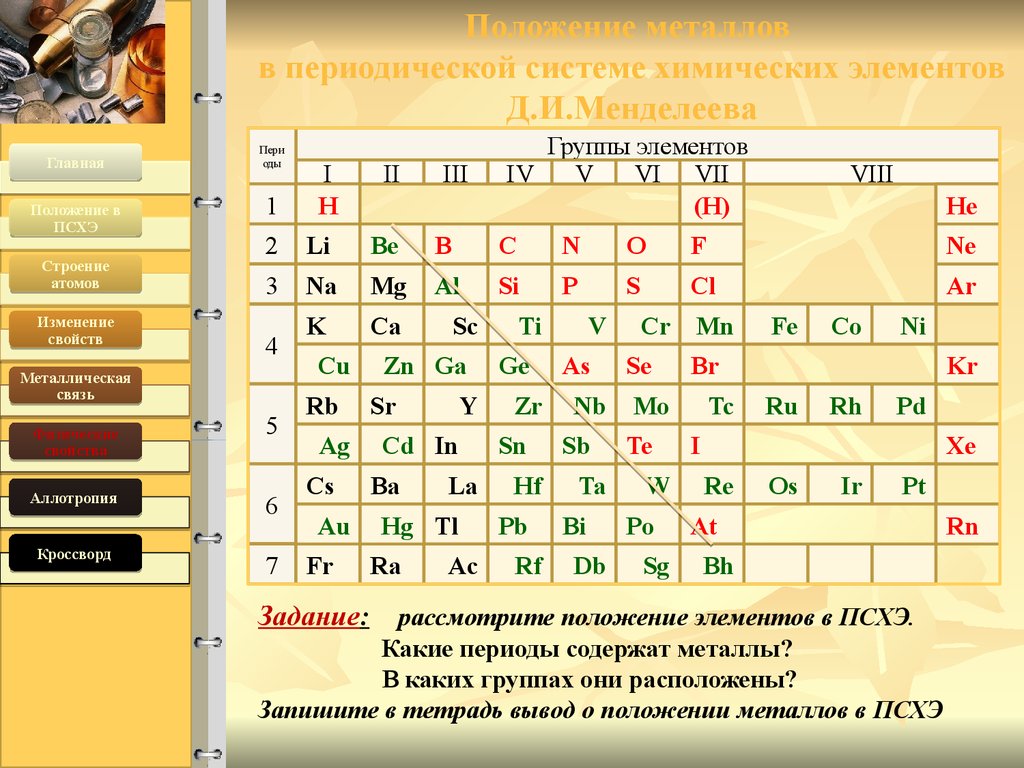
2. Положение металлов в периодической системе химических элементов Д.И.Менделеева
ГлавнаяПоложение в
ПСХЭ
Строение
атомов
Изменение
свойств
Пери
оды
1
Аллотропия
Кроссворд
III
VIII
He
Li
Be
B
C
N
O
F
Ne
3
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
4
5
6
7
Cu
Rb
Ag
Cs
Au
Fr
Задание:
4/19/16
II
2
Металлическая
связь
Физические
свойства
I
H
Группы элементов
IV
V
VI VII
(H)
Sc
Zn Ga
Sr
Y
Cd In
Ba
La
Hg Tl
Ra
Ac
Ti
Ge
Zr
Sn
Hf
Pb
Rf
V
As
Nb
Sb
Ta
Bi
Db
Cr
Se
Mn
W
Po
Sg
Co
Ni
Br
Mo
Te
Fe
Tc
Kr
Ru
Rh
Pd
I
Xe
Re
Os
Ir
Pt
At
Bh
рассмотрите положение элементов в ПСХЭ.
Какие периоды содержат металлы?
В каких группах они расположены?
Запишите в тетрадь вывод о положении металлов в ПСХЭ
Rn
3. Особенности строения атомов металлов
Соколова О.Е.Особенности строения атомов металлов
Задание: определите распределение электронов по
энергетическим уровням у элементов:
Главная
Положение в
ПСХЭ
Строение
атомов
Изменение
свойств
Металлическая
связь
Физические
свойства
Аллотропия
Кроссворд
4/19/16
Na
20 Са
26 Fe
11
2е 8е 1е
2е 8е 8е 2е
2е 8е 14е 2е
82
Pb 2е 8е 18е 18е 32е 4е
51
Sb 2е 8е 18е 18е 5е
но
Вывод: атомы металлов имеют большой радиус и малое
число электронов на последнем уровне.
Исключение составляют атомы олова Sn, свинца Pb,
германия Ge – 4 электрона, сурьмы Sb и висмута Bi –
5 электронов,, полония Ро – 6 электронов
4.
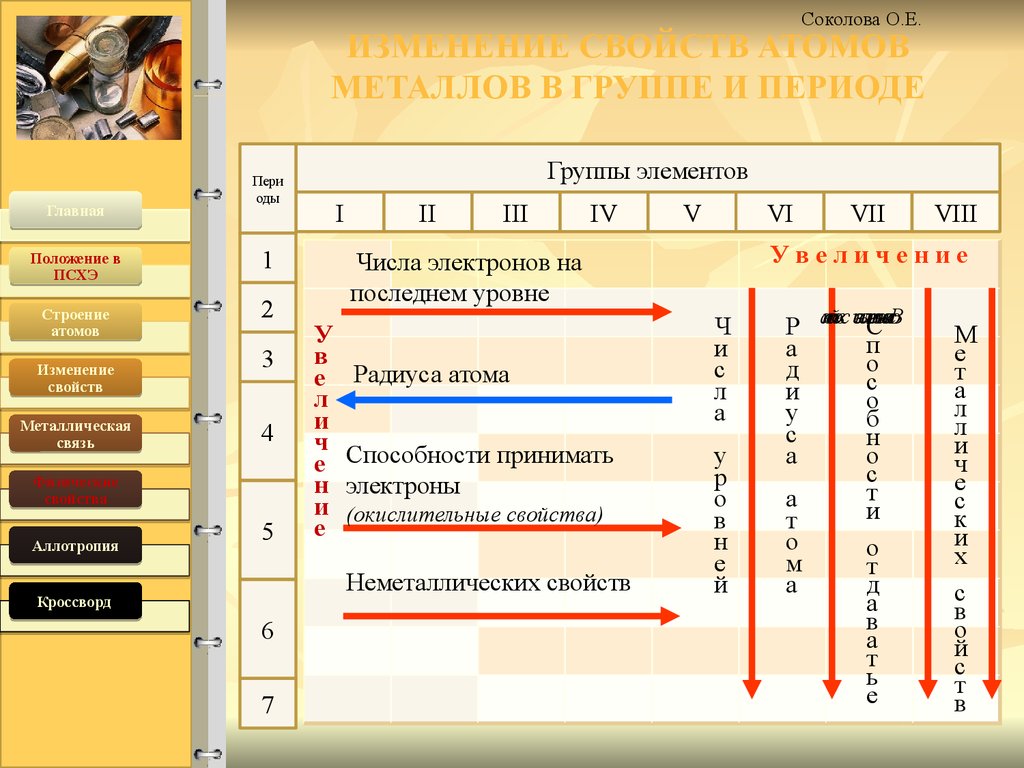
Соколова О.Е.ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ
МЕТАЛЛОВ В ГРУППЕ И ПЕРИОДЕ
Главная
Положение в
ПСХЭ
Строение
атомов
Изменение
свойств
Металлическая
связь
2
3
4
5
II
III
IV
6
7
V
VI
У
в
е
л
и
ч
е
н
и
е
Радиуса атома
Способности принимать
электроны
(окислительные свойства)
VII
VIII
Увеличение
Числа электронов на
последнем уровне
Неметаллических свойств
Кроссворд
4/19/16
I
1
Физические
свойства
Аллотропия
Группы элементов
Пери
оды
Ч
и
с
л
а
у
р
о
в
н
е
й
всйовс ы
еньлт
еивонт
ассоВ
С
Р ат
п
а
о
д
с
и
о
у
б
с
н
а
о
с
т
а
и
т
о
о
м
т
д
а
а
в
а
т
ь
е
М
е
т
а
л
л
и
ч
е
с
к
и
х
с
в
о
й
с
т
в
5. Металлическая связь
Соколова О.Е.Металлическая связь
Главная
Na+0
Na+0
Na0+
Na0+
Na0+
Na+0
Na0+
Na+0
Na0
Положение в
ПСХЭ
Строение
атомов
Изменение
свойств
Металлическая
связь
Физические
свойства
Аллотропия
Металлическая
связь – это особый
тип
связи
в
металлах
и
сплавах
между
атомами и ионами
металлов за счет
обобществленных
электронов.
Кроссворд
4/19/16
Вещества с металлической связью имеют
металлические кристаллические решетки
6.
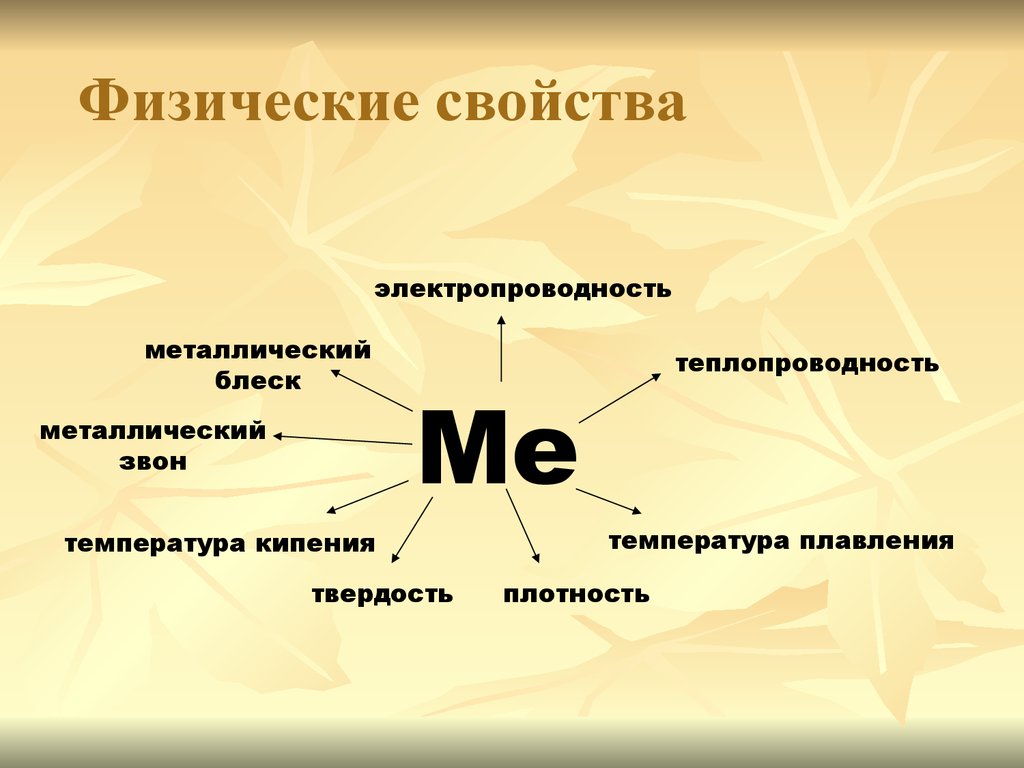
Соколова О.Е.ФИЗИЧЕСКИЕ СВОЙСТВА
Электропроводность
Пластичность
Плотность
Теплопроводность
металлов
и блеск
ковкость
различная
металлов
Температура
Металлический
плавления
различная
Главная
Положение в
ПСХЭ
Строение
атомов
Изменение
свойств
Металлическая
связь
Физические
свойства
3370
21.45 →
→
обусловлена
большой е
связана сое
19.3
подвижностью
смещением
слоев
электронов, которые
кристаллической
сталкиваясь
с
решетки
колеблющимися
атомами
и друг
ионами
относительно
обмениваются
1755 с ними
друга
энергией.
11.34
1539
Происходит
выравнивание
тем-8.9
961 7.87
пературы по всему
660
куску металла
+
328
Аллотропия
2.7
Кроссворд
4/19/16
-
Pt
Pb
W Au
Ptметаллы
Fe Cu
Ag
Тяжелые
Fe
Al
связана с
направленным
движением
электронов при
помещении
металла в
электрическое
поле
98
1.74
-39
0.5
Al
Mg
LiHg
PbЛегкие
Naметаллы
7. Физические свойства
электропроводностьметаллический
блеск
металлический
звон
теплопроводность
Ме
температура кипения
твердость
температура плавления
плотность
8.
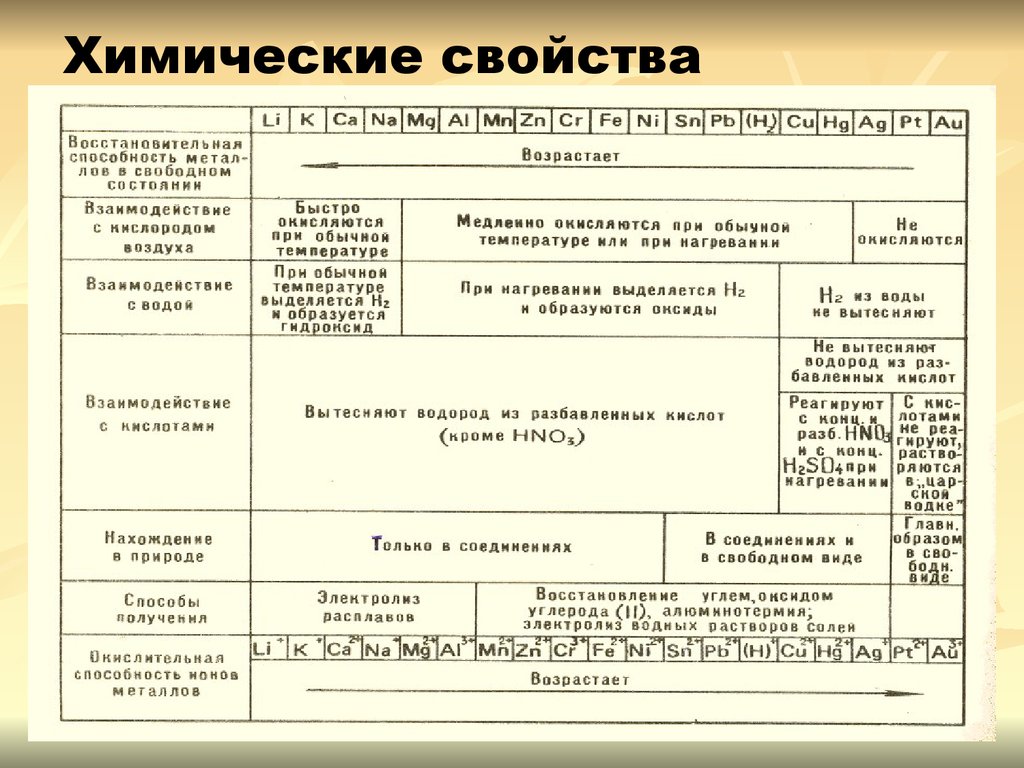
*Al, Zn, Be cо щелочами9. Химические свойства
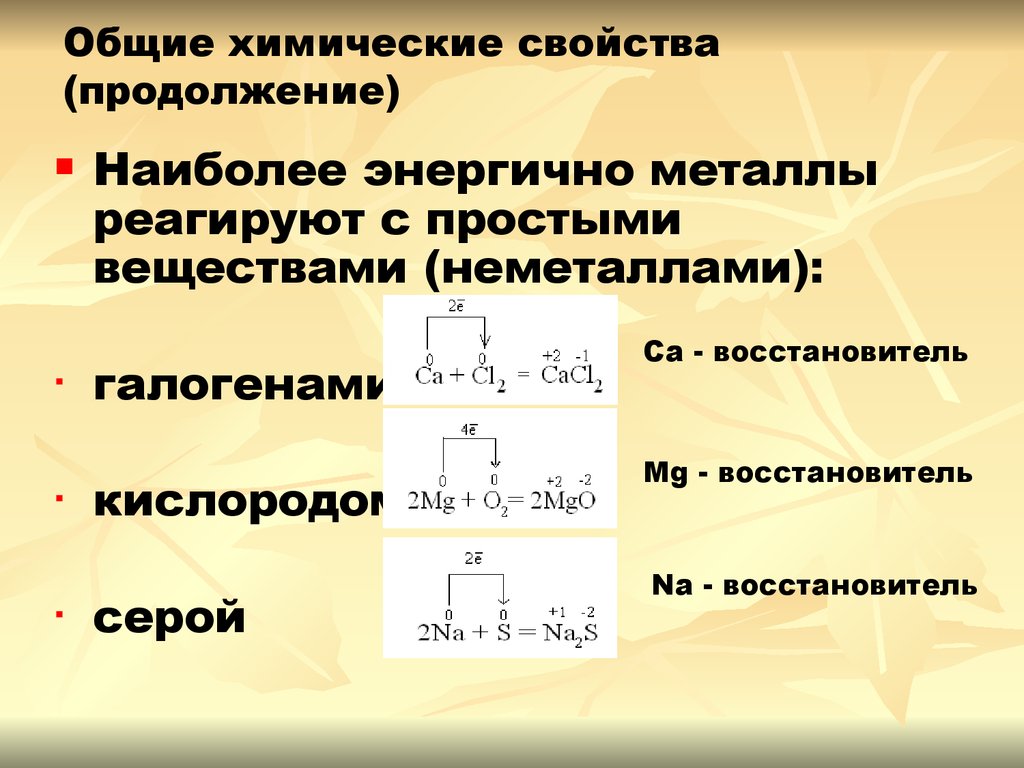
10. Общие химические свойства (продолжение)
▪▪
▪
Наиболее энергично металлы
реагируют с простыми
веществами (неметаллами):
галогенами
кислородом
серой
Ca - восстановитель
Mg - восстановитель
Na - восстановитель
11. Химические свойства металлов
Взаимодействие с неметаллами:с кислородом
Li K Ca Na
Mg Al Zn Cr Fe Ni Pb Cu Hg Ag
При обычных
условиях
Медленно или при
нагревании
M + О2 →
оксид,
спероксид
серой
с галогенами
M + O2 → оксид
Pt Au
M + O2
≠
12. Общие химические свойства (продолжение)
Металлы могут окисляться такжеионами водорода и ионами
других металлов.
Металлы реагируют со
сложными веществами:
Na - восстановитель
водой:
кислотами:
Zn - восстановитель
Fe - восстановитель
растворами солей:
13. Взаимодействие со сложными веществами:
с водойLi K Ca Na
Mg Al Zn Cr Fe Ni Pb
(H2)
При обычных
условиях
M + H2O → H2
+ основание
Cu Hg Ag Pt
Au
При нагревании
M + H2O ≠
M+H2O→H2+оксид,
кроме Al
2Al+6H2O=3H2+2Al(
OH)3
14. Взаимодействие c растворами кислот
Li K Ca Na Mg Al |Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt AuВытесняют H2↑ из растворов
кислот
Не вытесняют
H2↑ из
растворов
кислот
15. Взаимодействие с растворами солей
Взаимодействие с растворами солей
Каждый металл вытесняет из растворов
солей другие металлы, находящиеся правее
него в ряду напряжений, и сам может быть
вытеснен металлами, расположенными
левее.
16. Какие реакции практически осуществимы?
Реагирующиевещества
О2
Н2О
HCl
(раствор)
Pb(NO3)2
раствор
K
Ca
Fe
Cu
Au
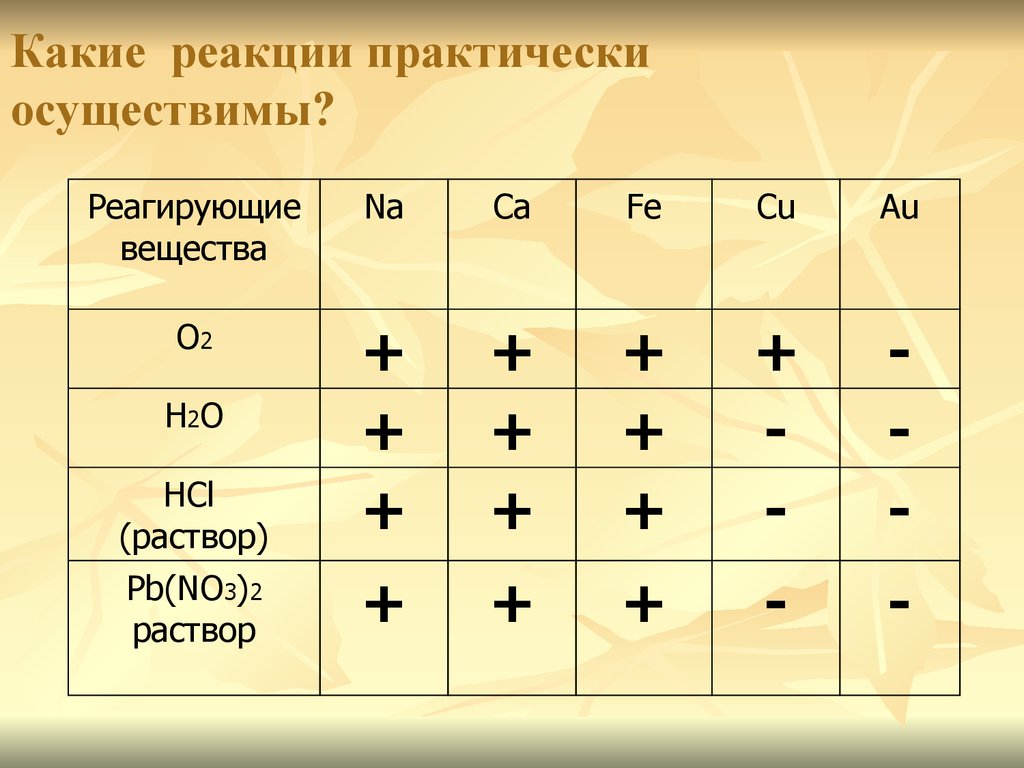
17. Какие реакции практически осуществимы?
Реагирующиевещества
Na
Ca
Fe
Cu
Au
О2
HCl
(раствор)
+
+
+
+
+
+
+
+
+
+
-
-
Pb(NO3)2
раствор
+
+
+
-
-
Н2О










 Химия
Химия








