Похожие презентации:
Белки, элементарный химический состав, строение, разнообразие, функции
1. Белки, элементарный химический состав, строение, разнообразие, функции
2. Элементарный химический состав
В состав белков входят атомы:С, О, Н, N, S
3. Белки
• Белки – нерегулярные полимеры, мономерами длякоторых являются аминокислоты.
• Аминокислоты – органические соединения, имеющие
в своем составе:
• - аминогруппу –NH2 (1 или 2),
• -карбоксильную группу –СООН (1 или 2),
• - радикал.
Связанные
с одним и
тем же
атомом
углерода
4.
5. Аминокислоты
• Всего в природе встречаетсяоколо 170 различных
аминокислот, однако в состав
белков входит лишь 20.
Животные в процессе эволюции
утратили способность
синтезировать 8 (10) из них и
должны получать эти
аминокислоты с пищей. Эти
аминокислоты называют
незаменимыми.
• Такие белки, как казеин молока,
миозин мышц, альбумин яйца,
содержат набор из всех 20 АМК,
в инсулине их 18, а в сальмине
(белок из молок рыб) – всего 7.
Аланин
Аргинин
Аспарагин
Аспарагиновая кислота
Гистидин
Глицин
Глутамин
Глутаминовая кислота
Пролин
Серин
Тирозин
Цистеин
Валин
Изолейцин
Лейцин
Лизин
Метионин
Треонин
Триптофан
Фенилаланин
6. Белки
• Каждый белок имеет строго индивидуальнуюпоследовательность аминокислотных остатков.
Двадцати аминокислот достаточно, чтобы создать
необычайное разнообразие белковых веществ.
• В состав большинства белков входит 300-500
аминокислотных остатков, известно несколько
очень коротких природных белков длиной в 3-8
АМК, а некоторые белки имеют в своем составе 1500
и более АМК.
• Молекулярная масса инсулина – 5700, яичного
альбумина – 36000, гемоглобина с общим
количеством АМК 574– 65000.
Наиболее высокомолекулярными являются белки вирусов. Белок,
образующий капсид вируса табачной мозаики, состоит из 2130
цепей и имеет молекулярную массу примерно 40 млн. !!!
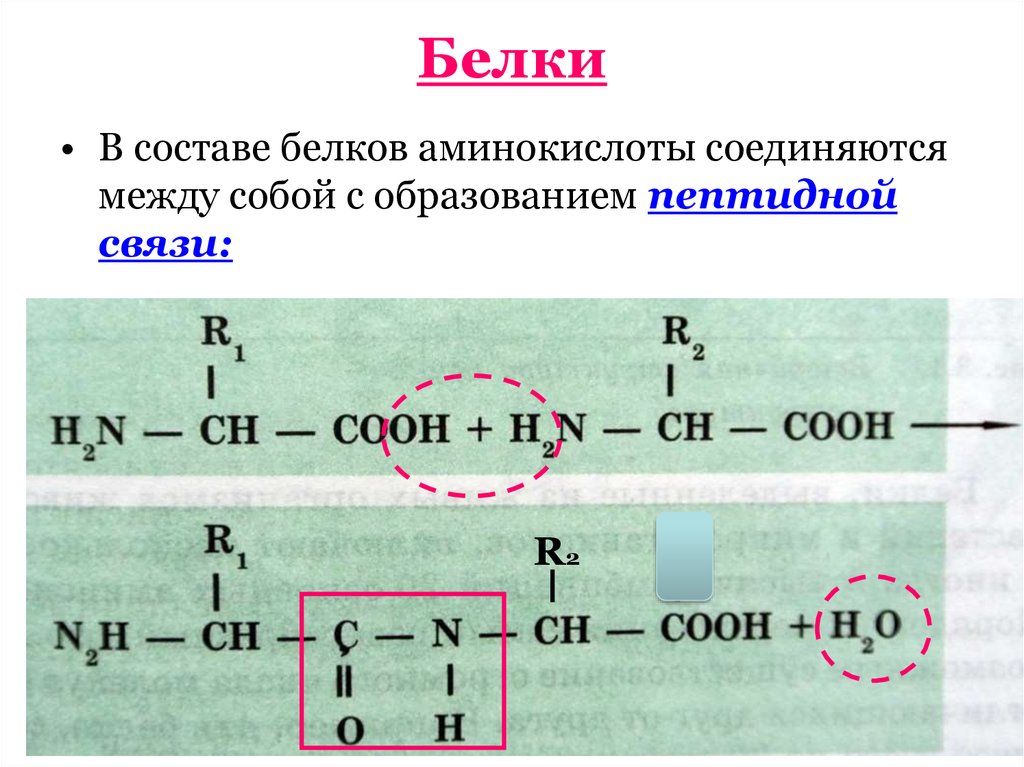
7. Белки
• В составе белков аминокислоты соединяютсямежду собой с образованием пептидной
связи:
R2
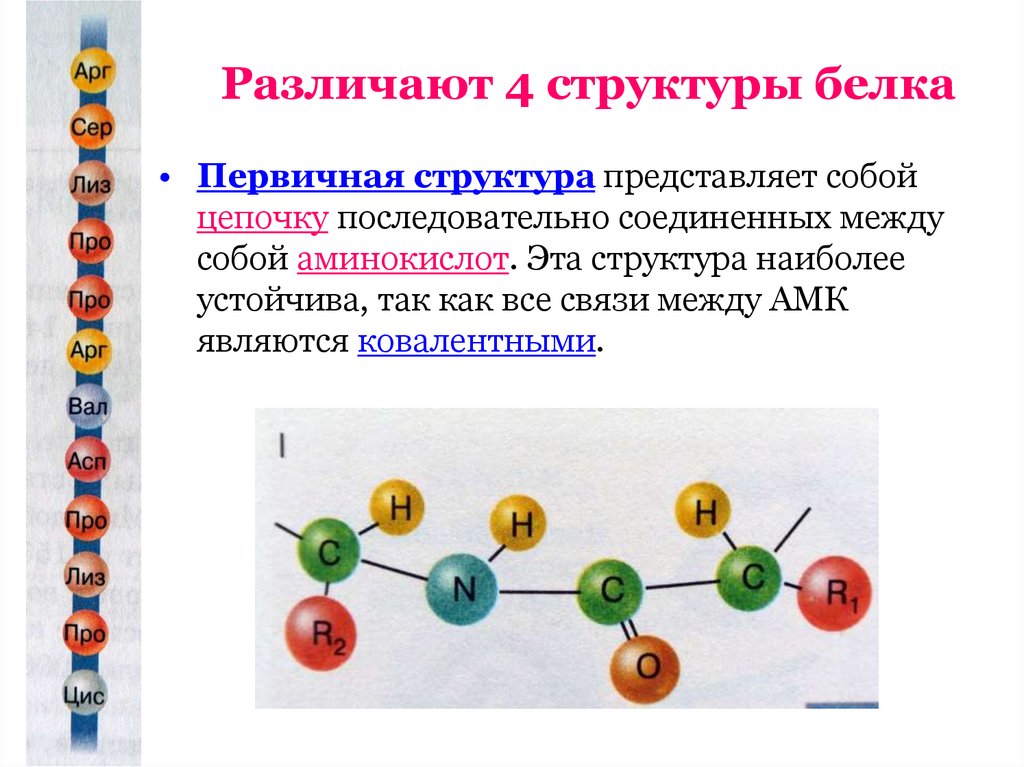
8. Различают 4 структуры белка
• Первичная структура представляет собойцепочку последовательно соединенных между
собой аминокислот. Эта структура наиболее
устойчива, так как все связи между АМК
являются ковалентными.
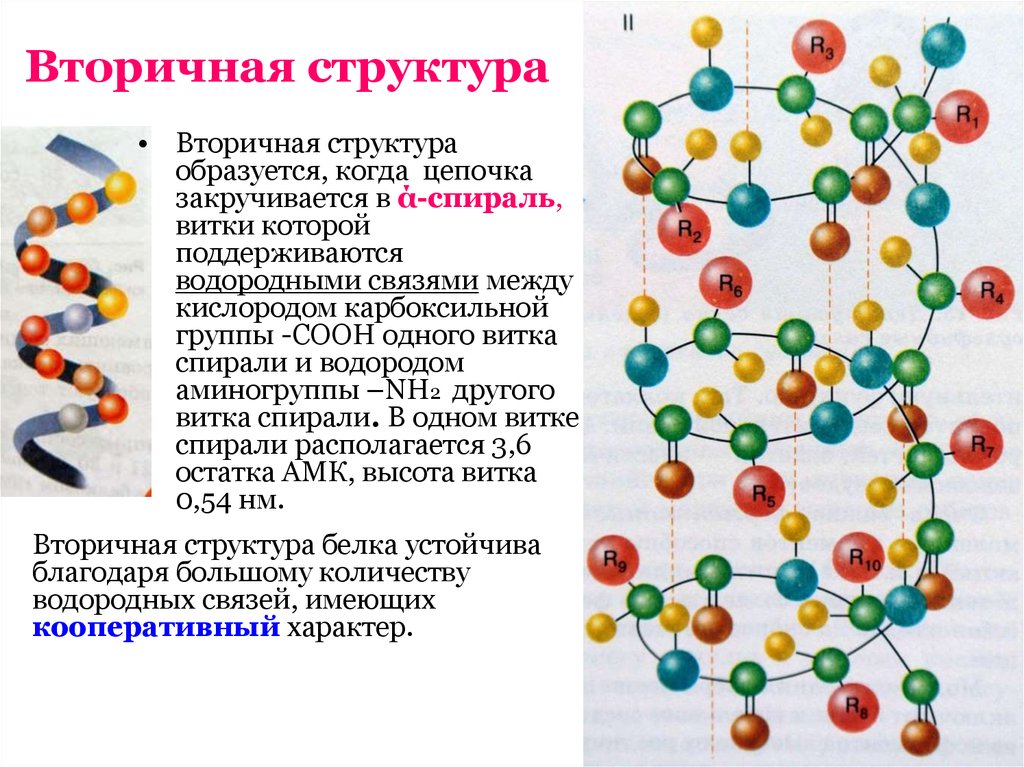
9. Вторичная структура
• Вторичная структураобразуется, когда цепочка
закручивается в ά-спираль,
витки которой
поддерживаются
водородными связями между
кислородом карбоксильной
группы -СООН одного витка
спирали и водородом
аминогруппы –NН2 другого
витка спирали. В одном витке
спирали располагается 3,6
остатка АМК, высота витка
0,54 нм.
Вторичная структура белка устойчива
благодаря большому количеству
водородных связей, имеющих
кооперативный характер.
10. Третичная структура
• Третичная структура представляетсобой еще более компактную
молекулу. Нить АМК далее
свертывается, образуя клубок или
фибриллу, для каждого белка
специфичную.
• Связи, поддерживающие третичную
структуру белка слабые, как правило,
между удаленными друг от друга
активными группами молекулы,
чаще всего между радикалами. Это
гидрофобные взаимодействия,
электростатические связи между
электроположительными и электроотрицательными радикалами. Это
могут быть и немногочисленные ковалентные дисульфидные –S-Sсвязи.
Белок, находящийся в третичной структуре, приобретает
биологическую активность. Такая структура называется нативной.
11. Четвертичная структура
Четвертичная структура характерна лишь для тех белков,которые функционируют только в комплексе с другими белковыми
молекулами и поодиночке биологического смысла не имеют.
• Например, в составе гемоглобина
таких полипептидных цепочек четыре
– 2 ά- цепи и 2 β-цепи, каждая из
которых соединена с
железосодержащим гемом;
Гем
12. Денатурация белков
• Начиная со вторичной структуры, пространственная конформациямакромолекул белка поддерживается, в основном, слабыми
химическими связями. Поэтому при нагревании или воздействии
химических веществ структура белка разрушается, и белок теряет свою
биологическую активность. Этот процесс получил название
денатурации. Под действием гормонов денатурируются белкиферменты, рецепторы, транспортеры. Эти изменения структуры белка
обычно легко обратимы.
Если денатурация не
затронула первичной
структуры, она обратима и
поддается ренатурации –
полипептидная цепочка
вновь закручивается в
спираль и приобретает
активность. Если же при
нагревании разрушается
последовательность
аминокислотных остатков, то ренатурация невозможна.
Иногда необратимая денатурация тоже имеет биологический смысл.
Например, жидкая после выделения паутина застывает и становится
прочной, когда паук слегка натягивает ниточку.
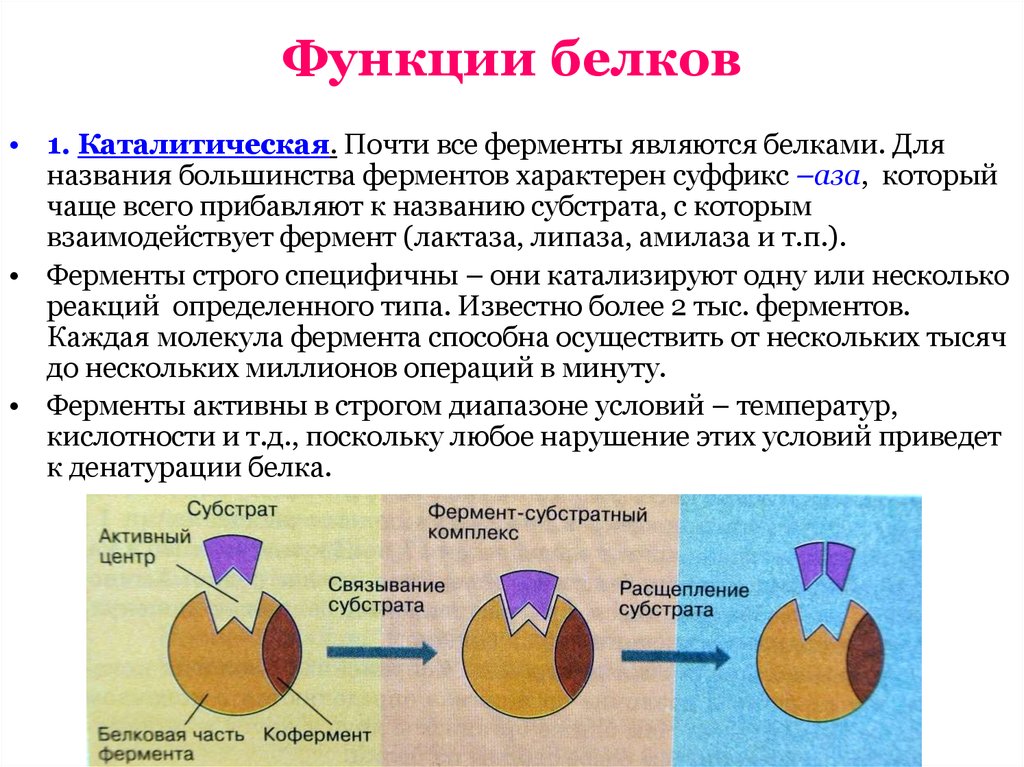
13. Функции белков
• 1. Каталитическая. Почти все ферменты являются белками. Дляназвания большинства ферментов характерен суффикс –аза, который
чаще всего прибавляют к названию субстрата, с которым
взаимодействует фермент (лактаза, липаза, амилаза и т.п.).
• Ферменты строго специфичны – они катализируют одну или несколько
реакций определенного типа. Известно более 2 тыс. ферментов.
Каждая молекула фермента способна осуществить от нескольких тысяч
до нескольких миллионов операций в минуту.
• Ферменты активны в строгом диапазоне условий – температур,
кислотности и т.д., поскольку любое нарушение этих условий приведет
к денатурации белка.
14. Функции белков
• 2. Структурная. Белки входят всостав мембраны клеток.
• 3. Транспортная. Белки
связывают различные вещества –
кислород, липиды – и переносят их
с током крови к местам назначения.
Другие белки образуют
транспортные каналы в клеточных
мембранах. По этим каналам
внутрь клетки попадают крупные
молекулы, не способные проникать
путем диффузии.
4. Резервная. Для белков не свойственна. Исключение – запас
белков в семенах (клейковина), в яйцеклетках (желточные белки),
казеин молока.
15. Функции белков
• 5. Сократительная. Все типы активного движения всегда связаныс белками. Актин и миозин входят в состав мышц, тубулин
образует микротрубочки цитоскелета и входит в составе жгутиков у
простейших.
• 6. Регуляторная. Эту функцию выполняют гормоны, имеющие
белковую природу (инсулин, глюкагон, все гормоны гипофиза и
гипоталамуса).
• 7. Белки гистоны входят в состав хромосом.
• 8. Белки-токсины, например, нейротоксин, блокируют передачу
нервных импульсов. Этот белок – действующее вещество змеиного
яда.
• 9. Энергетическая (белки используются в качестве
энергетического резерва в последнюю очередь).
16. Функции белков
• 11. Защитная:– А) структурные белки, обеспечивающие механическую
прочность тканей (кератин, коллаген).
– Б) ферменты разрушают клеточные стенки бактерий
(лизоцим).
– В) ферменты, участвующие в процессе свертывания крови.
– Г) антитела (иммуноглобулины), интерфероны и
белковые рецепторы лимфоцитов участвуют в
распознавании чужеродных агентов, попадающих в
организм.













 Биология
Биология








