Похожие презентации:
Элементы атомной физики и квантовой механики. Лекция 3
1.
ЭЛЕМЕНТЫ АТОМНОЙФИЗИКИ И КВАНТОВОЙ
МЕХАНИКИ
2.
Теория атома водородапо Бору
3. План лекции
I. Модели атома Томсона и Резерфорда.I.1. Модель атома Томсона.
I.2. Опыты Резерфорда.
I.3. Ядерная (планетарная) модель атома.
II. Квантовая теория атома
II.1. Линейчатый спектр атома водорода.
II.2. Постулаты Бора.
III. Опыты Франка и Герца
IV. Спектр атома водорода по Бору
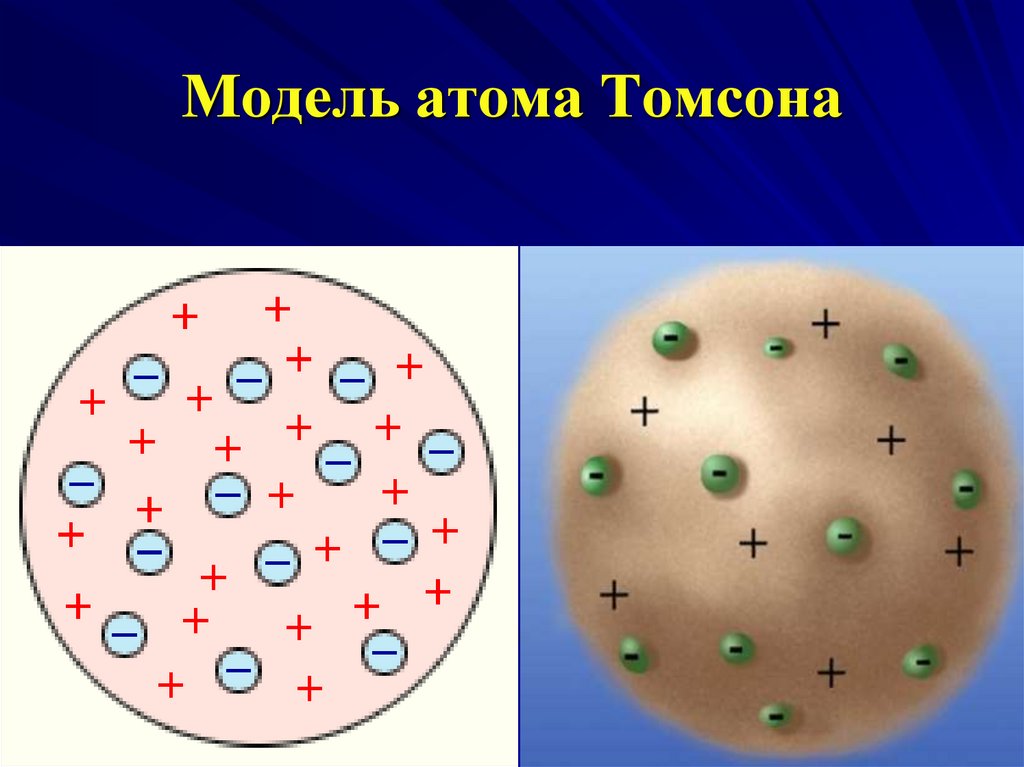
4. Модель атома Томсона
Атом представляет собой непрерывнозаряженный положительным зарядом шар
радиусом порядка 10 10
м,
внутри
которого около
своих положений
равновесия
колеблются
электроны;
суммарный
отрицательный
заряд
электронов равен положительному заряду
шара, поэтому атом в целом нейтрален.
P.S. Позже было доказано, что представление
о непрерывно распределённом внутри атома
положительном заряде ошибочно.
5. Модель атома Томсона
6. Эрнест Резерфорд
Английский физикродился в Новой
Зеландии
30.08.1871-19.10.1937
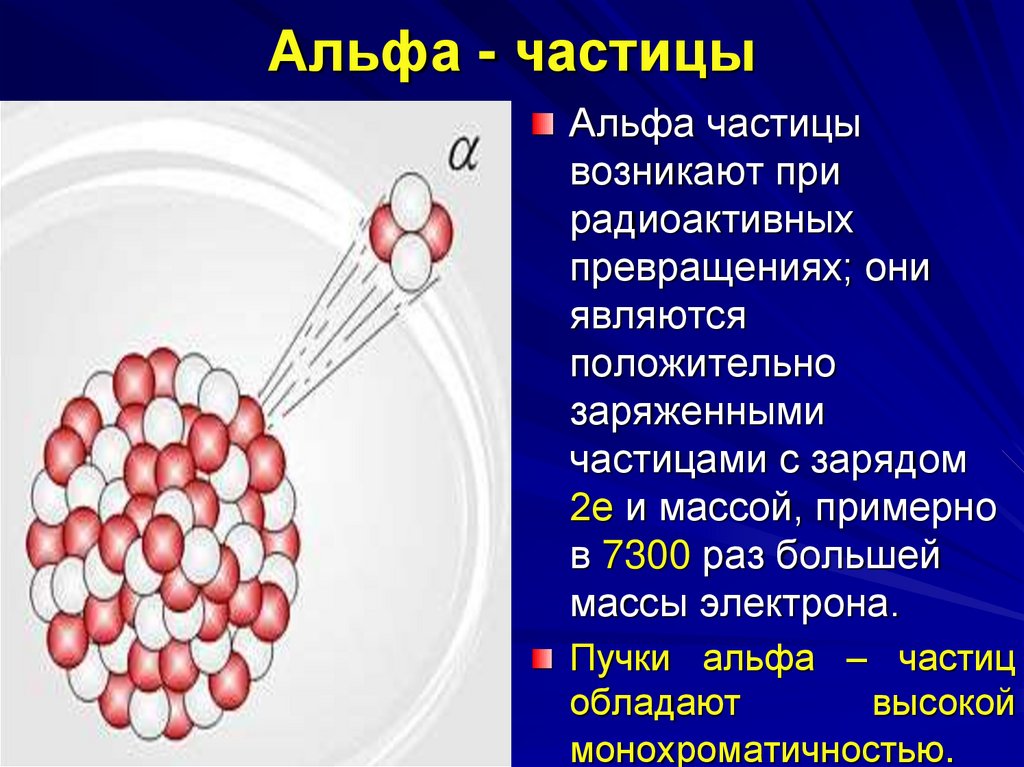
7. Альфа - частицы
Альфа частицывозникают при
радиоактивных
превращениях; они
являются
положительно
заряженными
частицами с зарядом
2е и массой, примерно
в 7300 раз большей
массы электрона.
Пучки альфа – частиц
обладают
высокой
монохроматичностью.
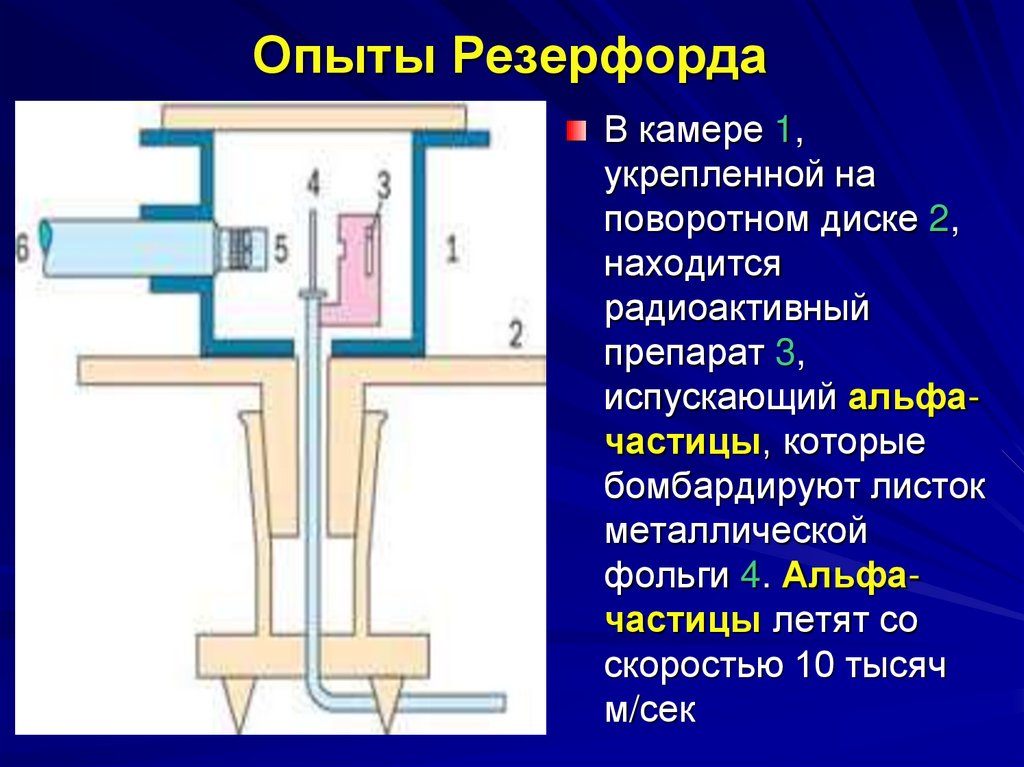
8. Опыты Резерфорда
В камере 1,укрепленной на
поворотном диске 2,
находится
радиоактивный
препарат 3,
испускающий альфачастицы, которые
бомбардируют листок
металлической
фольги 4. Альфачастицы летят со
скоростью 10 тысяч
м/сек
9. Опыты Резерфорда
Поток a - частиц, излучаемых радиоактивнымисточником через узкую щель направляется на
тонкую золотую фольгу. Регистрация a - частиц
проводилась при помощи флюоресцирующего
экрана. В отсутствии фольги a - частицы
двигались узким пучком, вызывая на экране
яркую вспышку.
10. Опыты Резерфорда
Когда на их пути помещали фольгу, то происходило восновном их слабое рассеивание. Однако, было
обнаружено, что отдельные a - частицы могут
отскакивать
от
фольги,
вызывая
свечение
дополнительных экранов, помещенных в различных
участках пространства до основного экрана
11. Результаты опыта Резерфорда
1. большинство частиц проходит через атомывещества. не рассеиваясь (как через
"пустоту");
2. с увеличением угла рассеяния число
отклонившихся
от
первоначального
направления частиц резко уменьшается;
3. имеются
отдельные
частицы,
отбрасываемые атомами назад, против их
первоначального движения (как мяч от
стенки). Следовательно, в атоме имеется
область занимающая ничтожно малую часть
атома, которая и отклоняет частицы на
большие углы вплоть до
180 0
12.
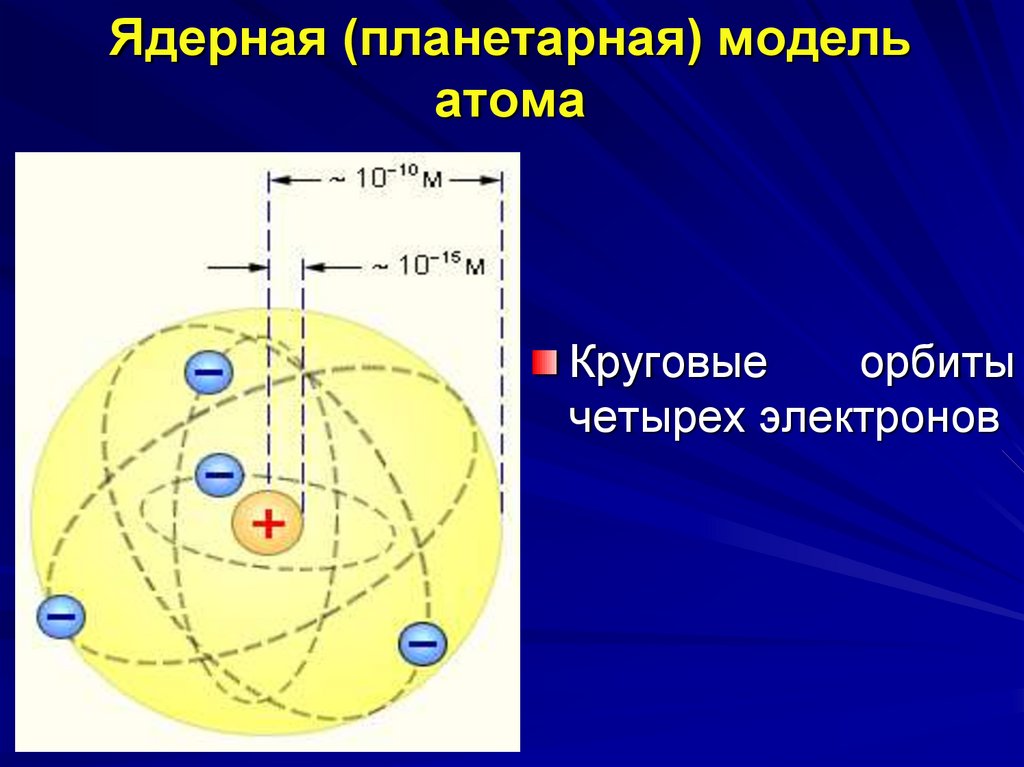
13. Ядерная (планетарная) модель атома
Вцентре
атома
находится положительно
заряженное
ядро,
которое
имеет
достаточно
малые
размеры, но в нем
заключена почти вся
масса, приходящаяся на
атом. Вокруг ядра, по
круговым
орбиталям
двигаются отрицательно
заряженные электроны,
подобно планетам вокруг
Солнца
14. Ядерная (планетарная) модель атома
Круговыеорбиты
четырех электронов
15. Объяснение модели с точки зрения электродинамики
Согласноэлектродинамике,
ускоренно
движущиеся
электроны
должны
излучать
электромагнитные волны и вследствие этого
непрерывно терять энергию. В результате
электроны будут приближаться к ядру и в конце
концов упадут на него. Таким образом, атом
Резерфорда оказывается неустойчивой системой,
что опять противоречит действительности.
Вывод:
попытки построить модель атома в
рамках классической физики не привели к успеху.
Модель Томсона была опровергнута опытами
Резерфорда, ядерная же модель оказалась
неустойчивой электродинамически.
16. Квантовая теория атома
Атомнаименьшая
частица вещества,
обладающая
всеми
химическими
свойствами
данного
химического
элемента.
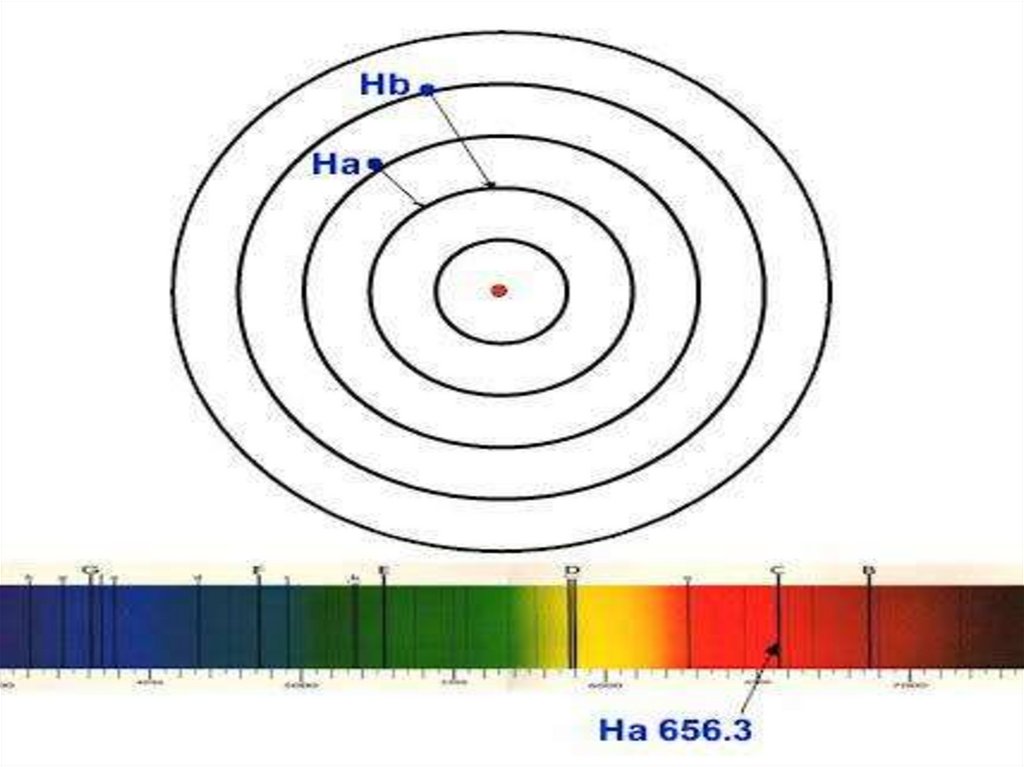
17. Линейчатый спектр атома водорода
Средиоптических
свойств
атома
важнейшим
является
его
спектр
излучения.
Исследования
спектров
излучения отдельных атомов показали,
что каждому газу присущ вполне
определенный
линейчатый
спектр,
состоящий из отдельных спектральных
линий или групп близко расположенных
линий. Самым изученным является
спектр наиболее простого атома – атома
водорода.
18.
19. Линейчатый спектр атома водорода
Частоты линий в дискретном линейчатом спектреатома водорода описываются формулой
Бальмера – Ридберга
1
1
R( 2 2 )
n
m
Величина R называется постоянной Ридберга,
R 3,2931193 10 15 с 1
4
me
ее можно определить по формуле
R
8 02 h 3
где m – масса электрона,
е – заряд электрона, h –
постоянная Планка,
в системе СИ.
0
– электрическая постоянная
20.
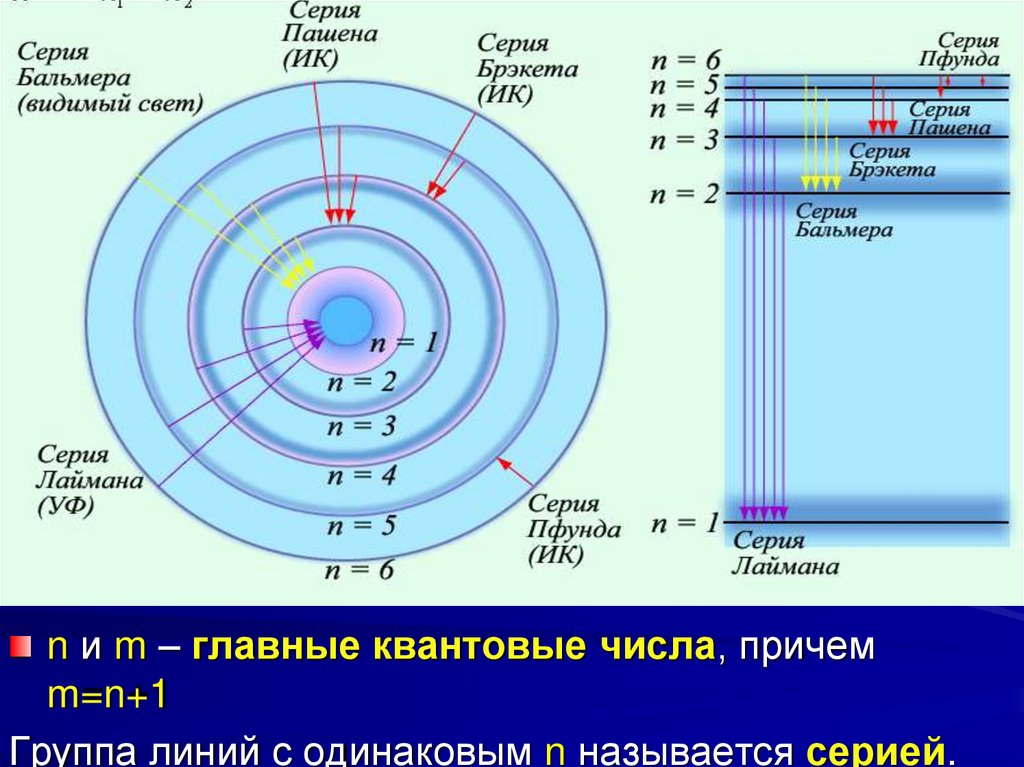
n и m – главные квантовые числа, причемm=n+1
Группа линий с одинаковым n называется серией.
21. Водородоподобные ионы
Для водородоподобных ионов формулаБальмера – Ридбергера примет вид
1
1
Z R( 2 2 )
n
m
2
где
Z – порядковый номер элемента в
периодической системе Менделеева.
Каждому значению квантового числа n в
формуле Бальмера – Ридберга соответствует
граница серии с наибольшей частотой (при
m = ∞), называемой термом Тn. Для
Z 2R
Tn
водородоподобного иона
n2
22. Энергия водородоподобного иона в состоянии с главным квантовым числом n
2Z Rh
Еn 2
n
или
En Tn h
Энергией связи электрона в атоме называется
абсолютная величина Еn. Наименьшее значение
энергии при (n=1) соответствует основному, или
нормальному, состоянию атома. Все
значения
энергии
при
n>1 характеризуют
возбужденные состояния атома.
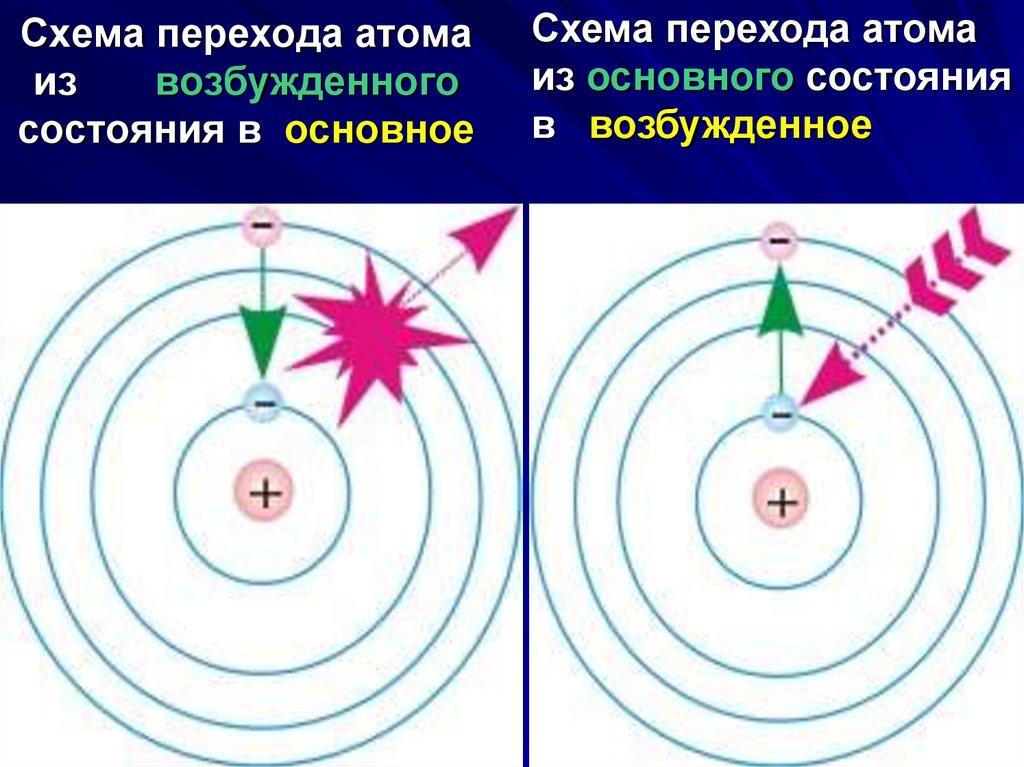
23. Схема перехода атома из возбужденного состояния в основное
Схема перехода атомаиз основного состояния
в возбужденное
24. Нильс Бор - датский физик
предлагает планетарную модель строенияатома.
25. Постулаты Бора
26. Первый постулат Бора
постулат стационарных состояний: ватоме существует набор стационарных
состояний, находясь в которых атом не
излучает
электромагнитных
волн.
Стационарным
состояниям
соответствуют стационарные орбиты,
по
которым
ускоренно
движутся
электроны, но излучения света при
этом не происходит.
27. Второй постулат Бора
правило квантования орбит: встационарном
состоянии
атома
электрон, движущийся по круговой
орбите, имеет квантованные значения
момента импульса, удовлетворяющие
условию
Lk m r k
Здесь
(k = 1, 2, 3,…).
m – масса электрона,
- его скорость;
r – радиус k – ой
орбиты.
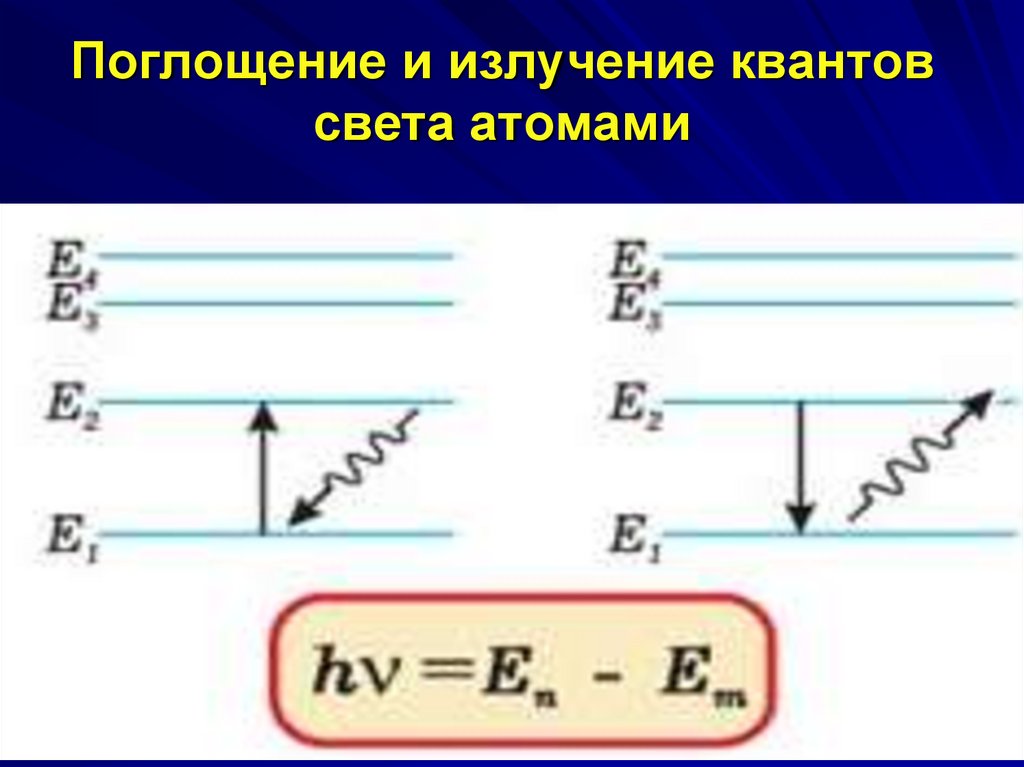
28. Третий постулат Бора
правило частот: при переходе атома изодного стационарного состояния в другое
испускается или поглощается один фотон.
Излучение фотона происходит при переходе
атома из состояния с большей энергией в
состояние с меньшей энергией. При обратном
переходе происходит поглощение фотона.
Энергия фотона равна разности энергий в
двух состояниях атома
h En Em
При En<Em происходит поглощение фотона, при
En>Em – происходит излучение фотона.
29. Поглощение и излучение квантов света атомами
30. Квантовые постулаты Н.Бора (1913 г.) нашли непосредственное экспериментальное подтверждение в опытах Дж.Франка и Г.Герца (1914
г ).31.
Джеймс ФранкГустав Людвиг Герц
32.
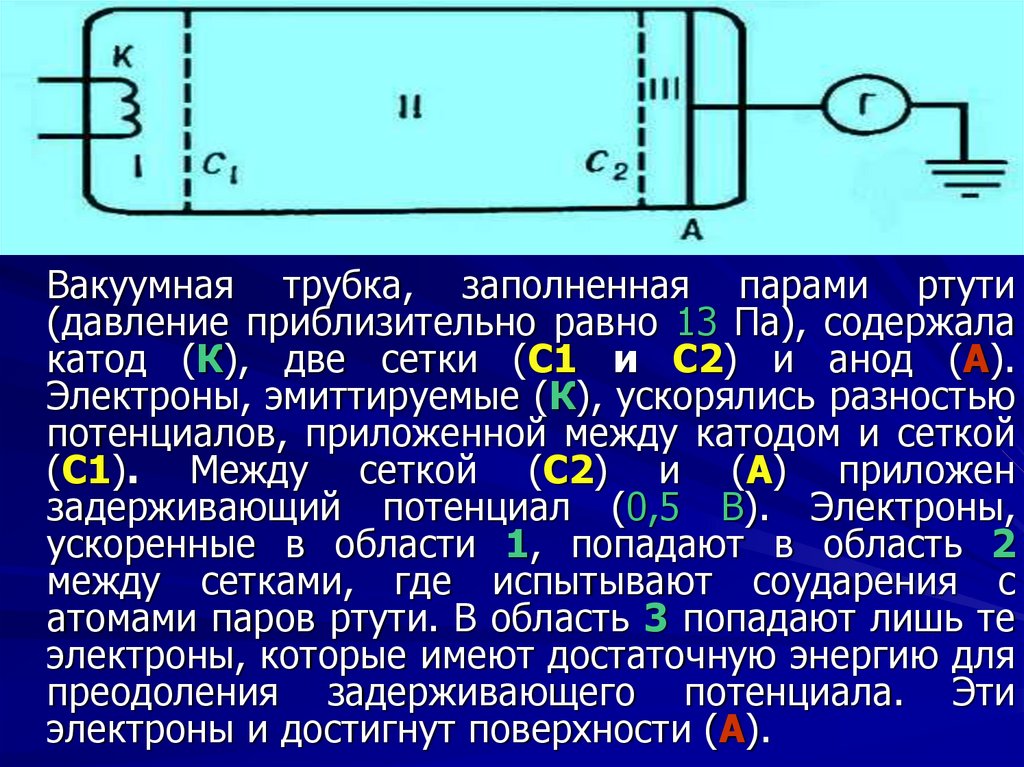
Вакуумная трубка, заполненная парами ртути(давление приблизительно равно 13 Па), содержала
катод (К), две сетки (С1 и С2) и анод (А).
Электроны, эмиттируемые (К), ускорялись разностью
потенциалов, приложенной между катодом и сеткой
(С1). Между сеткой (С2) и (А) приложен
задерживающий потенциал (0,5 В). Электроны,
ускоренные в области 1, попадают в область 2
между сетками, где испытывают соударения с
атомами паров ртути. В область 3 попадают лишь те
электроны, которые имеют достаточную энергию для
преодоления задерживающего потенциала. Эти
электроны и достигнут поверхности (А).
33. Объяснение опытов Франка и Герца
Донекоторого
времени,
электроны,
сталкиваясь с атомами ртути, почти не теряют
своей энергии, то есть удары упругие, так что
электрический ток соответствует закону Ома,
приблизительно равен приложенной разнице
потенциалов. Когда же энергия электронов
становится равной 4,9 эВ, ток резко падает.
Это происходит потому, что электрон теряет
энергию, сталкиваясь с атомом ртути,
возбуждая его. Таким образом, возбудить атом
ртути, передавая ему энергию менее 4,9 эВ.
невозможно.
Оказалось,
однако,
что
возбуждения не происходит и тогда, когда
энергия электрона больше величины 4,9 эВ.
34. Результаты опыта Франка и Герца
Зависимостьтока
от
напряжения.
Острые
периодические пики, соответствуют ионизации
атомов
35. Выводы
Опыты Ф. и Г. показали, что электроны пристолкновении с атомами ртути передают
атомам только определённые порции
энергии, причём 4,9 эВ – наименьшая
возможная порция энергии, которая может
быть поглощена атомом ртути в основном
энергетическом состоянии.
Следовательно,
идея
Бора
о
существовании в атомах стационарных
состояний
блестяще
выдержала
экспериментальную проверку.
36. Спектр атома водорода по Бору
Постулаты,выдвинутые
Бором,
позволили
рассчитать
спектр
атома
водорода
и
водородоподобных систем – систем, состоящих из
ядра с зарядом Ze и одного электрона, а так же
теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в
водородоподобной
системе,
ограничиваясь
круговыми стационарными орбитами.
Радиус n-й стационарной орбиты:
4 0
rn n
2
me Z e
2
2
n 1,2,3,...
37. Первый боровский радиус
4 010
rn a
0,528 10 м 52,8пм
2
me e
2
Энергия электрона может принимать
только
следующие
дозволенные
дискретные значения:
1 Z me e
En 2
2
2
n 8 0
2
4
n 1,2,3,...
Знак минус означает, что электрон
находится в связанном состоянии.
38. Следствия из формулы для энергии электрона
Энергетические состояния атомаобразуют
последовательность
энергетических
уровней,
изменяющихся в зависимости от
значения n.
39. Следствия из формулы для энергии электрона
Целое число n – главное квантовоечисло.
Наименьшее значение энергии при
(n = 1) соответствует основному,
или
нормальному,
состоянию
атома.
Все значения энергии при n>1
характеризуют
возбужденные
состояния атома.
40. Следствия из формулы для энергии электрона
Придавая n различные значения, получимдля атома водорода (Z=1), возможные
уровни энергии, схематически представленные на
следующих рисунках.
Спектральная линия излучается или
поглощается в результате перехода между
двумя дискретными уровнями энергии
41. Спектр поглощения атомарного водорода
42.
43. Спектр излучения атомарного водорода
44.
45.
46.
Квантовая механика46








































 Физика
Физика








