Похожие презентации:
Водородоподобные атомы
1.
ВОДОРОДОПОДОБНЫЕАТОМЫ
2.
Гипотеза о том, чтовещества состоят из
атомов, впервые была
высказана Левкиппом и
Демокритом примерно в
IV веке до н. э.
3.
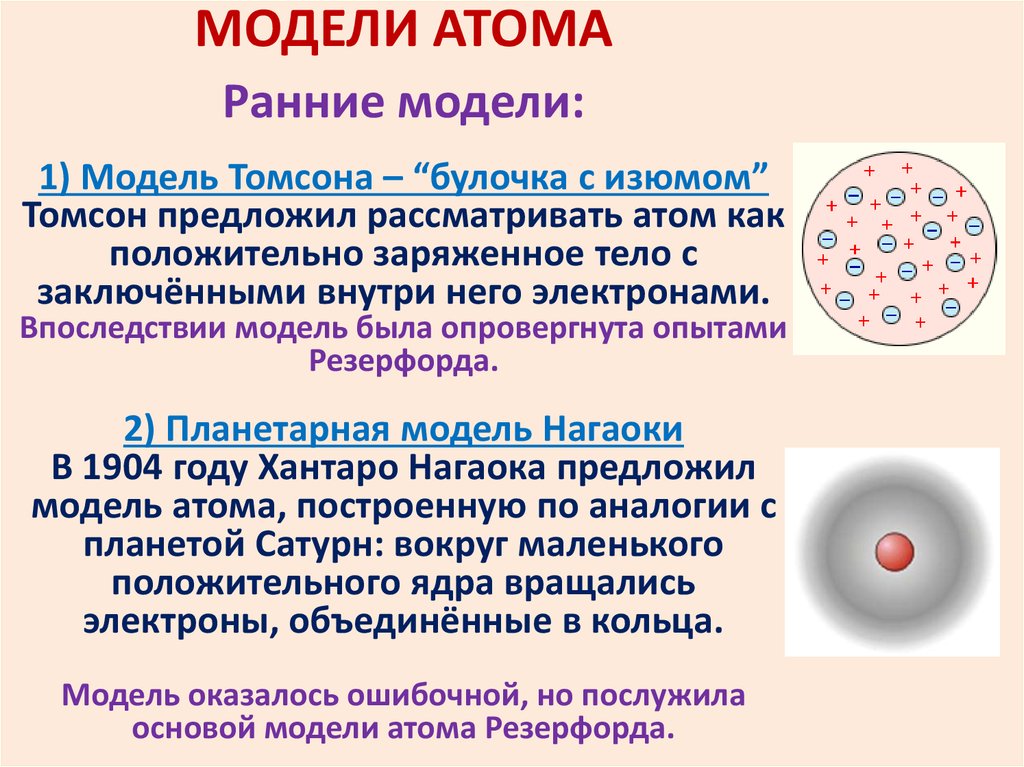
МОДЕЛИ АТОМАРанние модели:
1) Модель Томсона – “булочка с изюмом”
Томсон предложил рассматривать атом как
положительно заряженное тело с
заключёнными внутри него электронами.
Впоследствии модель была опровергнута опытами
Резерфорда.
2) Планетарная модель Нагаоки
В 1904 году Хантаро Нагаока предложил
модель атома, построенную по аналогии с
планетой Сатурн: вокруг маленького
положительного ядра вращались
электроны, объединённые в кольца.
Модель оказалось ошибочной, но послужила
основой модели атома Резерфорда.
4. Опыт Резерфорда по рассеянию α-частиц
Эрнст Резерфорд5.
Альфа-частица образована2-мя протонами и 2-мя
нейтронами, заряжена
положительно. Идентична
ядру атома гелия (4He2+).
Образуется при α-распаде
ядер. При этом ее скорость
достигает 1.6∙107 м/с .
При движении в веществе
α-частица создаёт сильную
ионизацию и в результате
быстро теряет энергию.
5
6.
Резерфорд направил поток α-частиц назолотую фольгу толщиной около 0,1 мкм.
Большинство частиц пролетели сквозь
фольгу, но некоторые отклонились на
очень большие углы вплоть до 180 град.
7.
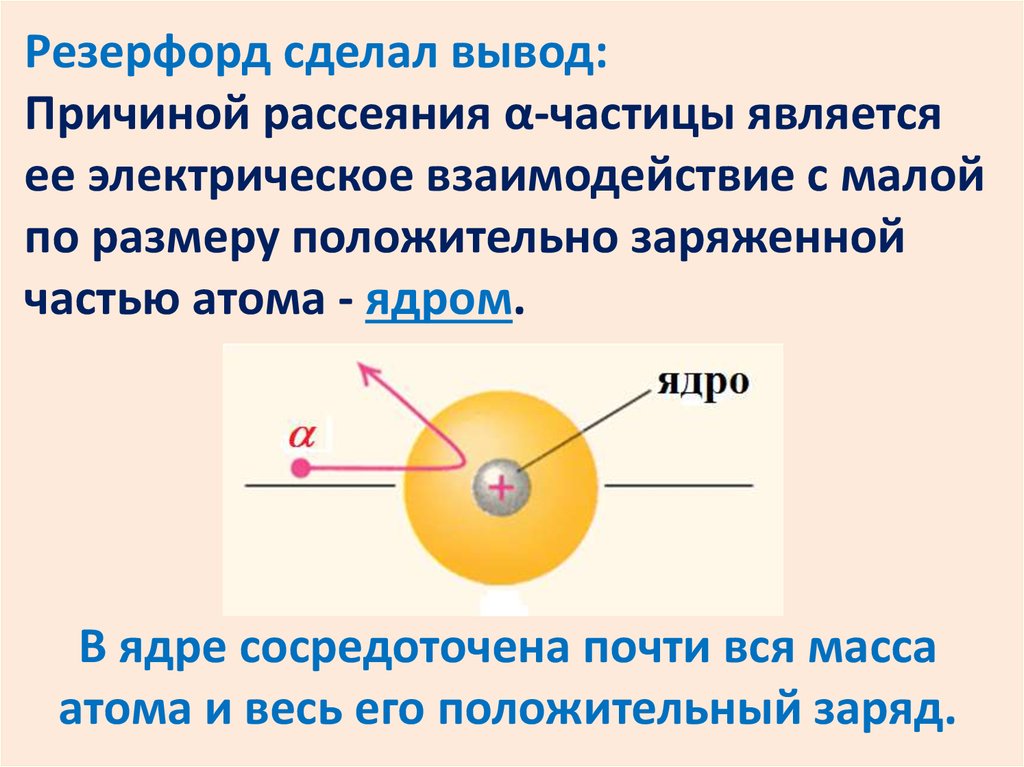
Резерфорд сделал вывод:Причиной рассеяния α-частицы является
ее электрическое взаимодействие с малой
по размеру положительно заряженной
частью атома - ядром.
В ядре сосредоточена почти вся масса
атома и весь его положительный заряд.
8. Планетарная модель атома Резерфорда
Атом представляет собой подобиепланетной системы, в которой электроны
движутся по орбитам вокруг тяжёлого
положительно заряженного ядра..
8
9.
Размеры:ядра
10
15
, атома 10
10
м.
10.
Неустойчивость атома РезерфордаСогласно классической электродинамике
электрон при движении с центростремительным ускорением должен излучать
электромагнитные волны и терять энергию.
В итоге он упадёт на ядро.
Для объяснения стабильности атомов Нильсу
Бору пришлось ввести особые предположения –
постулаты. Постулаты Бора показали, что для
атома классическая механика неприменима.
10
11.
Теория водородоподобногоатома по Бору
При построении теории Бор
опирался на опыт Резерфорда и
данные по спектрам атомарных
газов. Согласно опыту эти спектры
линейчатые.
12.
• Водородоподобный атом – это атом с однимвнешним электроном: Na, K, Rb, Cs.
• Спектр атома – это набор излучаемых или
поглощаемых частот.
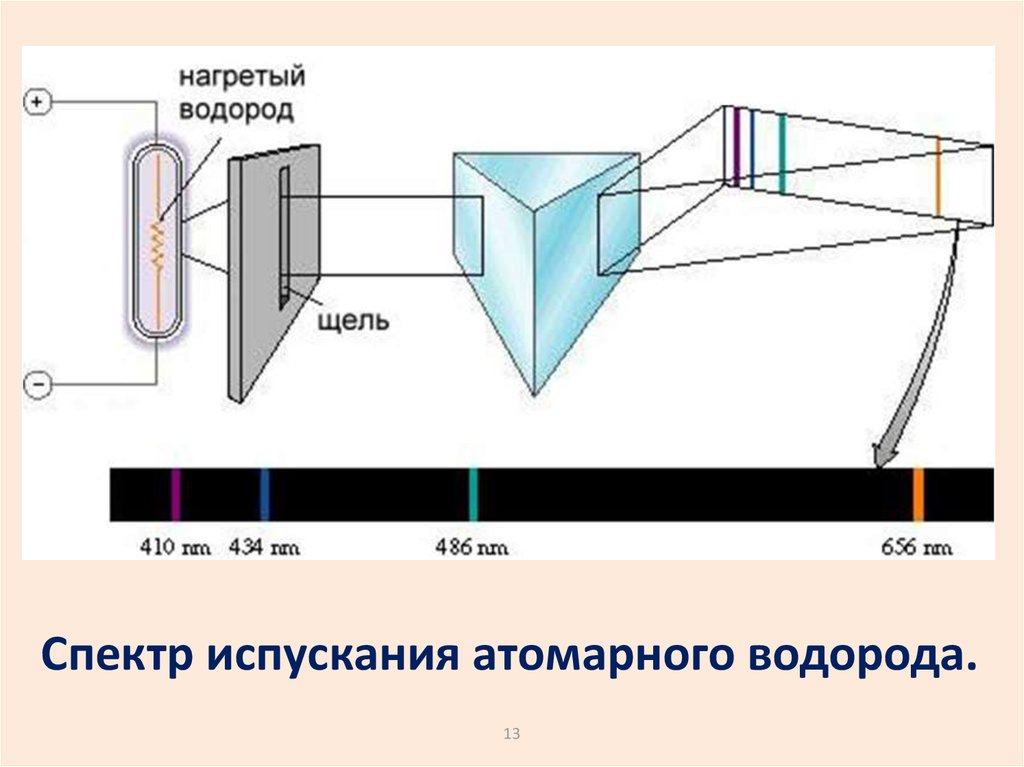
13.
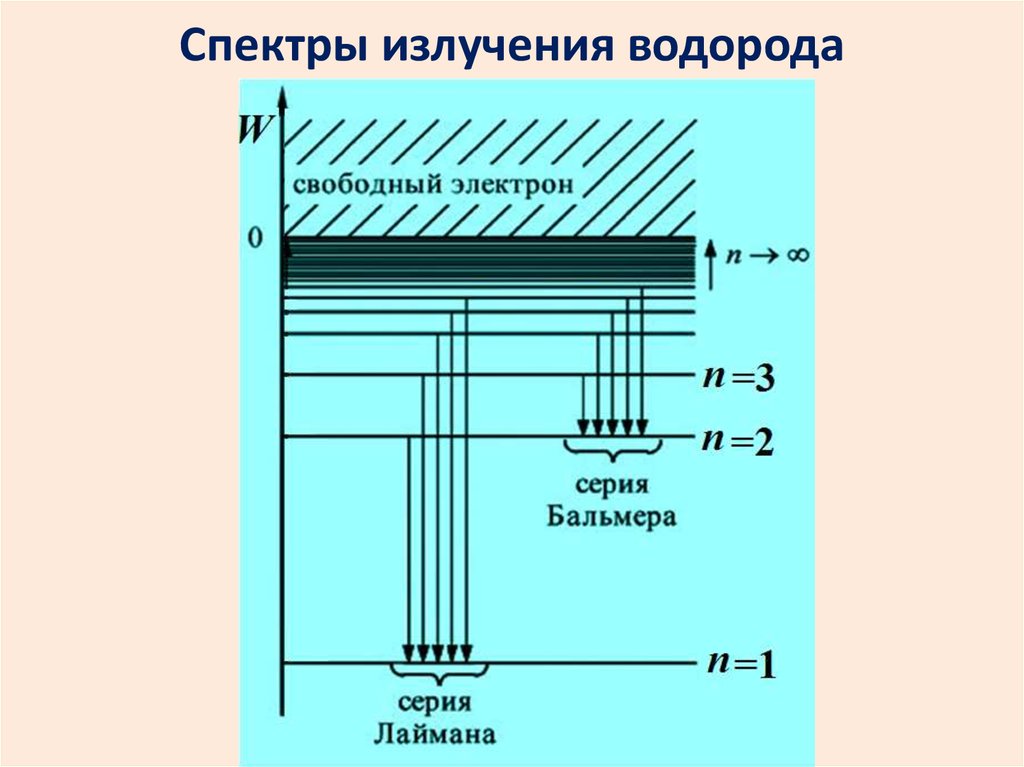
Спектр испускания атомарного водорода.13
14.
Спектр атома водорода образовансериями линий. Линии сгущаются к
высокочастотной границе серии.
В видимой области наблюдается
серия Бальмера.
Еще одна серия есть в УФ области. А в ИК
диапазоне – много серий.
Серии: … Брэкета Пашена Бальмера Лаймана
ИК
видимый
свет
УФ
15. Бальмер подобрал формулу для частот спектральных линий:
nm1
1
R 2 2
n
m
Для серии Бальмера m = 2, n = 3, 4, 5, ... .
Для серии Лаймана m = 1, n = 2, 3, 4, ... .
R - постоянная Ридберга
R = 3,3∙1015 Гц.
16. Постулаты Бора
Первый постулат Бора (постулатстационарных состояний)
Атом может находится только в особых
стационарных или квантовых
состояниях, каждому из которых
соответствует определенная энергия Wn.
В стационарных состояниях атом
не излучает.
17.
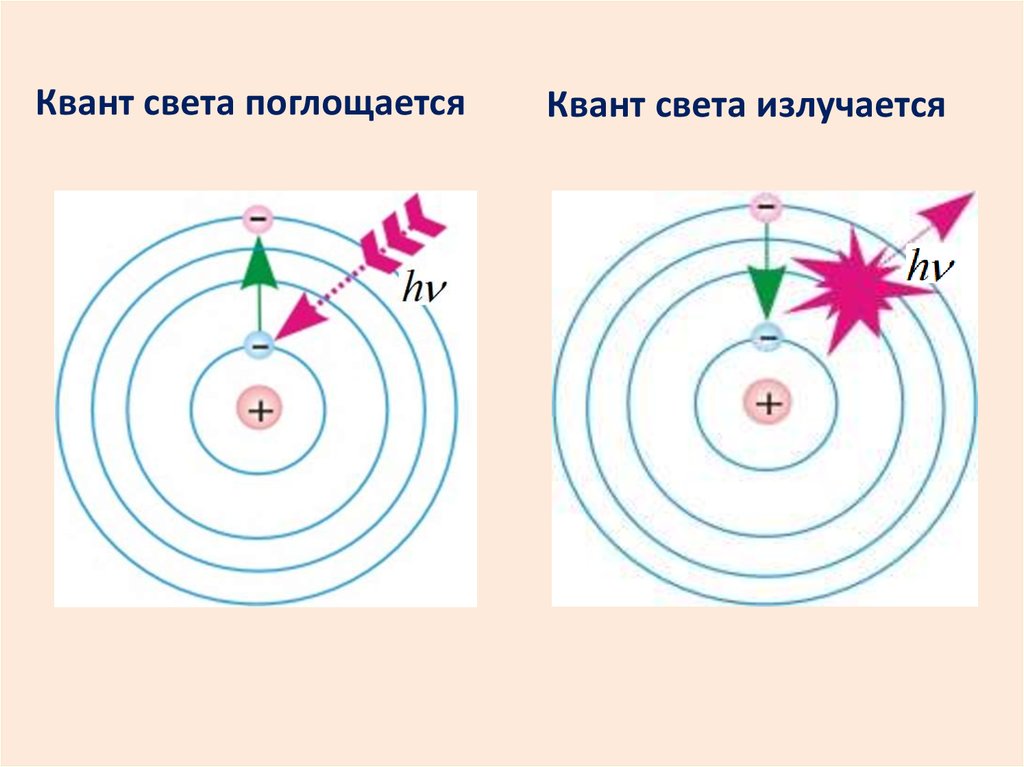
Второй постулат Бора (правило частот)При переходе атома из одного
стационарного состояния с энергией Wn в
другое с энергией Wm излучается или
поглощается квант, энергия которого
равна разности энергий этих состояний.
h nm Wn Wm
18. Квант света поглощается
Квант света излучается19.
Третий постулат (квантование орбит)Момент импульса электрона в атоме
принимает только дискретные
значения, кратные постоянной Планка:
mvn rn n
m – масса электрона,
vn – его скорость на орбите радиуса rn ,
n = 1, 2, 3 …
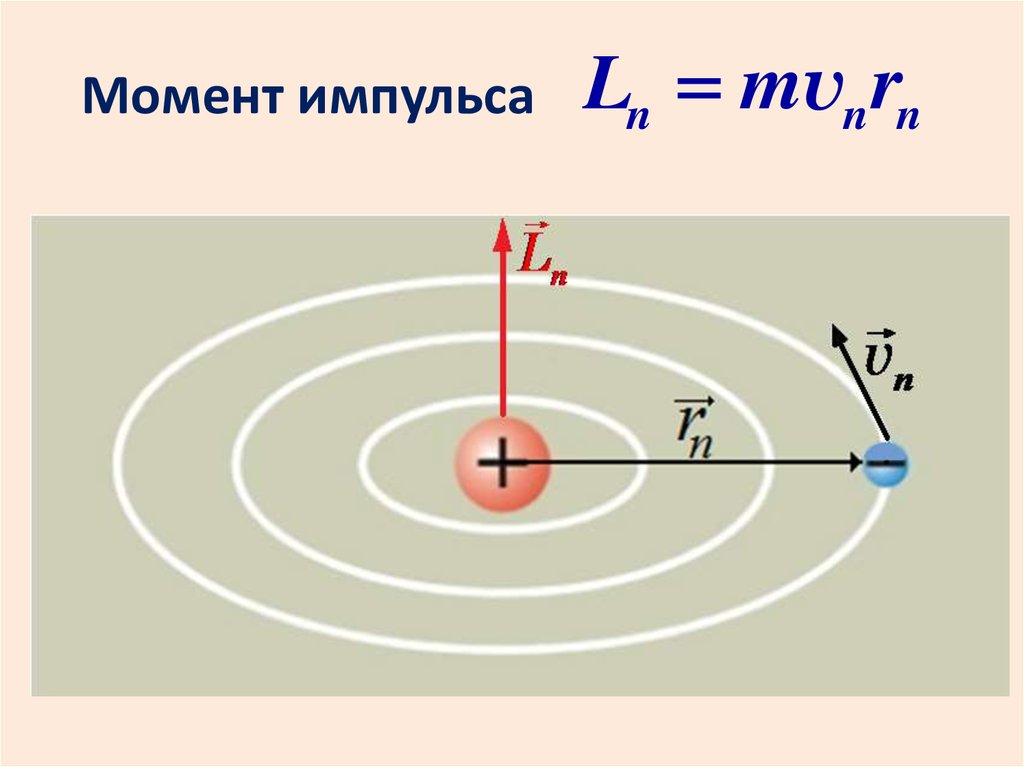
20.
Момент импульсаLn mvn rn
21.
На электрон действует кулоновскаясила. По 2-му закону Ньютона
ma Fк
v
Ze e
m k 2
r
r
2
rn
2
2
kZe m
n
2
22.
Радиус ближайшей к ядруорбиты называют
первым боровским радиусом.
aБ r1
2
2
kZe m
52, 8 пм
Z заряд ядра, k
1
4 0
23.
Полная энергия электрона в атоме:2 4
2
k em Z
Wn
2
2
2
n
Энергия электрона на первой
боровской орбите в атоме
водорода:
W1 13, 55 эВ
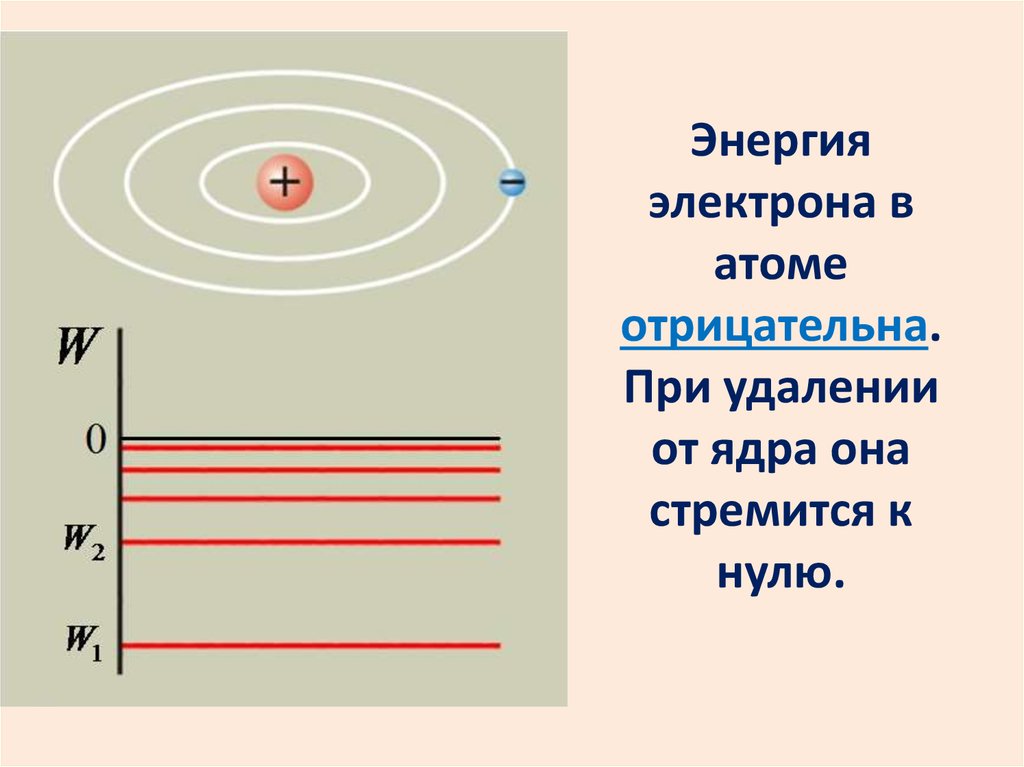
24.
Энергияэлектрона в
атоме
отрицательна.
При удалении
от ядра она
стремится к
нулю.
25.
Частота излучения при переходе с n-гона m-й уровень энергии:
nm
Wm Wn k me e 1
1
1
1
2 R 2 2
3
2
h
2
m n
m n
2
4
R=3,3∙1015 Гц - частотная константа Ридберга,
ее значение совпало с угаданным Бальмером
Длина волны :
1
nm
1
1
R 2 2
n
m
R’=1,1∙107 м-1 - волновая константа Ридберга
26. Спектры излучения водорода
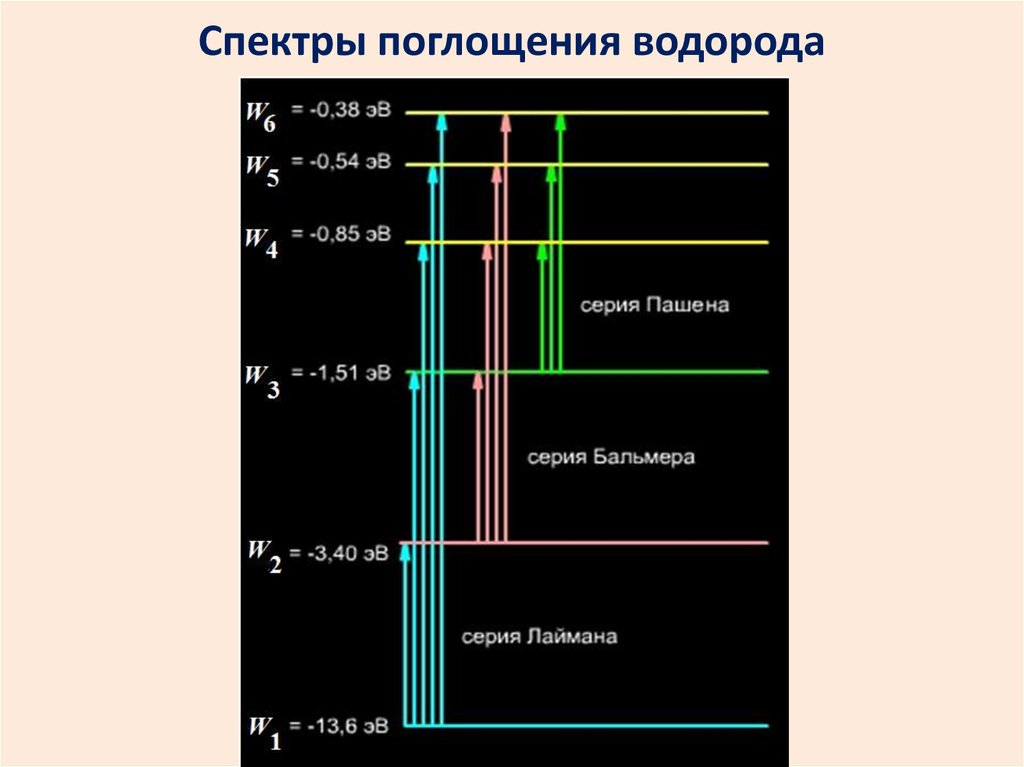
2627. Спектры поглощения водорода
2728.
Для серииЛаймана m=1, n=2, 3, 4,….
Бальмера m=2, n=3, 4, 5….
Пашена m=3, n=4, 5, 6,….
28
29.
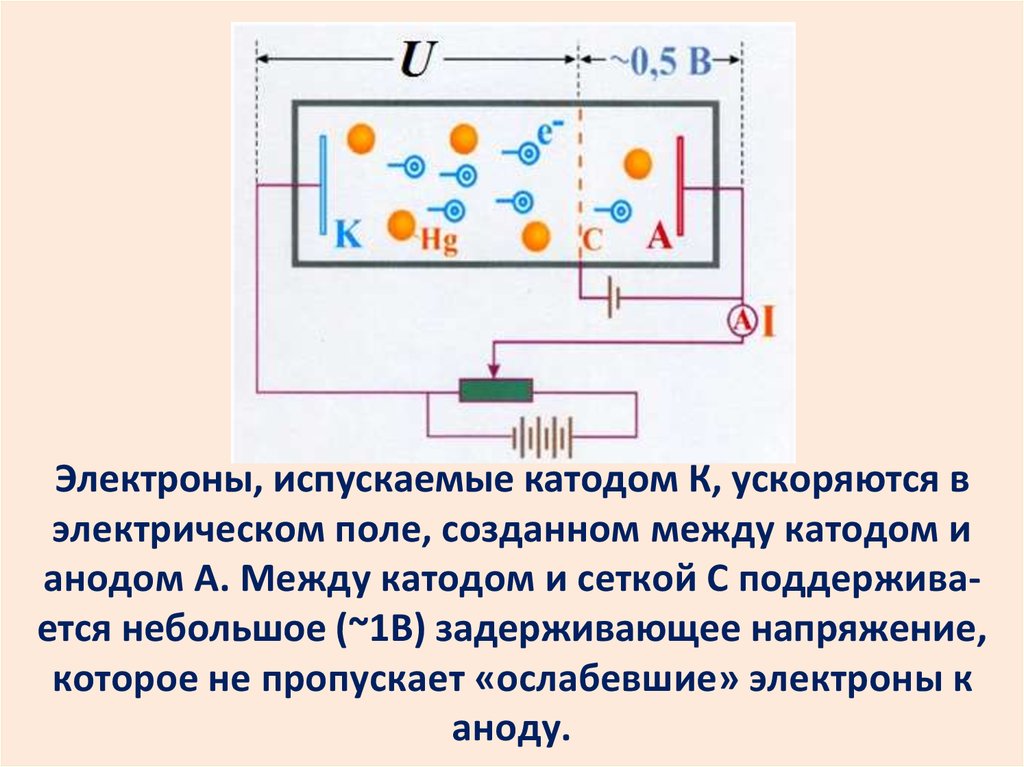
Опыт Франка и ГерцаКвантовые постулаты Бора нашли
экспериментальное подтверждение в
опыте Дж.Франка и Г. Герца.
Опыт заключался в пропускании
электронного пучка через пары ртути.
30.
Электроны, испускаемые катодом К, ускоряются вэлектрическом поле, созданном между катодом и
анодом А. Между катодом и сеткой С поддерживается небольшое (~1В) задерживающее напряжение,
которое не пропускает «ослабевшие» электроны к
аноду.
31.
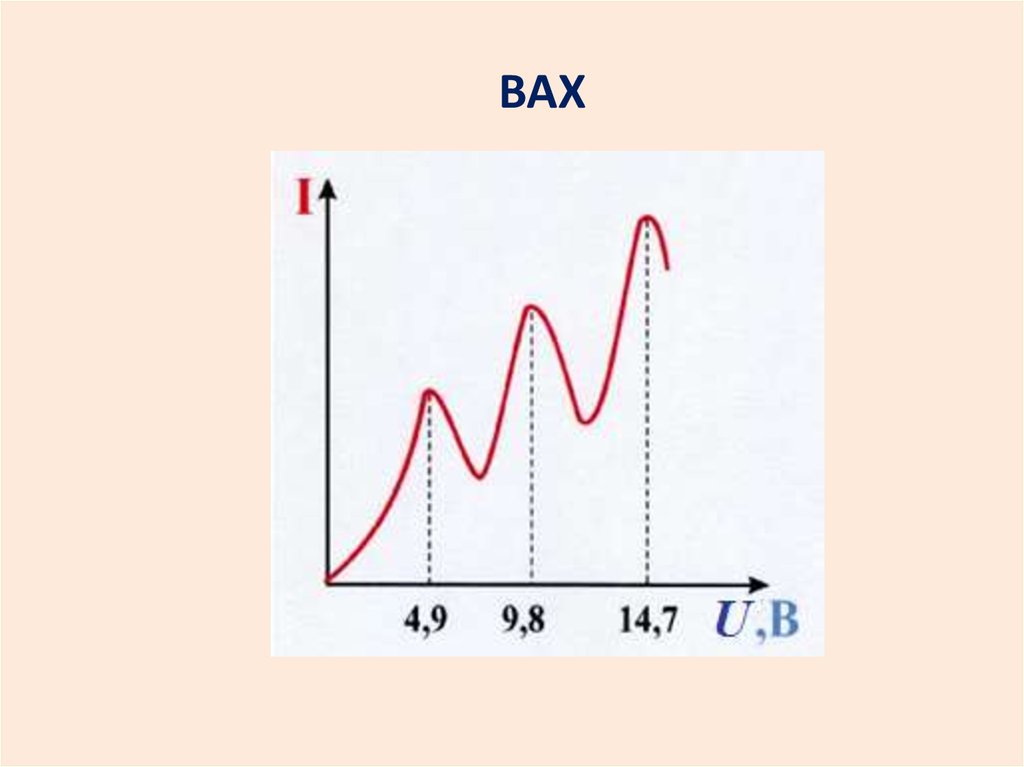
ВАХ32.
Через пары ртути пропускался поток электронов,энергия которых постепенно увеличивалась. Сначала
электроны, сталкиваясь с атомами ртути, не теряют
своей энергии, то есть удары упругие. И электрический
ток растет. Когда же энергия электронов становится
равной 4.9 эВ атомы ртути переходят в возбужденное
состояние, забирая энергию у электронов, ток падает.
Опыт Франка - Герца показал, что спектр поглощаемой
атомом энергии дискретен. Минимальная порция,
которую может поглотить атом ртути Hg, равна 4,9 эВ.
33.
Теория Бора дала не толькокачественное, но и
количественное описание
атомных спектров, а также
опытов Франка и Герца.
34. Достоинства и недостатки теории Бора
Достоинства:
1. Объяснила линейчатый спектр атомов.
2. Предсказала значения частот.
3. Правильно определила размеры атома водорода.
4. Рассчитала константу Ридберга.
Недостатки:
1. Для объяснения квантовых явлений использовала
не только квантовую, но и классическую физику.
• 2. Не смогла рассчитать интенсивность спектра
излучения.
• 3. Не дает объяснений причин перехода между
уровнями энергии
34
• 4. Не верна для многоэлектронных атомов (Не и т.п.)
35.
Квантовая теорияатома
36. Электрон в атоме находится в потенциальной яме. Применим к нему уравнение Шредингера
2m2
W U 0
Решение уравнения дает дискретные
значения энергии
2
Z h
Wn R 2 ,
n
совпадающие с полученными Бором.
37.
n=1, 2,… - главное квантовое число.Оно определяет энергию электрона,
степень его удаленности от ядра,
размеры электронной орбиты.
37
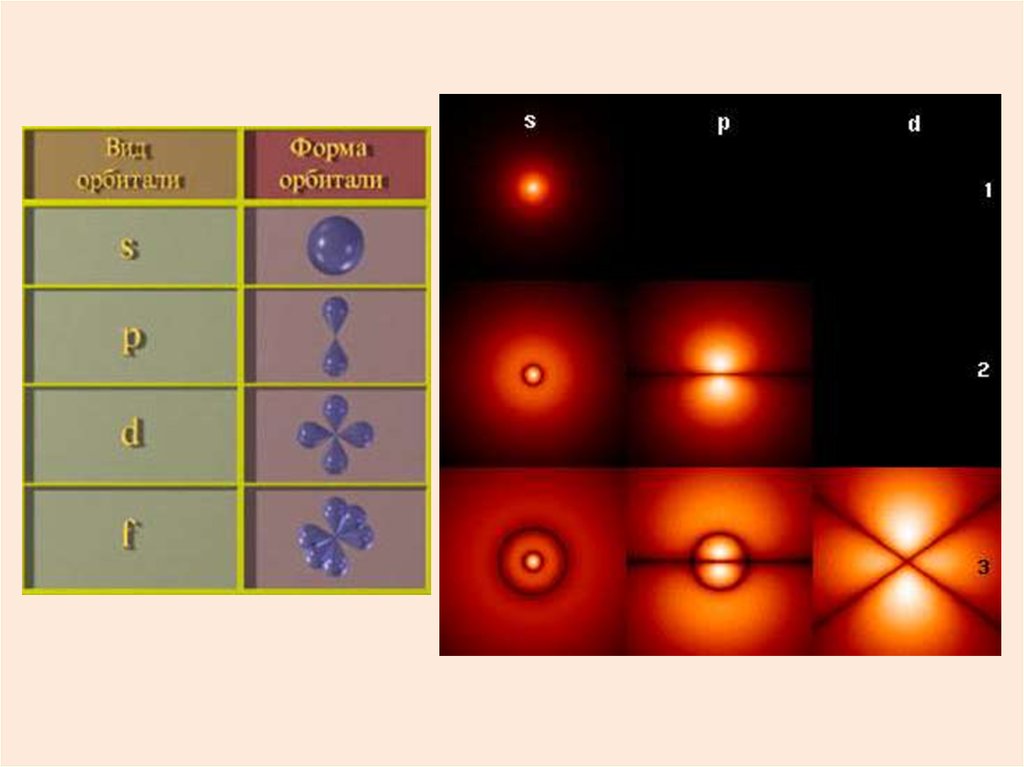
38. Квантование момента импульса
Модуль момента импульса электронаL принимает дискретные значения:
L
l = 0, 1, 2, …, n-1
1
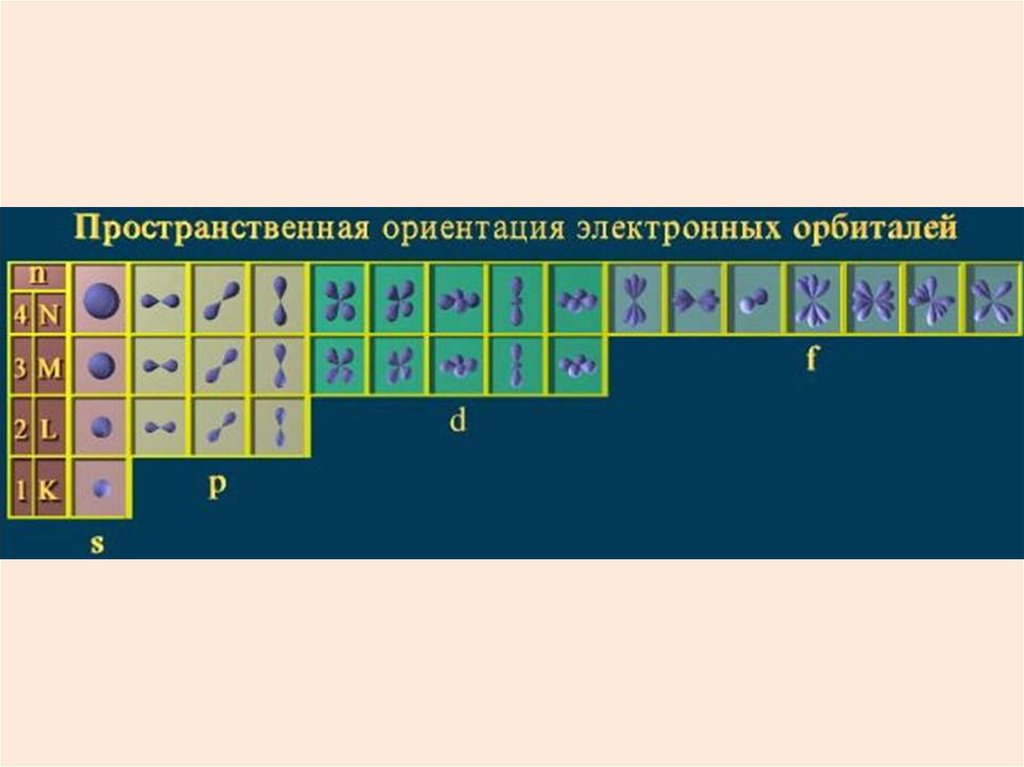
- орбитальное квантовое число.
Оно определяет размер и
форму электронной орбиты.
38
39.
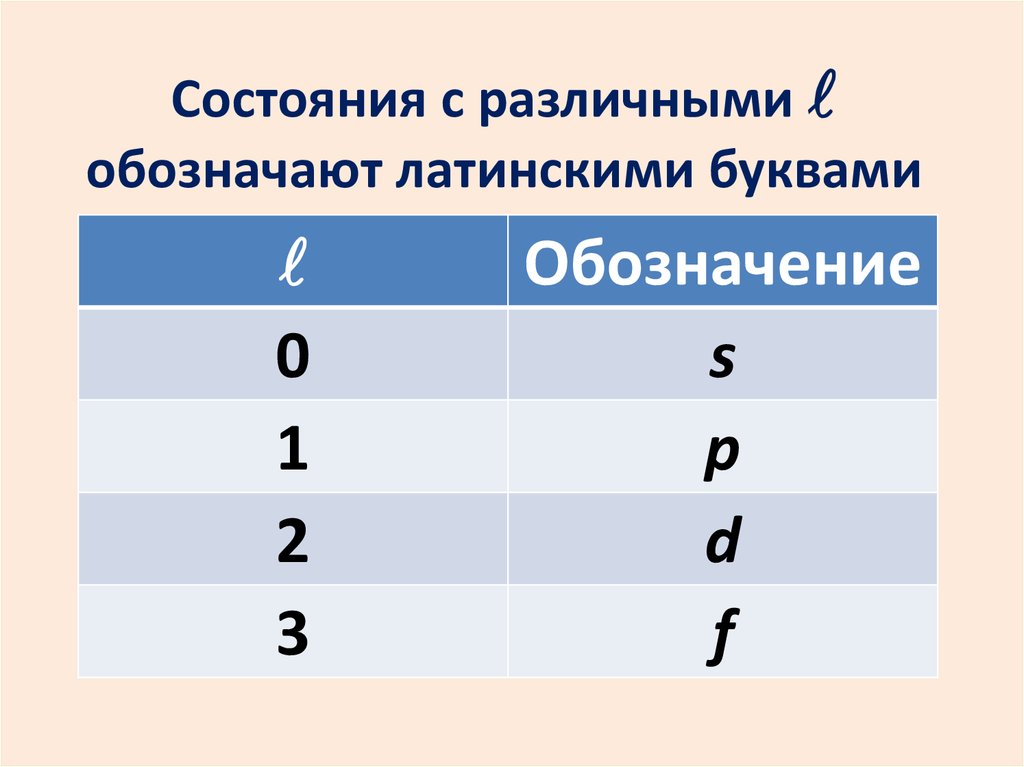
Состояния с различными lобозначают латинскими буквами
l
0
1
2
3
Обозначение
s
p
d
f
40.
41.
Выделим в пространствекакое-либо направление,
например, направление
магнитного поля.
Проекция момента импульса
электрона на это направление
может иметь только
дискретные значения.
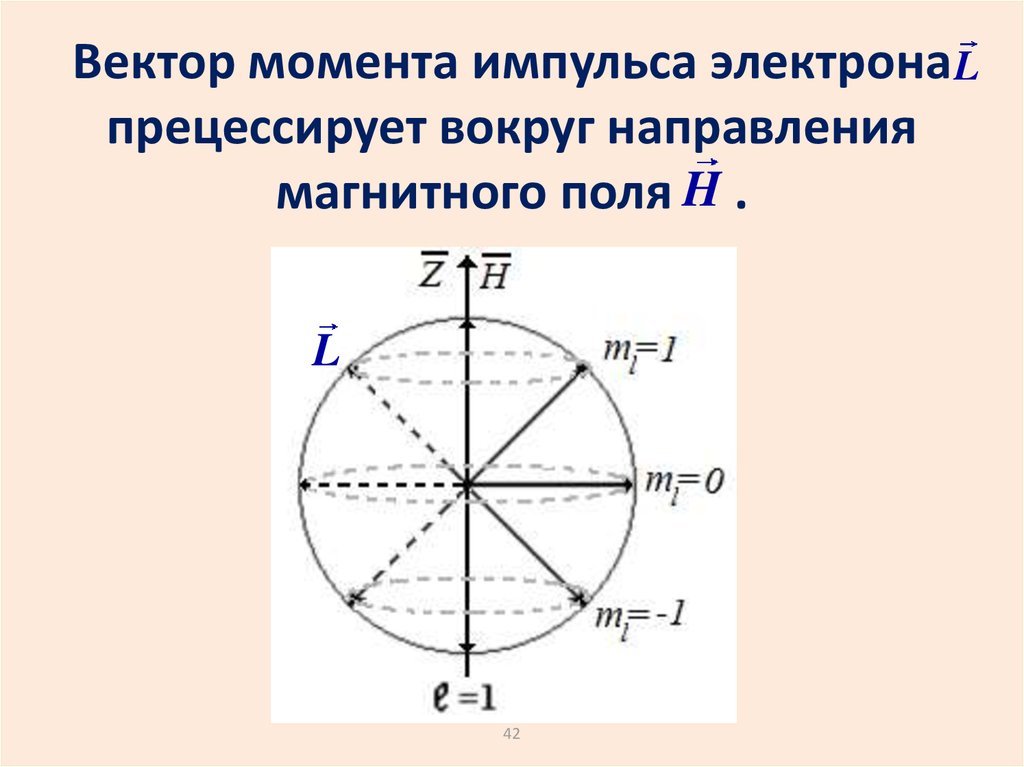
42.
Вектор момента импульса электрона Lпрецессирует вокруг направления
магнитного поля H .
L
42
43.
Проекция момента импульса на направление z имеет дискретные значения:Lz m (m 0, 1, 2... )
m – магнитное
квантовое число
Оно задает
ориентацию
орбиты в
пространстве.
44.
45.
Аналогично механическому моментуимпульса квантуется орбитальный
магнитный момент электрона:
Ml
I S e r
e
L m r T m r 2m
2
I
q
t
e
T
2 r
T
46.
M gLe
g
гиромагнитное отношение
2m
M g
1 B
1
e
B
магнетон Бора
2m
47.
L1
48.
Квантование спинаСпин электрона LS – это его
собственный момент импульса.
Спин квантуется по закону:
Ls
s( s 1)
1
спиновое
s
квантовое число
2
49.
Собственный магнитный моментэлектрона:
e
M S 2 gLS LS
m
e
MS
s ( s 1) 2 B s ( s 1)
m
49
50.
Проекция спина электрона нанаправление магнитного поля
может принимать только одно из
двух значений
Ls ,z m S
1
ms
2
магнитное
спиновое
квантовое число
51.
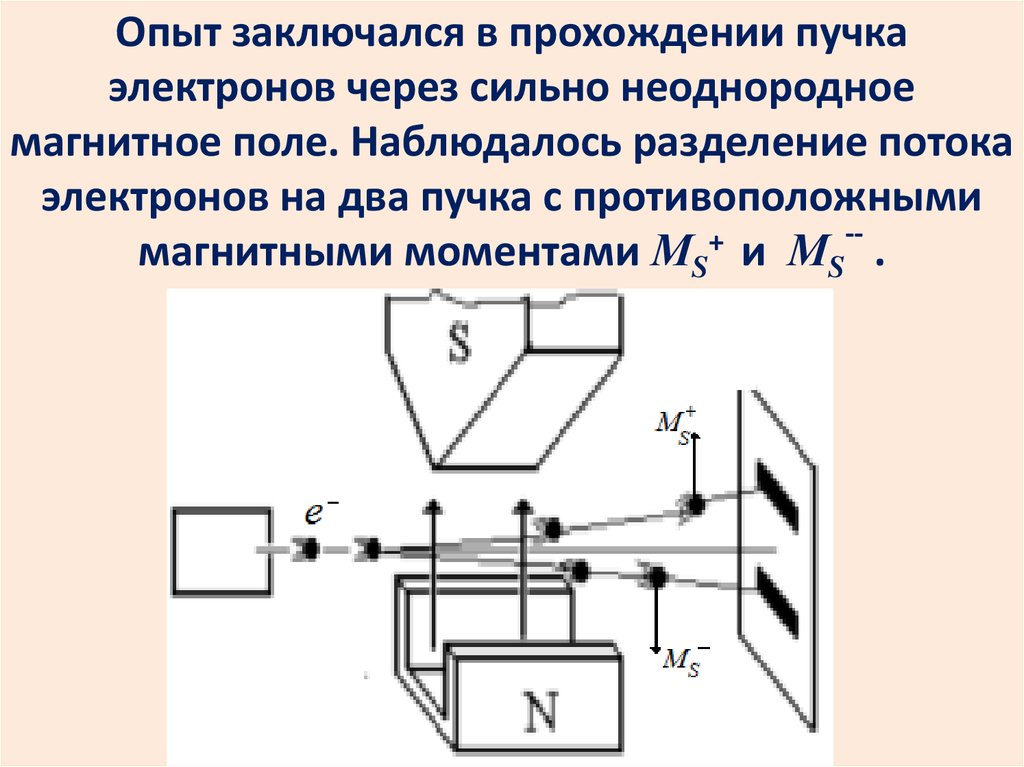
Квантование спина электронаэкспериментально доказано
опытами Штерна и Герлаха.
52.
Опыт заключался в прохождении пучкаэлектронов через сильно неоднородное
магнитное поле. Наблюдалось разделение потока
электронов на два пучка с противоположными
-+
магнитными моментами МS и МS .
52
53.
Вывод:Состояние электрона в атоме определяется
набором 4-х квантовых чисел:
главного
n, (n = 1, 2, 3, …)
орбитального l, (l = 0, 1, 2, … , n-1)
магнитного m, (m = - l, …-1, 0, 1, …, l)
спинового магнитного mS , (mS = -1/2, +1/2)
53
54.
Число состояний на энергетическом уровне с главным квантовымчислом n:
n 1
N 2 (2 1) 2n
0
с учетом спина
2
55.
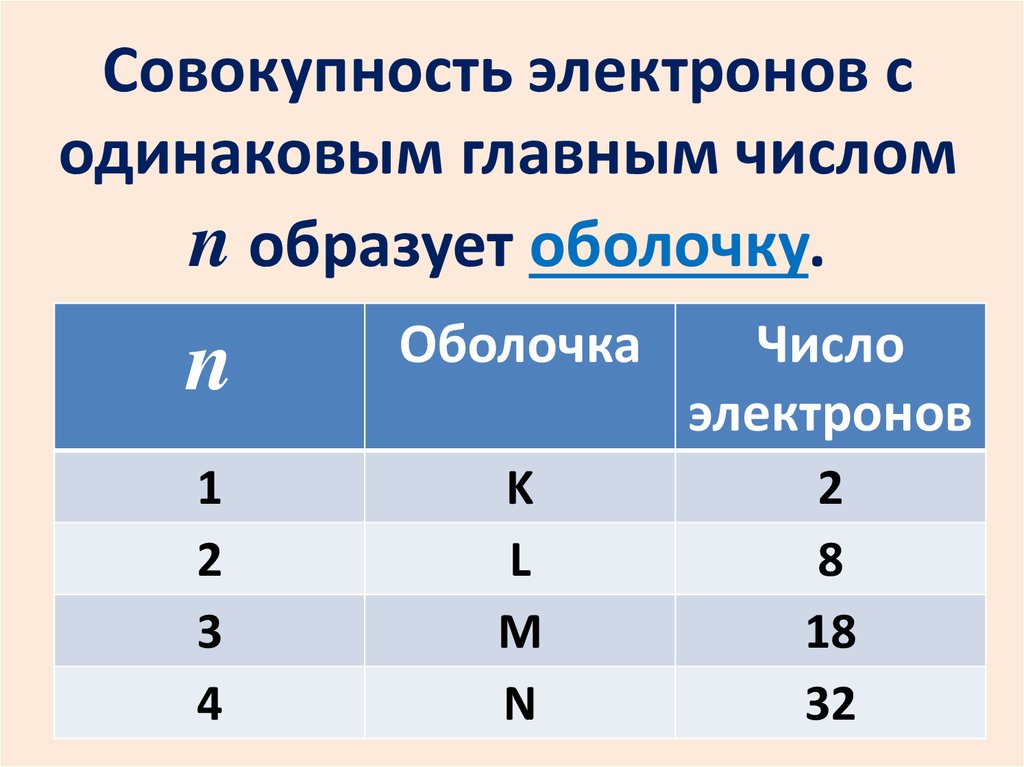
Совокупность электронов содинаковым главным числом
n образует оболочку.
n
Оболочка
Число
электронов
1
2
3
4
K
L
M
N
2
8
18
32
56.
Правила отбора:возможны лишь такие переходы
между состояниями, при которых
1; m 0, 1.
56
57.
Серия Лаймана:np 1s
n 2, 3...
Серия Бальмера:
np 2 s, ns 2 p, nd 2 p
n 3, 4...
































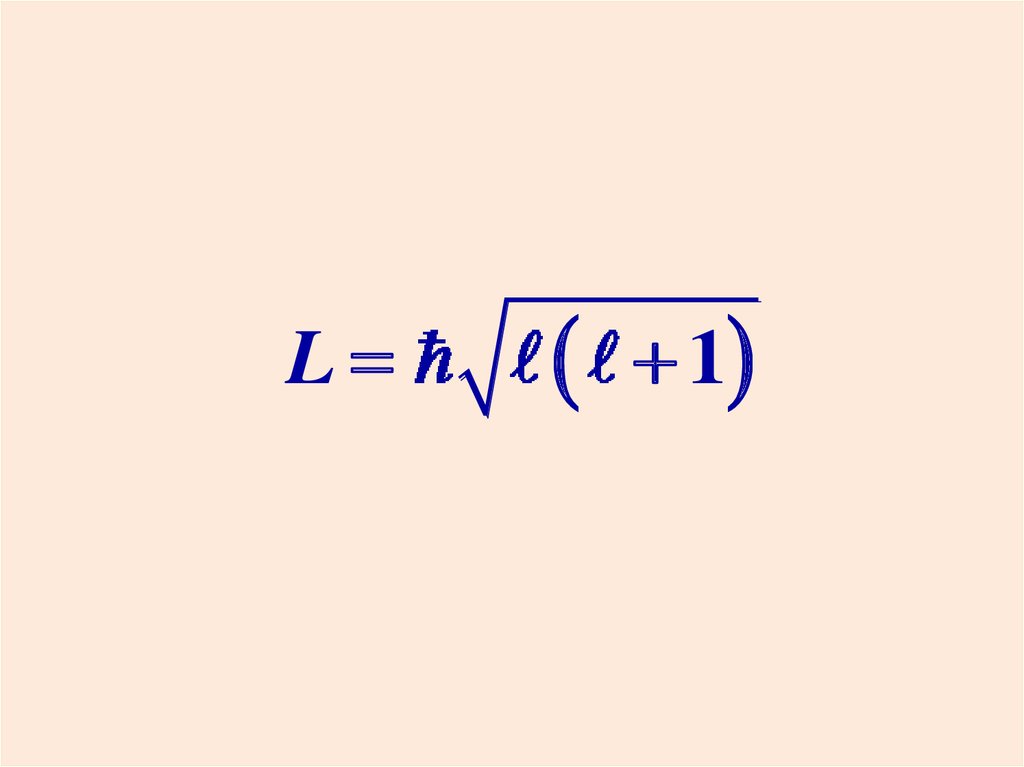








 Физика
Физика








