Похожие презентации:
Современная биология говорит на языке энзимологии
1. Ферменты
Современная биология говорит наязыке энзимологии.
А. Е. Браунштейн
2. Ферменты (энзимы)
• специфические и высокоэффективные катализаторыхимических реакций, протекающих в живой клетке
• Энзимология
– один из главных разделов биохимии
– изучает ферменты, их строение, свойства и механизм
биологического действия
3.
• Обмен веществ был бы невозможен без участиябиологических катализаторов – ферментов
• Биокаталитически ускоряются самые различные
превращения
Н2СО3 → Н2О + СО2
Фермент карбангидраза
4. Сходство и отличия ферментов и традиционных катализаторов
5. Катализаторы
• не создают реакции, а лишь ускоряют достижениеравновесия
• ускоряют реакции за счет снижения энергии активации
6.
Н2О2 Н2О + ½ О2• Еа = 75,24 кДж/моль (18 ккал/моль)
• Мелкодисперсная Pt ускоряет реакцию на 6 порядков;
Еа = 50,16 кДж/моль (12 ккал/моль)
• Каталаза ускоряет реакцию на 12 порядков;
Еа = 23,408 кДж/моль (5,6 ккал/моль)
7. Отличия ферментов и традиционных катализаторов
1. Бо́ льшая эффективность8. Отличия ферментов и традиционных катализаторов
2. Ферменты проявляют высокую каталитическую активностьв очень мягких условиях
– температура (?)
– давление (?)
– рН (?)
– Гидролиз белка
• в присутствии кислот или щелочей при Т > 100 С –
за несколько часов
• при участии специфических ферментов при 30–40 С –
за десятки минут
9. Отличия ферментов и традиционных катализаторов
3. Высокая специфичность действия– пределы ее у разных ферментов различны
10. Виды специфичности ферментов
• Относительная (групповая)• Наибольшее значение – тип химической связи в молекуле
субстрата
– Пепсин расщепляет белки, но не углеводы и жиры (?)
– Липазы: место действия – сложноэфирная связь
11. Виды специфичности ферментов
• Абсолютная• Фермент катализирует превращение одногоединственного субстрата
– Аргиназа ускоряет гидролиз аргинина
– Уреаза – мочевины
– Сахараза – сахарозы
– и т. д.
12. Виды специфичности ферментов
• стереохимическая• обусловлена существованием
– оптически активных субстратов
• оксидазы L- и D-аминокислот
• аспартатдекарбоксилаза (отщепление СО2 от L-асп)
• лактатдегидрогеназа (при восстановлении ПВК образуется
только L-лактат)
– цис- и транс-изомеров
• Фумараза действует на фумаровую кислоту (транс-изомер), но
не действует на малеиновую (цис-)
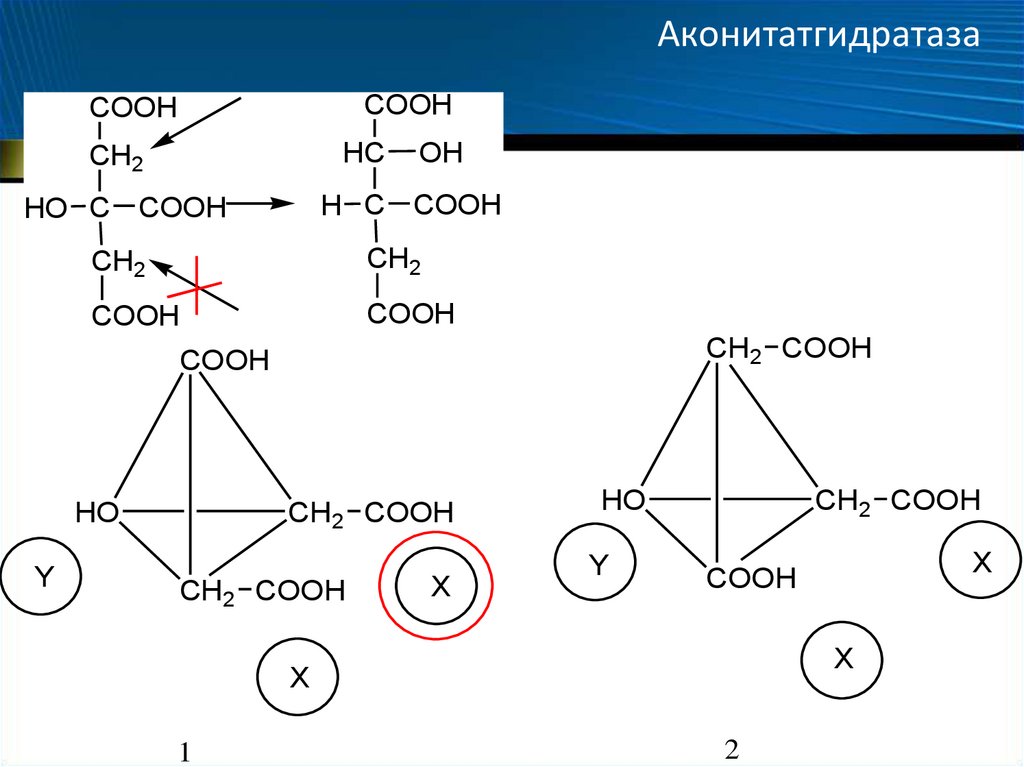
– симметричных субстратов
• Некоторые ферменты способны различать в симметричных
молекулах группы, которые являются химически идентичными
13. Аконитатгидратаза
COOHCOOH
HC
CH2
OH
H C COOH
HO C COOH
CH2
CH2
COOH
COOH
CH2 COOH
COOH
HO
Y
CH2 COOH
CH2 COOH
X
HO
Y
CH2 COOH
X
X
1
X
COOH
2
14. Отличия ферментов и традиционных катализаторов
4. Отличия, связанные с белковой природой ферментов(термолабильность, зависимость активности от рН,
наличие активаторов и ингибиторов и др.)
5. Кооперативность и жесткая запрограммированность
этапов действия ферментов в пространстве и времени
15. Строение ферментов
16. Природа ферментативного катализа
• Фермент (энзим) – катализатор, ускоряющий только однухимическую реакцию
• Фермент – белок
– Белки построены из 20 аминокислот, соединенных в
длинные цепи
– Белки – высокомолекулярные соединения: Мr – 10000
и>
– Одна из причин, по которой ферменты так велики, –
длинная цепь (или цепи), из которой они состоят,
должна свернуться с образованием некоего кармана,
называемого активным центром
– Попадая в такой карман, молекула вещества с
исключительной точностью атакуется
функциональными группами фермента
17.
ФерментыПростые
Сложные
(однокомпонентные)
(двухкомпонентные)
18. Однокомпонентные ферменты (ферменты-протеины)
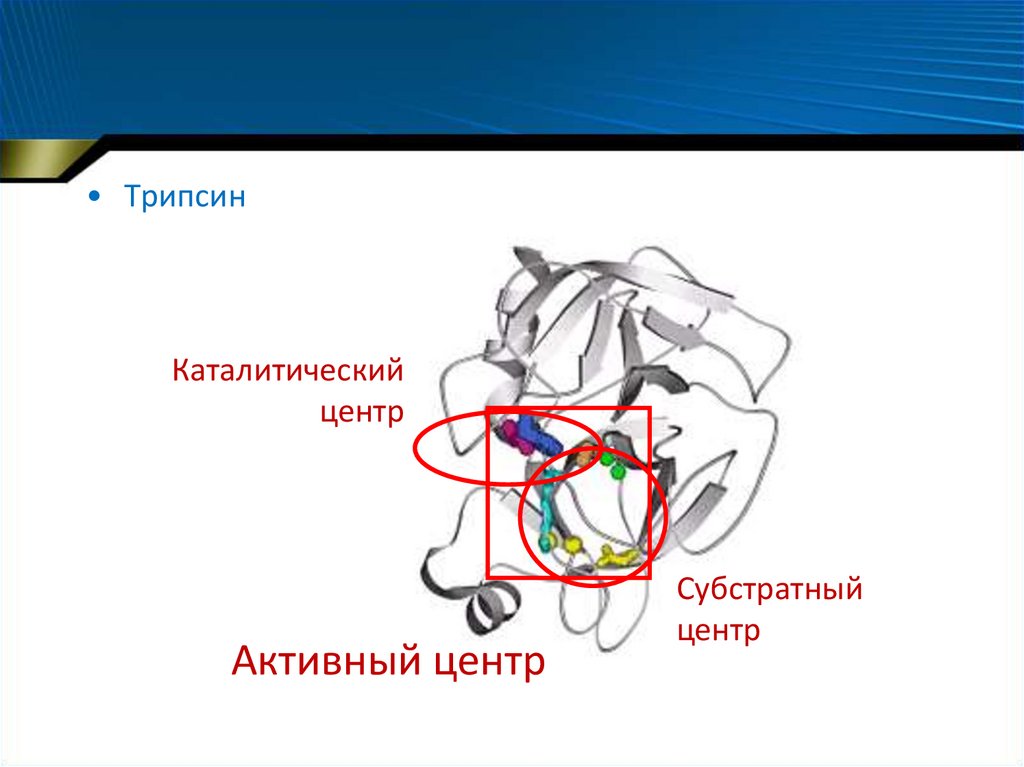
• Каталитический центр• Субстратный центр
– Субстратный центр может совпадать (или перекрываться)
с каталитическим
– Каталитический центр может окончательно
формироваться в момент присоединения субстрата
• Активный центр фермента – сочетание каталитического и
субстратного
– располагается на дне щели или впадины
• Аллостерический центр
19.
• ТрипсинКаталитический
центр
Активный центр
Субстратный
центр
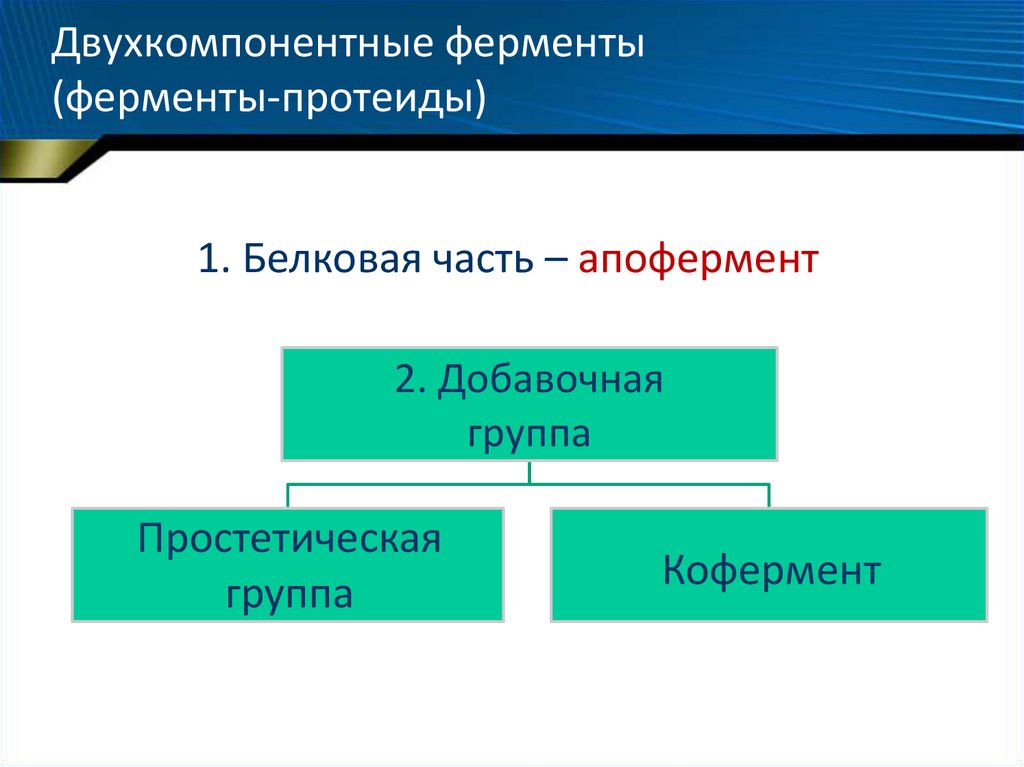
20. Двухкомпонентные ферменты (ферменты-протеиды)
1. Белковая часть – апофермент2. Добавочная
группа
Простетическая
группа
Кофермент
21. Природа коферментов (О. Г. Варбург, Р. Кун, П. Каррер)
1. Витамины (Е, К, Q, В1, В2, В6, В12, С, Н и др.)2. Соединения, построенные с участием витаминов (коА,
НАД, ФАД и др.)
3. НS-глутатион
4. Нуклеотиды и их производные (УМФ, ЦМФ)
5. Фосфорные эфиры моносахаридов (Г-1,6-дФ)
6. Ионы металлов (Fe2+, Cu2+ и др.)
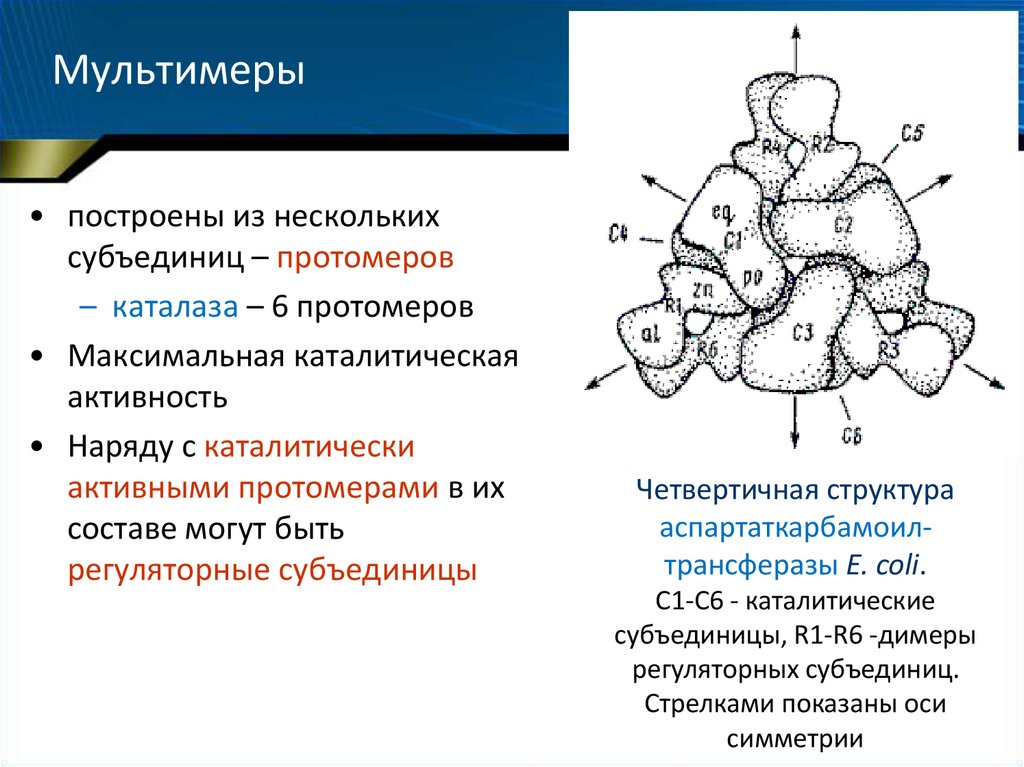
22. Мультимеры
• построены из несколькихсубъединиц – протомеров
– каталаза – 6 протомеров
• Максимальная каталитическая
активность
• Наряду с каталитически
активными протомерами в их
составе могут быть
регуляторные субъединицы
Четвертичная структура
аспартаткарбамоилтрансферазы Е. coli.
С1-С6 - каталитические
субъединицы, R1-R6 -димеры
регуляторных субъединиц.
Стрелками показаны оси
симметрии
23. Изозимы
• лактатдегидрогеназа– НННН, НННМ, ННММ, НМММ, ММММ
• H – от англ. heart – сердце
• M – от англ. muscle – мышца
24.
25. Изозимы
• отличаются– по степени активности
– по некоторым физическим свойствам
– по локализации в органах и тканях и т. д.
• соотношение может меняться в зависимости
– от возраста
– от физиологического состояния и др.
• используются
– для диагностики болезней в медицине
– для прогнозирования продуктивности с/х животных
– для подбора родительских пар при скрещивании и т. п.
26. Мультиэнзимы
• ферменты, способные одновременно ускорять несколькохимических реакций и осуществлять сложные
превращения субстрата
– пируватдегидрогеназный комплекс
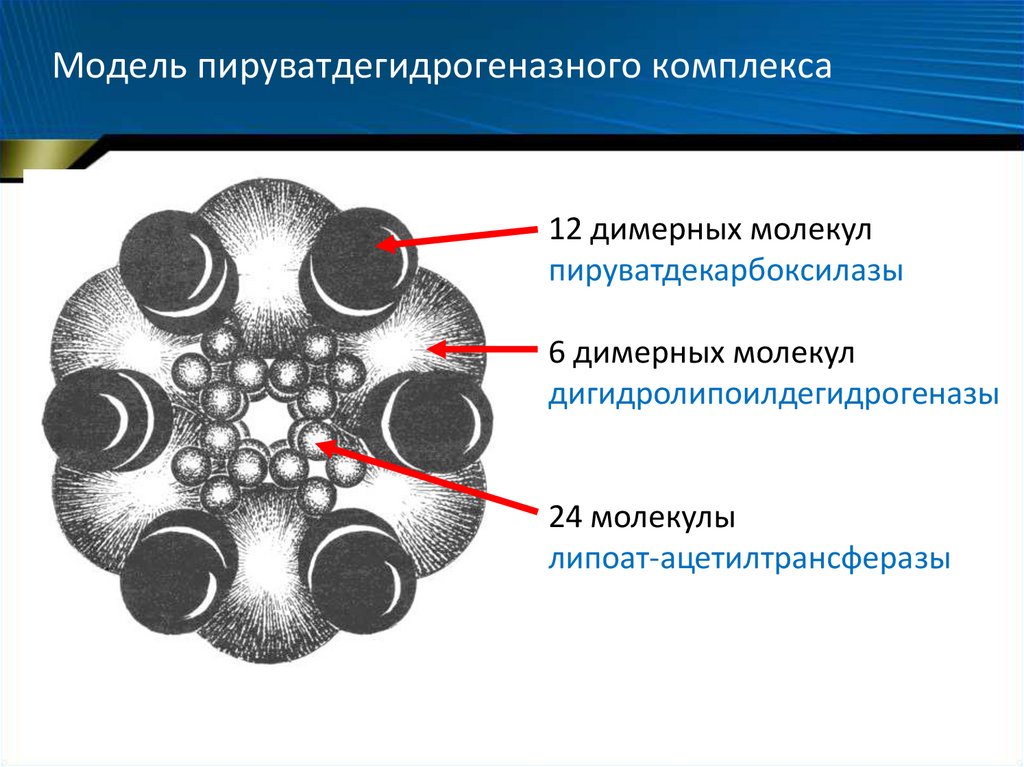
27. Модель пируватдегидрогеназного комплекса
12 димерных молекулпируватдекарбоксилазы
6 димерных молекул
дигидролипоилдегидрогеназы
24 молекулы
липоат-ацетилтрансферазы
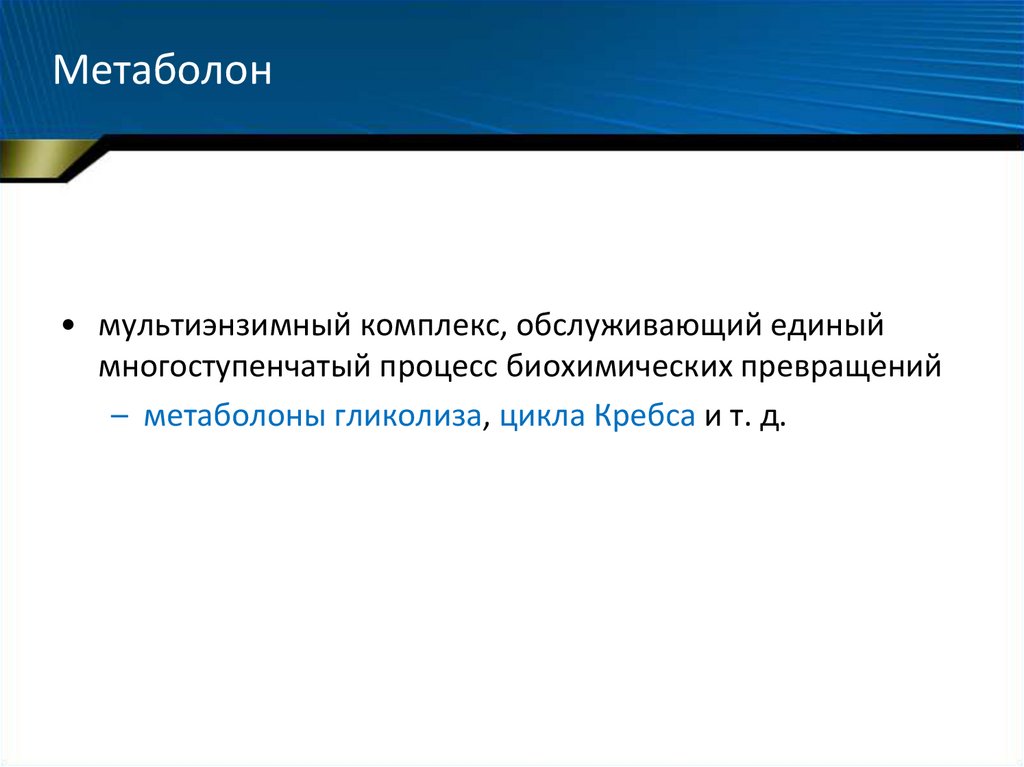
28. Метаболон
• мультиэнзимный комплекс, обслуживающий единыймногоступенчатый процесс биохимических превращений
– метаболоны гликолиза, цикла Кребса и т. д.
29. Полифункциональные ферменты
• состоят из одной полипептидной цепи, содержащейнесколько доменов, каждый из которых характеризуется
своей каталитической активностью
30. Ферменты и ферментные комплексы
Фермент«Обычный» фермент
Структура
Третичная
Ускоряет
1 реакцию
Мультимер
Полифункциональный
фермент
Мультэнзимный
комплекс
Четвертичная
1 реакцию
Третичная
Несколько реакций
Четвертичная
Несколько реакций
31. Физиологический смысл мультиэнзимных комплексов и полифункциональных ферментов
• слаженность во времени и пространстве действияферментов или доменов (кооперативность)
• повышение скорости метаболических процессов
• возможность осуществления эстафетной передачи
промежуточных продуктов реакции от одного компонента
каталитической системы к другому без их высвобождения
• возможность создания в клетке обособленных по функции
отделов
• возможность управления метаболическими путями
32. Кинетика ферментативных реакций (самостоятельно + лабораторные занятия)
33. Номенклатура и классификация ферментов
34.
Номенклатура ферментов35. 1. Тривиальная номенклатура
1. Тривиальная номенклатурапепсин – от греч. пепсис – пищеварение
трипсин – от греч. трипсис – разжижаю
папаин – от названия дынного дерева Carica papaja
цитохромы – от лат. citos – клетка и chroma – цвет
36. 2. Рациональная номенклатура
2. Рациональная номенклатураНазвание субстрата + окончание –аза
(1883 г., П. Э. Дюкло)
амилаза – от греч. амилон – крахмал
липаза – от греч. липос – жир
протеаза – фермент гидролиза протеинов
уреаза – от греч. уреа – мочевина
Используется для названий ферментов
класса гидролаз
Пьер Эмиль
Дюкло
(1840 – 1904)
37. 3. По названию простетической группы (кофермента)
3. По названию простетической группы(кофермента)
геминфермент (простетическая группа – гем)
пиридоксальфермент (кофермент – пиридоксаль,
витамин В6)
38. 4. По характеру субстрата и типу катализируемой реакции
4. По характеру субстрата и типукатализируемой реакции
Сукцинатдегидрогеназа
НООС–СН2–СН2–СООН → НООС–СН=СН–СООН + 2Н
янтарная кислота
фумаровая кислота
acidium succinicum
39. 5. Международная (московская) номенклатура
• V Международный биохимический конгресс, 10–16августа 1961 г., Москва
• Химическое название субстрата + название той реакции,
которая осуществляется ферментом
• Если химическая реакция сопровождается переносом
группировки атомов от субстрата к акцептору, название
фермента включает также химическое наименование
акцептора
40.
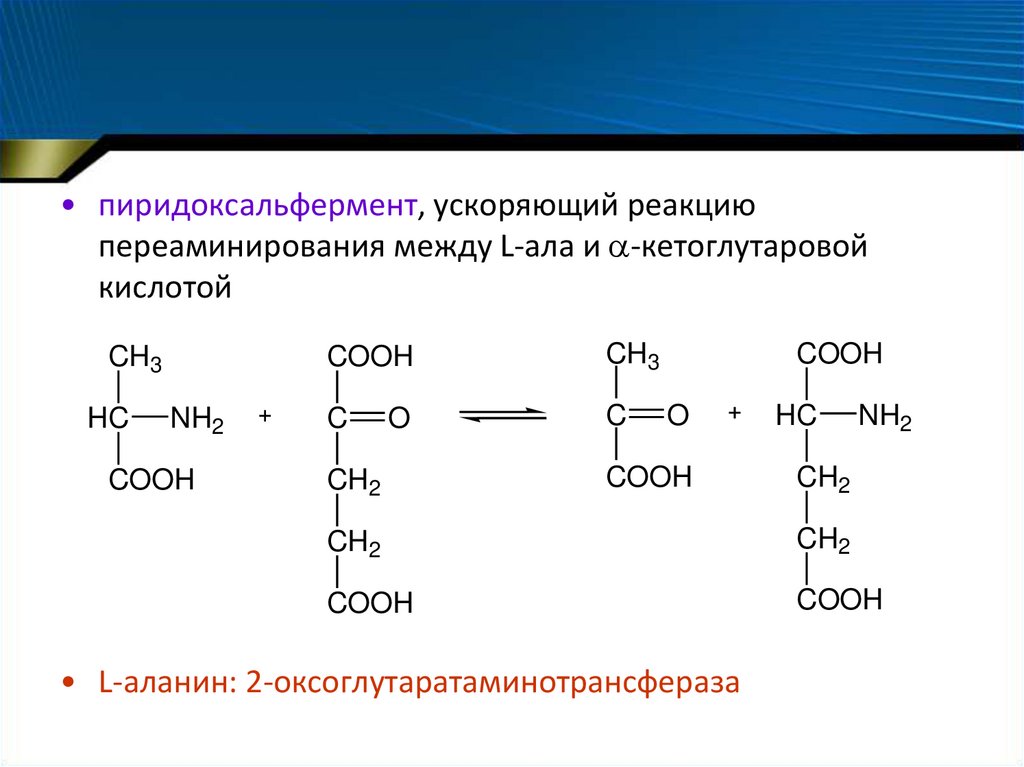
• пиридоксальфермент, ускоряющий реакциюпереаминирования между L-ала и -кетоглутаровой
кислотой
CH3
HC
NH2
COOH
COOH
CH3
C
C
O
CH2
COOH
O
COOH
HC
NH2
CH2
CH2
CH2
COOH
COOH
• L-аланин: 2-оксоглутаратаминотрансфераза
41.
• Названия ферментов выигрывают в точности, НО в рядеслучаев гораздо сложнее тривиальных
– уреаза – карбамид-амидогидролаза
– трегалаза – трегалоза-1-глюкогидролаза
• допускается сохранение тривиальных названий
42.
Классификация ферментов43.
Список ферментов44.
• Международной комиссией был составлен детальныйсписок ферментов, в котором на основании
классификации каждому ферменту присвоен шифр,
содержащий 4 числа, разделенных точками
45. 1 число
1.
2.
3.
4.
5.
6.
Класс
Оксидоредуктазы
Трансферазы
Гидролазы
Лиазы
Изомеразы
Лигазы (синтетазы)
46. 2 число
Подкласс
у оксидоредуктаз показывает природу той группы в
молекуле донора, которая подвергается окислению
(1 – –СН–ОН; 2 – альдегидная или кетогруппа и т. д.)
у трансфераз – природу транспортируемой группы
у гидролаз – тип гидролизуемой связи
у лиаз – тип связи, подвергающейся разрыву
у изомераз – тип катализируемой реакции
изомеризации
у лигаз – тип вновь образуемой связи
47. 3 число
Подподкласс
у оксидоредуктаз – тип участвующего в реакции
акцептора (1 – НАД или НАДФ; 2 – цитохром; 3 – О2 и т. д.)
– 1.2.3 – оксидоредуктаза, для которой донором атомов
водорода служит альдегид, а акцептором – О2
у трансфераз – тип транспортируемой группы (метил или
карбоксил и т. д.), тип акцептора (фосфотрансферазы)
у гидролаз – уточняет тип гидролизуемой связи
у лиаз – уточняет тип отщепляемой группы
у изомераз – уточняет характер превращения субстрата
у лигаз – природу образующегося соединения
48. 4 число
Порядковый номер
Уреаза 3.5.1.5
– 3 – класс гидролаз
– 5 – подкласс С–N-гидролаз
– 1 – подподкласс С–N-гидролаз, ускоряющих гидролиз
линейных амидов
• Лактатдегидрогеназа 1.1.1.27
– 1 – класс оксидоредуктаз
– 1 – подкласс оксидоредуктаз, действующих на СН–ОНгруппы
– 1 – подподкласс оксидоредуктаз, для которого
акцептором атомов Н служит НАД
49.
Оксидоредуктазы50. I. Оксидоредуктазы
ускоряют ОВР
Оксидоредуктаза
Субстрат + акцептор
окисленный + восстановленный
субстрат
акцептор
Окисление – процесс отнятия атомов Н или электронов
от субстрата, а восстановление – присоединения атомов
Н или электронов к акцептору
51. Особенности оксидоредуктаз
1.Способность образовывать цепи, в которых
осуществляется многоступенчатый перенос атомов Н
или электронов от первичного субстрата к конечному
акцептору (как правило, кислороду)
52. Особенности оксидоредуктаз
ОксидоредуктазыАэробные
дегидрогеназы
(оксидазы)
Анаэробные
дегидрогеназы
(редуктазы)
переносят атомы Н
или электроны
непосредственно на
атомы О
переносят атомы Н и
электроны от одного
компонента
окислительной цепи
ферментов к другому
53. Особенности оксидоредуктаз
ОксидоредуктазыПервичные
дегидрогеназы
Вторичные
дегидрогеназы
катализируют реакции
отнятия атомов Н
непосредственно от
окисляемого вещества
(первичного субстрата)
ускоряют отнятие атомов
Н от вторичного субстрата
54. Особенности оксидоредуктаз
2.Двухкомпонентные ферменты с ограниченным
набором коферментов, но способные ускорять
большое число самых разнообразных ОВР, т. к. один
и тот же кофермент может соединяться со многими
апоферментами
55. Особенности оксидоредуктаз
Пиридинпротеины
Аэробные дегидрогеназы
– Пример – алкогольдегидрогеназа
• Коферменты
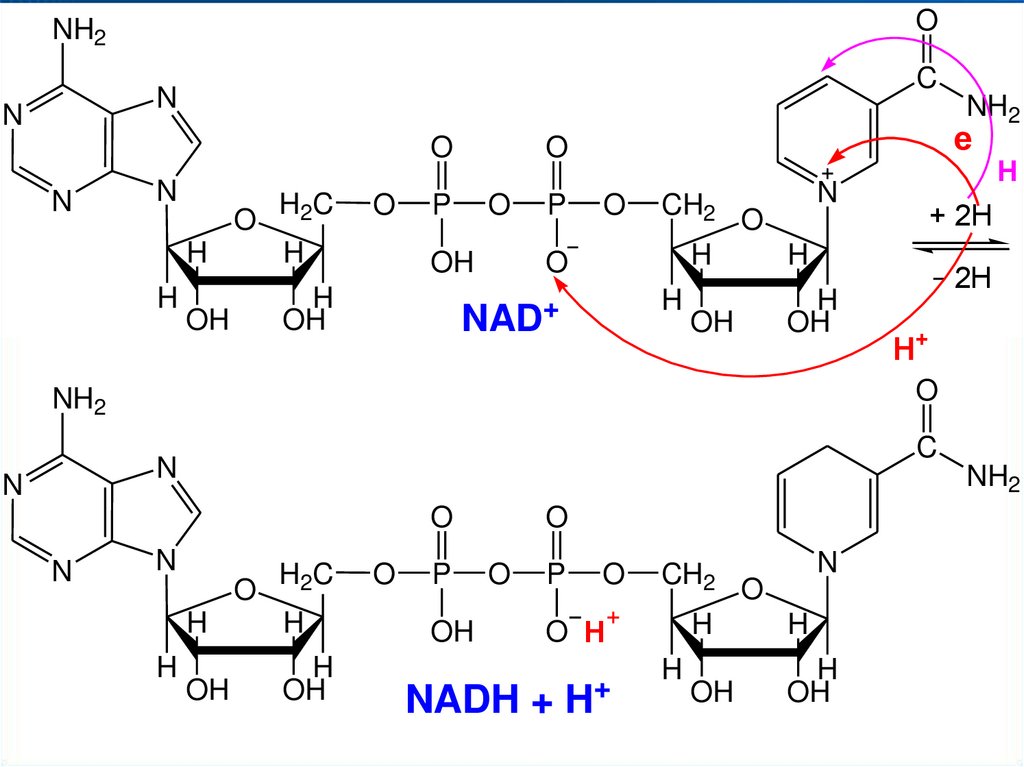
• никотинамидадениндинуклеотид (NAD+, НАД+)
• никотинамидадениндинуклеотидфосфат (NADP+, НАДФ+)
56.
ONH2
C
N
N
NH2
O
N
N
O
H
H2C
H
H
OH
H
OH
O
e
O
P
O
P
OH
O
CH2
O
H
+
NAD
N
H
OH
H
OH
H+
C
N
NH2
O
N
2H
O
NH2
N
+ 2H
O
H
H
N
O
H
H2C
H
H
OH
H
OH
O
P
OH
O
O
P
O
CH2
O H
+
NADH + H
H
N
O
H
H
OH
H
OH
57. Особенности оксидоредуктаз
Флавопротеины (ФП)
Партнеры восстановленных форм пиридинпротеинов в
окислительно-восстановительной цепи
В большинстве случаев – вторичные дегидрогеназы
Коферменты
рибофлавинфосфат (флавинмононуклеотид, FMN, ФМН)
флавинадениндинуклеотид (FAD, ФАД)
58.
OHH2C
O
H
C
OH
H
C
OH
H
C
OH
P
OH
O
H2C
OH
+ 2H
2H
CH2
H3C
N
O
H
C
OH
H
C
OH
H
C
OH
P
OH
CH2
O
N
H3C
N
H
N
NH
H3C
N
FMN
O
NH
H3C
O
O
N
H
FMNH2
O
59.
OHH2C
O
P
OH
O
P
H
C
OH O
H
C
OH
H
C
OH
N
O
N
H2C
H
N
N
O
H
H
OH
H
OH
O
NH
H3C
N
FAD
O
N
O
CH2
H3C
NH2
N
60. Особенности оксидоредуктаз
Другие коферменты оксидоредуктаз
хиноны (убихинон – витамин Q)
железопорфирины (цитохромы)
61. Особенности оксидоредуктаз
3.Ускоряют протекание реакций, связанных с
высвобождением энергии (цитохромная система)
62.
Трансферазы63. II. Трансферазы
ускоряют реакции переноса функциональных групп и
молекулярных остатков от одного соединения к другому
64. Подклассы
1.Фосфотрансферазы (киназы) переносят фосфатные
группы с участием АТФ
Гексокиназа (АТФ: D-глюкоза-6-фосфотрансфераза)
65.
NH2N
CH2OH
O
OH
HO
OH
HO
OH
P
OH
O
P
O
OH
глюкоза
O
P
O
O
CH2
O
N
OH
OH
NH2
OH
N
OH
O
O
OH
OH
HO
P
O
HO
N
O
АТФ
H2C O P
N
OH
OH
OH
Глюкозо-6-фосфат (Г-6-Ф)
N
OH
O
P
O
CH2
O
N
O
OH
АДФ
OH
N
66. Подклассы
2.Аминотрансферазы (трансаминазы) ускоряют реакции
переаминирования аминокислот с кетокислотами
Кофермент – пиридоксальфосфат
67. Подклассы
3.Гликозилтрансферазы ускоряют реакции переноса
остатков сахаров на различные акцепторы
• фосфорилазы катализируют реакции переноса
гликозильных групп от фосфорных эфиров
моносахаридов и реакции переноса этих групп на
свободный фосфат
– Сахароза: ортофосфат- -глюкозилтрансфераза, или
сахарозофосфорилаза
68.
сахарозаглюкозо-1-фосфат (Г-1-Ф)
фруктоза
69. Подклассы
4.Ацилтрансферазы ускоряют перенос ацильных групп
на аминокислоты, амины, спирты и др.
• Кофермент – коэнзим А (КоА)
– Холинацетилтрансфераза
• Играют важную роль в обмене липидов
70.
ацетил-КоАхолин
ацетилхолин
71. Подклассы
ферменты, ускоряющие перенос
одноуглеродных фрагментов
– Метилтрансферазы
– Оксиметилтрансферазы
– Формилтрансферазы и др.
• нуклеотидных остатков
– Нуклеотидилтрансферазы
72.
Гидролазы73. III. Гидролазы
ускоряют реакции гидролиза органических соединений
Делятся на подклассы по характеру субстрата
74. Подклассы
1.Эстеразы ускоряют гидролиз сложных эфиров
– Липаза ускоряет гидролиз -сложноэфирных связей в
молекулах триглицеридов (жиров)
O
C15H31
O H2C OH
O H2C O C C15H31
+ 2Н2О
C15H31 C O CH + 2 C15H31COOH
C O CH
H2C OH
H2C O C C15H31
O
Фосфатазы катализируют гидролиз фосфорных эфиров:
Г-1-Ф + Н2О глюкоза + Н3РО4
Фермент: D-глюкозо-1-фосфат-фосфогидролаза
(глюкозо-1-фосфатаза)
75. Подклассы
2.Гликозидазы ускоряют гидролиз гликозидов
Мальтаза
Сахараза
Амилаза
76. Подклассы
3.Пептидазы (пептид-гидролазы) ускоряют гидролиз
пептидных связей в белках и пептидах
– протеиназы (пептидил-пептидогидролазы)
ускоряют гидролиз внутренних пептидных связей в
молекуле белка – эндопептидазы
– Выборочный (селективный) характер действия:
– пепсин – гидролиз пептидных связей, образованных
фен и лей
– трипсин – арг и лиз
– химотрипсин – ароматическими аминокислотами
– папаин – арг, лиз и фен и т. д.
– пептидазы (пептид-гидролазы) обеспечивают
отщепление концевых аминокислот –
экзопептидазы (амино- и карбоксипептидазы)
77. Подклассы
4.Амидазы ускоряют гидролиз амидов кислот
уреаза (гидролиз мочевины до NH3 и СО2)
аспарагиназа и глутаминаза (гидролиз асн и глн)
78.
Лиазы79. IV. Лиазы
ускоряют реакции негидролитического распада
органических соединений
При этом замыкаются двойные связи и выделяются такие
простейшие продукты, как СО2, Н2О, NH3 и т. п.
Некоторые из этих реакций обратимы, и соответствующие
ферменты ускоряют реакции и распада, и синтеза
80. Подклассы
1.С–С-лиазы
декарбоксилазы кетокислот (кофермент – витамин В1)
декарбокислазы аминокислот (кофермент – витамин В6)
альдегид-лиазы
– альдолаза (фруктозо-1,6-дифосфат-триозофосфатлиаза)
81.
OHO
P
HO
OH
O CH2
CH2O P O
OH
O HO HO
OH
OH
фруктозо-1,6-дифосфат
(Ф-1,6-дФ)
H2C O
C O
P
O H2C
OH
OH
O
P
O
OH
HC OH
O
H2C OH
C
H
диоксиацетонфосфат
(ДОАФ)
3-фосфоглицериновый
альдегид
(3-ФГА)
82. Подклассы
2.С–О-лиазы (гидратазы) ускоряют гидратацию и
дегидратацию органических соединений
• Фумаратгидратаза
НООС–СН(ОН)–СН2–СООН ⇄
НООС–СН=СН–СООН + Н2О
Яблочная кислота (малат)
Фумаровая кислота
(фумарат)
83. Подклассы
3.С–N-лиазы
аспартат-аммиак-лиаза ускоряет прямое
дезаминирование асп
НООС–СН(NH2)–СН2–СООН ⇄ НООС–СН=СН–СООNH4
Аспарагиновая кислота
(асп)
Фумарат аммония
84.
Изомеразы85. V. Изомеразы
ускоряют геометрические или структурные изменения в
пределах одной молекулы
86. Подклассы
1.2.
Рацемазы и эпимеразы
Мутаротаза
-D-глюкопираноза ⇄ -D-глюкопираноза
Цис-транс-изомеразы
Ретинол-изомераза
87. Подклассы
3.Внутримолекулярные трансферазы (мутазы)
Фосфоглицерат-фосфомутаза
OH
H2C
O
HC
OH
O
P
O
OH
C
H2C
HC
OH
O
O
C
OH
3-фосфоглицериновая кислота
(3-ФГК)
OH
P
O
OH
OH
2-фосфоглицериновая кислота
(2-ФГК)
88. Подклассы
4.Внутримолекулярные оксидоредуктазы
триозофосфатизомераза
OH
OH
H2C
O
C
O
H2C
P
O
OH
OH
Диоксиацетонфосфат (ДОАФ)
H2C
O
HC
OH
O
P
O
OH
C
H
3-фосфоглицериновый
альдегид (3-ФГА)
89.
Лигазы90. VI. Лигазы
Ускоряют присоединение друг к другу двух молекул
Процесс сопряжен с разрывом макроэргической связи
АТФ; энергия, освобождаемая при этом, используется
для синтеза
• аминоацил-т-РНК-синтетазы
• ацил-коэнзим А-синтетазы
СН3–СООН + HS–КоА + АТФ
СН3–СО–S–КоА + АМФ + Н4Р2О7
• карбоксилазы (пируваткарбоксилаза)
СН3–СО–СООН + СО2 + АТФ
НООС–СН2–СО–СООН + АДФ + Н3РО4
91. Самостоятельная работа
Локализация ферментов в клетке
Применение ферментов


















































































 Биология
Биология








