Похожие презентации:
Ферменты – 1
1. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
ЛЕКЦИЯФЕРМЕНТЫ – 1
КРАСНОДАР
2016
2. Ферменты –
это биокатализаторы белковойприроды, изменяющие
скорость химических реакций
в живых клетках
3. Свойства ферментов как белков
Имеют высокую молекулярную массу
Образуют коллоидные растворы
Термолабильны
Обладают высокой вязкостью,
оптическими свойствами
• Могут обратимо и необратимо
осаждаться и т.д.
4. Свойства ферментов как катализаторов
• Катализируют только термодинамическивозможные реакции
• Не потребляются в ходе реакции и не входят в
состав конечных продуктов
• В случае обратимости реакции ускоряют и прямую
и обратную реакции
• Ведут реакцию «в обход энергетического барьера»
• Чувствительны к изменению параметров
проведения реакции (температуре, рН,
концентрации катализатора и реагирующих
веществ)
• Чувствительны к действию эффекторов –
активаторов и ингибиторов
5. Собственные свойства ферментов
• Высокая биологическая активность• Ферментная специфичность
• действия
• субстратная
• Иная зависимость от факторов,
влияющих на скорость реакции
• Наличие механизмов регуляции
активности
6. Ферменты
ОднокомпонентныеДвухкомпонентые
(только
аминокислоты) Апофермент (ак) Кофактор
Кофермент
Витаминные
Простетическая
группа (Ме2+)
Невитаминного
происхождения
7. Строение активного центра фермента
субстратучасток
связывания
каталитический
участок
активный центр
фермент
8. Активный центр –
участок молекулы фермента, вкотором происходит узнавание,
связывание и химическое
превращение молекулы субстрата.
У однокомпонентного фермента
активный центр образован
радикалами аминокислот, у
двухкомпонентного – и радикалами
аминокислот, и кофактором
9. Активный центр фермента
10. Образование фермент-субстратного комплекса согласно модели «жесткой матрицы» Фишера
Образование ферментсубстратного комплексасогласно модели «жесткой
матрицы» Фишера
E
S
ES
11. Схематическое представление конформационных изменений в молекуле фермента при связывании субстрата согласно модели
«индуцированногосоответствия» Кошланда
12. Общее уравнение ферментативной реакции:
k1E + S k ES
2
k3
EP
E+P
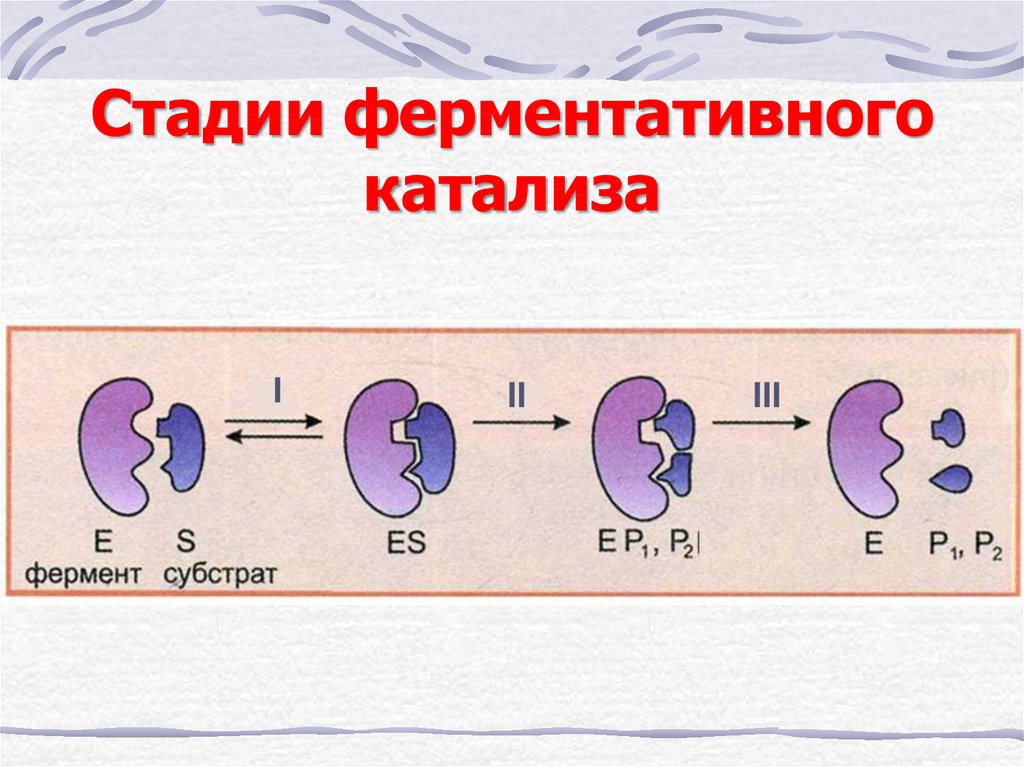
13. Стадии ферментативного катализа
III
III
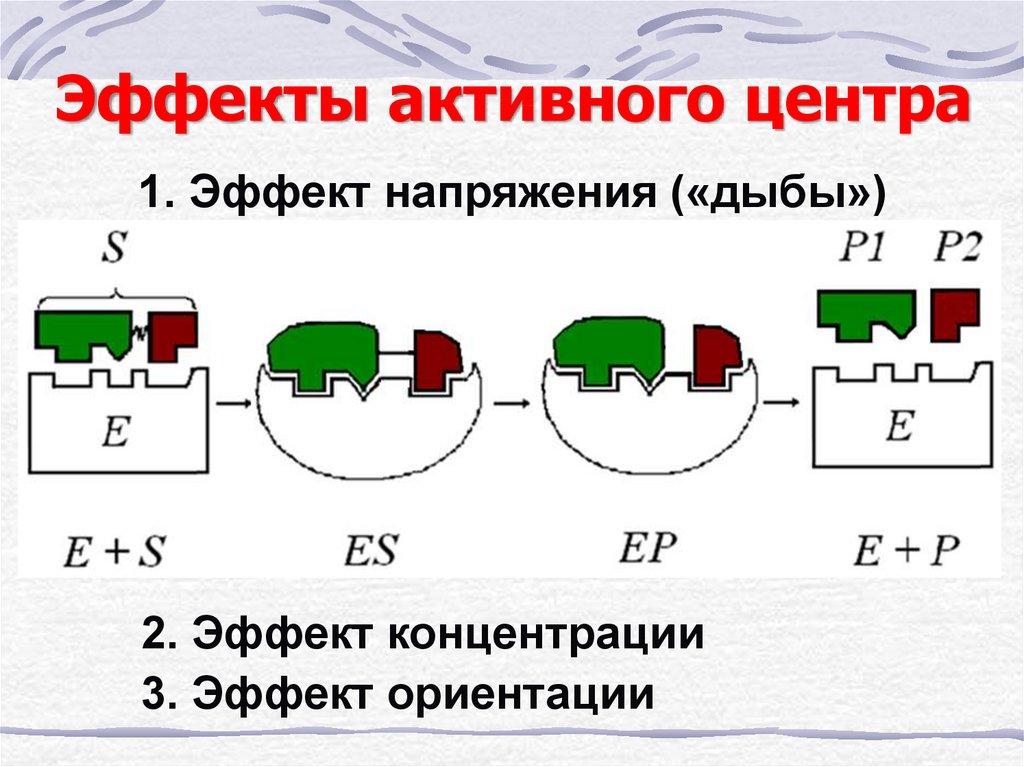
14. Эффекты активного центра
1. Эффект напряжения («дыбы»)2. Эффект концентрации
3. Эффект ориентации
15. Специфичность фермента (каталитическая специфичность, или специфичность действия) –
способность ферментакатализировать превращение
субстрата по одному из возможных
путей превращения
- СО2
Е3 декарбоксилиза
- NH3
Е1
оксидаза
ак
- NH2
Е2 трансаминаза
16.
Специфичность фермента(субстратная специфичность) –
способность фермента узнавать,
связывать и катализировать
превращение только определённых
субстратов, м.б.
• абсолютная,
• относительная,
• стереоспецифичность.
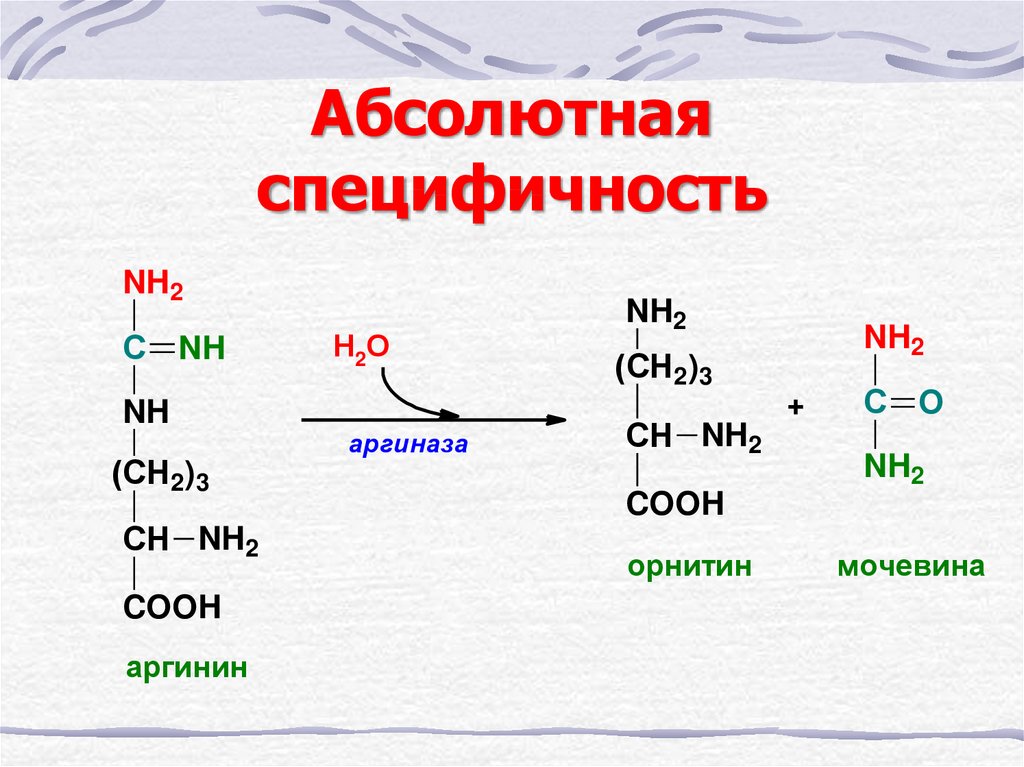
17. Абсолютная специфичность
NH2С NH
NH
(СН2)3
СН NH2
COOH
аргинин
Н2О
аргиназа
NH2
NH2
(СН2)3
СН NH2
+
С O
NH2
COOH
орнитин
мочевина
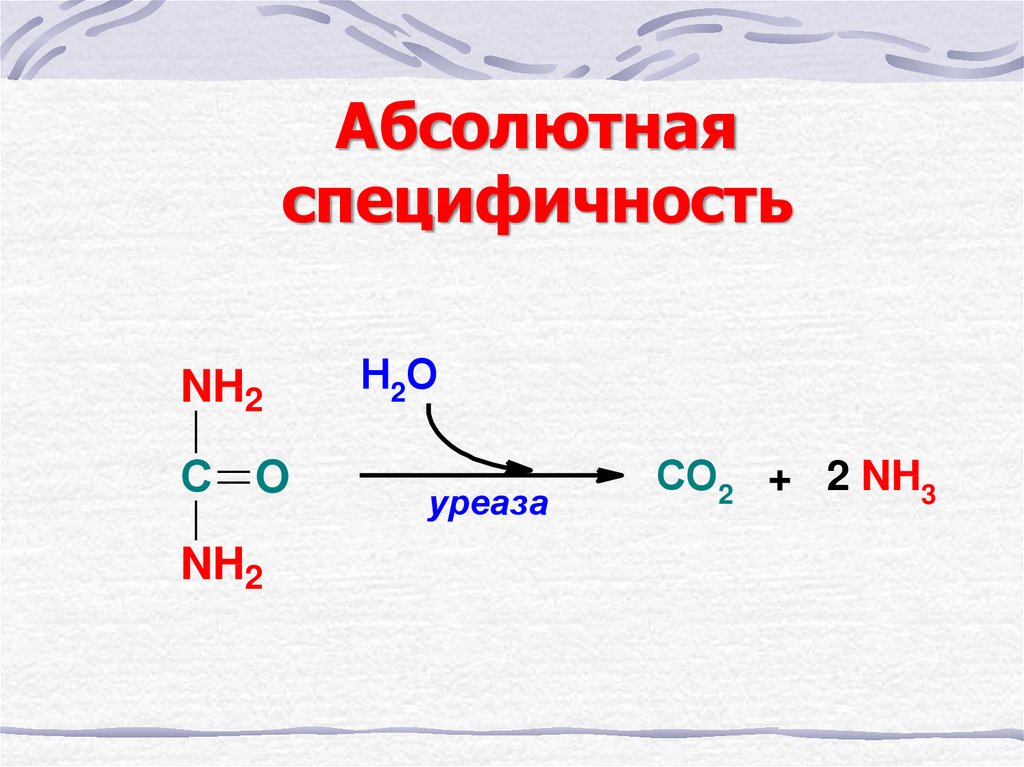
18. Абсолютная специфичность
NH2С O
NH2
Н2О
уреаза
СО2 + 2 NH3
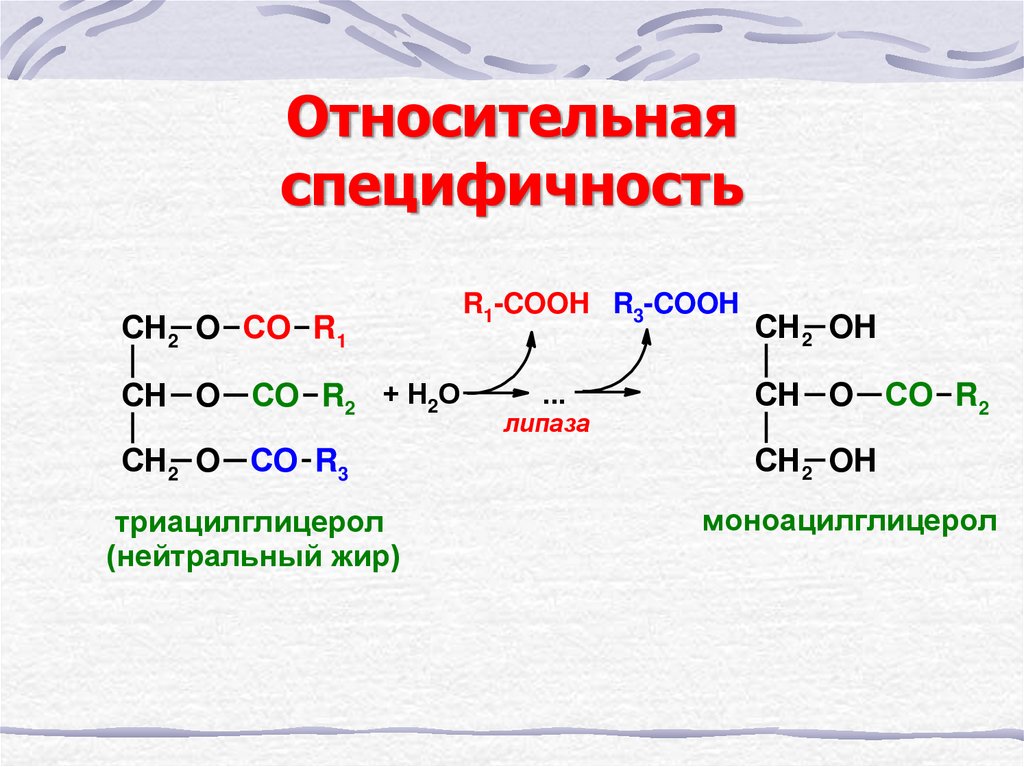
19. Относительная специфичность
СН2 O CО R1СН O CО R2 + Н2О
СН2 O СО R3
триацилглицерол
(нейтральный жир)
R1-COOH R3-COOH
...
липаза
СН2 OH
СН O CО R2
СН2 OH
моноацилглицерол
20. Стереоспецифичность
HCOOH
С
С
HOOC
H
фумарат
H
H
С
С
HOOC
COOH
малеинат
Н 2О
фумараза
H
COOH
СН
СН
HOOC
OH
малат
21. Общее уравнение ферментативной реакции:
E+Sk1
k2
ES
k3
EP
E+P
22. Константа Михаэлиса
23. Зависимость скорости ферментативной реакции от концентрации субстрата
24.
25. График зависимости скорости ферментативной реакции от концентрации субстрата
VVmax
Vmax
2
Km
S
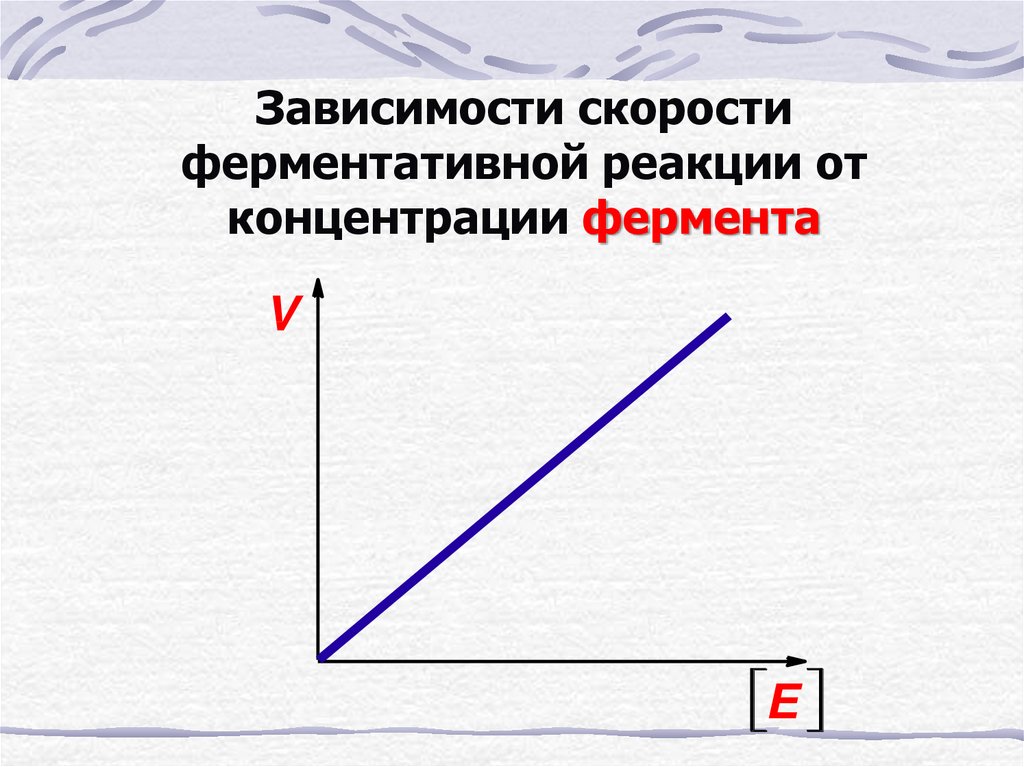
26. Зависимости скорости ферментативной реакции от концентрации фермента
VE
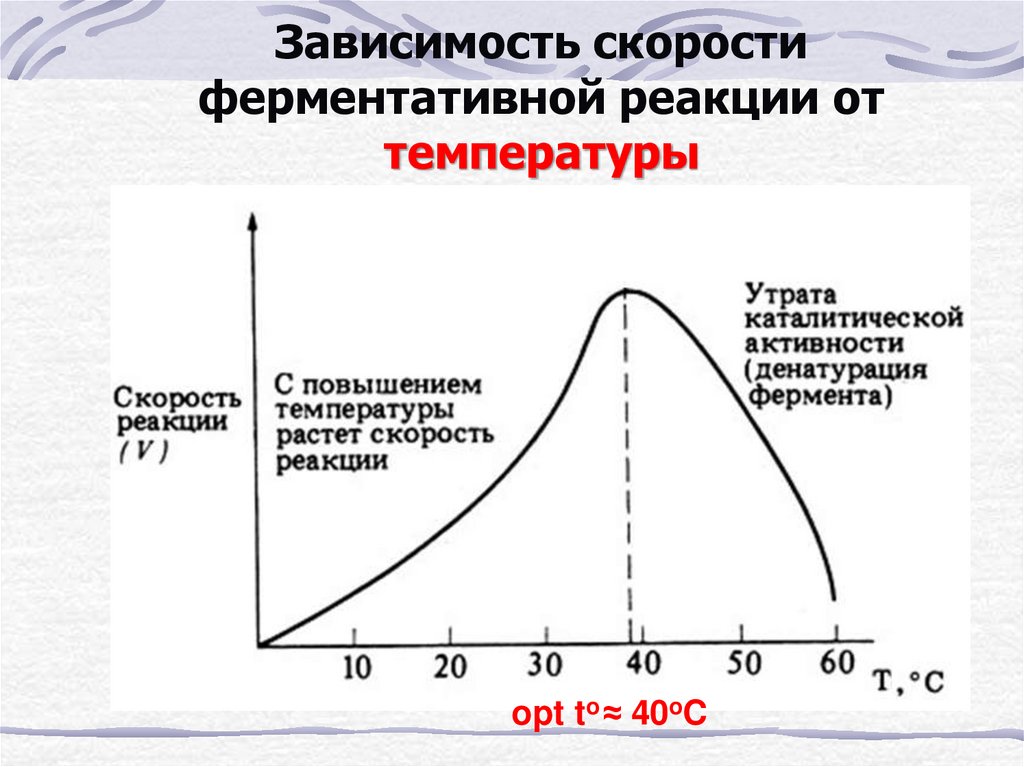
27. Зависимость скорости ферментативной реакции от температуры
opt to ≈ 40oC28.
Зависимость скоростиферментативной реакции от рН среды
колоколообразная
зависимость
V
pH opt
pH
29. Зависимость скорости ферментативной реакции от рН среды
Vплатообразная
зависимость
pH opt
pH
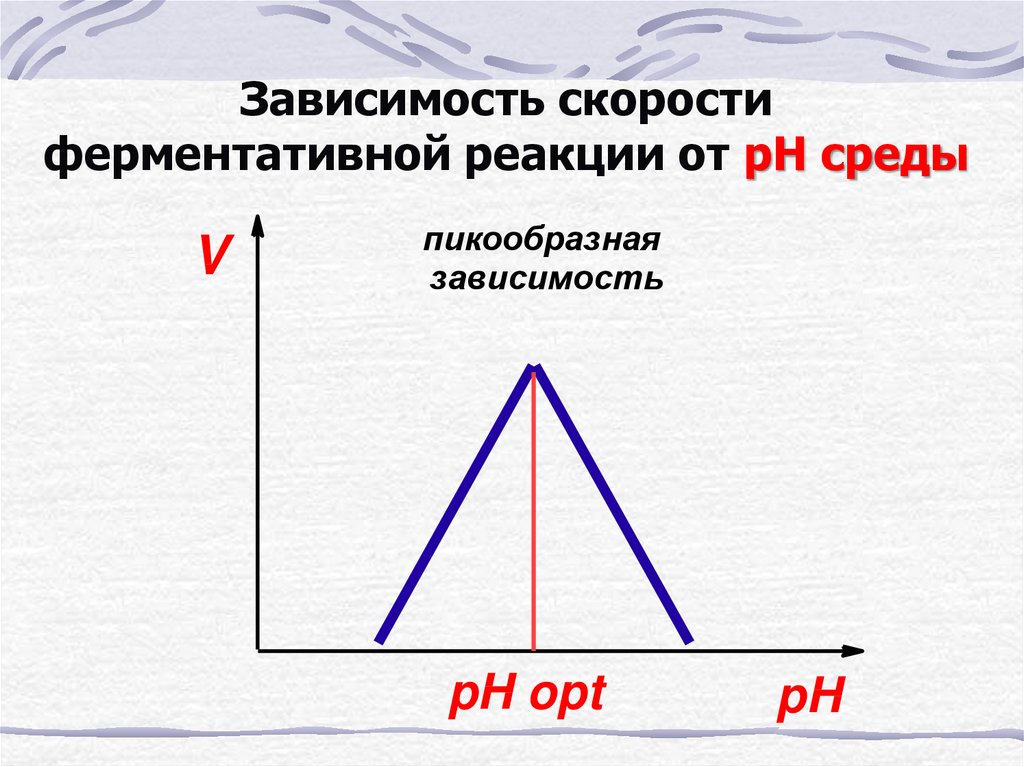
30.
Зависимость скоростиферментативной реакции от рН среды
V
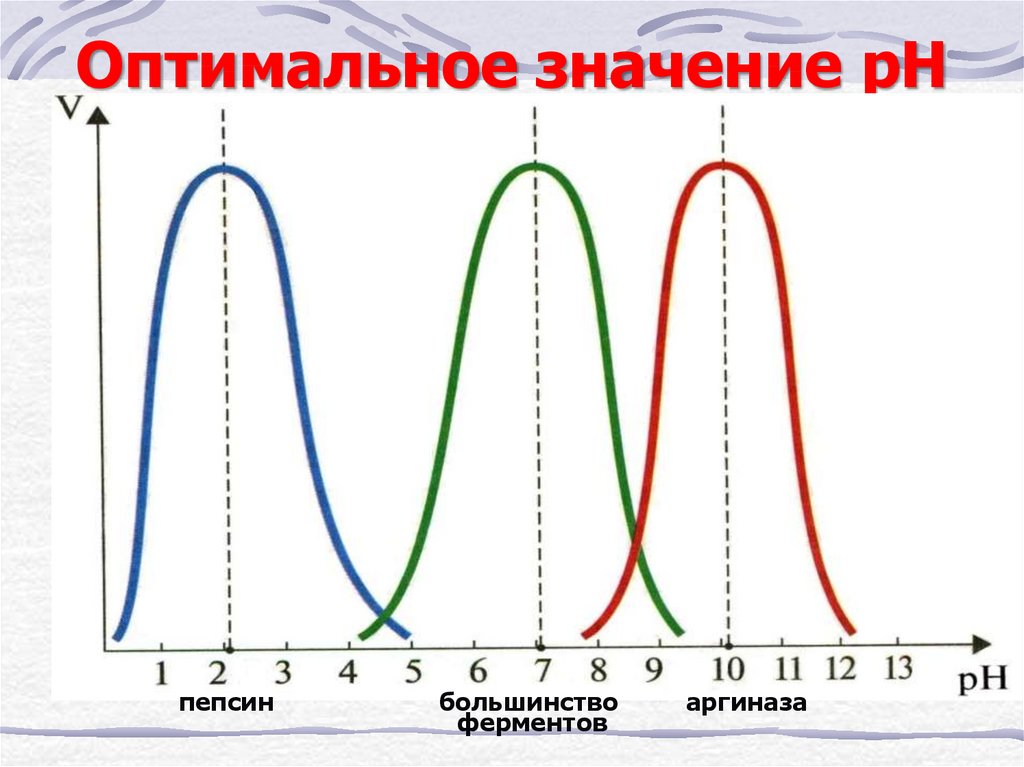
пикообразная
зависимость
pH opt
pH
31. Оптимальное значение рН
пепсинбольшинство
ферментов
аргиназа
32. Эффекторы
активаторыобратимые
ингибиторы
необратимые
33. Активаторы
•Неорганическиевещества
•Низкомолекулярные
органические
вещества
•Белки
34. Основные механизмы действия активаторов
•Площадка длявзаимодействия
фермента и субстрата
•Повышение сродства
фермента и субстрата
•Отщепление ингибитора
35. Механизмы ингибирования
•Конкурентное•Неконкурентное
•Бесконкурентное
•Субстратное
•Аллостерическое
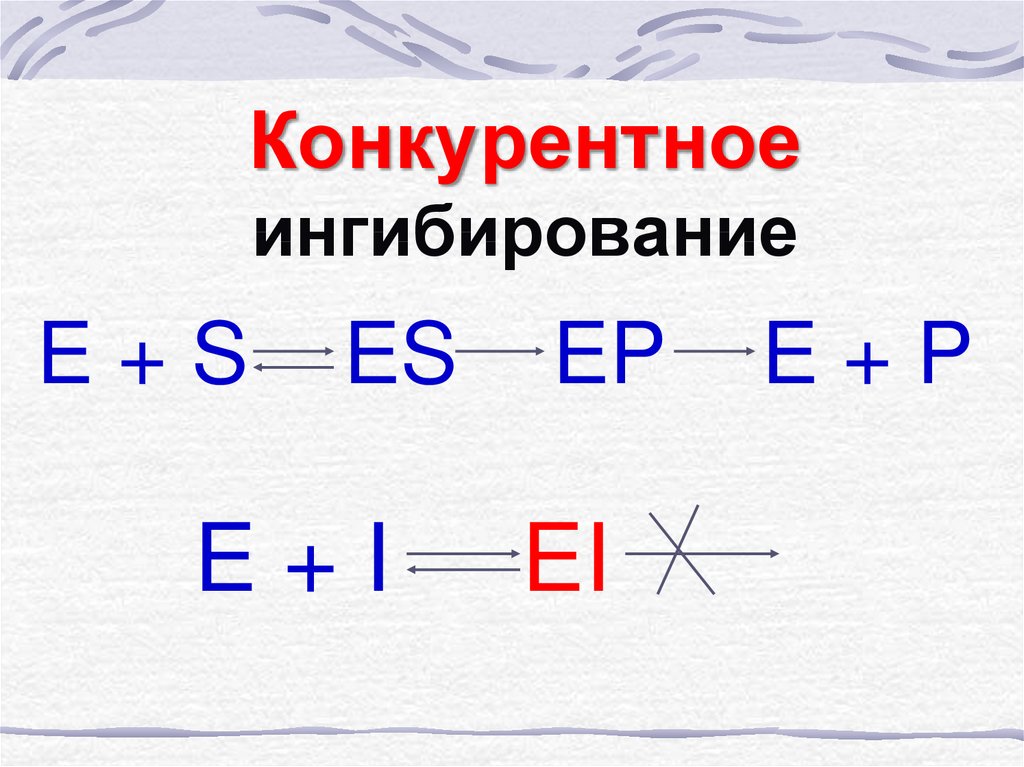
36. Конкурентное ингибирование
37. Конкурентное ингибирование
E+SES
E+I
EP
EI
E+P
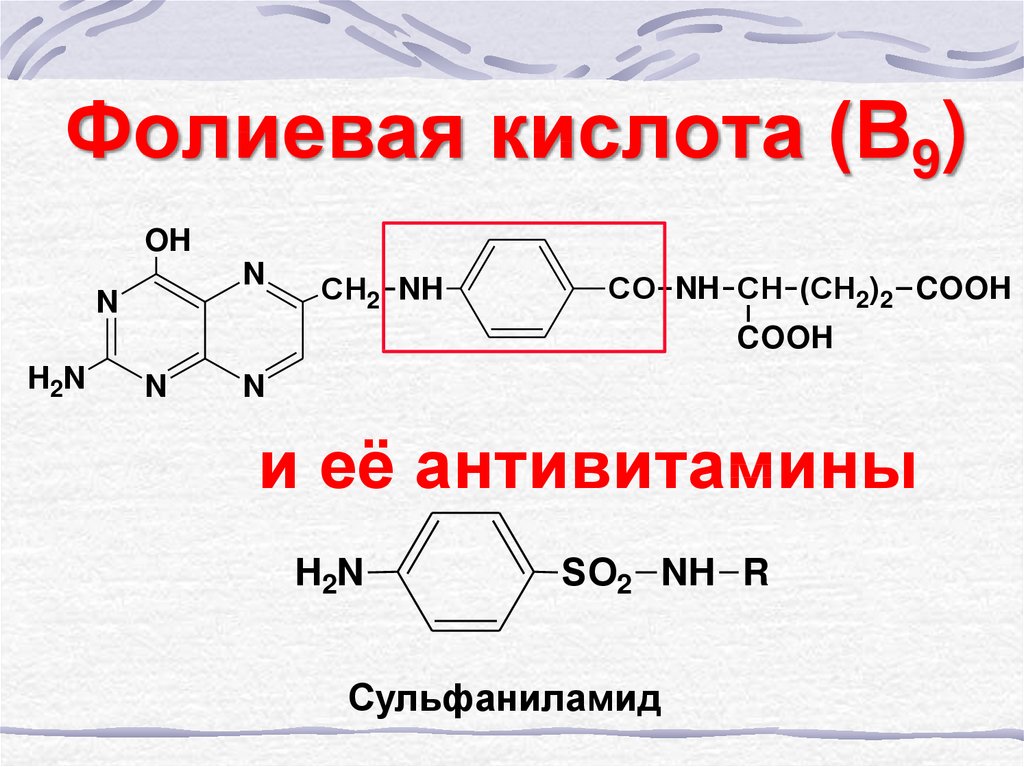
38. Фолиевая кислота (В9)
OHN
N
СН2 NH
СО NH СН (СН2)2 COOH
COOH
H2N
N
N
и её антивитамины
H2N
SО2 NH R
Сульфаниламид
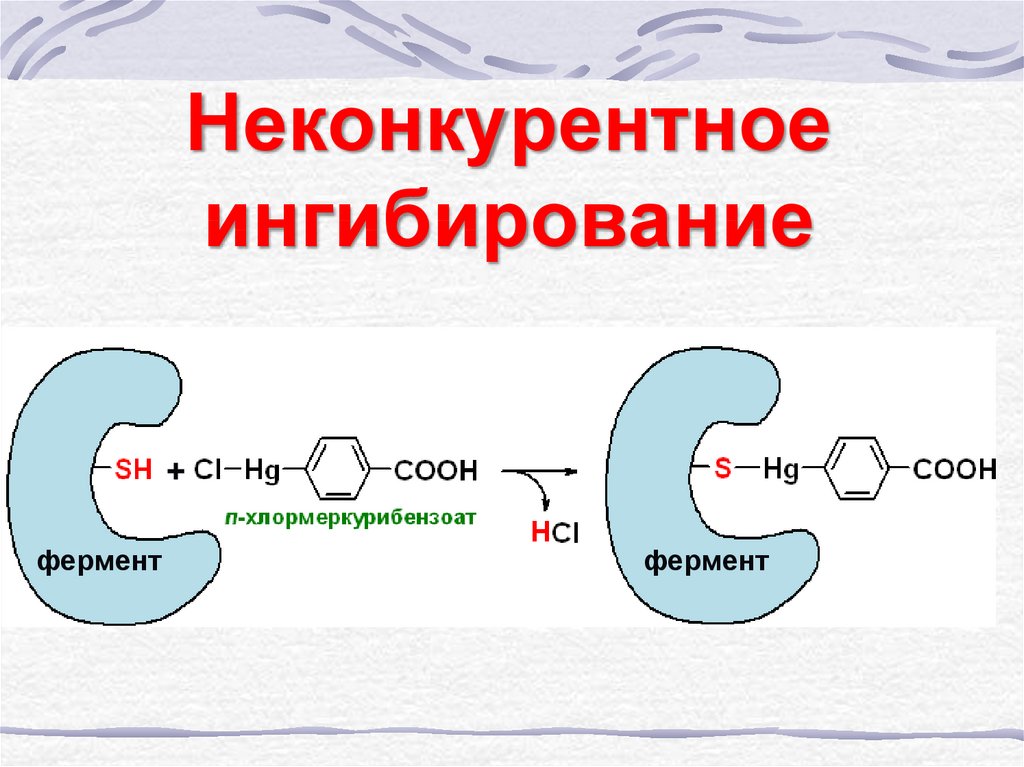
39. Неконкурентное ингибирование
40. Неконкурентное ингибирование
+фермент
фермент
41. Неконкурентное ингибирование
E+SES
E+I
EP
EI
E+P
42. Бесконкурентное ингибирование
E+SES
ES + I
EP
ESI
E+P
43. Субстратное ингибирование
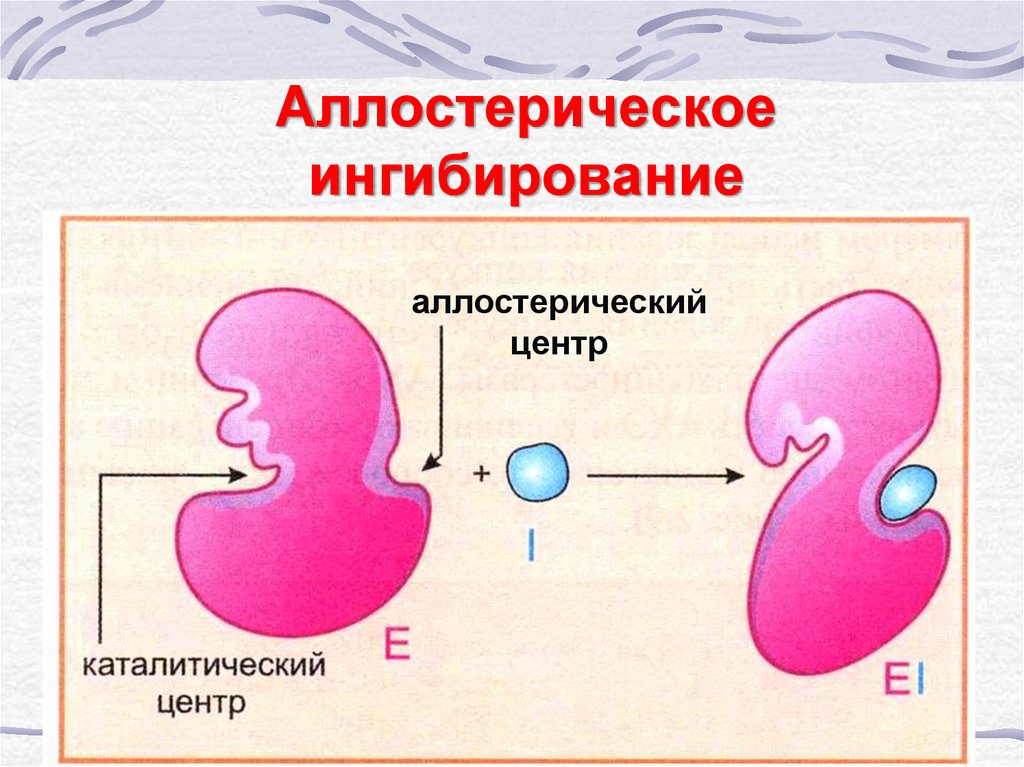
44. Аллостерическое ингибирование
аллостерическийцентр
45. Ферменты
ОднокомпонентныеДвухкомпонентые
(только
аминокислоты) Апофермент (ак) Кофактор
Кофермент
Витаминные
Простетическая
группа (Ме2+)
Невитаминного
происхождения
46. Металлы, содержащиеся в ферментах
Алкогольдегидрогеназа,карбоангидраза
Аргиназа, аминопептидаза
Дипептидаза
Zn
Mn
Co
Фосфатаза, фосфокиназа
Mg
Тирозиназа
Cu
Сукцинатдегидрогеназа
Fe
Ксантиноксидаза
Mo
47. Классификация коферментов
По химическому строению1. Алифатические (липоевая
кислота);
2. Ароматические (коэнзим Q);
3. Гетероциклические (ТПФ, ПФ);
4. Нуклеотиды (НАД, НАДФ, ФАД,
ФМН)
48. Липоевая кислота
CH2СН2
СН
S
S
(СН2)4
COOH
49. КоQ (коэнзим Q, убихинон)
Н3СОO
CH3
CH3
Н3СО
O
(СН2
СН
С
СН2)n
Н
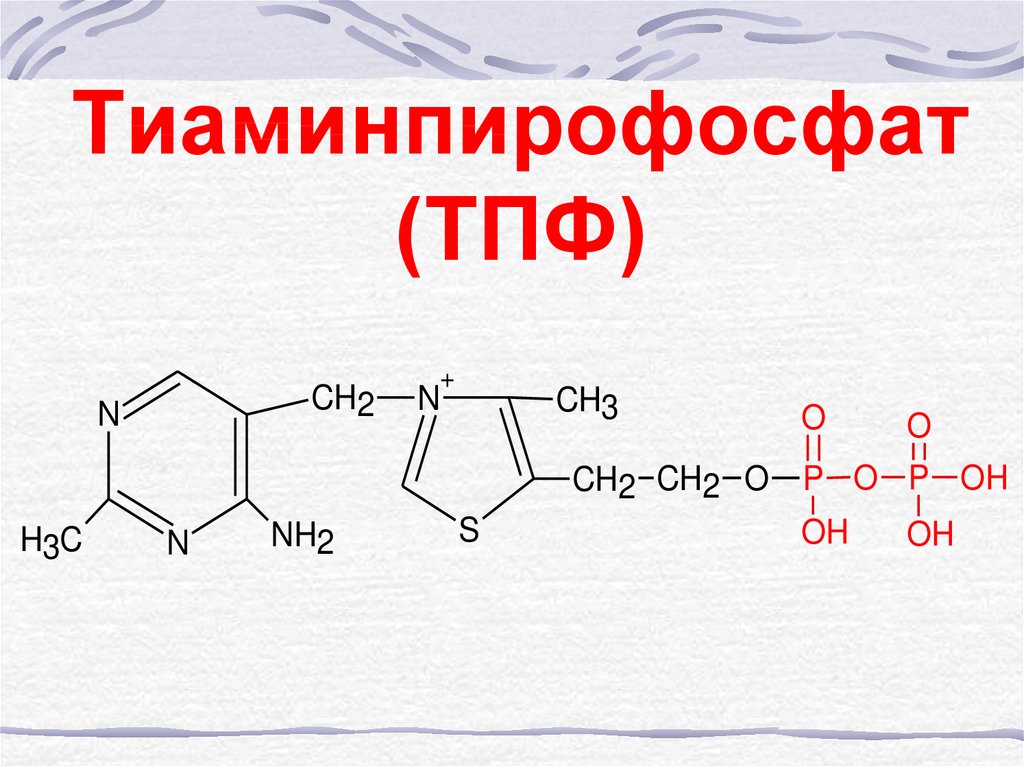
50. Тиаминпирофосфат (ТПФ)
CH2N
H3C
N
NH2
+
N
CH3
S
O
O
CH2 CH2 O P O P OH
OH
OH
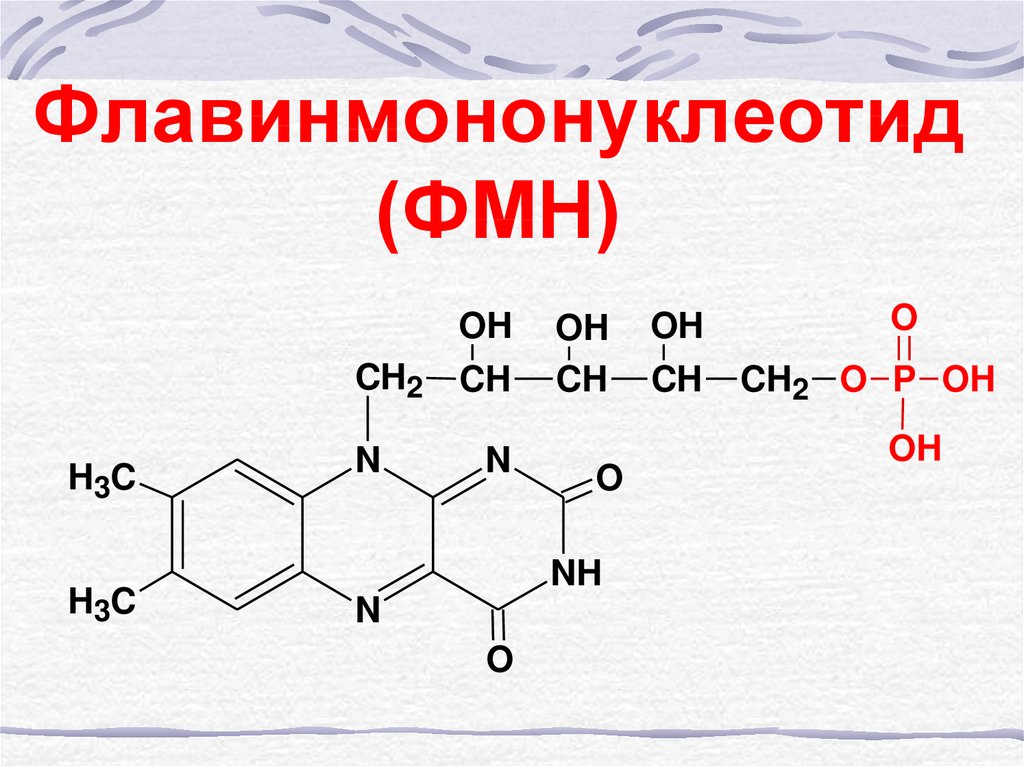
51. Флавинмононуклеотид (ФМН)
OHCH2
H3C
H3C
N
CH
N
OH
CH
O
NH
N
O
OH
CH
O
CH2 O P OH
OH
52. По выполняемым функциям
1. Переносчики протонов иэлектронов (НАД, ФАД, Ко Q);
2. Переносчики групп (ТПФ,
ПФ, КоА);
3. Коферменты синтеза и
изомеризации
53. По механизму действия
1. Коферменты с высокимпотенциалом переноса энергии
(переносчики энергии);
2. Коферменты, участвующие в
окислительно-восстановительных
реакциях;
3. Коферменты, формирующие
активный центр фермента.
54. Классификация ферментов
1. ОксидоредуктазыА Н2 + В
А + В Н2
2. Трансферазы
А Х + В
А+ В Х
3. Гидролазы
А В + Н2О
А Н + В ОН
55.
4. ЛиазыА В + а-в
5. Изомеразы
цис
транс, D
А
а
В
в
L
6. Лигазы (синтетазы)
А + В + АТФ
А В + НР + АДФ
56.
классподкласс
1.оксидоредуктазы
катализируемая
реакция
Гидрогенизация и
дегидрогенизация
1.1
1.2
1.3
1.4
1.5
СН OH
H
С O
СН
СН
СН NH2
H
СН NН
H
1.6 НАДН, НАДФН
57.
классподкласс
2.трансферазы
катализируемая реакция
перенос функциональных
групп
2.1
Одноуглеродных групп
2.2
Альдегидной или кетогруппы
2.3
Ацила
2.4
Гликозила
2.5
2.6
Алкильной (но не метила) или
арильной группы
Азотсодержащей группы
2.7
Фосфатсодержащей группы
2.8
Серосодержащей группы
58.
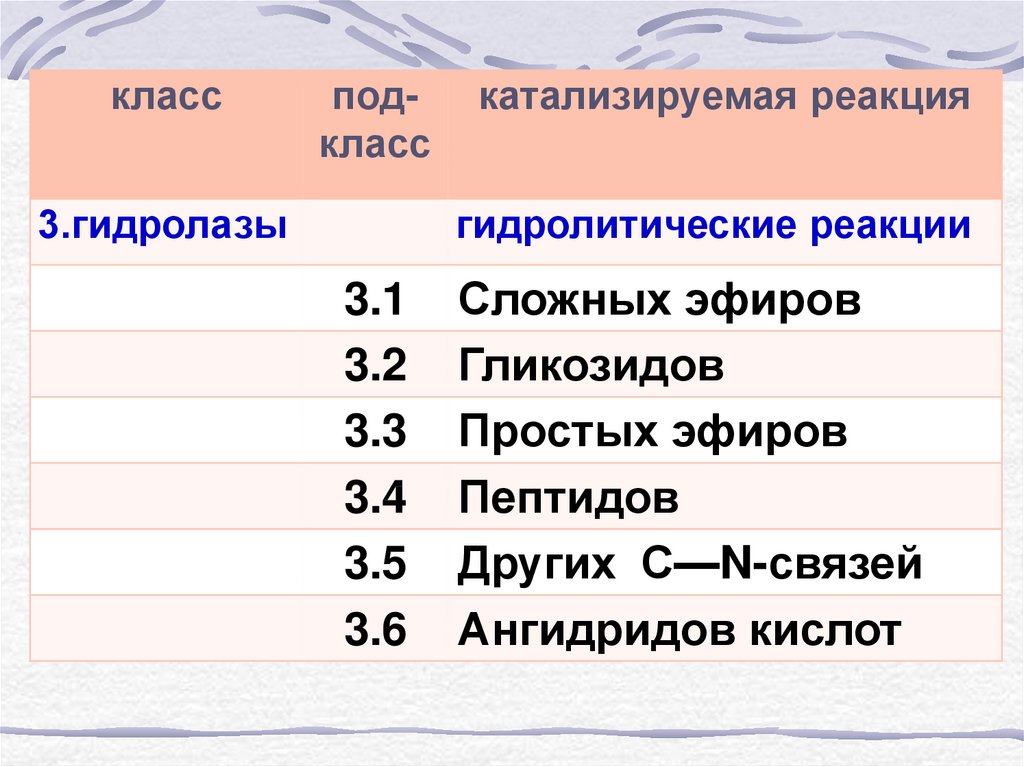
классподкласс
3.гидролазы
катализируемая реакция
гидролитические реакции
3.1
3.2
3.3
3.4
3.5
3.6
Сложных эфиров
Гликозидов
Простых эфиров
Пептидов
Других С—N-связей
Ангидридов кислот
59. Шифр ферментов
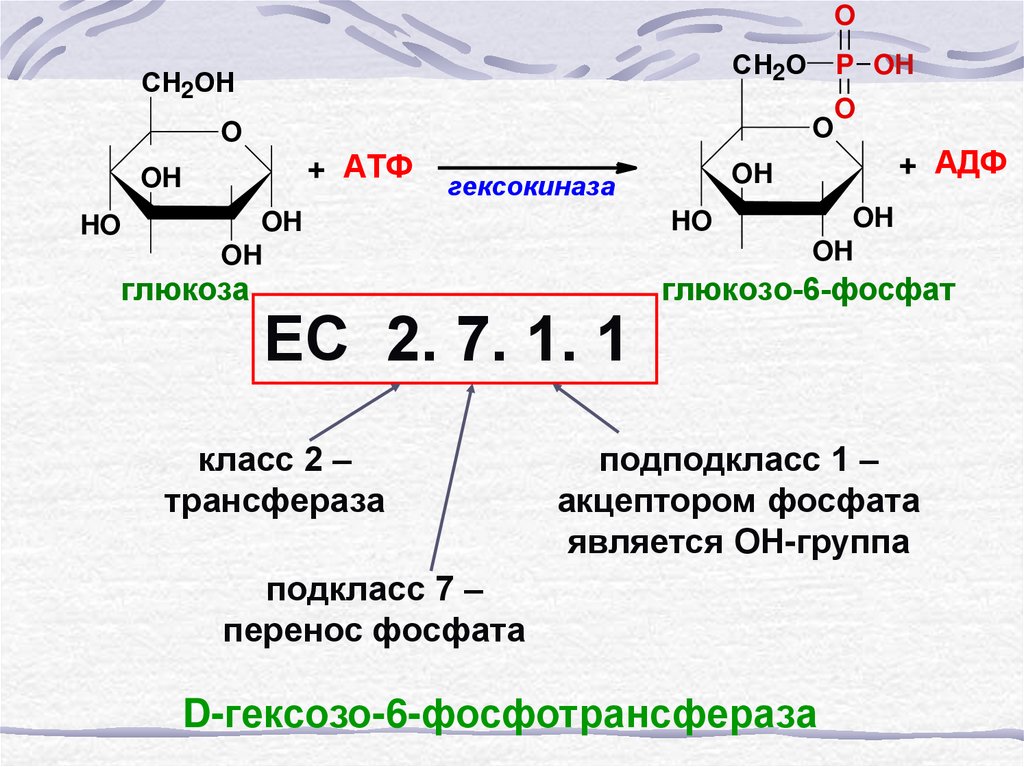
60.
OСН2О
СН2ОН
O
O
+ АТФ
OH
HO
HO
ЕС 2. 7. 1. 1
класс 2 –
трансфераза
O
+ АДФ
OH
гексокиназа
OH
OH
глюкоза
P OH
OH
OH
глюкозо-6-фосфат
подподкласс 1 –
акцептором фосфата
является ОН-группа
подкласс 7 –
перенос фосфата
D-гексозо-6-фосфотрансфераза
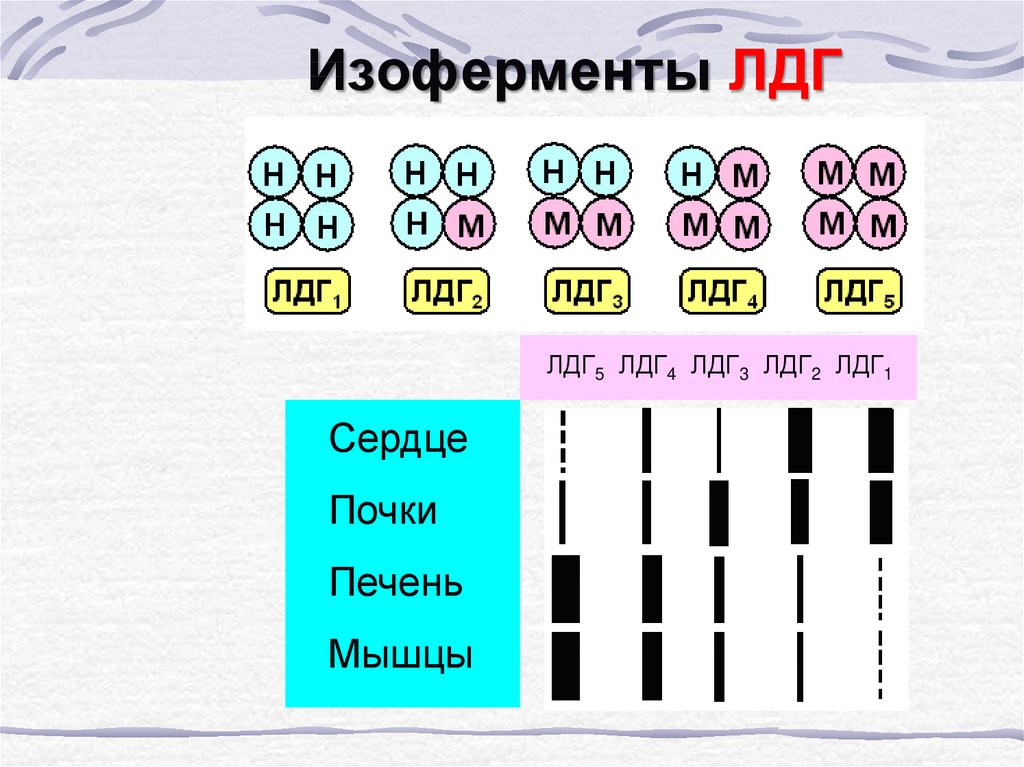
61. Изоферменты ЛДГ
ЛДГ5 ЛДГ4 ЛДГ3 ЛДГ2 ЛДГ1Сердце
Почки
Печень
Мышцы
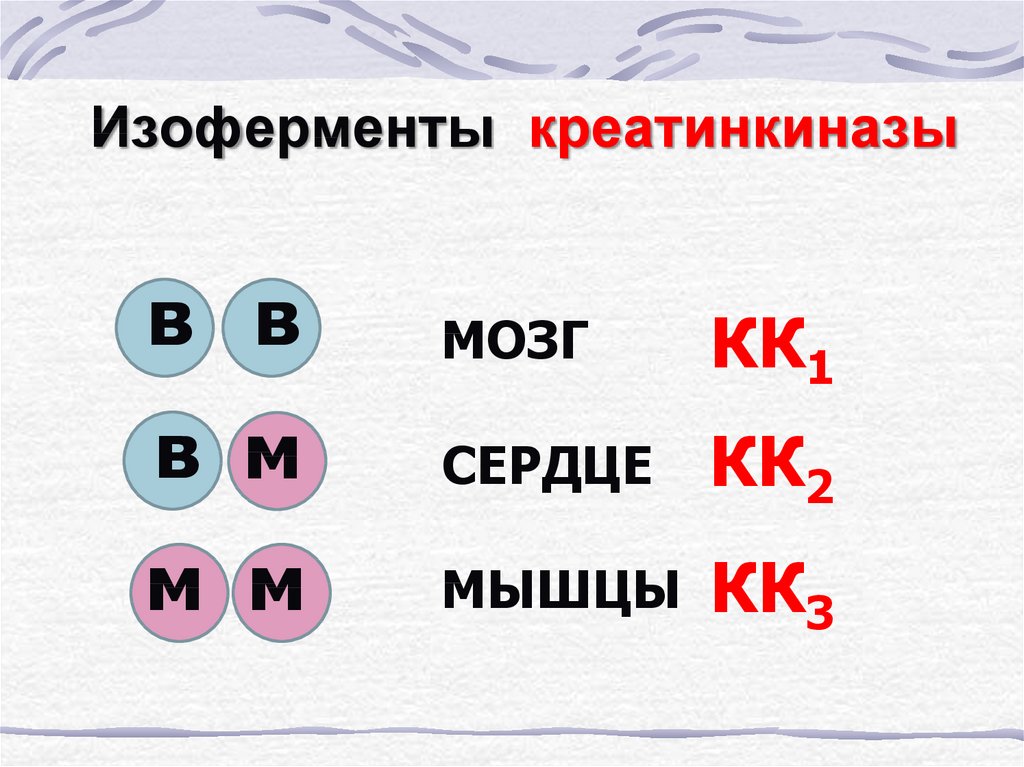
62. Изоферменты креатинкиназы
в вМОЗГ
КК1
в м
СЕРДЦЕ
КК2
м м
МЫШЦЫ
КК3
63. Единицы измерения количества и активности фермента
1МЕ =1 мкмоль превращенного S
1 мин
64. nМЕ – количество единиц активности
nМЕ =Кол-во превращенного S (мкмоль)
Время (мин)
65. Катал
1 моль превращенного S1 катал =
1 секунда















































 Биология
Биология








