Похожие презентации:
Химическая термодинамика
1.
Химическая термодинамика количественно определяеттепловые
эффекты
различных
процессов,
выясняет
принципиальную возможность самопроизвольного течения
химических реакций и условия, при которых химические реакции
могут находиться в состоянии равновесия.
Система – тело или группа тел, находящихся во
взаимодействии и отделенных от окружающей среды реальной
или воображаемой границей.
Окружающая среда – это все, что находится в прямом или
косвенном контакте с системой. Принято считать, что окружающая
среда имеет такой большой размер, что отдача или приобретение
ею теплоты не изменяет ее температуру.
Фаза – это часть системы, отделенная от других частей
системы поверхностью раздела фаз и характеризующаяся
одинаковыми физико-химическими свойствами во всех ее точках.
2. Основные разделы:
Химическая термодинамикаХимическое и фазовое равновесие
Термодинамическая теория
растворов
Химическая кинетика
Электрохимия
3.
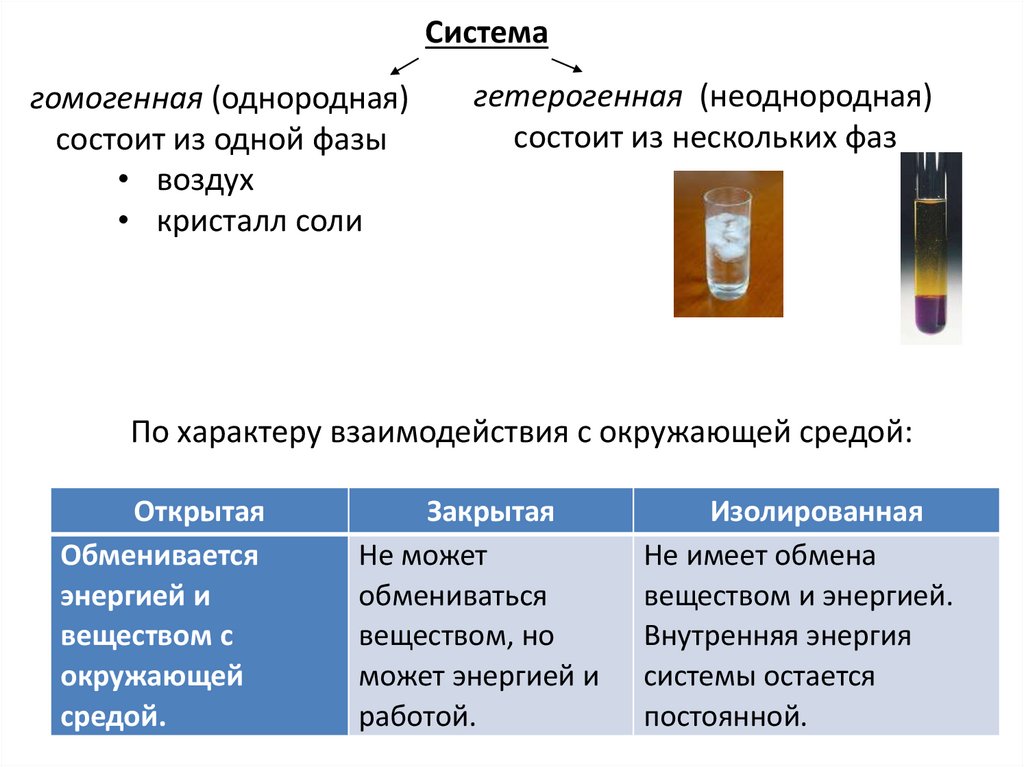
Системагомогенная (однородная)
состоит из одной фазы
• воздух
• кристалл соли
гетерогенная (неоднородная)
состоит из нескольких фаз
По характеру взаимодействия с окружающей средой:
Открытая
Обменивается
энергией и
веществом с
окружающей
средой.
Закрытая
Не может
обмениваться
веществом, но
может энергией и
работой.
Изолированная
Не имеет обмена
веществом и энергией.
Внутренняя энергия
системы остается
постоянной.
4.
Параметрысостояния
–
физические
величины,
характеризующие состояние термодинамической системы .
Экстенсивные - значения зависят от массы (объем, масса,
внутренняя энергия, теплоемкость и др.). Обладают свойством
аддитивности.
Интенсивные не зависят от массы (температура, давление,
плотность, концентрация и др.). Свойством аддитивности не
обладают, они определяются природой системы.
Независимые параметры состояния (основные) - параметры,
которые поддаются непосредственному измерению:
• масса
• объем
• давление
• состав
• теплоемкость
5.
Функции состояния - параметры состояния, которые неподдаются непосредственному измерению (внутренняя энергия,
энтальпия, энтропия, термодинамические потенциалы).
! Значения функций состояния не зависит от пути перехода, а
определяется лишь начальным и конечным состоянием системы.
Термодинамический процесс - изменение термодинамического
состояния системы (изменения хотя бы одного параметра
состояния).
изотермические – T=const;
изобарные – P=const;
изохорные – V=const;
адиабатные – протекают без
теплообмена с окружающей средой.
6.
Классификация процессовПо самопроизвольности:
Самопроизвольный протекает без затрат энергии извне.
Несамопроизвольный требует затрат энергии извне.
По обратимости
Обратимый - процесс, при котором система может
вернуться в первоначальное состояние без каких-либо
изменений как в самой системе, так и во внешней среде.
Необратимый - при протекании процесса в прямом и
обратном направлении в системе или окружающей среде
происходят какие-либо изменения.
7.
Внутренняя энергия (U) сумма всех видов энергии кромекинетической и потенциальной энергии системы как целого.
ΔU=U2-U1;
ΔU=0 в изолированных системах
Энтальпия (H) – теплосодержание системы
H=U+pV
Теплота (Q) (тепловой эффект процесса) – форма передачи
энергии, реализуемая путем изменения кинетической энергии
теплового (хаотического) движения частиц (атомов, молекул).
Работа (А) – форма обмена энергией с окружающей средой,
реализуется путем упорядоченного движения молекул под
действием определенной силы.
8.
Первое начало термодинамикиЭнергия не исчезает и не возникает из ничего, переход ее из
одного вида в другой происходит в строго эквивалентных
количествах.
Полная энергия изолированной системы постоянна.
Невозможно создать вечный двигатель (perpetuum mobile)
первого рода, т.е. такую периодически действующую машину,
которая производила бы работу без затрат энергии извне.
Тепло, сообщенное системе в каком-либо процессе,
расходуется на приращение внутренней энергии системы и
совершение работы.
Q = U + А
Q – теплота процесса
A – работа процесса
U – изменение внутренней энергии системы
-Q – теплота выделяется;
+Q – теплота поглощается
9. Теплоёмкость
Это количество теплоты, необходимое для нагрева вещества на 1 0С.Удельная теплоемкость (Дж/кг·К)
Мольная теплоемкость (Дж/моль·К)
Изобарная
теплоемкость:
Изохорная
теплоемкость:


















 Химия
Химия








