Похожие презентации:
Химическая термодинамика
1.
ХИМИЯ2. Химическая термодинамика
3.
Химическая термодинамикаТермодинамика (греч. тепло + сила)
изучает
взаимные
превращения
различных форм энергии, происходящие
в результате химических реакций, а
также фазовых переходов вещества;
изучает только макроскопические
свойства материи и макроскопические
объекты (термодинамические системы).
4. Термохимия - раздел термодинамики, включающий изучение тепловых эффектов химических реакций.
ОСНОВНЫЕ ПОНЯТИЯТермодинамическая система
Фаза
Термодинамический процесс
Внутренняя энергия
Теплота и работа
Функции состояния
5.
(1)Термодинамическая система - этотело или группа тел, отделенных от
окружающей
среды
реальной
или
условной границей раздела.
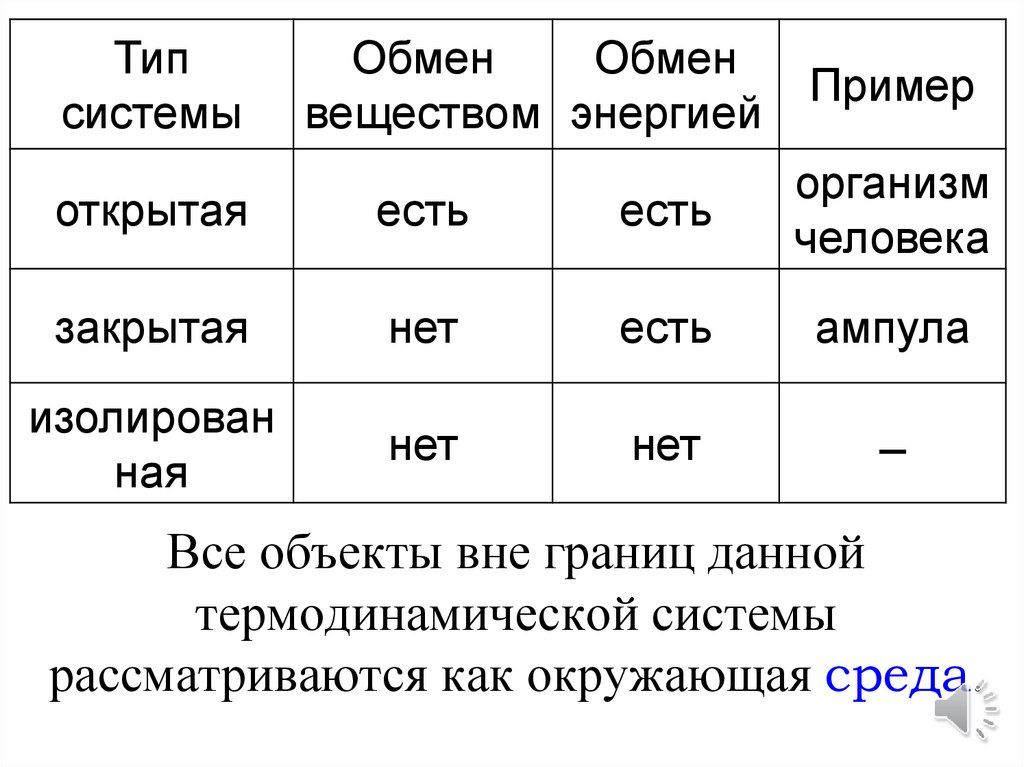
Открытая
система
способна
обмениваться с окружающей средой и
веществом, и энергией.
Закрытая система обменивается с
окружающей средой только энергией.
Изолированная
система
не
обменивается со средой ни веществом, ни
6.
Типсистемы
Обмен
Обмен
веществом энергией
Пример
открытая
есть
есть
организм
человека
закрытая
нет
есть
ампула
изолирован
ная
нет
нет
̶
Все объекты вне границ данной
термодинамической системы
рассматриваются как окружающая среда.
7.
Фаза - это часть системы,обладающая на всём протяжении
одинаковыми
физическими
и
химическими свойствами.
Системы, состоящие из одной фазы,
называются гомогенными.
Пример: воздух (смесь газов)
Системы, состоящие из нескольких фаз,
отделенных друг от друга границами
раздела, называются гетерогенными.
Пример: тающий лед; масло + вода.
(2)
8. Параметры системы
Экстенсивные параметры зависят отколичества вещества в системе.
Пример: масса, объем, энергия.
Интенсивные параметры не зависят
от количества вещества в системе
(качественные характеристики системы).
Пример:
температура,
давление,
плотность, поверхностное натяжение.
9.
(3) Процесс – это переход системы изодного состояния в другое.
изотермический процесс T = const
изобарный процесс
P = const
изохорный процесс
V = const
* Изобарно-изотермические процессы,
протекающие в закрытых системах это
простейшая термодинамическая модель
процессов в живых системах.
10. (4) Внутренняя энергия (U)
Это общий запас энергии, состоящий изкинетической
энергии
частиц
и
потенциальной
энергии
их
взаимодействия (единицы измерения: Дж)
Изменение внутренней энергии системы
(ΔU) при переходе из одного состояния в
другое равно разности между конечным
(U2) и начальным (U1) значениями:
ΔU = U2 – U1
11.
(5) Работа (W)Упорядоченная
форма
передачи
энергии называется работа.
Из всех типов работы мы рассмотрим
только работу “расширения-сжатия”.
W = pΔV
(6) Теплота (Q)
Неупорядоченная форма передачи
энергии называется теплота.
(от “беспорядочного”движения частиц)
12.
(7) Функции состоянияФункции состояния это свойства,
величины которых зависят только от
начального и конечного состояния
системы, и не зависят от пути перехода.
Пример: ΔU при переходе системы из
одного состояния в другое будет всегда
равно разности U2 – U1, независимо от
пути перехода.
ΔU это функция состояния системы
13. Первое начало термодинамики
Энергияне
создается
и
не
уничтожается; в изолированной системе
возможен её переход из одной формы в
другую, но ее количество остается
постоянным (закон сохранения энергии)
Тогда, для двух форм передачи энергии:
теплоты (Q) и работы (W) следует, что:
Q = ΔU + W
14.
Первое начало термодинамикиИзменение U системы равно разности
количества теплоты, переданной системе
извне, и работы, совершенной системой
над средой. Q = ΔU + W
Внутренняя энергия изолированной
системы есть величина постоянная.
ΔU = 0
Вечный двигатель первого рода
(совершение системой работы без
затраты энергии) невозможен.
15.
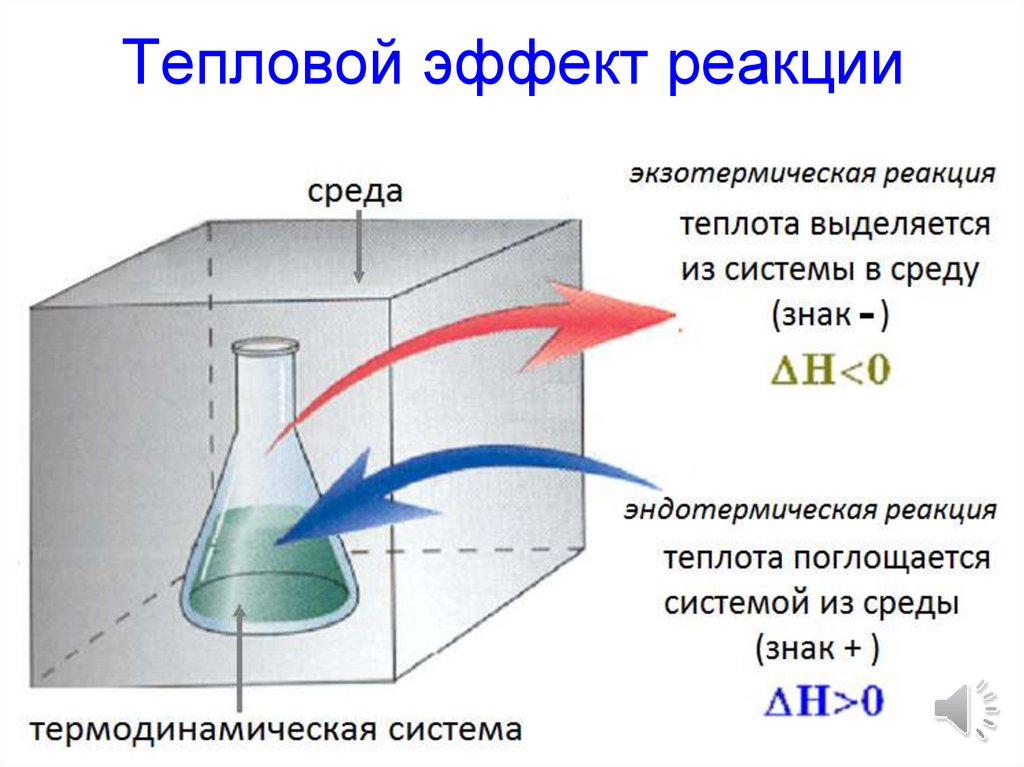
Процесс при постоянном давлении:Q = ΔU + W ,
откуда Qp = ΔU + P ΔV
К изобарным процессам относится
большинство реакций, их тепловой
эффект
обозначают
специальным
символом H (энтальпия реакции).
Теплота изобарного процесса равна
изменению энтальпии системы:
Qp = H
16.
Стандартные условияСимвол “o” или “знак градуса” в
термодинамике обозначает стандартное
состояние системы (например, Hо):
p =101.3 кПa
Т = 298 K (25 oC)
n = 1 моль
Пример: стандартная энтальпия реакции
Ho
[Дж/моль]
17. Тепловой эффект реакции
18.
Химическаятермодинамика
Термохимия
Химическое равновесие
















 Химия
Химия








