Похожие презентации:
Фазовые равновесия
1.
Фазовые равновесияФаза – часть гетерогенной системы, ограниченная поверхностью раздела фаз и в
отсутствие внешних воздействий характеризующаяся одинаковыми физикохимическими свойствами во всех точках.
Классификация систем по числу фаз:
Однофазные
Двухфазные
Трехфазные
Многофазные
Условия фазового равновесия в гетерогенной системе: равенство температур и
давлений во всех фазах системы.
2.
Компонент - индивидуальное химическое вещество, которое являетсясоставной частью системы, может быть выделено из нее и существовать
самостоятельно.
Число независимых компонентов (К) системы равно числу компонентов минус
число возможных химических реакций между ними.
H2+He+Ar:
CaCO3 CaO CO2
К=3
К=3-1=2
Классификация систем по числу компонентов:
Однокомпонентные
Двухкомпонентные
Трехкомпонентные
Многокомпонентные
3.
Число степеней свободы (С) – число параметров состояния системы, которыемогут быть одновременно произвольно изменены в некоторых пределах без
изменения числа и природы фаз в системе.
Классификация систем по степеней свободы:
Инвариантные (С=0)
Моновариантные (С=1)
Бивариантные (С=2)
Правило
фаз
Гиббса:
число
степеней
свободы
(С)
равновесной
термодинамической системы равно числу независимых компонентов системы К минус
число фаз Ф плюс число внешних факторов, влияющих на равновесие.
С=К–Ф+2
С=К–Ф+1
для систем с участием конденсированной фазы
4.
уравнение Клапейрона–Клаузиуса:H ф.п.
dP
dT Vф.п. Tф.п
Если Vфп = Vг,
dP p H ф.п.
dT
R Tф2.п
то Vг = RT/P
p2 H (T2 T1 )
ln
p1
R T1 T2
5.
Диаграммы однокомпонентных системыС=3 – Ф
Фазовая диаграмма (диаграмма состояния) - графическое изображение
зависимости Р от Т (Р от состава или Т от состава).
Принцип непрерывности: при непрерывном изменении параметров состояния все
свойства отдельных фаз изменяются также непрерывно; свойства системы в целом
изменяются непрерывно до тех пор, пока не изменится число или природа фаз в
системе, что приводит к скачкообразному изменению свойств системы.
Принцип соответствия: на диаграмме состояния каждой фазе соответствует своя
часть плоскости, которая называется полем фазы.
6.
Фазовая диаграмма водыОB – зависимость давления насыщенного
пара воды от температуры
С= 2
ОС – зависимость давления насыщенного
пара надо льдом от температуры
С= 2
С= 2
ОA – зависимость температуры плавления
льда от давления
С=1
тройная точка О: Р = 6.1 кПа, Т = 273.16 К
С=0
Равновесие Ж Г: Hфп 0 , Vфп 0, dP/dT > 0, наклон вправо
Равновесие Т Ж : Hфп 0 , Vфп 0, dP/dT 0, наклон влево
7.
Диаграммы двухкомпонентных системыС=2–Ф+2=4–Ф
С=2–Ф+1=3–Ф
Неизоморфные системы – системы с неограниченной растворимостью компонентов в
жидкой фазе и взаимной нерастворимостью в твердой.
ТАпл – Е и Е – ТВпл – линии ликвидуса
Е – точка эвтектики
1 система гомогенна, С = 2 – 1 + 1 = 2
2 и 3 система состоит из жидкой (расплав
компонентов А и В, для точки О состав
жидкой фазы – К) и твердой фазы (вещество A
и B соответственно, С = 2 – 2 + 1 = 1
4 система двухфазна, состоит из кристаллов А
и кристаллов В, С = 2-2+1=1.
8.
Состав фазы – это процентное содержание в данной фазе (жидкой или твердой)вещества А и вещества – В.
Соотношение фаз – это весовые доли твердой и жидкой фазы.
правило рычага: доля твердой фазы пропорциональна длине отрезка конноды
(изотермы) от точки пересечения с ликвидусом до точки общего состава системы
(точка О), а доля жидкой фазы пропорциональна отрезку изотермы от точки общего
состава до оси ординат
mтв.
CO
mжидк . OD
9.
Термический анализ10.
Изоморфные системы – системы, состоящие из компонентов, неограниченнорастворимых друг в друге как в жидком, так и в твердом состоянии.
Химически близкие вещества, способные кристаллизоваться в единую решетку: NaCl–
NaBr, NaCl–AgCl, Au–Ag
1 система гомогенна, является ненасыщенным
раствором, С = 2 – 1 + 1 = 2
2 система состоит из жидкой и твердой фазы, в
обеих фазах находятся растворы веществ А и В,
С=2–2+1=1
3 система состоит из твердого раствора веществ А
и В, однофазна и С = 2 – 1 + 1 = 2
11.
Системы с неограниченной взаимной растворимостью летучих жидкостейНеограниченно растворимые - жидкости, которые могут растворяться друг в друге
в любых соотношениях, образуя одну жидкую фазу.
1 –зависимость температуры кипения от состава пара;
2 –зависимость температуры кипения от состава жидкости
П – система гомогенна, С=2-1+1=2
Ж – система гомогенна, С=2-1+1=2
Ж+П – система гетерогенна С=2-2+1=1
правило рычага: произведение массы жидкой фазы на
плечо, соединяющее точку с линией жидкости равно
произведению массы пара на плечо, соединяющее эту
точку с линией пара.
mжидк . co mпара od
mжидк. co
mпара cd
12.
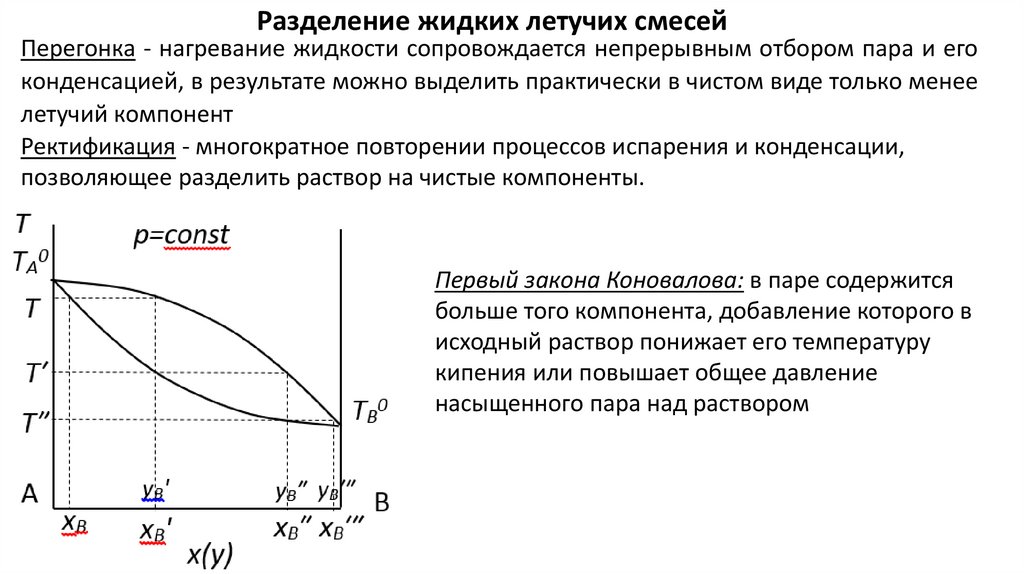
Разделение жидких летучих смесейПерегонка - нагревание жидкости сопровождается непрерывным отбором пара и его
конденсацией, в результате можно выделить практически в чистом виде только менее
летучий компонент
Ректификация - многократное повторении процессов испарения и конденсации,
позволяющее разделить раствор на чистые компоненты.
Первый закона Коновалова: в паре содержится
больше того компонента, добавление которого в
исходный раствор понижает его температуру
кипения или повышает общее давление
насыщенного пара над раствором
13.
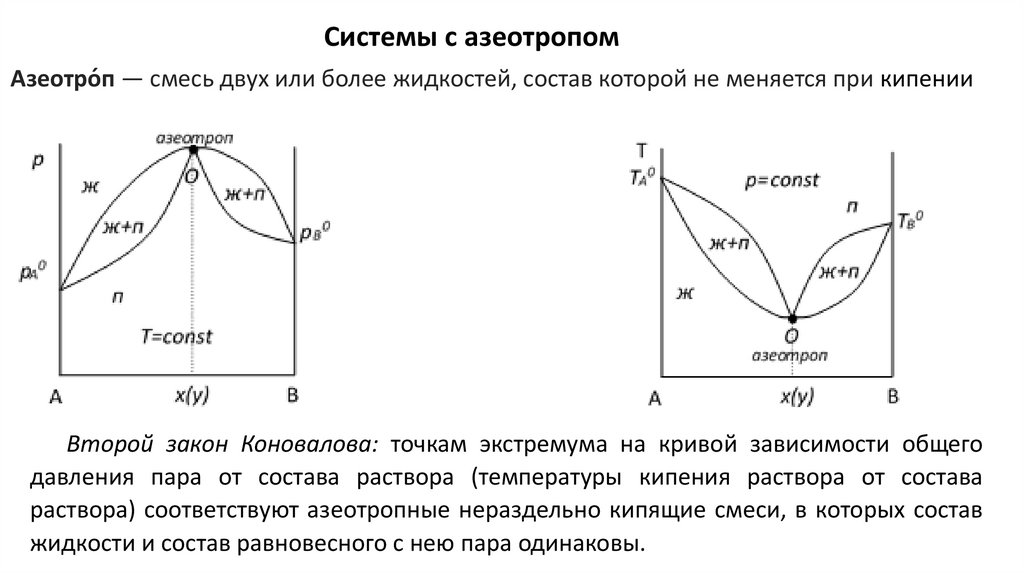
Системы с азеотропомАзеотро́п — смесь двух или более жидкостей, состав которой не меняется при кипении
Второй закон Коновалова: точкам экстремума на кривой зависимости общего
давления пара от состава раствора (температуры кипения раствора от состава
раствора) соответствуют азеотропные нераздельно кипящие смеси, в которых состав
жидкости и состав равновесного с нею пара одинаковы.
14.
Ограниченно растворимые жидкостиОграниченно растворимые - жидкости, которые в пределах определенных
концентраций и температур образуют одну гомогенную фазу, в другой области
концентраций и температур система становится гетерогенной.
Классификация:
с верхней критической точкой
с нижней критической точкой
с двумя критическими точками
без критических точек
15.
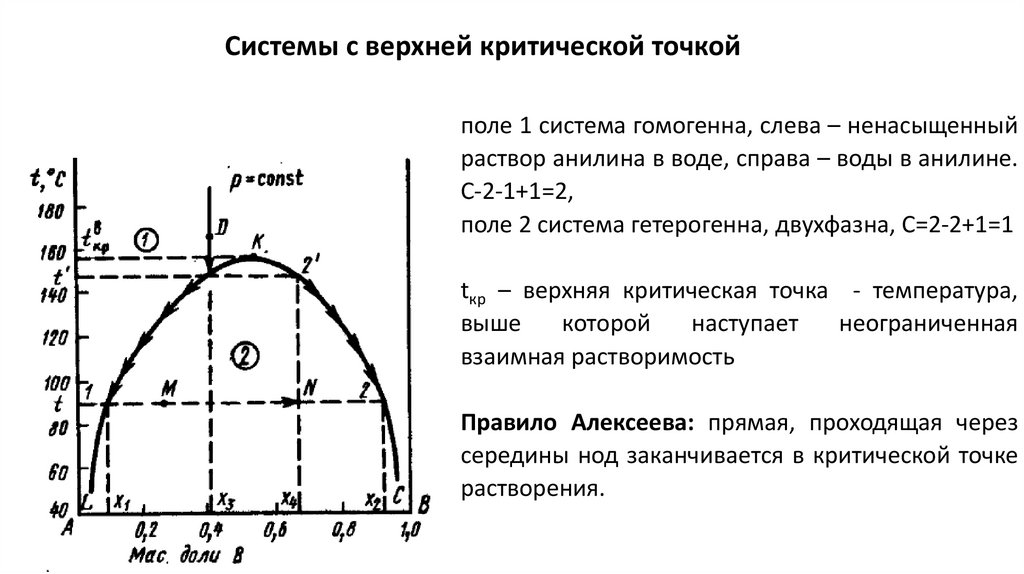
Системы с верхней критической точкойполе 1 система гомогенна, слева – ненасыщенный
раствор анилина в воде, справа – воды в анилине.
С-2-1+1=2,
поле 2 система гетерогенна, двухфазна, С=2-2+1=1
tкр – верхняя критическая точка - температура,
выше
которой
наступает
неограниченная
взаимная растворимость
Правило Алексеева: прямая, проходящая через
середины нод заканчивается в критической точке
растворения.
16.
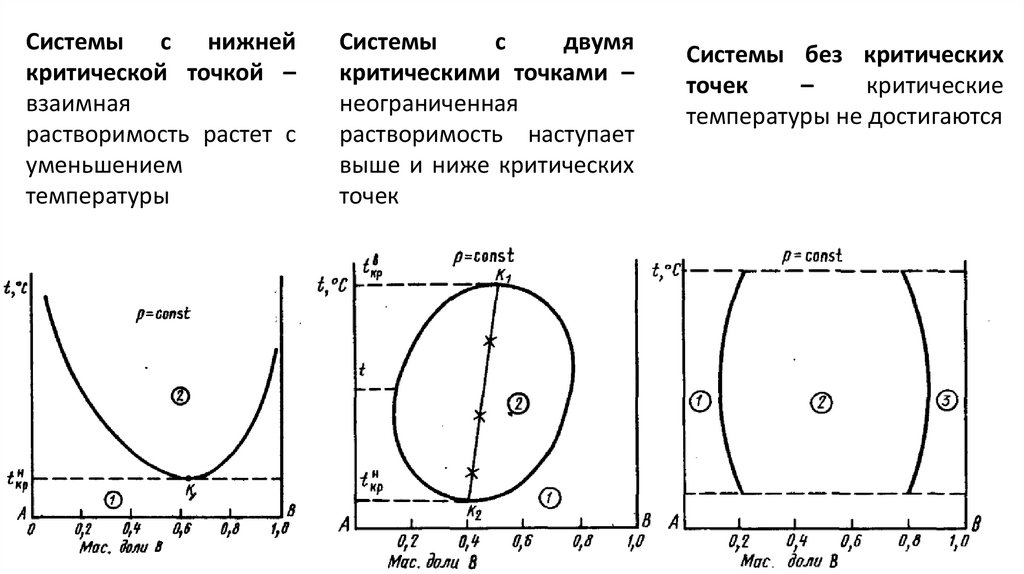
Системы с нижнейкритической точкой –
взаимная
растворимость растет с
уменьшением
температуры
Системы
с
двумя
критическими точками –
неограниченная
растворимость наступает
выше и ниже критических
точек
Системы без критических
точек
–
критические
температуры не достигаются
17.
Распределение вещества между двумя несмешивающимися жидкостямизакон распределения Нернста: отношение равновесных концентраций
распределяющегося вещества в двух соприкасающихся, но не смешивающихся
растворителях есть величина постоянная при Т = const.
а 3I
с3I
с3I
n – степень
K
K
K
II n
ассоциации
с3II
а 3II
с
3
Экстракция – процесс извлечения растворенного вещества (целевого компонента) из
раствора с помощью другого растворителя (экстрагента), который практически не
смешивается с первым и лучше растворяет извлекаемое вещество.
Основные цели экстракции:
1. получение чистого растворителя (очистка)
2. концентрирование целевого компонента в аналитических и технологических целях.
V1
m m0
K V2 V1
n
m – масса оставшегося после экстракции вещества, m0 –
начальная масса вещества, V1 – объем раствора, V2 –
объем порции экстрагента, n – кратность экстракции













 Химия
Химия








