Похожие презентации:
Фазовое равновесие
1. Лекция 3
ФАЗОВОЕ РАВНОВЕСИЕ.2. Определение
Фазу определяют как состояние материи,которое «повсюду однородно не только по
химическому составу, но и по физическому
состоянию»
3.
Равновесие перехода вещества из одной фазы вдругую без изменения химического состава
называется фазовым равновесием.
плавление
твердое вещество
жидкость
кристаллизация
4.
Фазовое равновесие являетсядинамическим, т.е. скорость прямого
процесса равна скорости обратного
процесса. Энергия Гиббса равна нулю.
(∆G=0)
5. Правило фаз.
Согласно правилу фаз, числа степеней свободы С,фаз Ф, независимых компонентов К и внешних
условий n, влияющих на равновесие,
взаимосвязаны соотношением:
С+Ф=К+n
6.
Компонент — это однородная по химическимсвойствам часть термодинамической системы,
которая может быть выделена из неё.
7.
Например, система из аммиака, хлороводорода ихлорида аммония состоит из трех компонентов и
двух независимых компонентов, так как один из
компонентов можно определить по реакции:
NH3 + HCl = NH4+*Cl-
8.
Числом степеней свободы С называетсячисло внешних условий, которые можно
изменять в определенных пределах без
изменения числа и вида фаз.
На фазовое равновесие обычно влияют
температура и давление, в этом случае n = 2
и правило фаз можно переписать в виде:
С+Ф=К+2
9.
Правило справедливо при соблюденииследующих условий:
фазы имеют достаточно большие
размеры, так что поверхностными
явлениями можно пренебречь;
поверхности раздела фаз проницаемы
для всех компонентов системы в любых
направлениях.
10.
С = О (безвариантная система) определяетвозможное число фаз Ф в равновесной системе,
составленной из данного числа независимых
компонентов К.
При С = 1 (моновариантная система) один из
параметров состояния системы можно изменять,
тогда другие параметры состояния полностью
зависят от первого.
При С = 2 (бивариантная система) изменять
независимо можно два параметра состояния, а все
остальные параметры состояния полностью
зависят от этих двух и т. д.
11.
Физико-химический анализДля изучения фазового равновесия в
термодинамических системах используется так
называемая фазовая диаграмма. Это обычная
диаграмма состояния (графическое изображение
соотношений между параметрами состояния), но
построенная в координатах, позволяющих
определить условия устойчивости фаз и фазового
равновесия.
12.
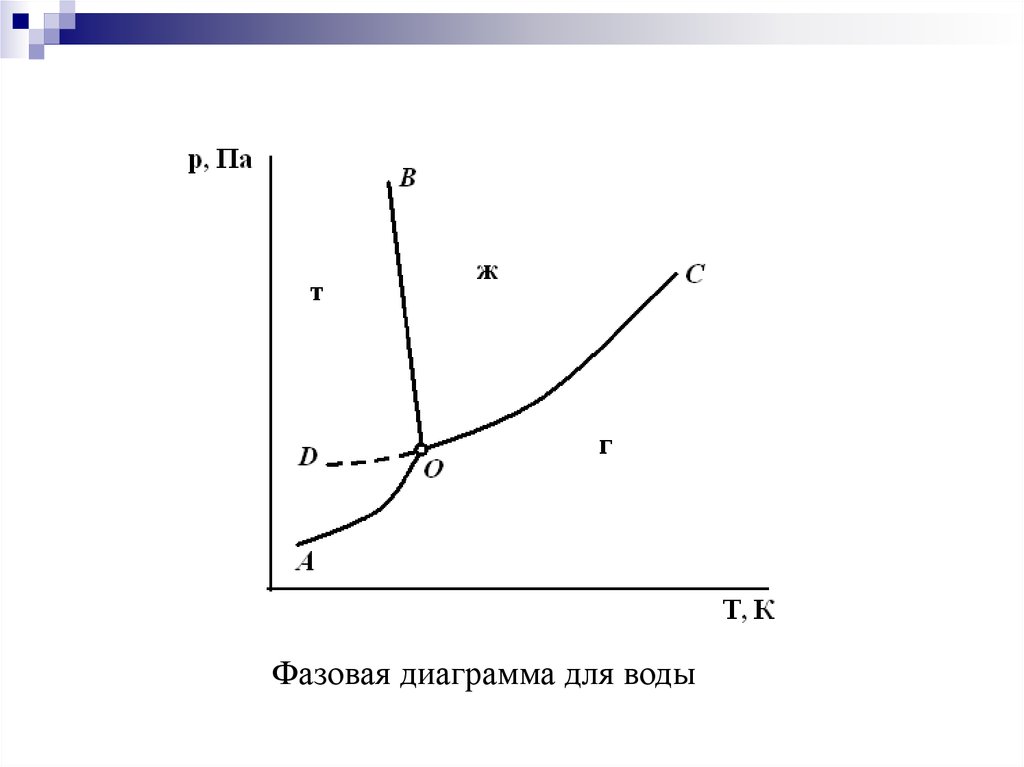
Фазовая диаграмма для воды13.
Линия АО называется линией сублимации(возгонки);
Линия ВО соответствует линии плавления;
Кривая СО - линия испарения.
В тройной точке О система нонвариантна (С = 1 +
2 - 3 = 0), что характеризуется фиксированными
значениями давления и температуры. Точка О для
воды имеет следующие координаты: Т = 273,16 К,
p = 610,5 Па.
14.
Для определения фазового состава сплава, знаниекоторого необходимо для понимания его
структуры и свойств, используются методы
физико-химического анализа. С его помощью
изучается зависимость свойств
(электропроводность, температура
кристаллизации, плотность, вязкость и др.) от
состава, обычно выражаемые в виде диаграмм
«состав – свойство».
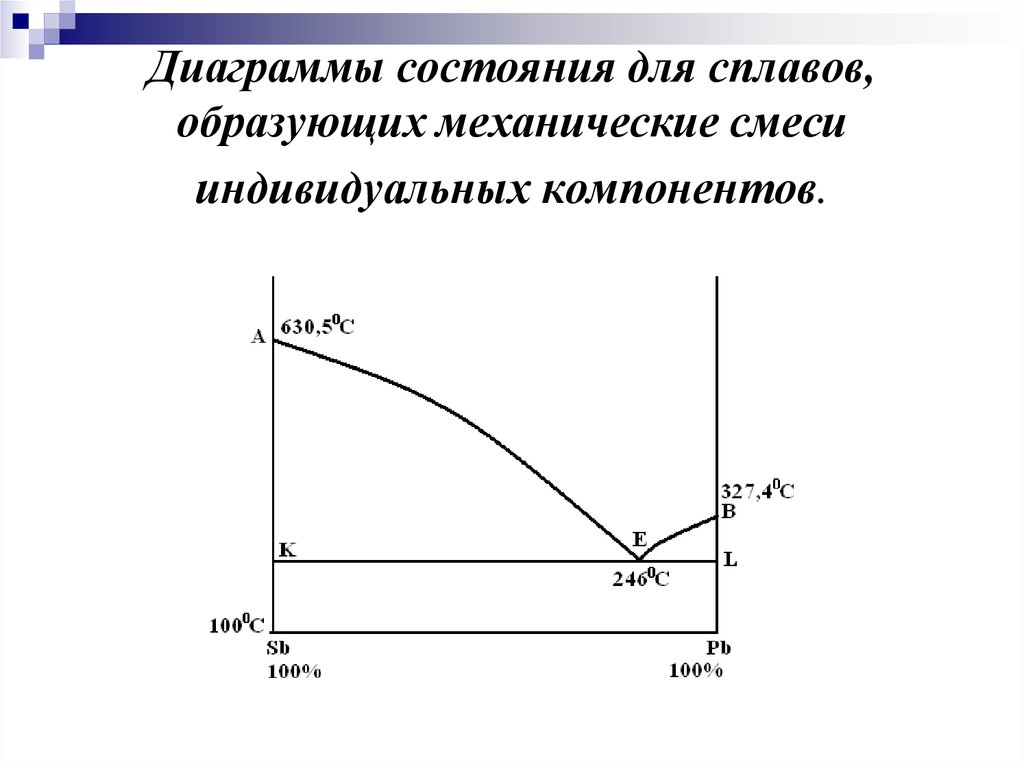
15. Диаграммы состояния для сплавов, образующих механические смеси индивидуальных компонентов.
16.
Линия AEB на диаграмме называетсялинией ликвидуса
Точка Е с координатами ω(Pb) = 83 % и
ТЕ = 2460С − точка эвтектики.
Линия KEL – линия солидуса
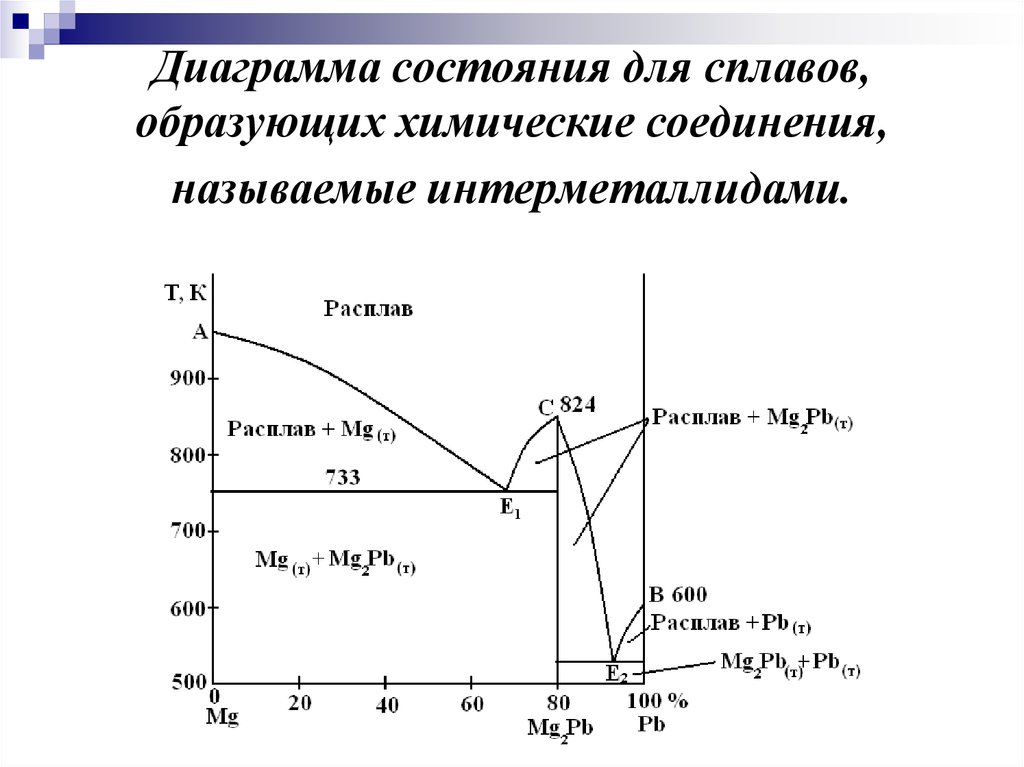
17. Диаграмма состояния для сплавов, образующих химические соединения, называемые интерметаллидами.
18. ТЕРМОДИНАМИКА ПРОЦЕССА РАСТВОРЕНИЯ
19. Основные положения
Растворение – это физико-химическийпроцесс.
Физическая сторона – растворяющее
вещество теряет свою структуру,
разрушается.
Химическая сторона – растворяемое
вещество взаимодействует с
растворителем- сольватация- образуются
сольваты, если растворение идет в воде,
то процесс называется гидратацией образуются гидраты.
20.
Теплотой или энтальпиейрастворения – называется количество
теплоты, которое выделяется или
поглощается при растворении.
кДж
[ H раств ]
моль
21. Что происходит при растворении?
а) разрушение структурырастворенного вещества, т.е.
фазовый переход Нфп
Нфп > 0 тепло затрачивается
NaClтв = Na+ + Cl–
H>0 S>0
22.
б) гидратацияНгидр < 0 тепло выделяется
Na+ + n·H2O = [Na(H2O)n]+
–
–
Cl + m·H2O = Cl •m·H2O
H<0 S<0
23.
в) Hраст = Hфп + НгидрЕсли Hфп > Нгидр – то
процесс эндотермический,
Если Hфп < Нгидр – то
процесс экзотермический.
24. Энтропия растворения
Дж[ S раств ]
моль К
Энтропия
растворения твердых и
жидких веществ всегда больше
нуля S>0
Энтропия
растворения газов S<0
25. Энергия Гиббса
Gраств= Нраств+Т· SраствGраств <0 – растворение
идет самопроизвольно.
G насыщенного раствора
равна нулю.
26.
Насыщенный раствор– это раствор который
находится в равновесии
с растворяющимся
веществом.
27. ИДЕАЛЬНЫЕ РАСТВОРЫ. Закон Рауля
28.
Идеальные растворы – это такиерастворы, образование которых
происходит без изменения объема и
теплового эффекта.( H=0, V=0), лишь
за счет увеличения энтропии.
Идеальные растворы – это растворы, в
которых пренебрегают
межмолекулярным взаимодействием.
29.
В идеальных растворах частицырастворенного вещества находятся
на большом расстоянии друг от друга
и их взаимное влияние можно
исключить, а растворитель
практически не меняет своих
свойств.
30.
Разбавленныерастворы
приближаются к идеальным.
Из реальных растворов
разбавленные растворы
неэлектролитов могут по своим
свойствам приближаться к
идеальным.
31.
Растворы не проводящиеэлектрический ток называются
неэлектролитами.
Слабые электролиты в
растворе не диссоциируют на
ионы.
32.
Некоторые физические свойстварастворов неэлектролитов зависят
только от концентрации частиц
растворенного вещества и природы
растворителя и не зависят от
природы растворенного вещества.
Эти свойства называются
коллигативными свойствами.
33.
К коллигативным свойствам относятсяследующие:
1. Понижение давления паров
растворителя над раствором
2. Повышение температуры кипения,
понижение температуры затвердевания
3. Осмотическое давление
34. 1. Понижение давления паров растворителя над раствором
Согласно, первому закону Рауля –относительное понижение давления
насыщенного пара растворителя над
раствором пропорционально молярной
доле растворенного вещества в
растворе
P0 n1
P
P0 N
n1 n2
35.
Р0 – давление насыщенногопара над чистым
растворителем;
N – молярная доля
растворенного вещества в
растворе.
36. 2а. Повышение температуры кипения
Второй закон Рауля:а) Повышение температуры кипения
Ткип раствора пропорционально
моляльной концентрации раствора
Tкип Екип Сm
37.
Екип – это моляльная константаповышения температуры кипения
растворителя или его
эбуллиоскопическая константа,
которая зависит от природы
растворителя.
Екип приведена в справочниках.
38. 2б. Понижение температуры затвердевания растворов
Второй закон Рауля:б) Понижение температуры
затвердевания растворов
пропорционально моляльной
концентрации раствора
Tзатв К затв Сm
39.
Кзатв – это моляльнаяконстанта понижения
температуры затвердевания
или криоскопическая
константа (длярастворителя).
40. ПРИМЕР
Вычислить температурузатвердевания раствора
состоящего из 100 гр
этиленгликоля С2Н6О2
(М=62) и 900 граммов
воды, Кзатв=1,86.
41. 3. Осмотическое давление
Растворпредставляет собой
однородную систему.
Частицы растворенного вещества и
растворителя находятся в
беспорядочном тепловом движении
и равномерно распределяются по
всему объему раствора.
42.
Молекулырастворителя и
растворенного вещества будут
диффундировать преимущественно
в том направлении, где их
концентрация ниже.
Такая двухсторонняя диффузия
приведет к выравниванию
концентраций и С1=С2.
43.
Однако диффузия бывает односторонней,если растворы разделить полупроницаемой
перегородкой,
пропускающей
только
молекулы растворителя.
При этом условии, что С2>С1 молекулы
растворителя с большей скоростью будут
диффундировать в направлении С1 С2 и
объем раствора с концентрацией С2
несколько возрастет. Такая односторонняя
диффузия называется осмосом.
44.
Дляколичественной характеристики
осмотических свойств вводится понятие
осмотического давления.
Осмотическое давление – это такое
давление, которое нужно приложить,
чтобы осмос прекратился. .
45.
Вант –Гофф предложил, что дляосмотического давления можно
применять уравнение состояния
идеального газа
PV nRT
n
P RT
V
46.
n( р.в.)СМ
V
P CM RT
СМ – молярная концентрация
раствора. Растворы с одинаковым
осмотическим давлением
называются изотоническими.
47. ПРИМЕР:
Вычислить осмотическоедавление при 270 С раствора
сахара С12Н22О11 (М=342) 1
литр которого содержит 91г
сахара.












































 Химия
Химия








