Похожие презентации:
Антагонист ГК рецепторов
1.
.Антагонист ГК рецепторов
RU 486, или (11р-4-диметиламинофенил)-17р-
гидро-кси-7а-(пропил-1-инил)эстра-4,9-диен-3он,
2.
Важной ролью эндогенных ГК является подавление иммуннойреакции, чтобы предотвратить ее от достижения уровня, который
может вызвать повреждение. Эта гипотеза подтверждается
работами, в которых обнаружено, что АЭ приводит к смерти
животных в течение 24-48 часов после иммунизации крыс
лошадиной сывороткой, но после заместительной ГК терапии их
можно спасти. Антагонист RU 486 индуцирует воспаление к
ряду факторов , как и АЭ.
3.
Крысы Lewis, которые генетическидетерминированы на гипореактивность ГГН
системы, предрасположены к хроническим
воспалительным процессам.
Кроме того, имеются работы, которые
демонстрируют
существование негативного механизма
обратной связи между иммунной системой и
ГГН осью.
.
4.
Провоспалительные медиаторы, в частности ИЛ-1 и ФНОα,повышаются в начале развития иммунной реакции, они
стимулируют ГГНось, которая приводит к повышению
секреции кортикостерона, подавляющего иммунный ответ.
Антагонист ГК рецепторов RU-486 повышал смертность
таких животных, поскольку ГК не имели возможности
остановить выработку прововоспалительных цитокинов
активированными АГ лимфоцитами и привлеченными ими
макрофагами. Таким образом, ГК предотвращают организм
от потенциально возможного повреждения.
Апоптоз, который вызывают ГК, т.е. элиминация из
организма активированных антигеном клонов
лимфоцитов, останавливает деструктивные для
организма компоненты иммунной реакции.
5.
. У мышей с генетически детерминированнымнарушением иммунной системы - мыши линии MRL/lpr,
гомозиготные по гену лимфопролиферации lpr, МП
оказывает иммунопротективный эффект. У таких мышей
спонтанно развиваются аутоиммунные расстройства,
протекающие по типу системной красной волчанки,
нарушена продукция ИЛ-2, снижен клеточный и
гуморальный (на ЭБ) иммунитет, отсутствует 2-ый ответ
(число АОК после повторной иммунизации находится на
уровне фона). После введение МП на пике ответа (4
день) иммунная реакция увеличивается до нормы в
контроле, например, мышей гибридов (СВА х С57BL/6J).
Системное введение МП 3 раза в месяц увеличивала
продолжительность жизни таких мышей в 2 раза (обычно
гибнут на 6-7 месяце).
6.
Обнаружена дефектность мышей MLR/lprпо продукции и/или по функциональной
активности МП.
Показан протективный эффект МП на
иммунологическую активность при
стрессе.
При стрессе снижается естественная
продукция
МП, что говорит о
возможной зависимости его выработки от
нейроэндокринной системы
7. Психонейроиммуномодуляция: интегративный анализ взаимоотношения серотонинергической системы мозга и иммунологической
Г.В.ИдоваПсихонейроиммуномодуляция:
интегративный анализ взаимоотношения
серотонинергической системы мозга и
иммунологической реактивности.
Лаборатория механизмов нейрохимической
регуляции
ГУ НИИ физиологии СО РАМН
г.Новосибирск
Работа выполнена при поддержке РФФИ (гранты № 99-04-50017 и № 04-04-48069)
8. Olivier B.
SEROTONIN: A NEVER-ENDING STORYEur.J Pharmacol. -2015.-Vol. 753.-P. 2-18
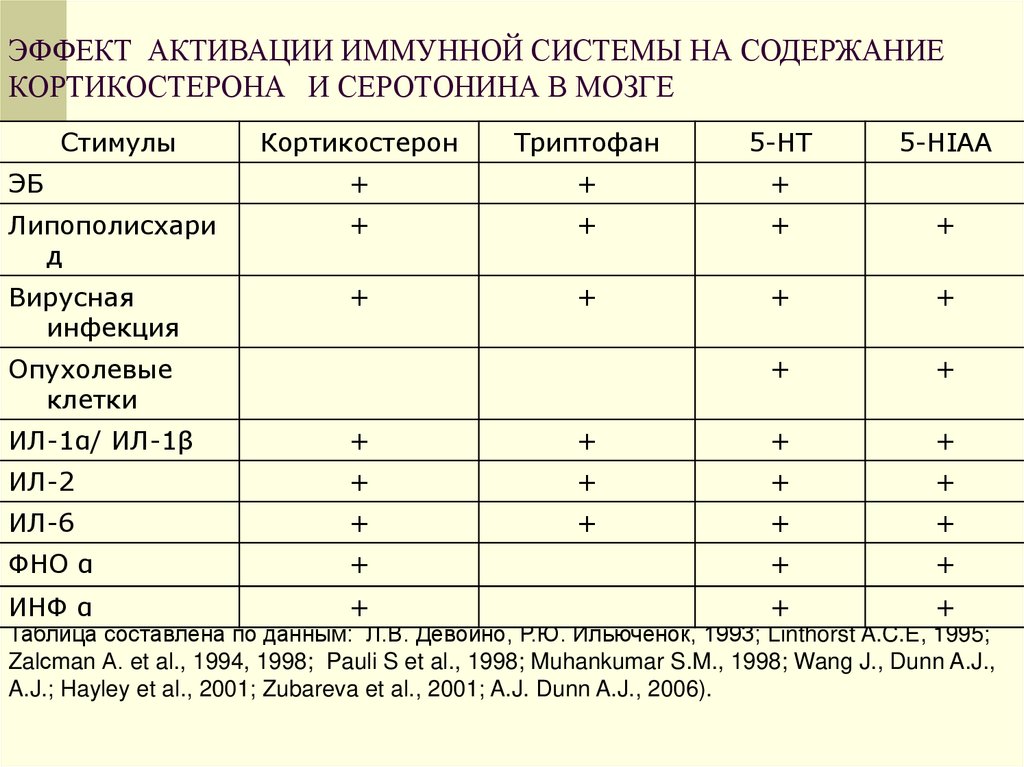
9. ЭФФЕКТ АКТИВАЦИИ ИММУННОЙ СИСТЕМЫ НА СОДЕРЖАНИЕ КОРТИКОСТЕРОНА И СЕРОТОНИНА В МОЗГЕ
СтимулыКортикостерон
Триптофан
5-НТ
ЭБ
+
+
+
Липополисхари
д
+
+
+
+
Вирусная
инфекция
+
+
+
+
+
+
Опухолевые
клетки
5-HIAA
ИЛ-1α/ ИЛ-1β
+
+
+
+
ИЛ-2
+
+
+
+
ИЛ-6
+
+
+
+
ФНО α
+
+
+
ИНФ α
+
+
+
Таблица составлена по данным: Л.В. Девойно, Р.Ю. Ильюченок, 1993; Linthorst A.C.E, 1995;
Zalсman А. et al., 1994, 1998; Pauli S et al., 1998; Muhankumar S.M., 1998; Wang J., Dunn A.J.,
A.J.; Hayley et al., 2001; Zubareva et al., 2001; A.J. Dunn A.J., 2006).
10.
11. Угнетение иммунного ответа при активации 5-НТ сисемы:
1. Введение серотнина в дозах 50-100 мг/кг;2.Введение предшественника 5-НТР 100-200;
3. Блокада МАО-А ипразидом;
4. Блокада обратного захвата 5-НТ (сертралин
обратный захват уменьшается до 80%);
5.Активация постсинаптических 5-НТ1Арецепторов 8-OH-DPAT, 1.0 ;
6. Активация постсинаптических 5-НТ2Арецепторов DOI, 1.0
12. Стимуляция иммунного ответа при снижении 5-НТ системы:
Стимуляция иммунного ответа при снижении 5НТ системы:1. Электролитическое разрушение ядер
шва среднего мозга;
2.Блокада фермента синтеза 5-НТ
трипофагидроксилазы ПХФА 500 мг/кг;
3.Блокада пресинаптических 5-НТ1А- рецепторов
8-OH-DPAT, 0.1 и делизидом, 0.1 ;
4.Блокада постсинаптических 5-НТ1А- рецепторов
WAY-100635, 1.0;
5.Блокада постсинаптических 5-НТ2А- рецепторов
ципрогептадином, 20.0 и кетансерином 1.0
13.
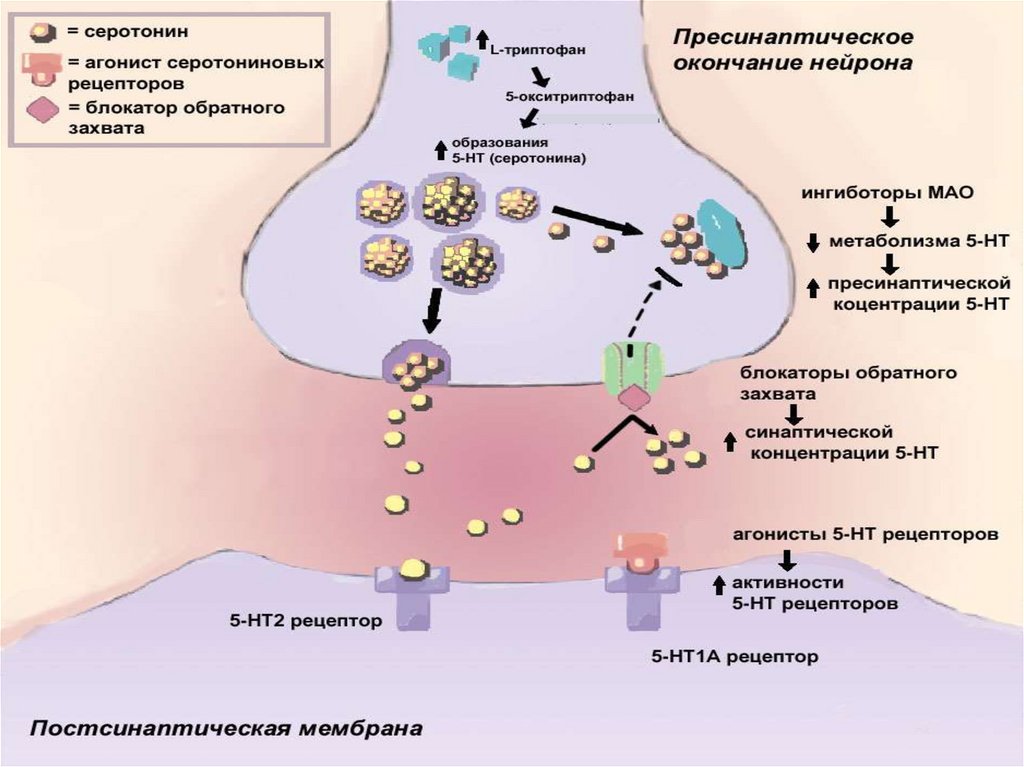
.L- триптофан
( блокатор ПХФА)
5-окситриптофан (5-ОТФ)
Триптофангидроксилаза
Декарбоксилаза
5-оксиртиптамин (5-ОТ, 5-НТ – серотонин)
ПХФА (300-500 мг/кг) через 2 суток после применения повышает уровень
серотонина в мозге на 92%.
ПХФА увеличивает иммунный ответ в 2 раза при введении за 2 дня до антигена
ЭБ, но не изменяет иммунный ответ
при введении за сутки до иммунизации
14.
15.
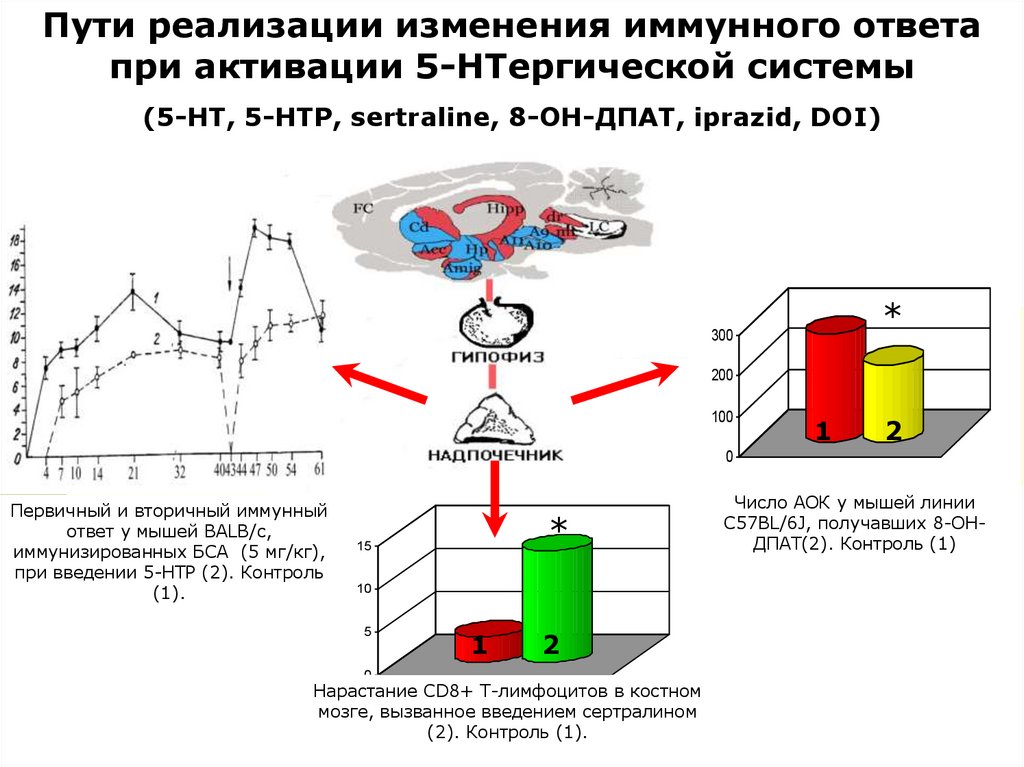
Пути реализации изменения иммунного ответапри активации 5-НТергической системы
(5-НТ, 5-НТР, sertraline, 8-ОН-ДПАТ, iprazid, DOI)
300
*
200
100
1 1 22
0
Первичный и вторичный иммунный
ответ у мышей BALB/с,
иммунизированных БСА (5 мг/кг),
при введении 5-НТР (2). Контроль
(1).
*
15
10
5
0
1
2
Нарастание СD8+ Т-лимфоцитов в костном
мозге, вызванное введением сертралином
(2). Контроль (1).
Число АОК у мышей линии
С57BL/6J, получавших 8-ОНДПАТ(2). Контроль (1)
16.
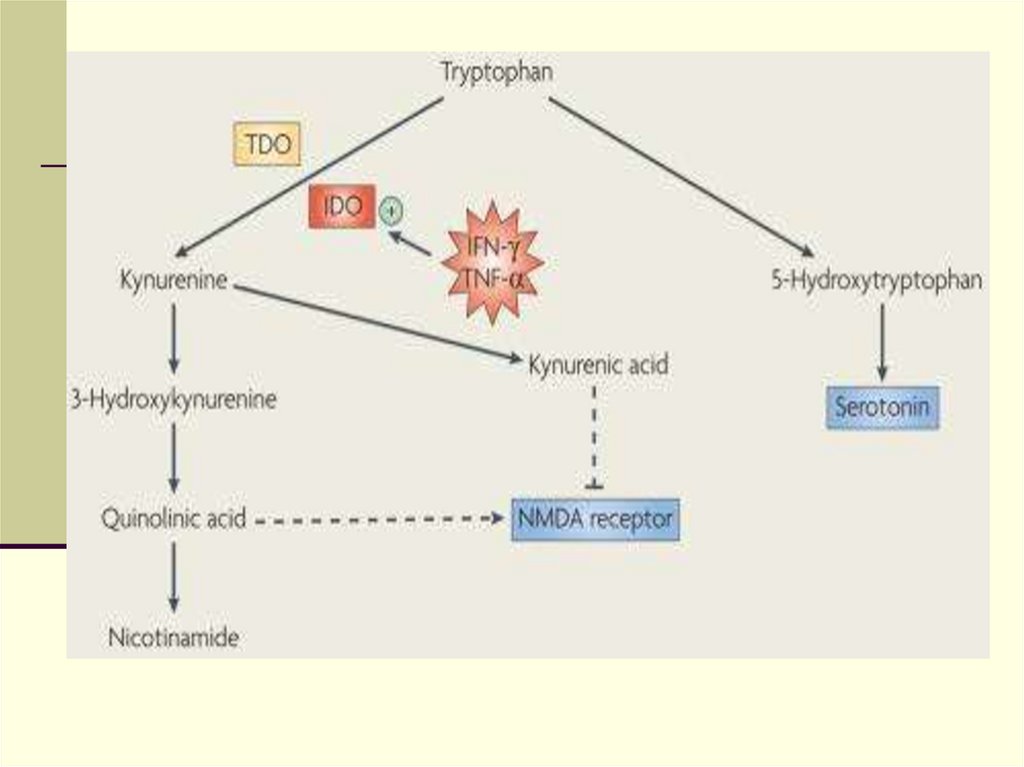
5-НТ включен в регуляцию ГГН оси и контролируетактивность КРФ нейронов в гипоталамусе и кортикотрофов,
снтезирущих АКТГ, в гипофизе. 5-НТ1А и 5-НТ2А рецепторы
обнаружены в паравентрикулярном ядре и различные их
агонисты (8-OH-DPAT и DOI) вызывают повышение КРФ,
АКТГ и кортикостероидов у человека и животных.
Существуют многочисленные терминали, которые идут из
ядер шва в гипоталамус и обнаружено синаптическое
взаимодействие между 5-НТ терминалями и КРФсодержащими нейронами паравентрикулярного ядра
гипоталамуса
17.
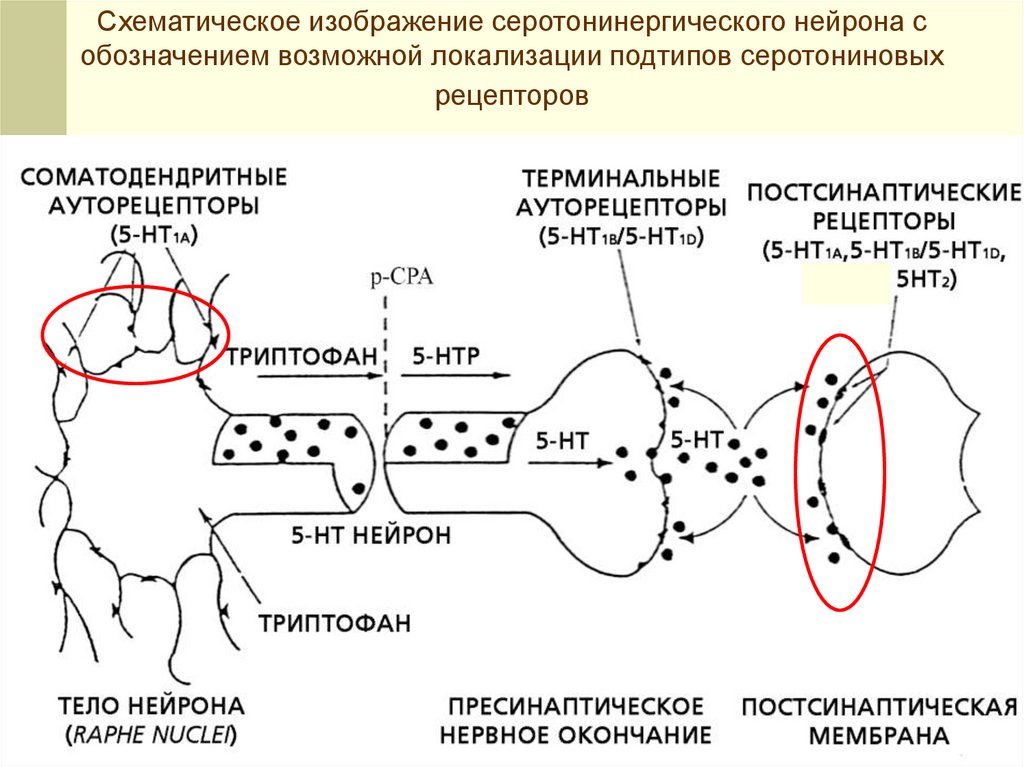
Схематическое изображение серотонинергического нейрона собозначением возможной локализации подтипов серотониновых
рецепторов
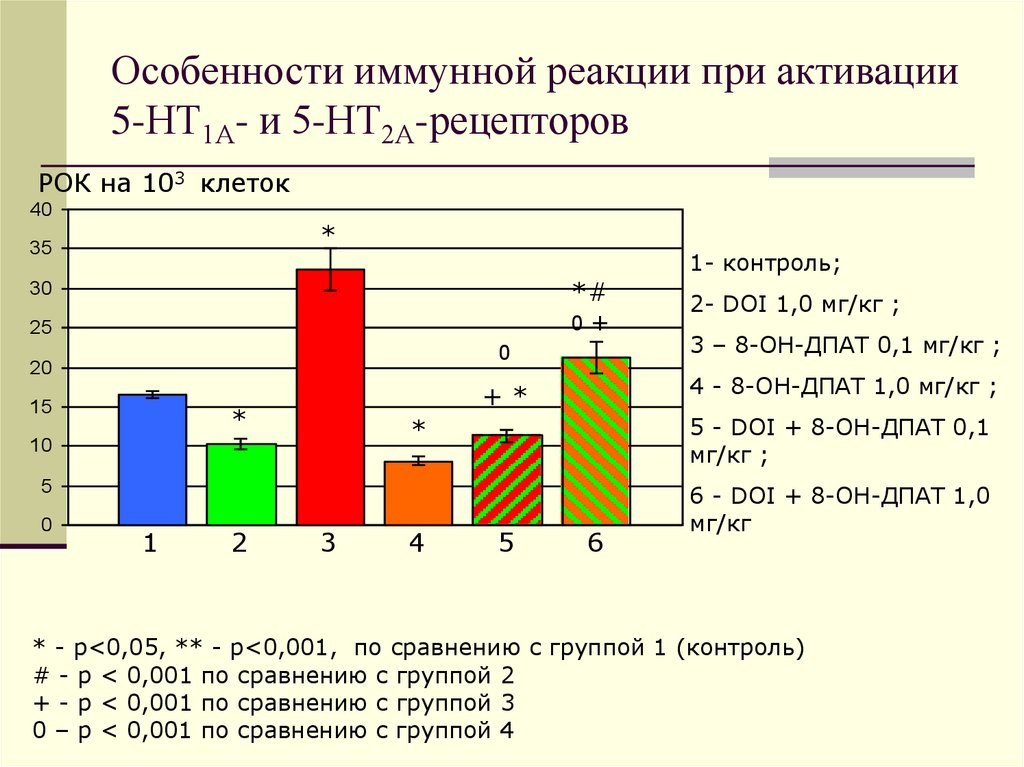
18. Особенности иммунной реакции при активации 5-НТ1А- и 5-НТ2А-рецепторов
РОК на 103 клеток40
*
35
30
*#
25
0+
0
20
15
5
0
1
2
3
4
3 – 8-ОН-ДПАТ 0,1 мг/кг ;
5 - DOI + 8-ОН-ДПАТ 0,1
мг/кг ;
*
10
2- DOI 1,0 мг/кг ;
4 - 8-ОН-ДПАТ 1,0 мг/кг ;
+*
*
1- контроль;
5
6
6 - DOI + 8-ОН-ДПАТ 1,0
мг/кг
* - р<0,05, ** - р<0,001, по сравнению с группой 1 (контроль)
# - p < 0,001 по сравнению с группой 2
+ - р < 0,001 по сравнению с группой 3
0 – р < 0,001 по сравнению с группой 4
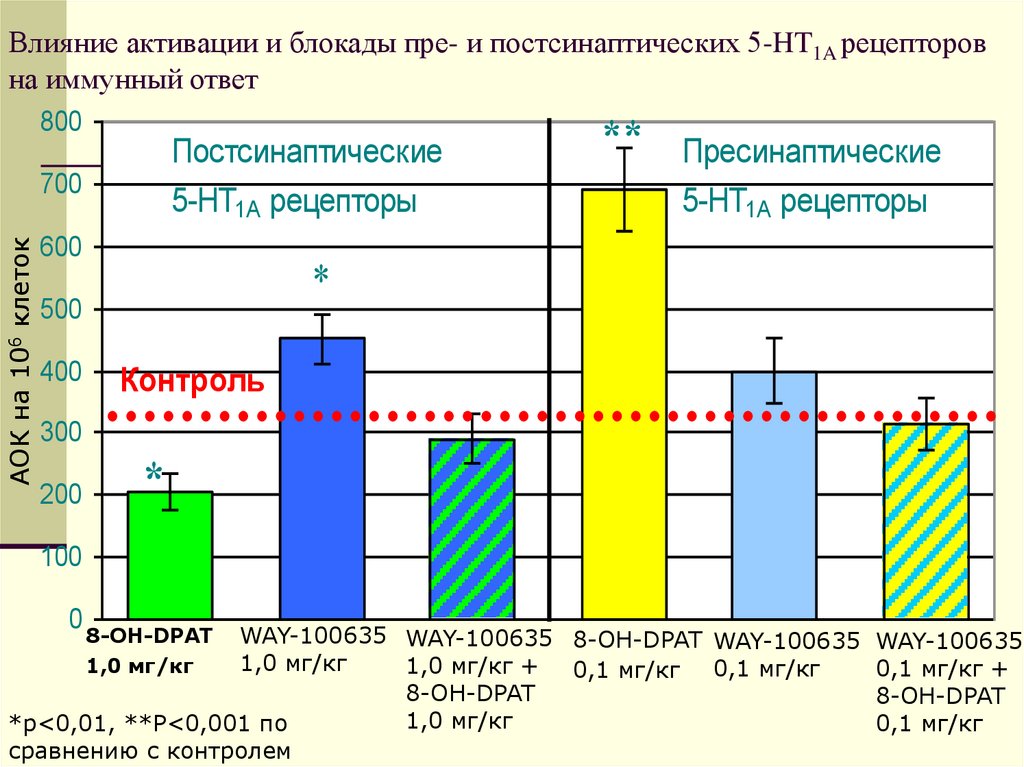
19. Влияние активации и блокады пре- и постсинаптических 5-HT1A рецепторов на иммунный ответ
800Постсинаптические
5-HT1A рецепторы
АОК на 106 клеток
700
600
Пресинаптические
5-HT1A рецепторы
*
500
400
**
Контроль
300
200
*
100
0
WAY-100635 WAY-100635 8-OH-DPAT WAY-100635 WAY-100635
1,0 мг/кг
1,0 мг/кг + 0,1 мг/кг 0,1 мг/кг
0,1 мг/кг +
8-OH-DPAT
8-OH-DPAT
1,0 мг/кг
0,1 мг/кг
*p<0,01, **P<0,001 по
сравнению с контролем
8-OH-DPAT
1,0 мг/кг
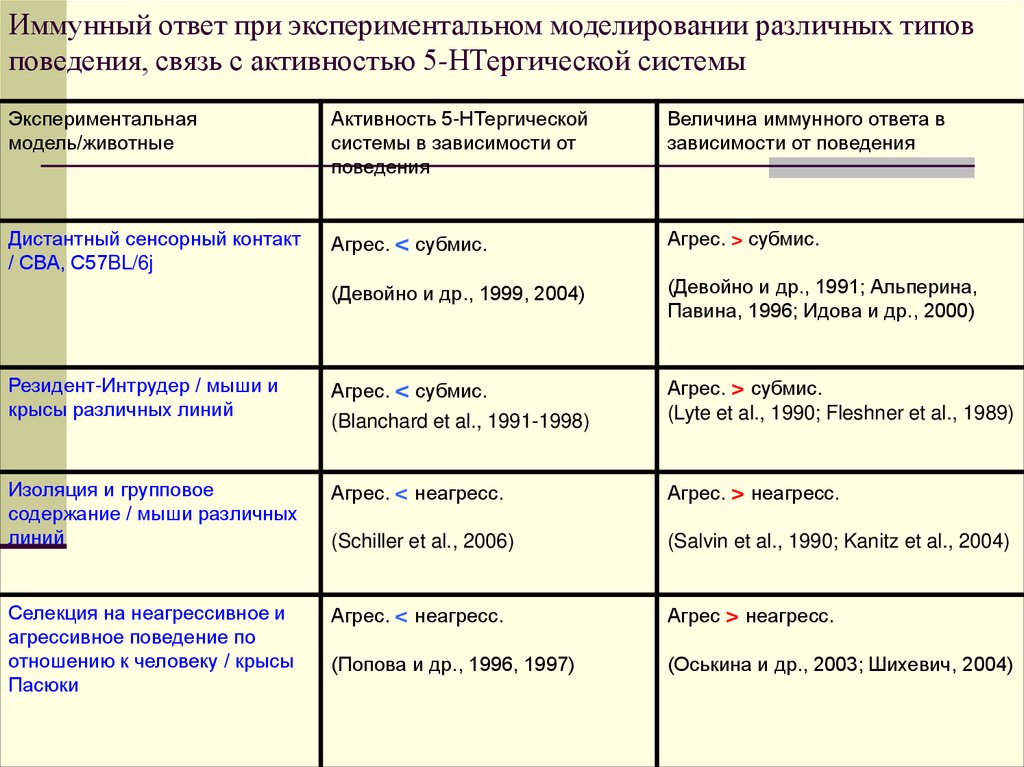
20. Иммунный ответ при экспериментальном моделировании различных типов поведения, связь с активностью 5-НТергической системы
Экспериментальнаямодель/животные
Активность 5-НТергической
системы в зависимости от
поведения
Величина иммунного ответа в
зависимости от поведения
Дистантный сенсорный контакт
/ СВА, С57BL/6j
Агрес. < субмис.
Агрес. > субмис.
(Девойно и др., 1999, 2004)
(Девойно и др., 1991; Альперина,
Павина, 1996; Идова и др., 2000)
Резидент-Интрудер / мыши и
крысы различных линий
Агрес. < субмис.
(Blanchard et al., 1991-1998)
Агрес. > субмис.
(Lyte et al., 1990; Fleshner et al., 1989)
Изоляция и групповое
содержание / мыши различных
линий
Агрес. < неагресс.
Агрес. > неагресс.
(Schiller et al., 2006)
(Salvin et al., 1990; Kanitz et al., 2004)
Селекция на неагрессивное и
агрессивное поведение по
отношению к человеку / крысы
Пасюки
Агрес. < неагресс.
Агрес > неагресс.
(Попова и др., 1996, 1997)
(Оськина и др., 2003; Шихевич, 2004)
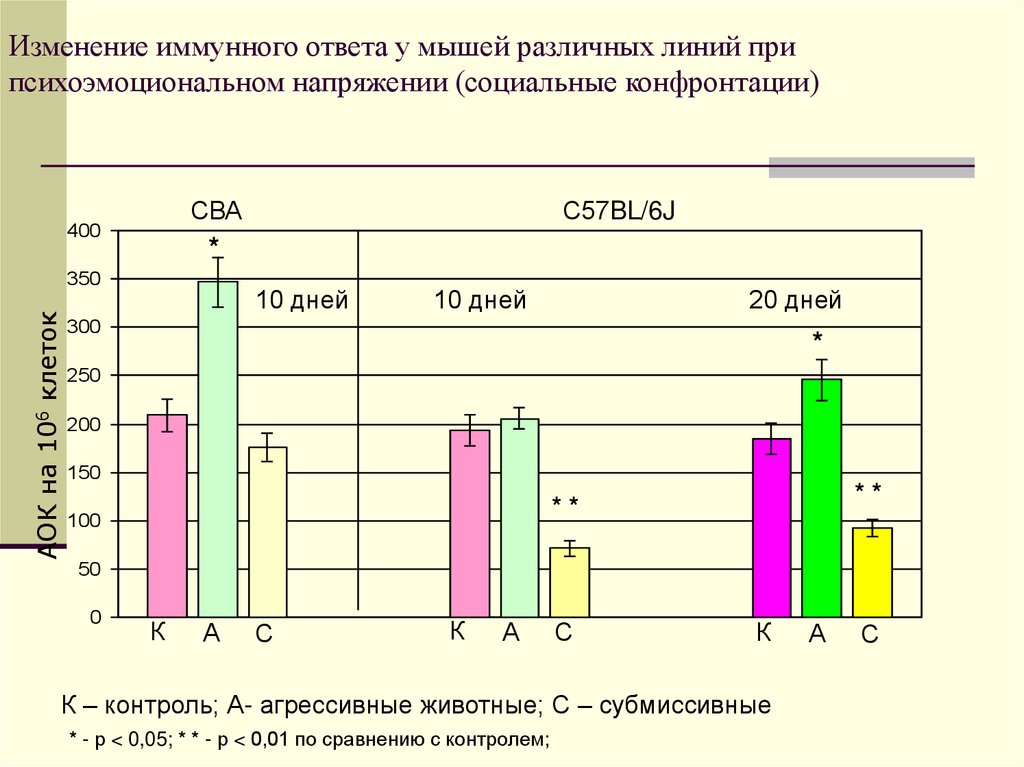
21. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (социальные конфронтации)
СВА400
*
350
АОК на 106 клеток
С57BL/6J
10 дней
10 дней
20 дней
300
*
250
200
150
**
**
100
50
0
К
А
С
К
А
С
К
К – контроль; А- агрессивные животные; С – субмиссивные
* - р < 0,05; * * - р < 0,01 по сравнению с контролем;
А
С
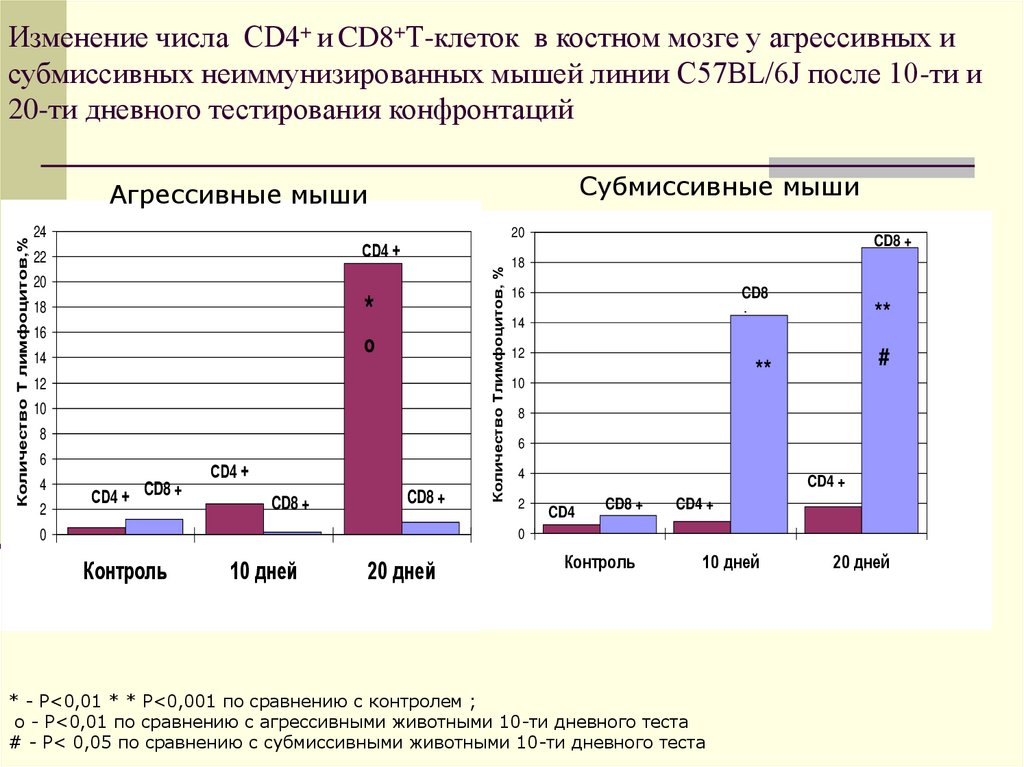
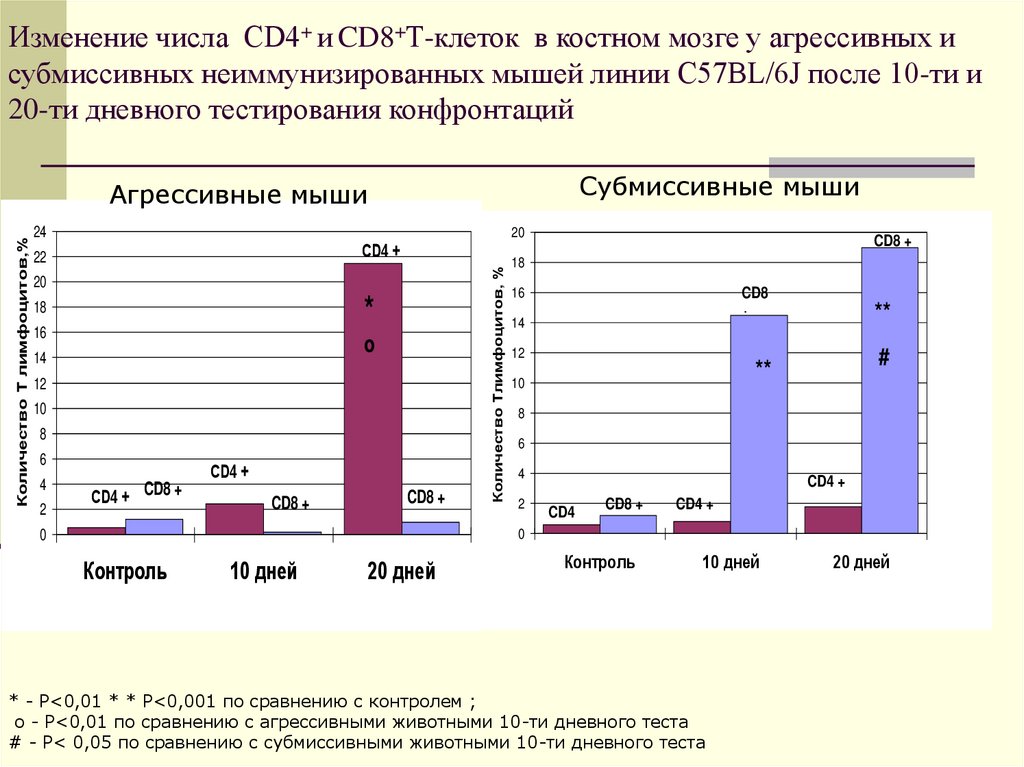
22. Изменение числа CD4+ и CD8+Т-клеток в костном мозге у агрессивных и субмиссивных неиммунизированных мышей линии C57BL/6J после
10-ти и20-ти дневного тестирования конфронтаций
Субмиссивные мыши
24
20
СD4 +
22
20
*
18
16
о
14
12
10
8
6
4
2
СD4 +
СD4 + CD8 +
CD8 +
CD8 +
Количество Тлимфоцитов, %
Количество Т лимфоцитов,%
Агрессивные мыши
18
Контроль
10 дней
20 дней
CD8
+
16
14
12
**
#
**
10
8
6
4
2
0
0
CD8 +
CD4 +
CD4
+
CD8 +
Контроль
CD4 +
10 дней
* - Р<0,01 * * Р<0,001 по сравнению с контролем ;
о - Р<0,01 по сравнению с агрессивными животными 10-ти дневного теста
# - Р< 0,05 по сравнению с субмиссивными животными 10-ти дневного теста
20 дней
23.
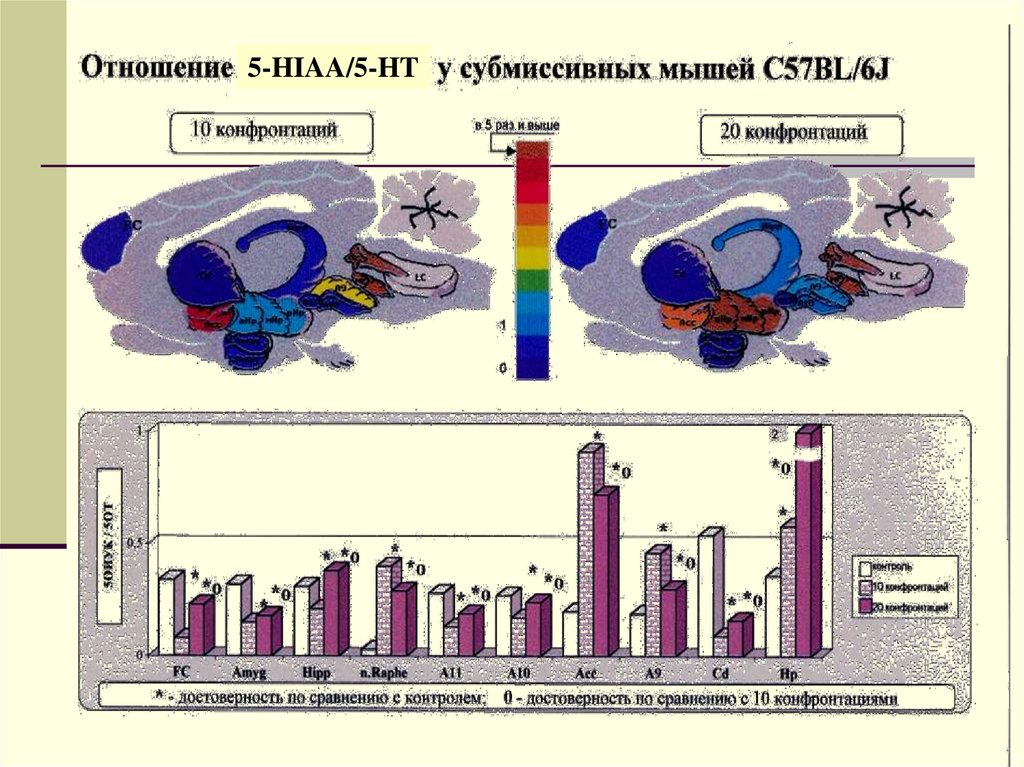
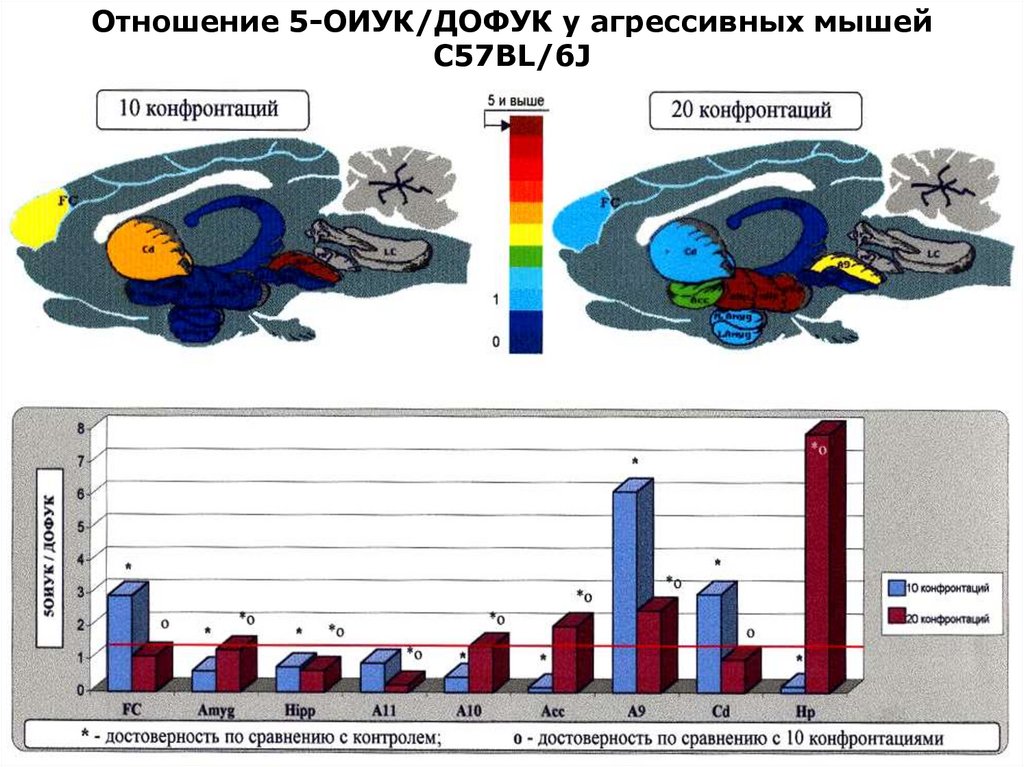
5-HIAA/5-HT24.
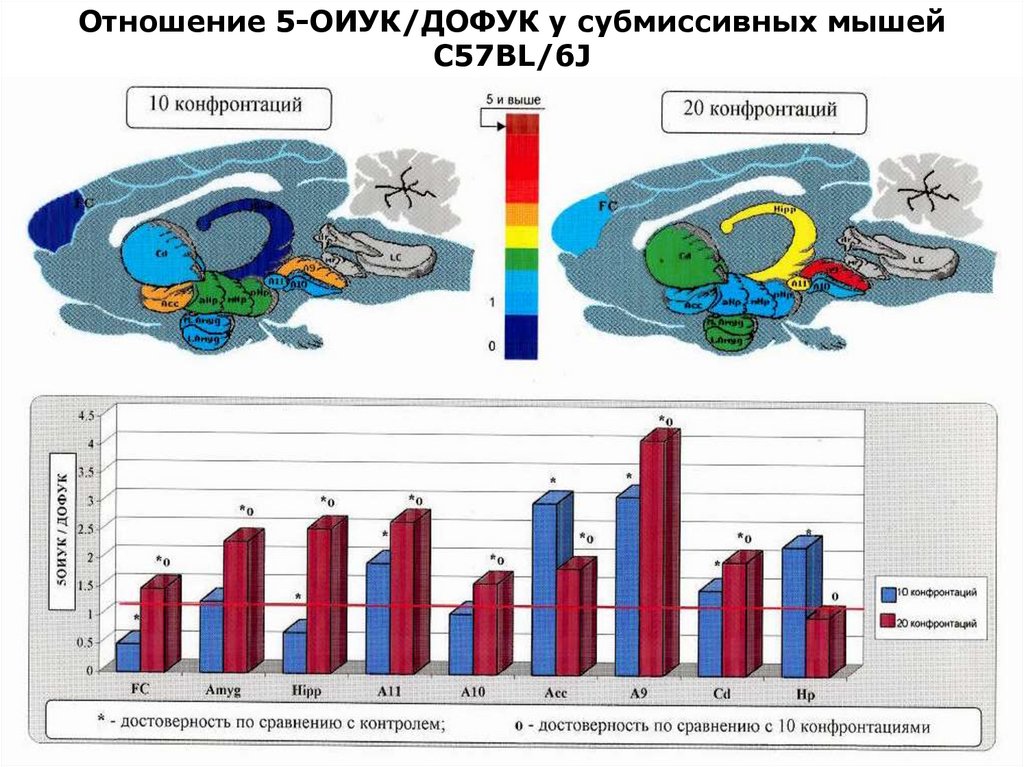
Отношение 5-ОИУК/ДОФУК у субмиссивных мышейС57BL/6J
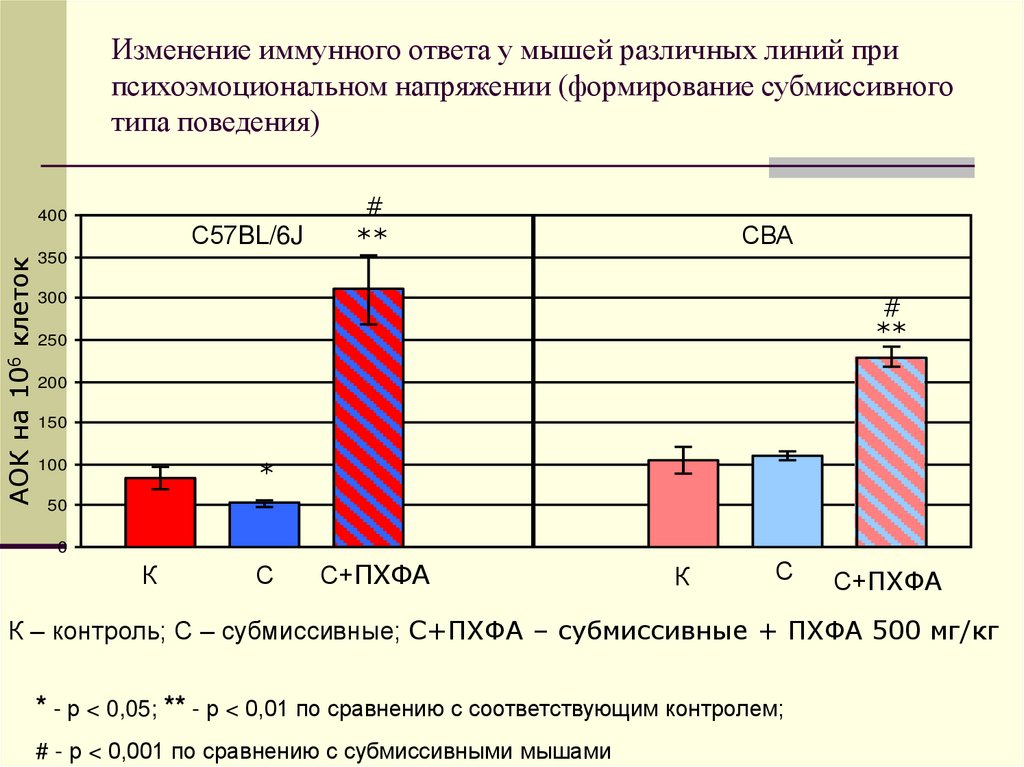
25. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (формирование субмиссивного типа
поведения)АОК на 106 клеток
400
С57BL/6J
350
#
**
СВА
#
**
300
250
200
150
*
100
50
0
К
С
С+ПХФА
К
С
С+ПХФА
К – контроль; С – субмиссивные; С+ПХФА – субмиссивные + ПХФА 500 мг/кг
* - р < 0,05; ** - р < 0,01 по сравнению с соответствующим контролем;
# - р < 0,001 по сравнению с субмиссивными мышами
26.
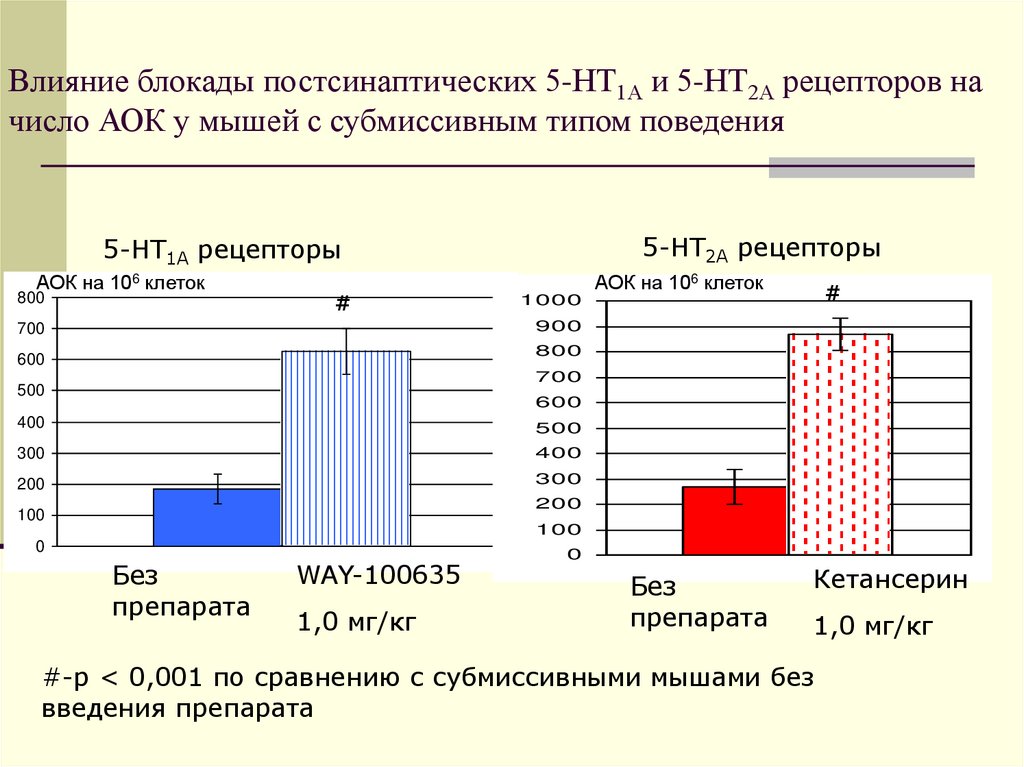
Влияние блокады постсинаптических 5-НТ1А и 5-НТ2А рецепторов начисло АОК у мышей с субмиссивным типом поведения
5-НТ2А рецепторы
5-НТ1А рецепторы
АОК на 106 клеток
800
#
АОК на 106 клеток
#
1000
900
700
800
600
700
500
600
400
500
300
400
200
300
200
100
100
0
Без
препарата
WAY-100635
1,0 мг/кг
0
Без
препарата
Кетансерин
1,0 мг/кг
#-р < 0,001 по сравнению с субмиссивными мышами без
введения препарата
27.
Отношение 5-ОИУК/ДОФУК у агрессивных мышейС57BL/6J
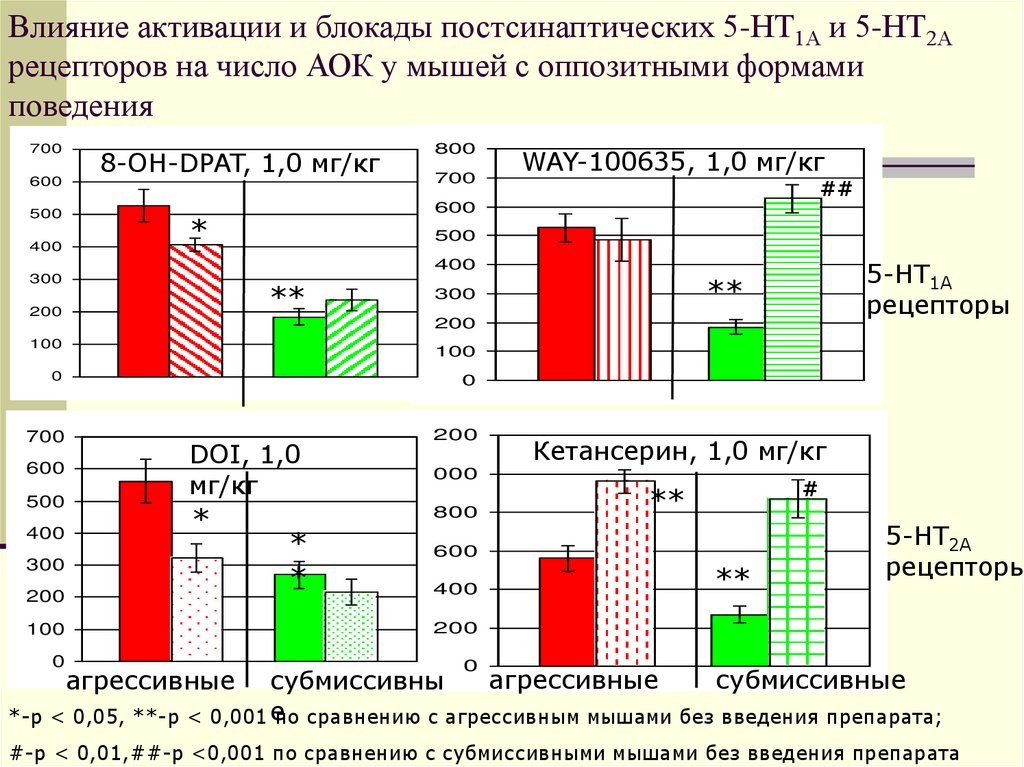
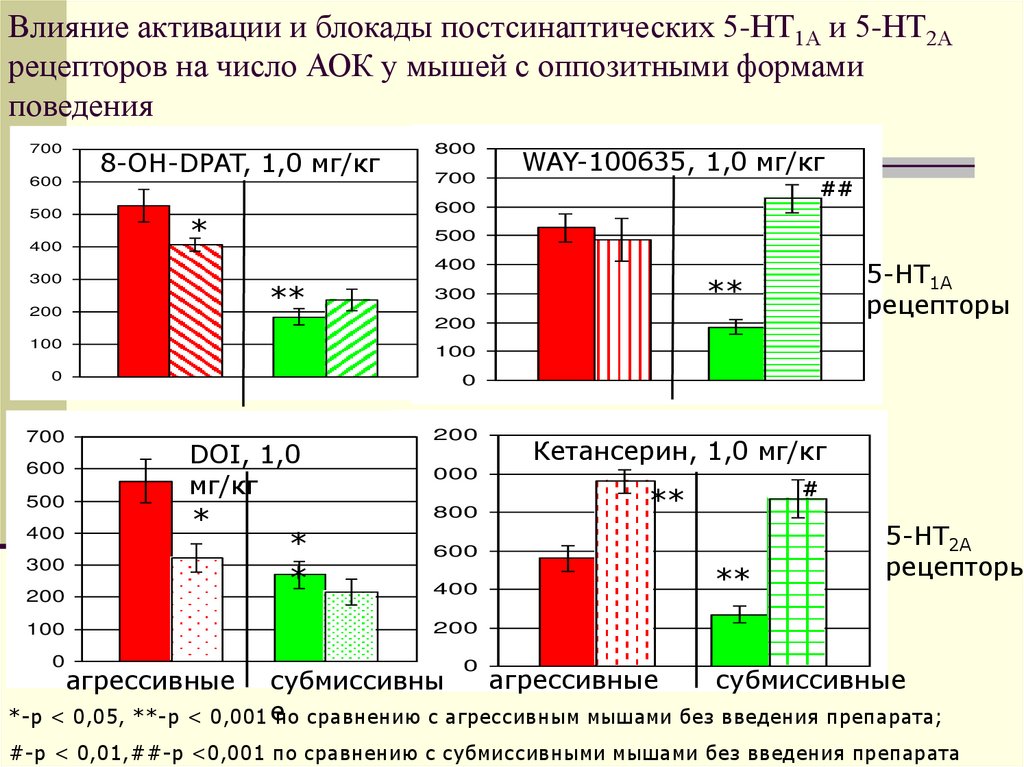
28. Влияние активации и блокады постсинаптических 5-НТ1А и 5-НТ2А рецепторов на число АОК у мышей с оппозитными формами поведения
700600
500
400
8-ОН-DPAT, 1,0 мг/кг
800
700
WAY-100635, 1,0 мг/кг
##
600
*
500
5-НТ1А
рецепторы
400
300
**
200
200
100
100
0
0
700
1200
600
500
400
**
300
DOI, 1,0
мг/кг
*
300
200
1000
800
*
*
Кетансерин, 1,0 мг/кг
#
**
600
400
100
200
0
0
**
5-НТ2А
рецепторы
агрессивные
субмиссивные
субмиссивны
*-р < 0,05, **-р < 0,001 е
по сравнению с агрессивным мышами без введения препарата;
агрессивные
#-р < 0,01,##-р <0,001 по сравнению с субмиссивными мышами без введения препарата
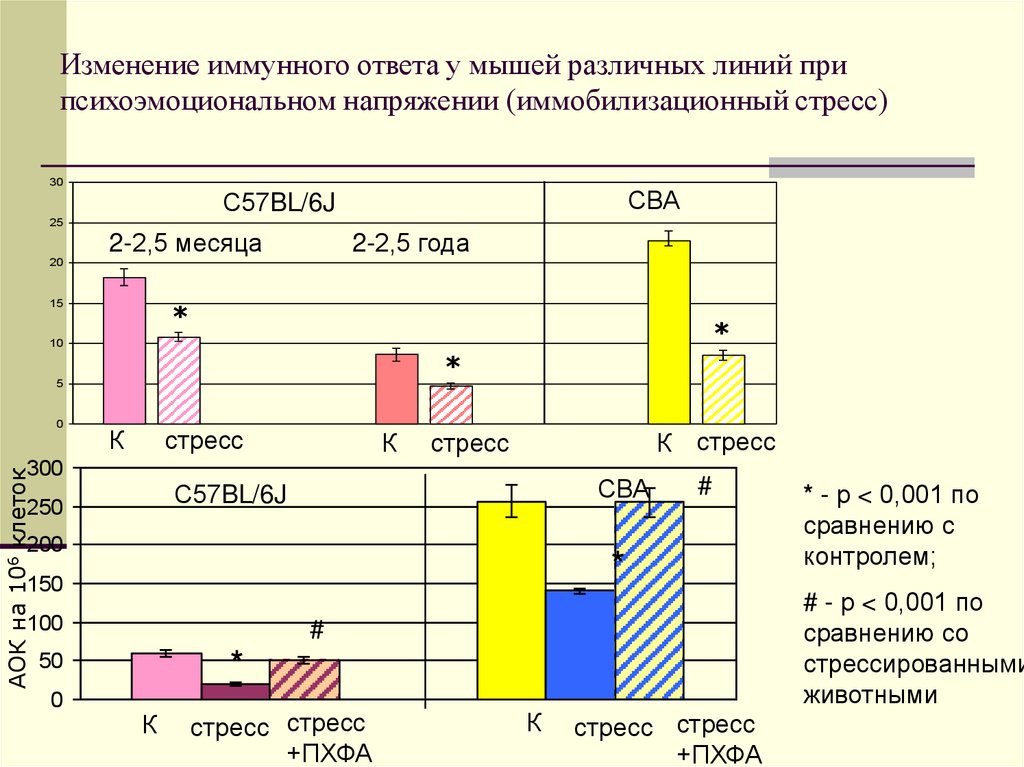
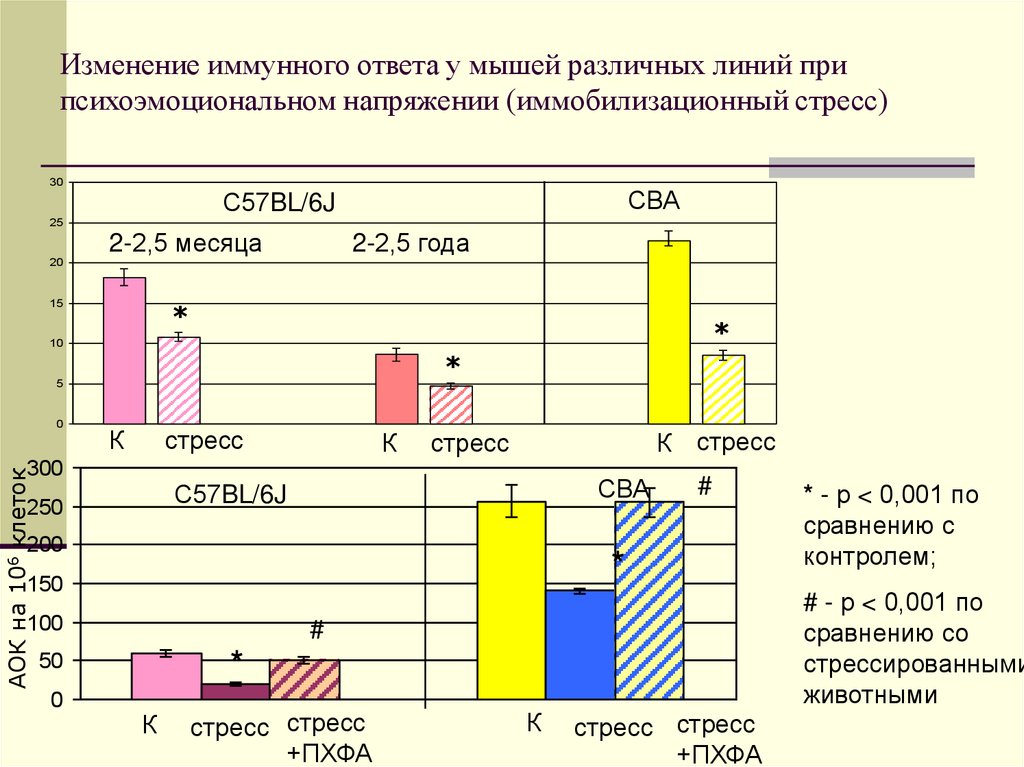
29. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (иммобилизационный стресс)
3025
20
СВА
С57BL/6J
2-2,5 месяца
15
2-2,5 года
*
*
10
*
5
0
К
стресс
АОК на 106 клеток
300
К
К стресс
стресс
СВА
С57BL/6J
250
200
*
150
100
*
К
стресс стресс
+ПХФА
К
* - р < 0,001 по
сравнению с
контролем;
# - р < 0,001 по
сравнению со
стрессированными
животными
#
50
0
#
стресс стресс
+ПХФА
30. Костный мозг – центральный орган иммунитета, источник стволовых клеток -всех элементов иммунной системы – лимфоцитарного и
моноцитарномакрофагального ряда, основноеместо дифференцировки В
лимфоцитов.
31. Клетки костного мозга вырабатывают группу регуляторных пептидов - миелопептидов, обладающих иммунорегуляторной (повышают
антитлолообразование),дифференцировочной (влияют на стволовую
клетки и ранние предшественники
лимфоцитов) нейротропной активностью
(влияют на болевую чувствительность,
эффект налоксонзависимый)
32. Серамиил –иммуномодулятор с противобактериальным действием на основе миелопида (МП) 3; Бивален иммуномодулятор с
противоопухолевым действием на основемиелопида (МП) 2;
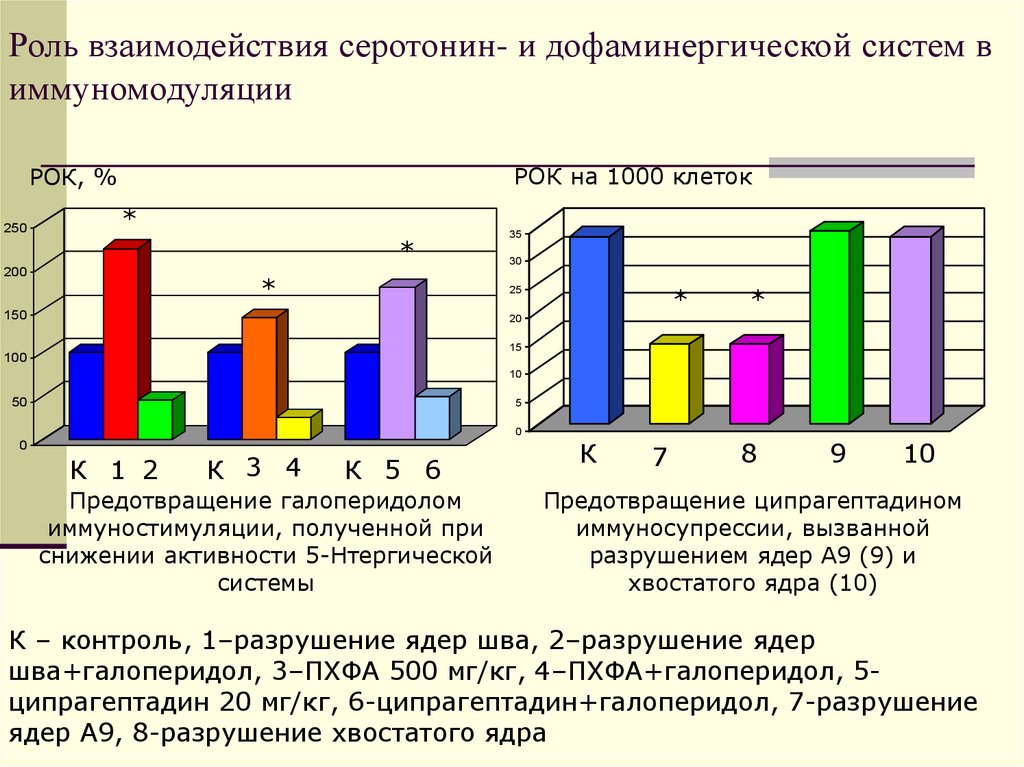
33. Роль взаимодействия серотонин- и дофаминергической систем в иммуномодуляции
РОК на 1000 клетокРОК, %
250
*
*
200
*
35
30
*
25
150
20
*
15
100
10
50
5
0
0
К 1 2
К 3 4
К 5 6
Предотвращение галоперидолом
иммуностимуляции, полученной при
снижении активности 5-Нтергической
системы
К
7
8
9
10
Предотвращение ципрагептадином
иммуносупрессии, вызванной
разрушением ядер А9 (9) и
хвостатого ядра (10)
К – контроль, 1–разрушение ядер шва, 2–разрушение ядер
шва+галоперидол, 3–ПХФА 500 мг/кг, 4–ПХФА+галоперидол, 5ципрагептадин 20 мг/кг, 6-ципрагептадин+галоперидол, 7-разрушение
ядер А9, 8-разрушение хвостатого ядра
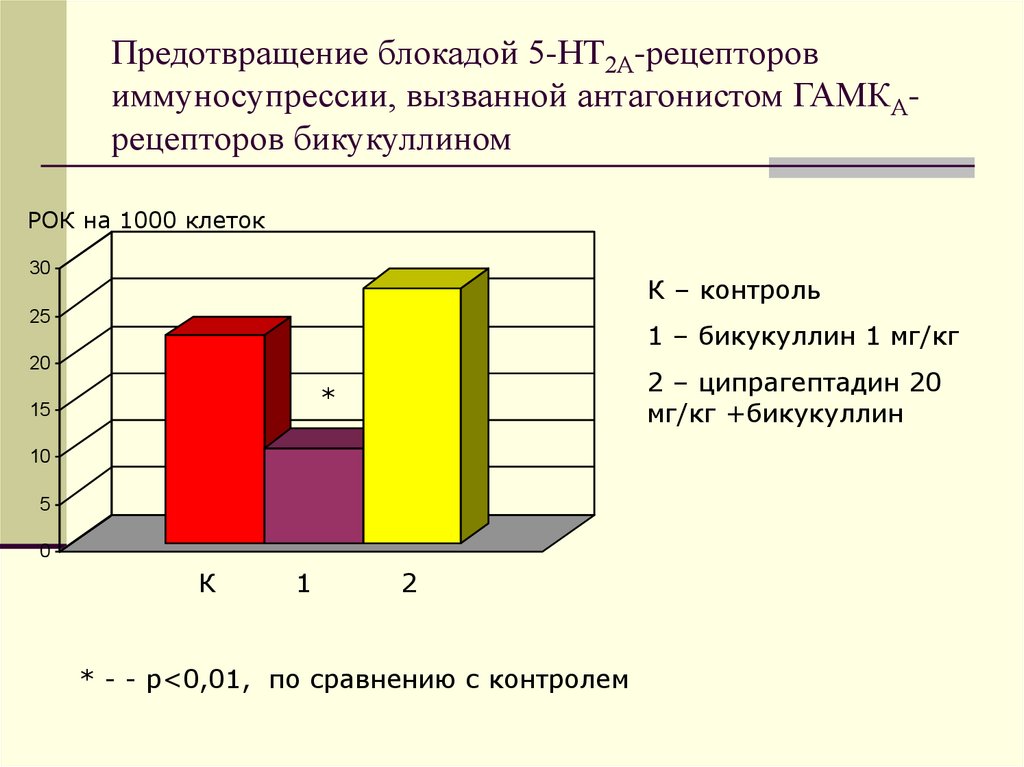
34. Предотвращение блокадой 5-НТ2А-рецепторов иммуносупрессии, вызванной антагонистом ГАМКА-рецепторов бикукуллином
Предотвращение блокадой 5-НТ2А-рецепторовиммуносупрессии, вызванной антагонистом ГАМКАрецепторов бикукуллином
РОК на 1000 клеток
30
К – контроль
25
1 – бикукуллин 1 мг/кг
20
2 – ципрагептадин 20
мг/кг +бикукуллин
*
15
10
5
0
К
1
2
* - - р<0,01, по сравнению с контролем
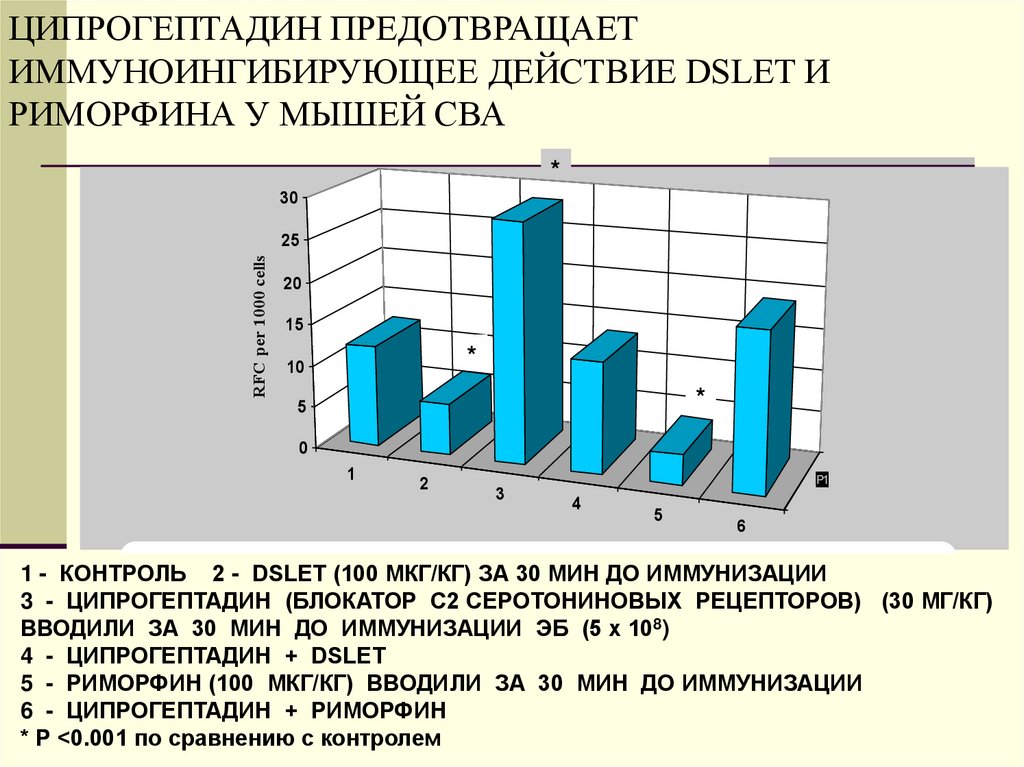
35. ЦИПРОГЕПТАДИН ПРЕДОТВРАЩАЕТ ИММУНОИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ DSLET И РИМОРФИНА У МЫШЕЙ СВА
*30
RFC per 1000 cells
25
20
15
*
10
*
5
0
1
1 - Vehicle (control)
2
3
2 - DSLET
Р1
4
5
6
1 - КОНТРОЛЬ 3 -2Cyproheptadine
- DSLET (100 МКГ/КГ)
ЗА 30 МИН
ДО ИММУНИЗАЦИИ
4 - Cyproheptadine
+ DSLET
5 - Rimorphin(БЛОКАТОР 6С2
- Cyproheptadine
+ Rimorphin
3 - ЦИПРОГЕПТАДИН
СЕРОТОНИНОВЫХ
РЕЦЕПТОРОВ) (30 МГ/КГ)
ВВОДИЛИ ЗА 30 МИН ДО ИММУНИЗАЦИИ ЭБ (5 х 108)
4 - ЦИПРОГЕПТАДИН + DSLET
5 - РИМОРФИН (100 МКГ/КГ) ВВОДИЛИ ЗА 30 МИН ДО ИММУНИЗАЦИИ
6 - ЦИПРОГЕПТАДИН + РИМОРФИН
* Р <0.001 по сравнению с контролем
36.
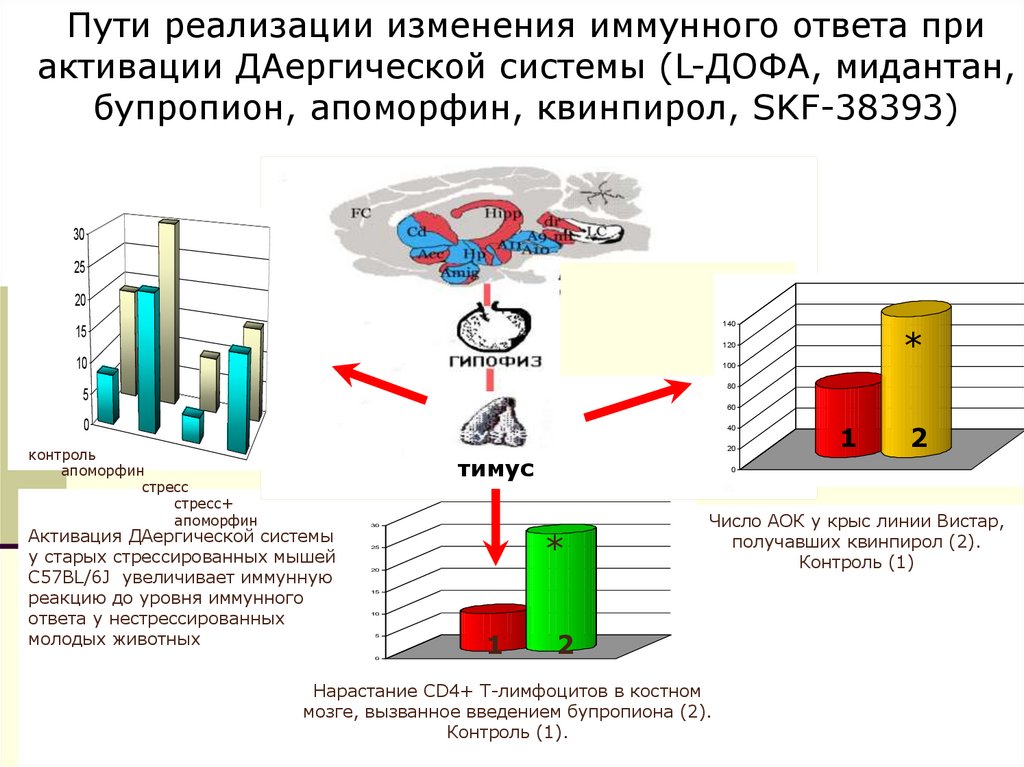
Пути реализации изменения иммунного ответа приактивации ДАергической системы (L-ДОФА, мидантан,
бупропион, апоморфин, квинпирол, SKF-38393)
30
25
*
20
140
15
100
80
5
0
контроль
апоморфин
стресс
стресс+
апоморфин
*
120
10
60
40
2,0-2,5 месяца
тимус
2,0-2,5
года
Активация ДАергической системы
у старых стрессированных мышей
C57BL/6J увеличивает иммунную
реакцию до уровня иммунного
ответа у нестрессированных
молодых животных
20
30
0
*
25
20
10
0
1
2
2
Число АОК у крыс линии Вистар,
получавших квинпирол (2).
Контроль (1)
15
5
1
1
2
Нарастание СD4+ Т-лимфоцитов в костном
мозге, вызванное введением бупропиона (2).
Контроль (1).
37. Изменение числа CD4+ и CD8+Т-клеток в костном мозге у агрессивных и субмиссивных неиммунизированных мышей линии C57BL/6J после
10-ти и20-ти дневного тестирования конфронтаций
Субмиссивные мыши
24
20
СD4 +
22
20
*
18
16
о
14
12
10
8
6
4
2
СD4 +
СD4 + CD8 +
CD8 +
CD8 +
Количество Тлимфоцитов, %
Количество Т лимфоцитов,%
Агрессивные мыши
18
Контроль
10 дней
20 дней
CD8
+
16
14
12
**
#
**
10
8
6
4
2
0
0
CD8 +
CD4 +
CD4
+
CD8 +
Контроль
CD4 +
10 дней
* - Р<0,01 * * Р<0,001 по сравнению с контролем ;
о - Р<0,01 по сравнению с агрессивными животными 10-ти дневного теста
# - Р< 0,05 по сравнению с субмиссивными животными 10-ти дневного теста
20 дней
38.
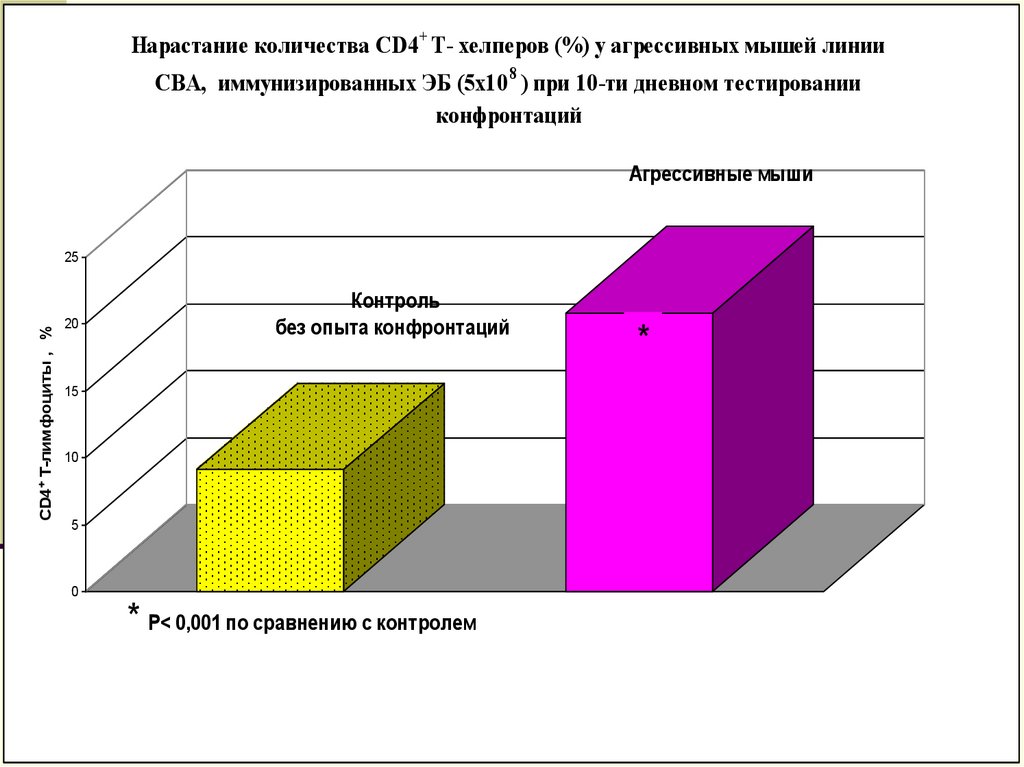
Нарастание количества CD4 + Т- хелперов (%) у агрессивных мышей линииCBA, иммунизированных ЭБ (5х10 8 ) при 10-ти дневном тестировании
конфронтаций
Агрессивные мыши
CD4+ Т-лимфоциты , %
25
20
Контроль
без опыта конфронтаций
15
10
5
0
* Р< 0,001 по сравнению с контролем
*
39.
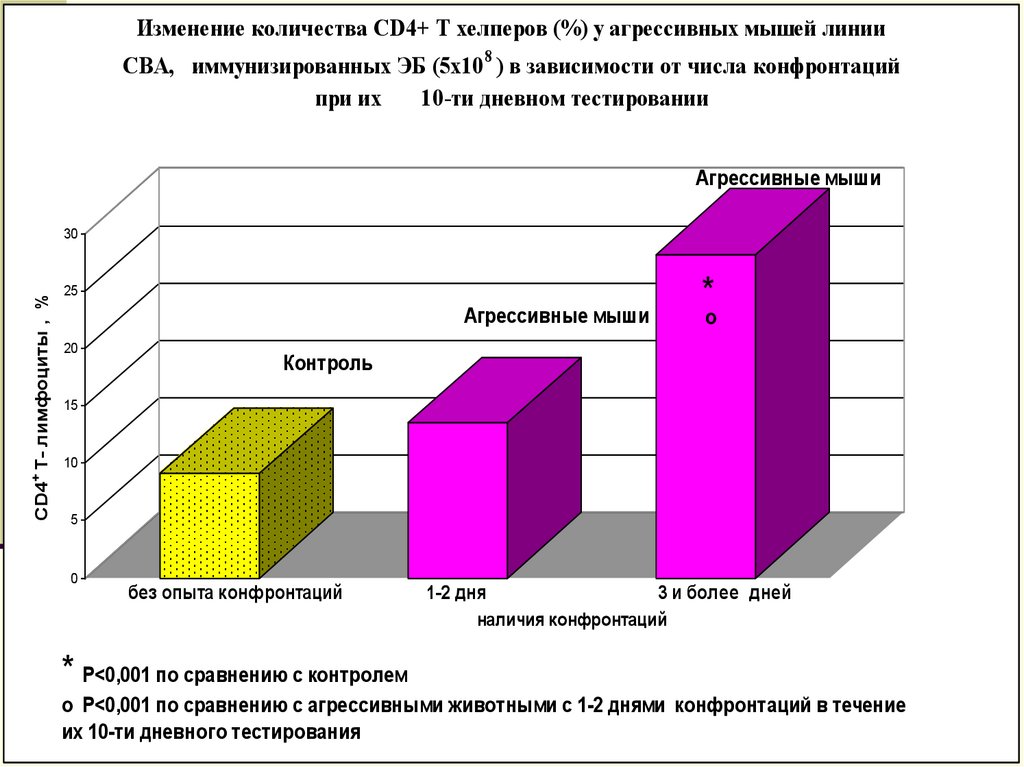
Изменение количества CD4+ Т хелперов (%) у агрессивных мышей линииСВА, иммунизированных ЭБ (5х10 8 ) в зависимости от числа конфронтаций
при их
10-ти дневном тестировании
Агрессивные мыши
CD4+ Т- лимфоциты , %
30
*
25
Агрессивные мыши
20
о
Контроль
15
10
5
0
без опыта конфронтаций
1-2 дня
3 и более дней
наличия конфронтаций
* Р<0,001 по сравнению с контролем
о Р<0,001 по сравнению с агрессивными животными с 1-2 днями конфронтаций в течение
их 10-ти дневного тестирования
40.
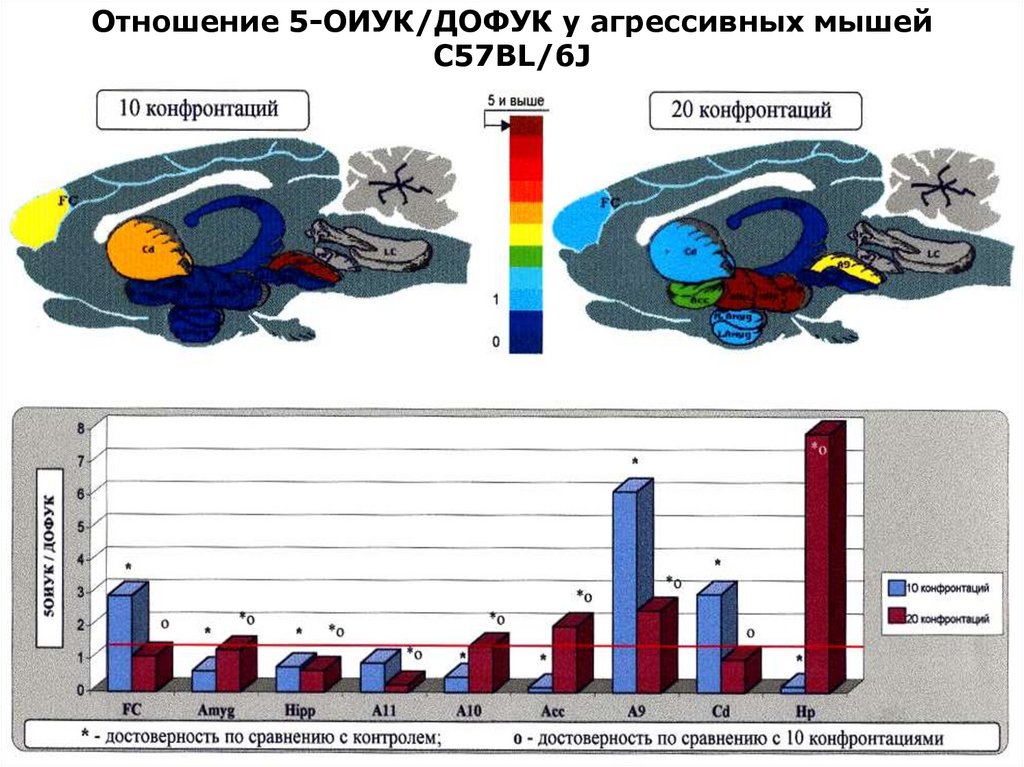
Отношение 5-ОИУК/ДОФУК у агрессивных мышейС57BL/6J
41.
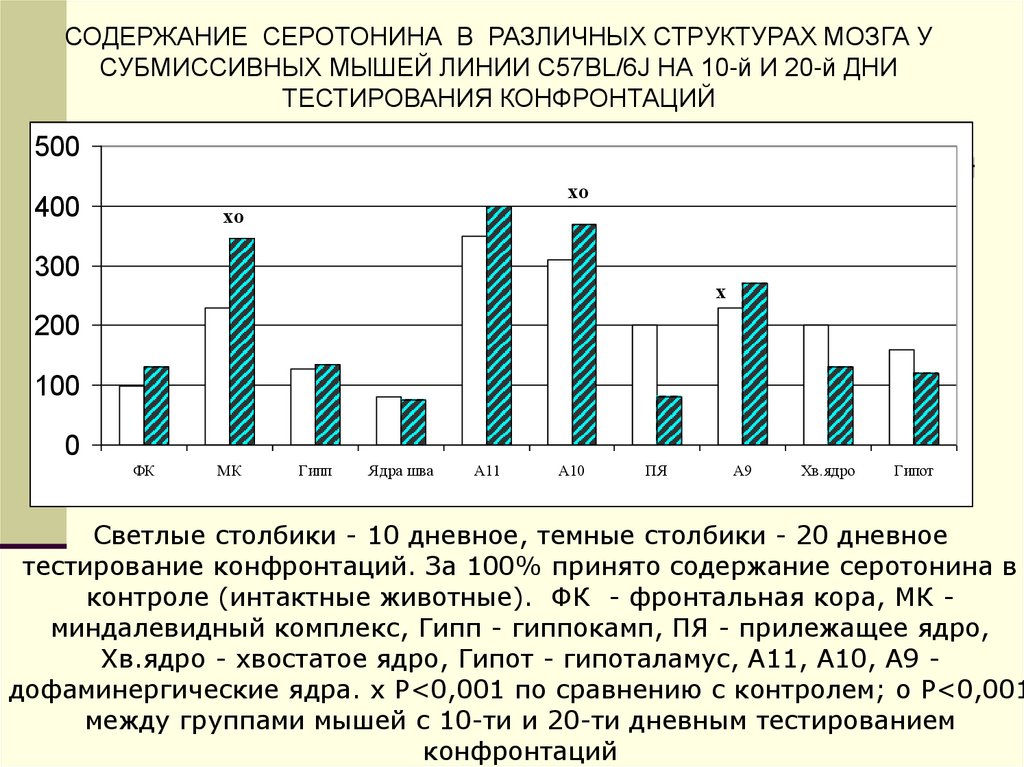
СОДЕРЖАНИЕ СЕРОТОНИНА В РАЗЛИЧНЫХ СТРУКТУРАХ МОЗГА УСУБМИССИВНЫХ МЫШЕЙ ЛИНИИ C57BL/6J НА 10-й И 20-й ДНИ
ТЕСТИРОВАНИЯ КОНФРОНТАЦИЙ
500
хо
400
хо
300
х
200
100
0
ФК
МК
Гипп
Ядра шва
А11
А10
ПЯ
А9
Хв.ядро
Гипот
Светлые столбики - 10 дневное, темные столбики - 20 дневное
тестирование конфронтаций. За 100% принято содержание серотонина в
контроле (интактные животные). ФК - фронтальная кора, МК миндалевидный комплекс, Гипп - гиппокамп, ПЯ - прилежащее ядро,
Хв.ядро - хвостатое ядро, Гипот - гипоталамус, А11, А10, А9 дофаминергические ядра. х P<0,001 по сравнению с контролем; о P<0,001
между группами мышей с 10-ти и 20-ти дневным тестированием
конфронтаций
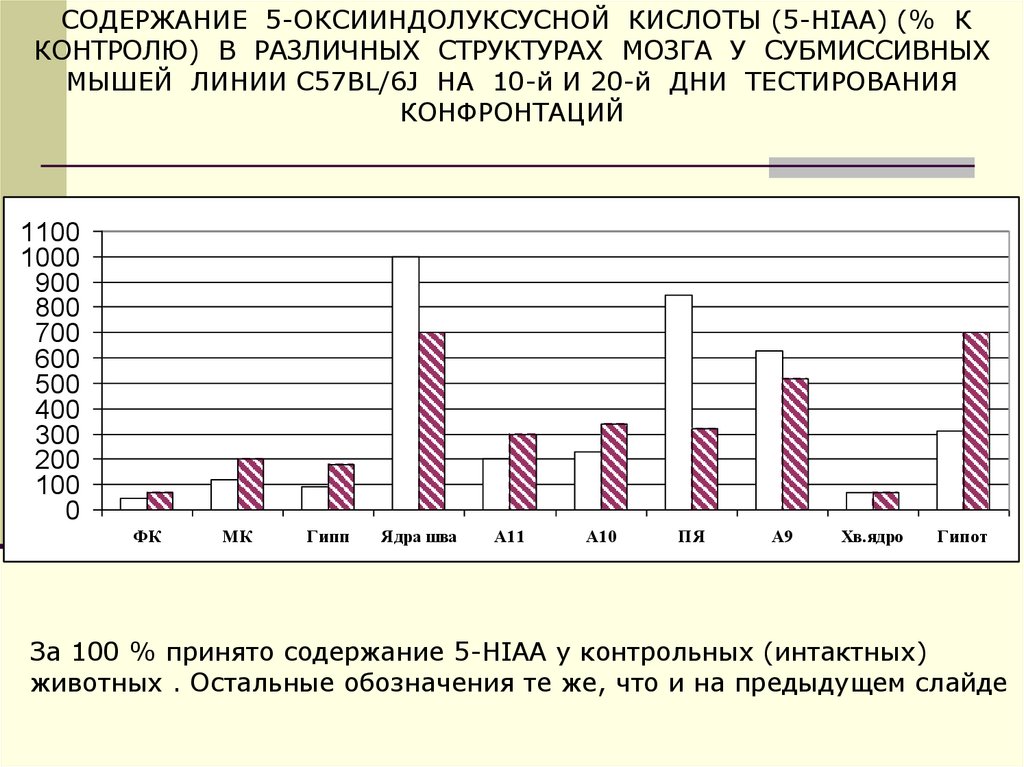
42.
СОДЕРЖАНИЕ 5-ОКСИИНДОЛУКСУСНОЙ КИСЛОТЫ (5-HIAA) (% ККОНТРОЛЮ) В РАЗЛИЧНЫХ СТРУКТУРАХ МОЗГА У СУБМИССИВНЫХ
МЫШЕЙ ЛИНИИ C57BL/6J НА 10-й И 20-й ДНИ ТЕСТИРОВАНИЯ
КОНФРОНТАЦИЙ
1100
1000
900
800
700
600
500
400
300
200
100
0
ФК
МК
Гипп
Ядра шва
А11
А10
ПЯ
А9
Хв.ядро
Гипот
За 100 % принято содержание 5-HIAA у контрольных (интактных)
животных . Остальные обозначения те же, что и на предыдущем слайде
43.
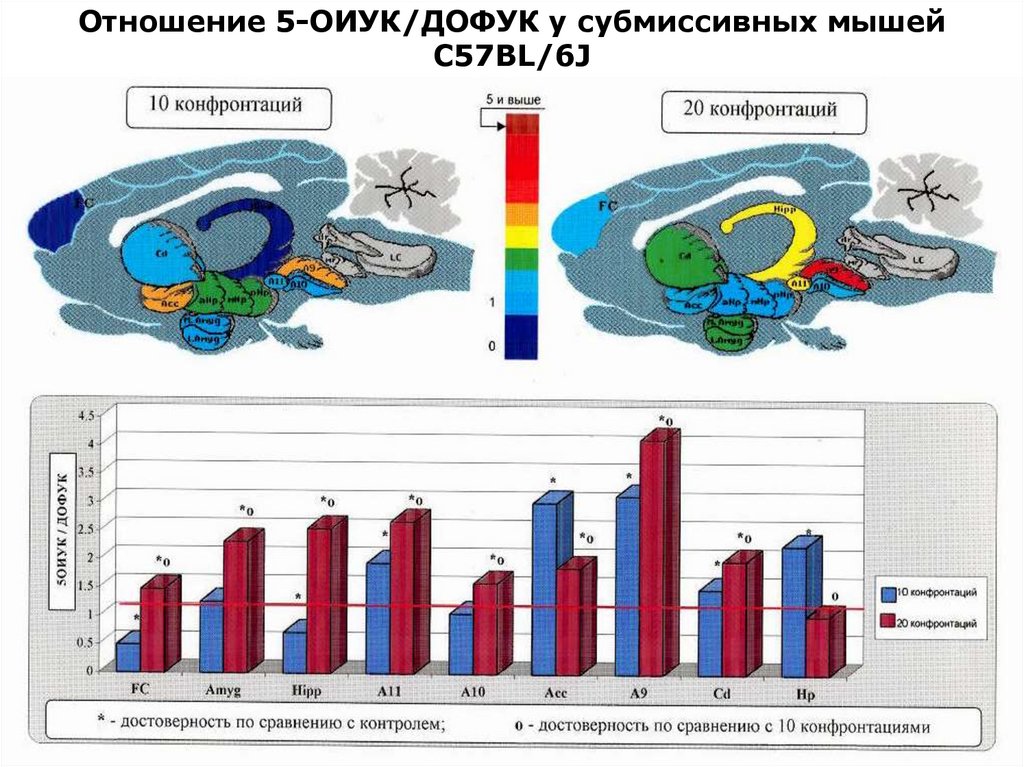
Отношение 5-ОИУК/ДОФУК у субмиссивных мышейС57BL/6J
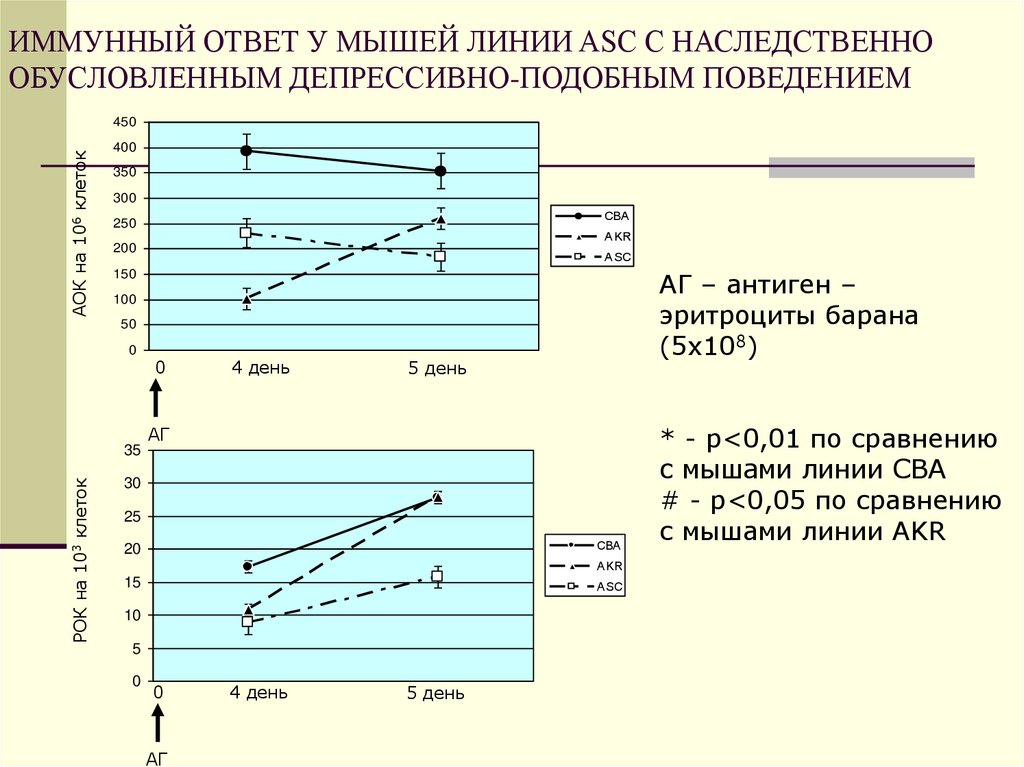
44. ИММУННЫЙ ОТВЕТ У МЫШЕЙ ЛИНИИ ASC С НАСЛЕДСТВЕННО ОБУСЛОВЛЕННЫМ ДЕПРЕССИВНО-ПОДОБНЫМ ПОВЕДЕНИЕМ
АОК на 106 клеток450
400
350
300
СВА
250
AKR
200
ASC
АГ – антиген –
эритроциты барана
(5х108)
150
100
50
0
0
4 день
5 день
АГ
РОК на 103 клеток
35
30
25
СВА
20
AKR
15
ASC
10
5
0
0
АГ
4 день
5 день
* - р<0,01 по сравнению
с мышами линии СВА
# - р<0,05 по сравнению
с мышами линии AKR
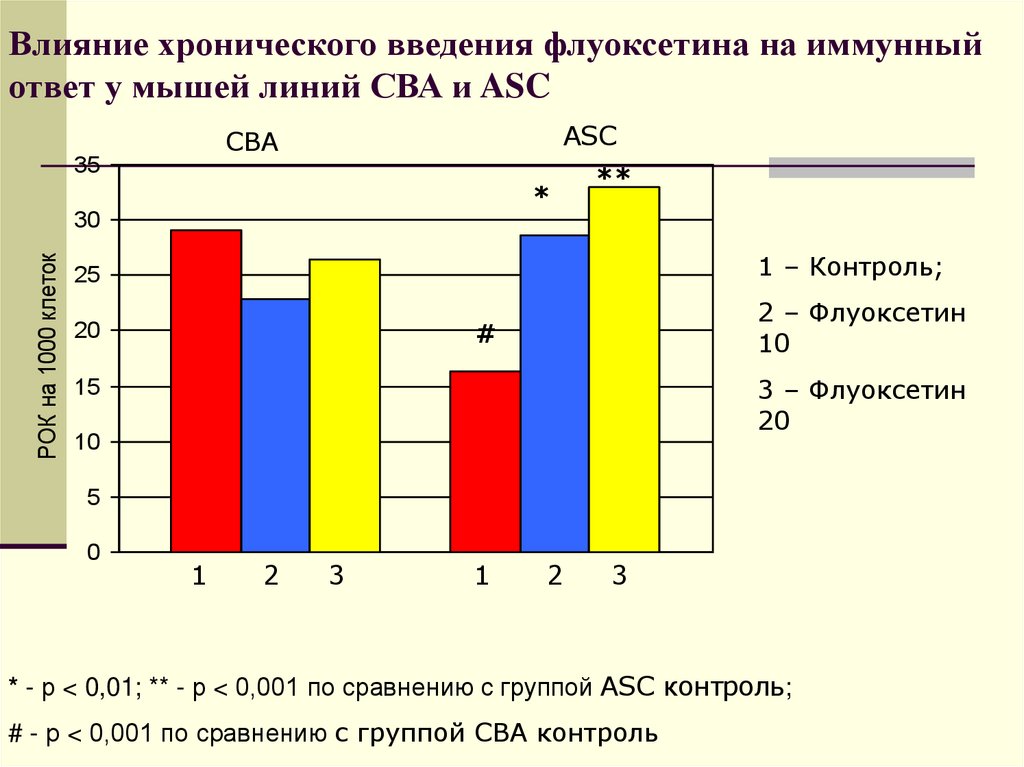
45. Влияние хронического введения флуоксетина на иммунный ответ у мышей линий СВА и ASC
ASCСВА
35
*
РОК на 1000 клеток
30
**
25
1 – Контроль;
20
2 – Флуоксетин
10
#
3 – Флуоксетин
20
15
10
5
0
1
2
3
1
2
3
* - р < 0,01; ** - р < 0,001 по сравнению с группой ASC контроль;
# - р < 0,001 по сравнению с группой СВА контроль
46. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (иммобилизационный стресс)
3025
20
СВА
С57BL/6J
2-2,5 месяца
15
2-2,5 года
*
*
10
*
5
0
К
стресс
АОК на 106 клеток
300
К
К стресс
стресс
СВА
С57BL/6J
250
200
*
150
100
*
К
стресс стресс
+ПХФА
К
* - р < 0,001 по
сравнению с
контролем;
# - р < 0,001 по
сравнению со
стрессированными
животными
#
50
0
#
стресс стресс
+ПХФА
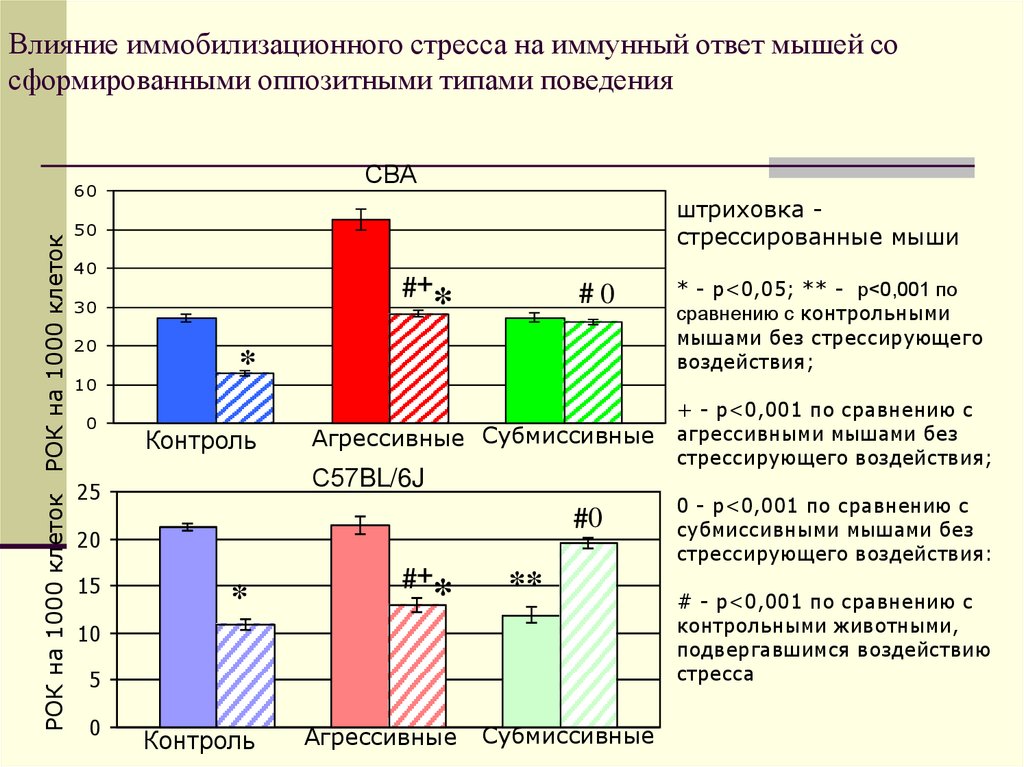
47. Влияние иммобилизационного стресса на иммунный ответ мышей со сформированными оппозитными типами поведения
СВАштриховка стрессированные мыши
50
40
*+#
30
20
10
0
#0
*
Контроль
Агрессивные Субмиссивные
С57BL/6J
25
0#
20
15
*
*+#
РОК на 1000 клеток РОК на 1000 клеток
60
**
10
5
0
Контроль
Агрессивные
Субмиссивные
* - р<0,05; ** - р<0,001 по
сравнению с контрольными
мышами без стрессирующего
воздействия;
+ - р<0,001 по сравнению с
агрессивными мышами без
стрессирующего воздействия;
0 - р<0,001 по сравнению с
субмиссивными мышами без
стрессирующего воздействия:
# - р<0,001 по сравнению с
контрольными животными,
подвергавшимся воздействию
стресса
48. Влияние активации и блокады постсинаптических 5-НТ1А и 5-НТ2А рецепторов на число АОК у мышей с оппозитными формами поведения
700600
500
400
8-ОН-DPAT, 1,0 мг/кг
800
700
WAY-100635, 1,0 мг/кг
##
600
*
500
5-НТ1А
рецепторы
400
300
**
200
200
100
100
0
0
700
1200
600
500
400
**
300
DOI, 1,0
мг/кг
*
300
200
1000
800
*
*
Кетансерин, 1,0 мг/кг
#
**
600
400
100
200
0
0
**
5-НТ2А
рецепторы
агрессивные
субмиссивные
субмиссивны
*-р < 0,05, **-р < 0,001 е
по сравнению с агрессивным мышами без введения препарата;
агрессивные
#-р < 0,01,##-р <0,001 по сравнению с субмиссивными мышами без введения препарата
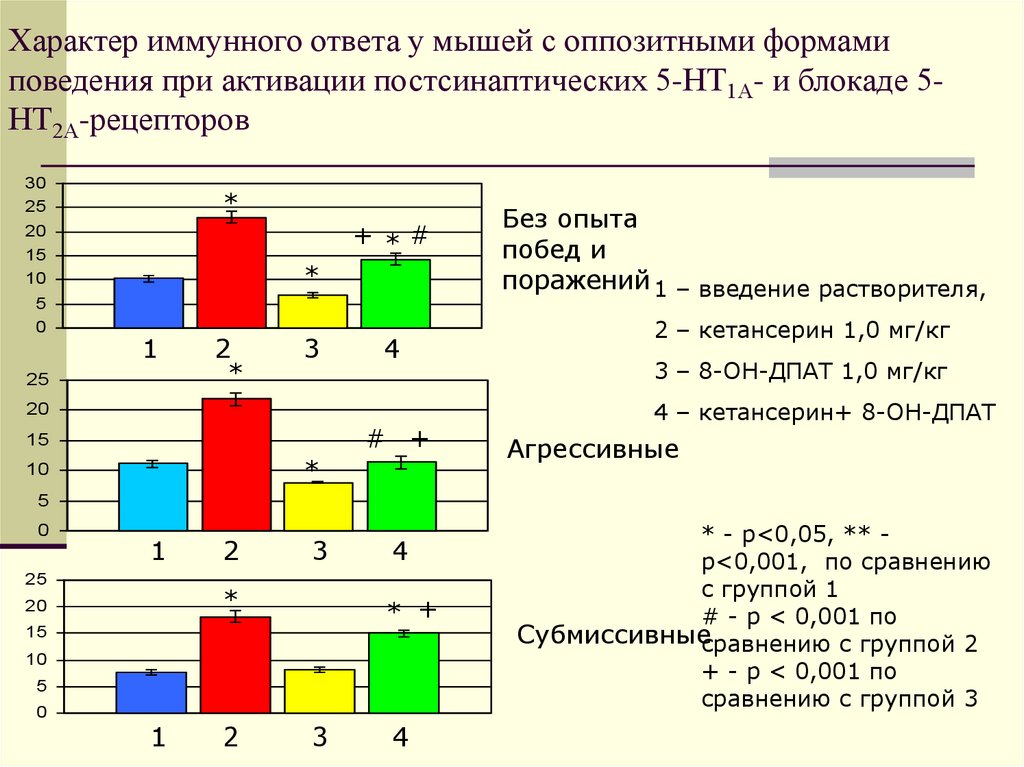
49. Характер иммунного ответа у мышей с оппозитными формами поведения при активации постсинаптических 5-НТ1А- и блокаде
5НТ2А-рецепторов30
25
*
+ *#
20
15
10
*
5
0
1
25
2
*
3
4
20
# +
15
*
10
Без опыта
побед и
поражений 1 – введение растворителя,
2 – кетансерин 1,0 мг/кг
3 – 8-ОН-ДПАТ 1,0 мг/кг
4 – кетансерин+ 8-ОН-ДПАТ
Агрессивные
5
0
1
25
2
3
*
20
4
* +
15
10
5
0
1
2
3
4
* - р<0,05, ** р<0,001, по сравнению
с группой 1
# - p < 0,001 по
Субмиссивныесравнению с группой 2
+ - р < 0,001 по
сравнению с группой 3















 Химия
Химия








