Похожие презентации:
Методы анализа стабильных изотопов
1. Методы анализа стабильных изотопов
Масс-спектрометрический анализМасс- спектрометрия включает в себя методы разделения в
пространстве или времени ионов с различным отношением
массы к заряду при прохождении ими электрического или
магнитного полей в условиях высокого вакуума.
Масс-спектр при любых, но определенных условиях ионизации,
является молекулярной константой, которая может быть
использована для идентификации химических соединений, для
количественного и качественного анализа.
2.
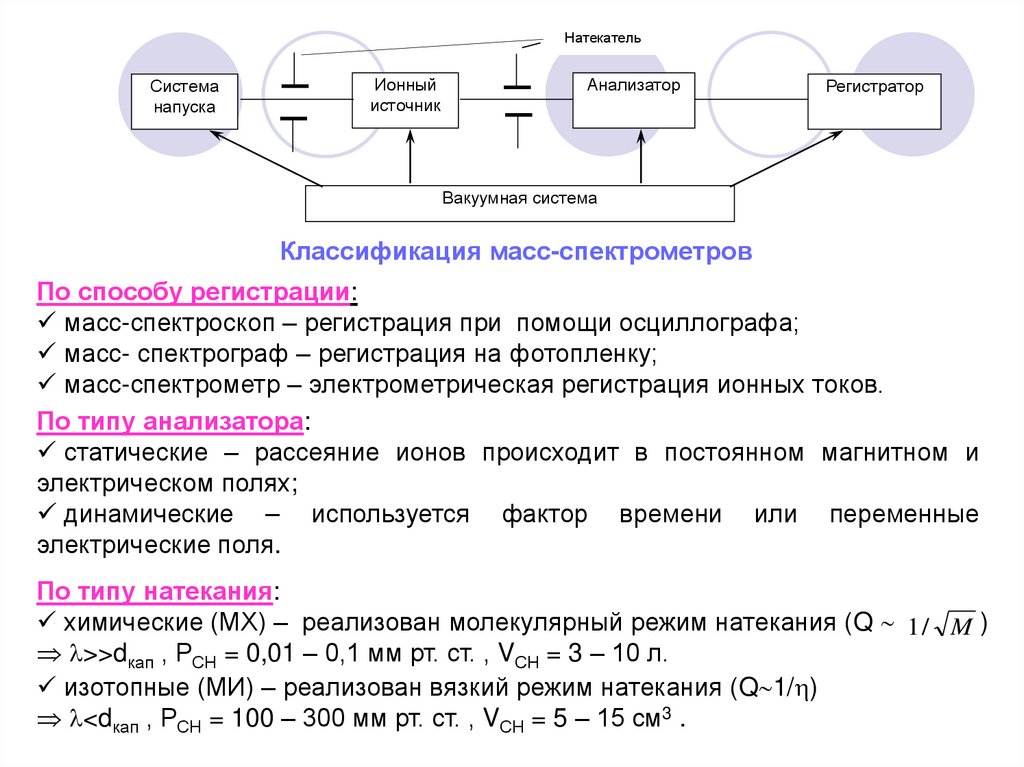
НатекательСистема
напуска
Ионный
источник
Анализатор
Регистратор
Вакуумная система
Классификация масс-спектрометров
По способу регистрации:
масс-спектроскоп – регистрация при помощи осциллографа;
масс- спектрограф – регистрация на фотопленку;
масс-спектрометр – электрометрическая регистрация ионных токов.
По типу анализатора:
статические – рассеяние ионов происходит в постоянном магнитном и
электрическом полях;
динамические – используется фактор времени или переменные
электрические поля.
По типу натекания:
химические (МХ) – реализован молекулярный режим натекания (Q 1 / M )
>>dкап , РСН = 0,01 – 0,1 мм рт. ст. , VСН = 3 – 10 л.
изотопные (МИ) – реализован вязкий режим натекания (Q 1/ )
<dкап , РСН = 100 – 300 мм рт. ст. , VСН = 5 – 15 см3 .
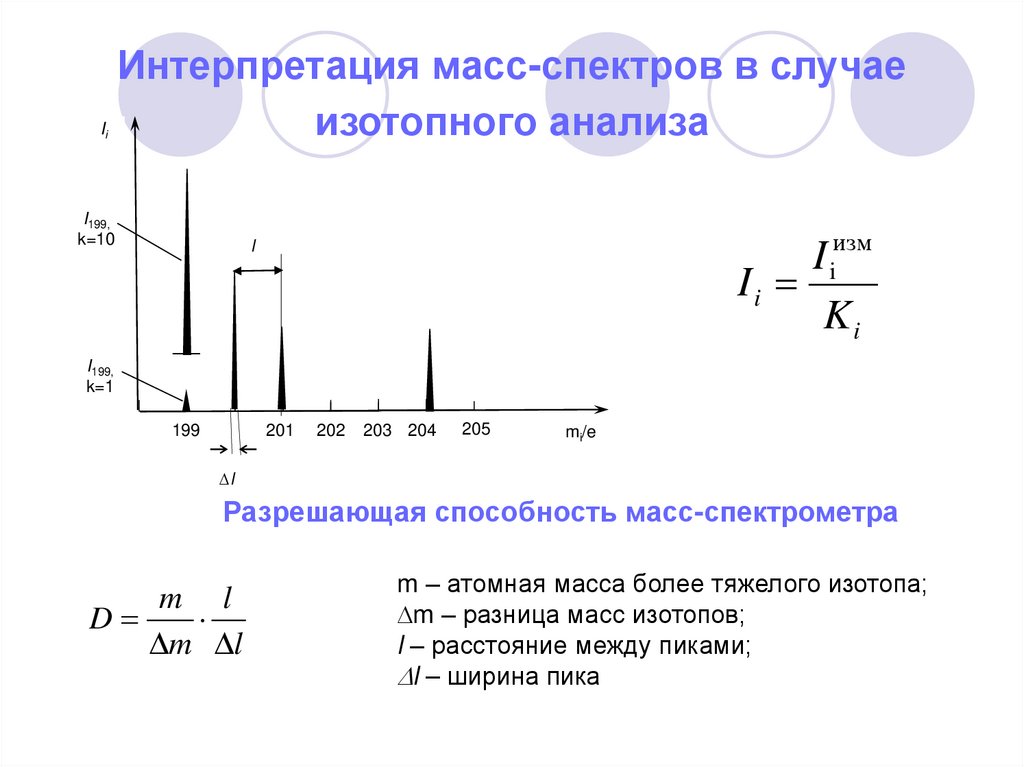
3. Интерпретация масс-спектров в случае изотопного анализа
IiИнтерпретация масс-спектров в случае
изотопного анализа
I199,
k=10
I iизм
Ii
Ki
l
I199,
k=1
199
201
202
203 204
205
mi/e
l
Разрешающая способность масс-спектрометра
m l
D
m l
m – атомная масса более тяжелого изотопа;
m – разница масс изотопов;
l – расстояние между пиками;
l – ширина пика
4. Изотопный анализ по пикам атомарных ионов
Метод часто используется для определения разрешающей способностимасс-спектрометра.
Ртуть имеет 7 изотопов с атомными массами:
М=196, 198, 199, 200, 201, 202, 204.
Hg I
200
I 200
I
200
7
196 I 198 I 199 I 200 I 201 I 202 I 204
Ii
i 1
Если элемент имеет только 2 изотопа, то обычно определяют
относительную интенсивность ионных токов (R).
Пример: Литий имеет два изотопа – 6Li и 7Li.
I7
R
I6
Li I I I
6
6
6
7
1
1 R
5. Изотопный анализ по пикам молекулярных ионов
Для многоатомных молекул полезно сначала теоретически определитьраспределение изотопов в молекулах. В большинстве случаев при этом
принимается равновероятностное распределение.
Квазиатомарный случай
Молекула содержит один атом определяемого элемента.
В качестве противоиона удобно выбирать моноизотопный элемент – F или I
Пример 1. Определение изотопного состава германия ионам GeF4+
F Ar = 19
GeF4+ М= 146, 148, 149, 150, 152.
Ge Ar = 70, 72, 73, 74,76
Ge I
73
I149
100( ат.% )
146 I148 I149 I150 I152
6.
Пример 2. Определить изотопный состав углерода, используяаналитическую форму СО.
Массовые числа 12СО и 13СО равны 28 и 29, тогда
I
I 29
1
13
R 28
C
I 29
I 28 I 29 1 R
НО : В природе [16 O] = 99,763 ат.%,
Изотопная
форма
12С16О
Молярная масса
28
[17 O] = 0,037 ат.% , [18 O] = 0,2 ат.%.
13С16О
12С17О
13С17О
29
'
''
I 29 I 29
I
(13 C 16O )
29(12 C 17O )
12С18О
13С18О
30
31
Если для окисления углерода использовали природный кислород, то
I 29 I
'
29(13 С16O )
I 28 0.00037
C
13
'
I 29
'
I 28 I 29
1
I 28
'
I 29
1
1
I 28
I 29 0,00037 I 28
1
7.
Можно ли наблюдать раздельно масс-спектрометрические пики12С17 О и 13С16О?
масса электрона:
масса протона:
масса нейтрона:
me = 5,485799 10-4 а.е.м.
mp = 1,007276 а.е.м.
mn = 1,008665 а.е.м.
12С17О:
е= 6+8=14;
р= 6+8=14;
n= 6+9=15
13С16О:
е= 6+8=14;
р= 6+8=14;
n= 7+8=15
m = 0
m
D
m
Пики 12С17 О и 13С16О
разрешить нельзя!
8. Двухатомные молекулы
В молекуле содержится два стабильных изотопаПример: Изотопный анализ азота по ионам N2+:
У азота есть два стабильных изотопа 14 N и 15 N (в природе [15 N] 0,36 ат.%) .
N2
14
N14 N (М=28), 14 N15N (М=29) и 15 N15 N (М=30)
1
I I
30 2 29
15 N
I I I
28 29 30
В области малых концентраций [15N] 0, то I30 0
I 28
R
I 29
1
1
I
1
2
15 N 2 29
I I
I
28 1 2 R 2
28
29
I
29
9.
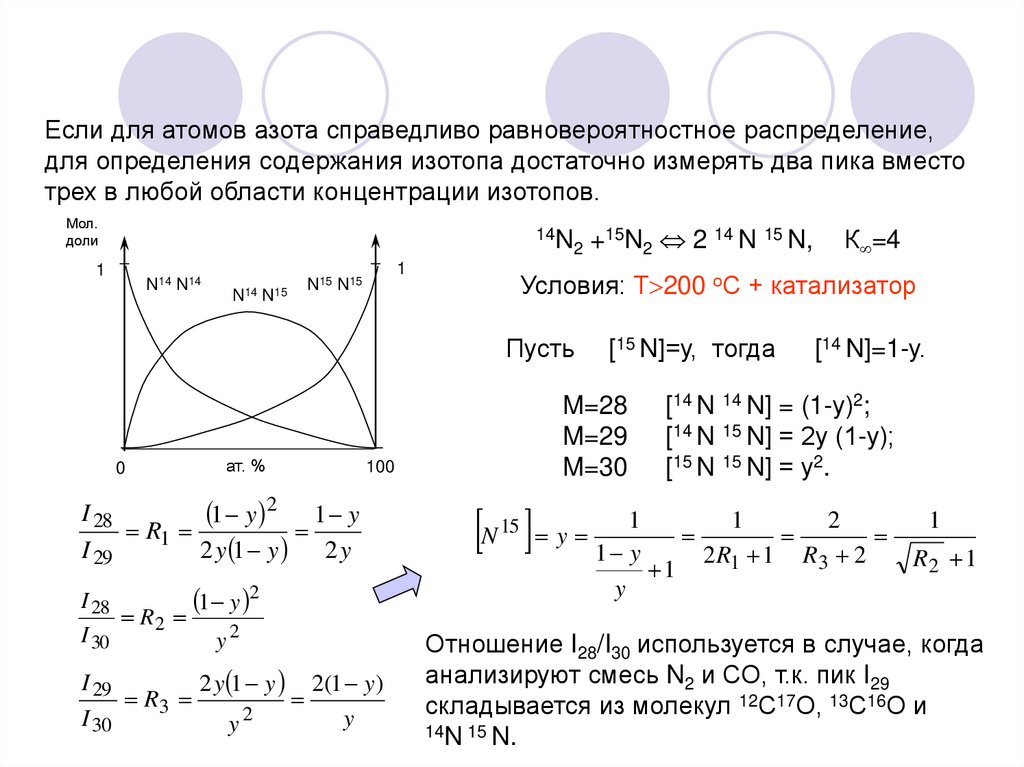
Если для атомов азота справедливо равновероятностное распределение,для определения содержания изотопа достаточно измерять два пика вместо
трех в любой области концентрации изотопов.
Мол.
доли
14N
2
1
N14 N14
N14 N15
1
N15 N15
ат. %
I 28
1 y 2
R2
I 30
y2
I 29
2 y 1 y 2(1 y )
R3
2
I 30
y
y
[15 N]=у, тогда
M=28
M=29
M=30
100
I 28
1 y 2 1 y
R1
I 29
2 y 1 y 2 y
К =4
Условия: Т 200 оС + катализатор
Пусть
0
+15N2 2 14 N 15 N,
N y 1 1y
[14 N 14 N] = (1-у)2;
[14 N 15 N] = 2у (1-у);
[15 N 15 N] = у2.
15
y
[14 N]=1-у.
1
1
2
2 R1 1 R3 2
1
R2 1
Отношение I28/I30 используется в случае, когда
анализируют смесь N2 и СО, т.к. пик I29
складывается из молекул 12С17О, 13С16О и
14N 15 N.
10. В молекуле содержится более двух стабильных изотопов
Пример: Изотопный анализ кислорода по ионам О2+:В природе у кислорода 3 стабильных изотопа: 16О, 17О, 18О:
I32
16О16О
O
18
I33
16О17О
I34
16О18О+ 17О17О
'
0,5 I 34
0,5I 35 I 36
I 32 I 33 I 34 I 35 I 36
I35
17О18О
I36
18 О18О
где I34’ – доля пика I34 за счет молекул 16О18О
Т.к. (16О-18О)> (16О-17О) и [17 O]прир=0,037 ат.% < [18 O]прир=0,2 ат.%
[17 O2] 0
В области малых концентраций 18О
0,5 I
0,5I
34
34
I I I 16 17
I I
33 34 O O 0 32
34
O2 0 32
O18
17
11.
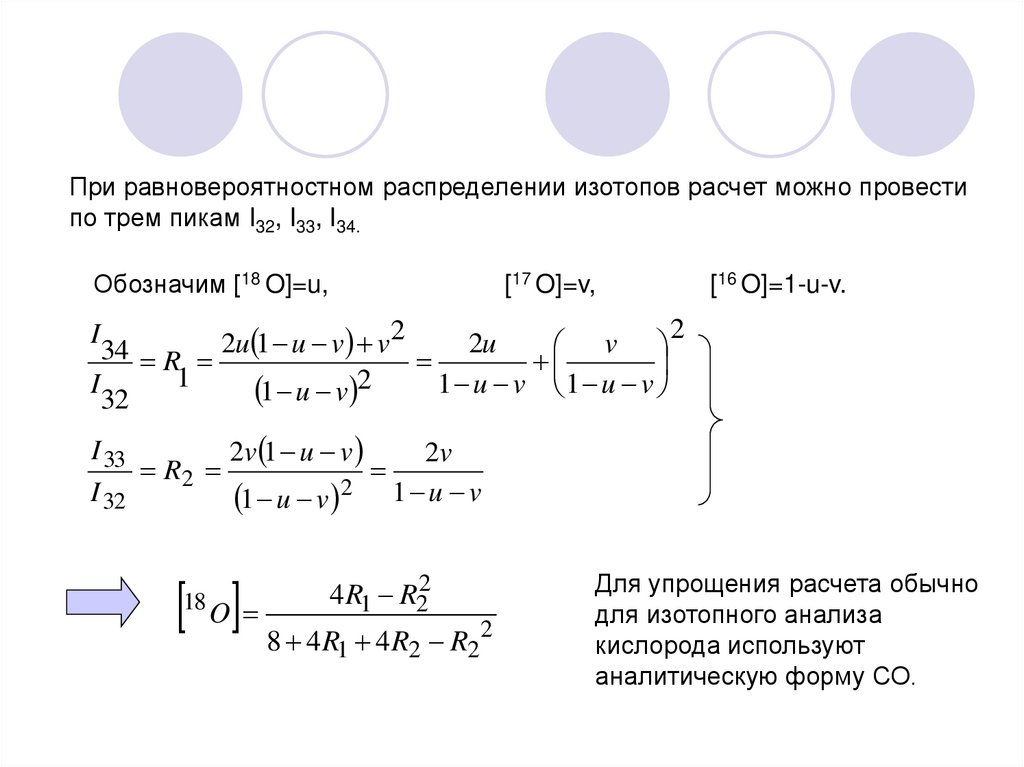
При равновероятностном распределении изотопов расчет можно провестипо трем пикам I32, I33, I34.
Обозначим [18 O]=u,
[17 O]=v,
2
2
u
1
u
v
v
2u
v
34 R
1
2
I
1 u v 1 u v
1 u v
32
I
[16 O]=1-u-v.
2
I 33
2v 1 u v
2v
R2
I 32
1 u v 2 1 u v
O 8 4R 4R
18
4 R1 R22
1
2
R
2
2
Для упрощения расчета обычно
для изотопного анализа
кислорода используют
аналитическую форму СО.
12. Многоатомные молекулы
При изотопном анализе многоатомных молекул, число измеренийионных токов всегда больше числа изотопов элемента
Пример: Определение состава 37Cl по анализируемой форме CCl4+
Хлор имеет два стабильных изотопа – 35Cl и 3Cl, углерод – 12C и 13 С.
Для упрощения примем, что [13С]=0, тогда
Изотопная форма
12C35Cl +
4
Масса иона
152
12C35Cl 37Cl + 12C35Cl 37Cl + 12C35Cl37Cl + 12C37Cl +
3
2
2
3
4
154
156
Полная формула:
1
1
3
I
I
I
I
37 Cl 4 154 2 156 4 158 160
I
I
I
I
I
152 154 156 158 160
158
160
13.
При равновероятностном распределении изотопов[37Cl] = x;
[35Cl] = 1- x.
I152 = [C35Cl4] = (1 – x)4;
I154 = [C35Cl337Cl] = 4x(1 – x)3;
I156 = [C35Cl237Cl2] = 6x2(1 – x)2;
I158 = [C35Cl37Cl3] = 4x3(1 – x);
I160 = [C37Cl4] = x4
Cl R 1 x 4x 1 x
1 x
x
Cl
35
37
3
4 I 152 6 I 152 3 4 I 152 4
4
I 154
I 156
I 158
I 152
3 I
154
I 160
2 I 156
I 154
1 I 154
2 I
1 I 156
1 I 158
3
156
I 158
4 I 160
3 I 158
6 I 160
4 I 160
Далее из материального баланса [37Cl] +[35Cl] = 1, определяют нужную
концентрацию.