Похожие презентации:
Строение атома и химическая связь
1. Строение атома и химическая связь
2. Квантовая механика
Квантовая механика – система понятий иуравнений, которые применяются для описания
элементарных частиц, ядер, атомов, молекул.
Составными частями квантовой механики являются:
1) корпускулярно-волновой дуализм;
2) принцип неопределенности;
3) волновое управление.
3. Корпускулярно-волновой дуализм
В 1924 г. французский физик Луи де Бройльвысказал предположение:
«Любая движущаяся частица одновременно
обладает и механическими и волновыми
свойствами».
Предположение де Бройля подтвердилось
экспериментально
на
явлении
дифракции
электронов и нашло применение в электронных
микроскопах.
4. Корпускулярно-волновой дуализм
Эта зависимость выражается уравнением:,
где – длина волны;
h – постоянная Планка, 6,6·10 -34 Дж·с;
m – масса частицы (электрона);
ν – скорость частицы.
5. Принцип неопределенности
В 1925 г. немецкий физик В. Гейзенбергвысказал положение:
«Для микрочастицы атомного масштаба
невозможно одновременно и точно указать
координату и скорость ее движения».
6. Принцип неопределенности
Математическое выражение этого положения:,
где ∆q – неопределенность координат, или положения в
пространстве;
∆p – неопределенность импульса,
p = m·V, где m – масса, V – скорость;
h – постоянная Планка,
ћ – приведенная постоянная Планка.
7. Принцип неопределенности
Из принципа неопределенности следует двавывода:
1) Невозможно точно представить траекторию
движения электрона в атоме;
2) Электрон в атоме нельзя рассматривать с
математической точностью.
Можно
лишь
вычислить
вероятность
пребывания
электрона в околоядерном
пространстве.
8. Волновое уравнение
В 1926 г. австрийский ученый Э. Шредингер предложилуравнение с помощью которого вычисляют вероятность
нахождения электрона в атоме:
,
9. Волновое уравнение
гдесумма вторых производных
волновой функции (пси) ;
m – масса электрона;
h – постоянная Планка;
E – полная энергия электрона;
U – потенциальная энергия электрона
– функция координат x, y, z, называемая волновой функцией
(орбиталью) и является основной характеристикой электрона в
атоме.
10. Квантово-механическая модель атома
• Квантово-механическая модель атома – этовоображаемый вид атома, созданный на основе
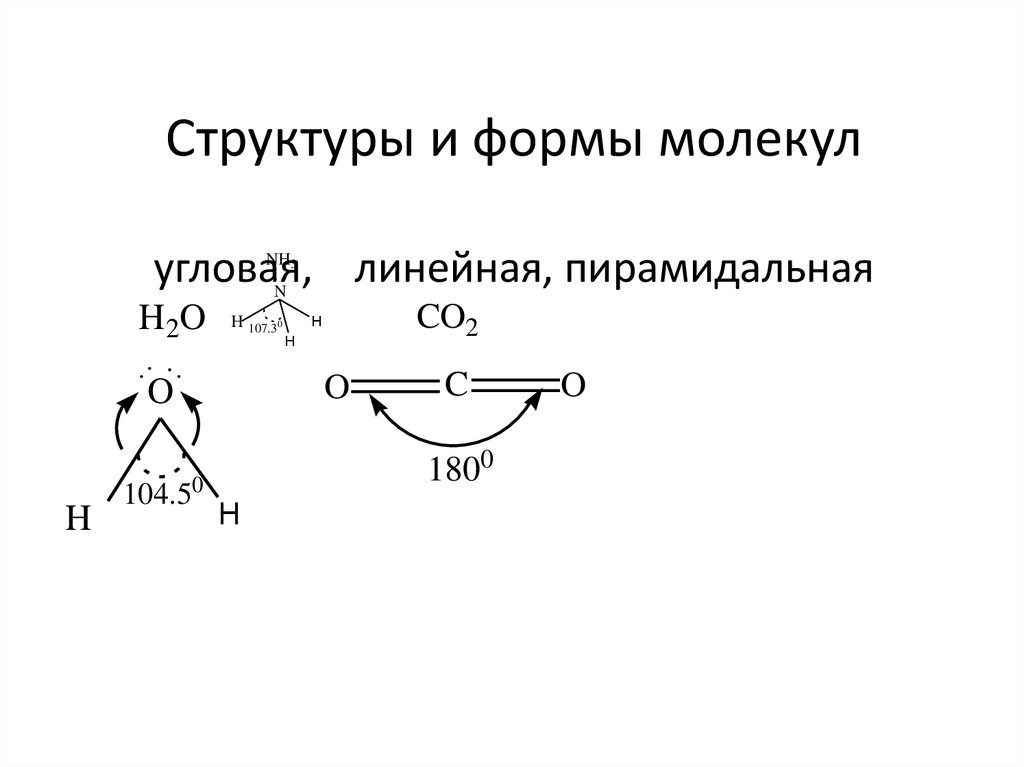
положений квантовой механики.
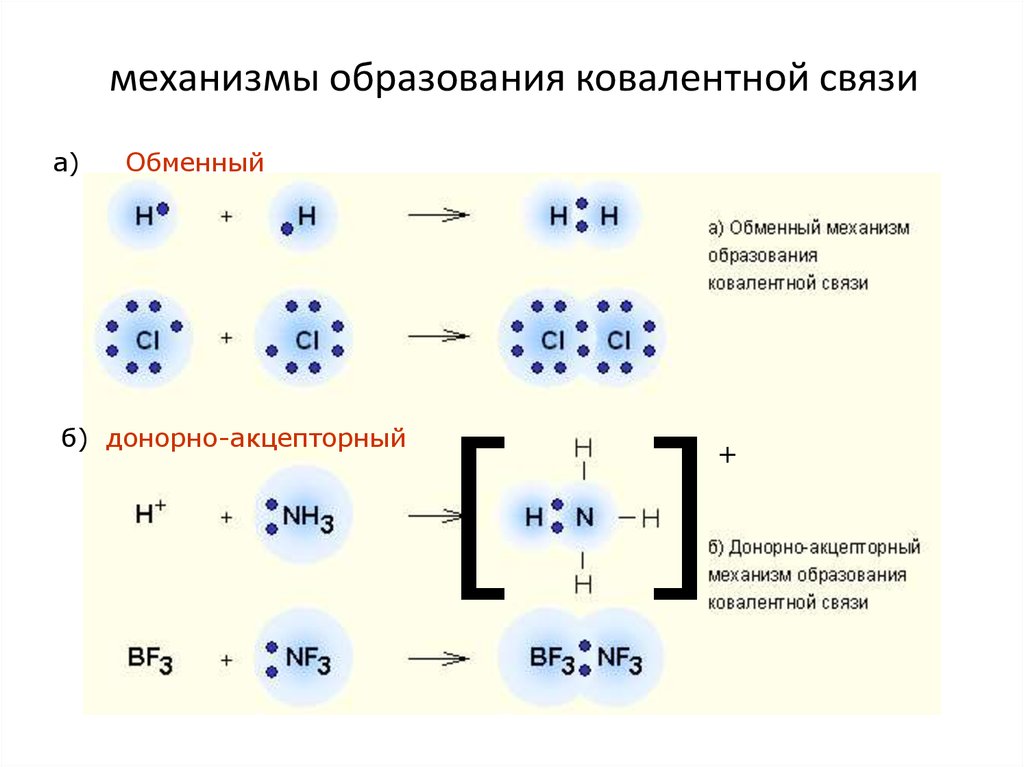
• Электронное облако – это околоядерное
пространство, в котором вероятность пребывания
электрона максимальна.
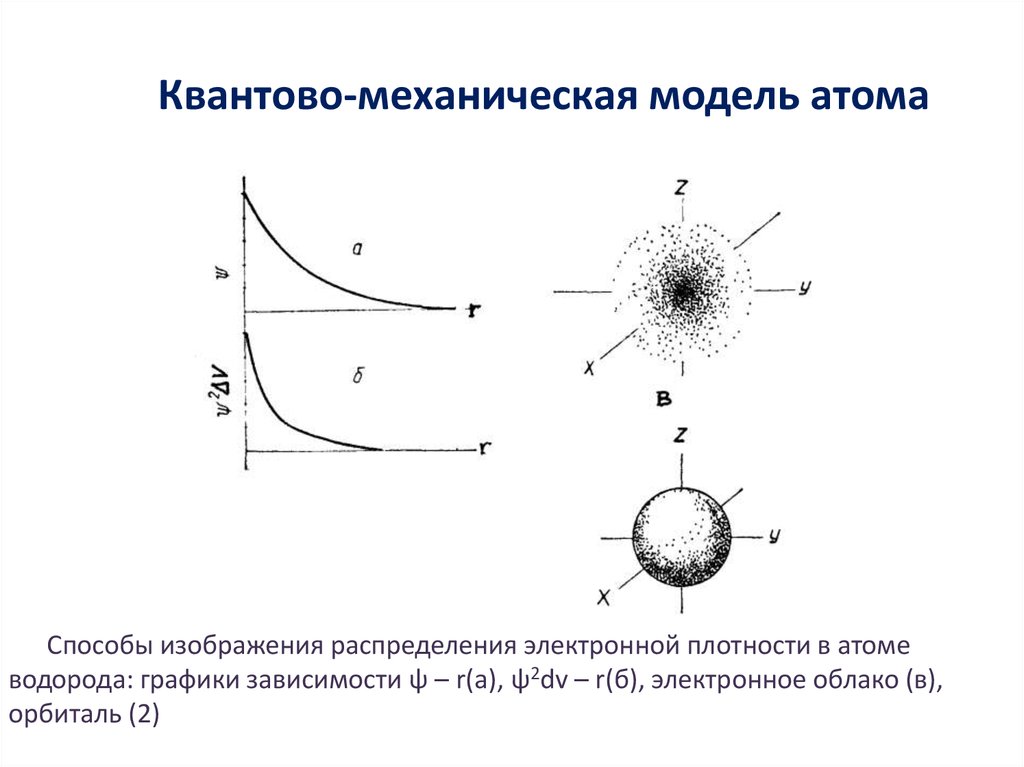
11. Квантово-механическая модель атома
Способы изображения распределения электронной плотности в атомеводорода: графики зависимости ψ – r(a), ψ2dv – r(б), электронное облако (в),
орбиталь (2)
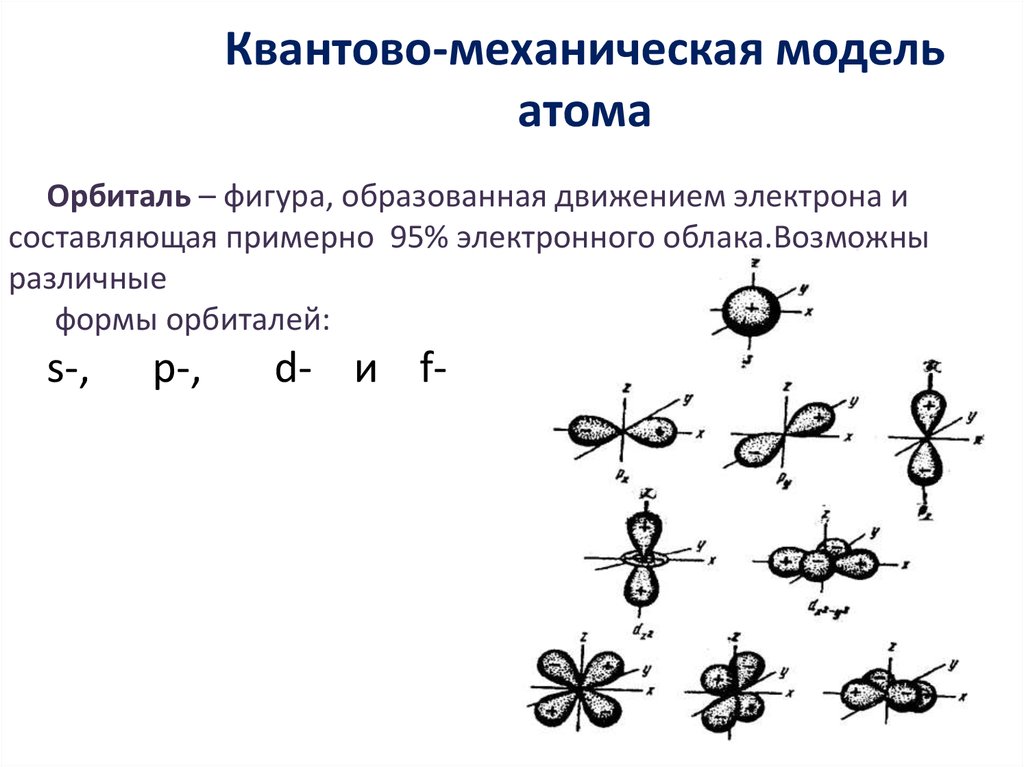
12. Квантово-механическая модель атома
Орбиталь – фигура, образованная движением электрона исоставляющая примерно 95% электронного облака.Возможны
различные
формы орбиталей:
s-,
p-,
d- и f-
13. Квантовые числа
Энергетическое состояние электрона вхарактеризуется четырьмя квантовыми числами;
n – главное,
ℓ - орбитальное,
m – магнитное,
s – спиновое.
атоме
Все эти числа характеризуют определенную энергию
электрона.
14. n - главное квантовое число
• определяет полный запас энергии электрона в размерэлектронной обитали.
• n принимает значения от 1 до 7 (стремится к ∞).
При n = 1 электрон находится на первом слое, при n= 2 - на
втором и т.д., т.е. n указывает номер электронного слоя
(уровня) и номер периода, в котором расположен элемент в
периодической системе элементов Д.И. Менделеева.
• В многоэлектронных атомах электроны с одинаковыми
значениями n образуют слой или уровень, обозначаемый
буквами K, L, M, N, O, P и Q. Буква K соответствует первому
уровню, L – второму и так далее.
15. l - побочное (орбитальное) квантовое число
• устанавливает уровень (подуровень) энергии иформу
обитали,
а
следовательно,
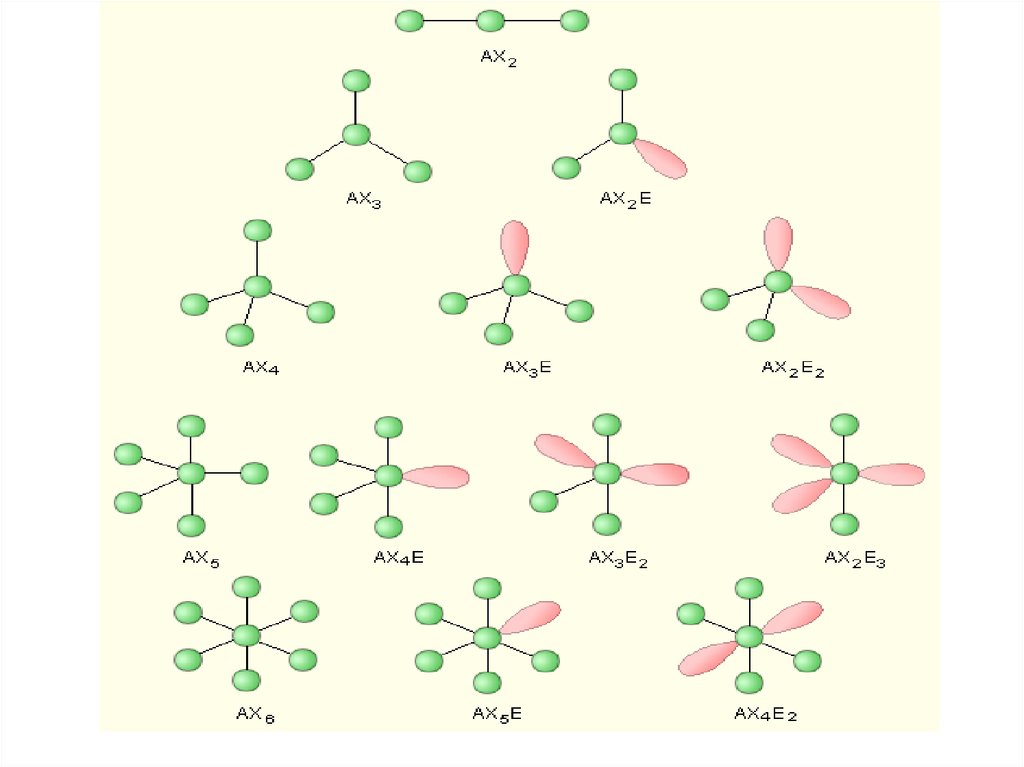
форму
электронного облака.
• принимает значения l =(n-1), численно равное
значению орбитального момента количества
движения электрона.
• Кроме числовых l имеет буквенные обозначения
l = 0 1 2 3 4…
l = s p d f g…
16. ml - магнитное квантовое число
Оно определяет пространственноерасположение атомной орбитали и принимает
целые значения
от –l до + l через нуль,
то есть всего в атоме может быть
-2l + 1 значений.
17.
Орбитальноеквантовое
число
Магнитное
квантовое число
Число
орбиталей
с данным
значением l
l
ml
2l + 1
0 (s)
0
1
1 (p)
–1, 0, +1
3
2 (d)
–2, –1, 0, +1, +2
5
3 (f)
–3, –2, –1, 0,+1+2, +3
,
7
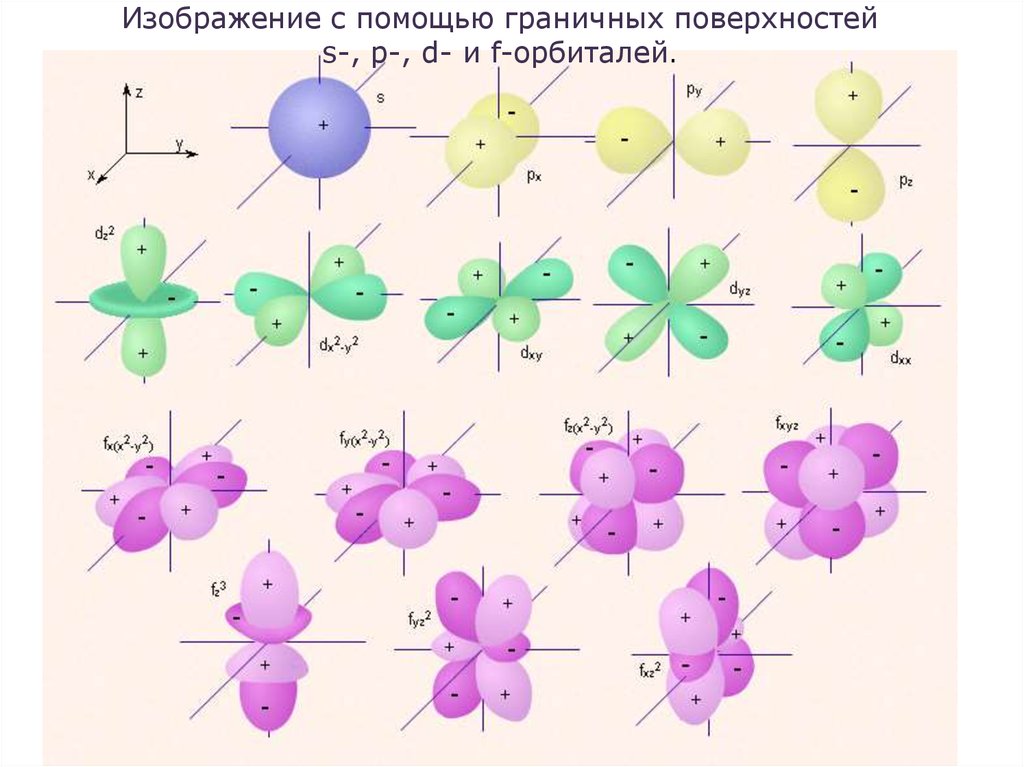
18.
Изображение с помощью граничных поверхностейs-, p-, d- и f-орбиталей.
19.
• s-Орбитали сферически симметричны длялюбого n и отличаются друг от друга только
размером
сферы.
Их
максимально
симметричная форма обусловлена тем, что
при l = 0 и ml = 0.
• p-Орбитали существуют при n ≥ 2 и l=1,
поэтому возможны три варианта ориентации в
пространстве: ml= –1, 0,+1.
• Все p-орбитали обладают узловой плоскостью,
делящей орбиталь на две области, поэтому
граничные
поверхности
имеют
форму
гантелей, ориентированных в пространстве под
углом 90° друг относительно друга. Осями
симметрии для них являются координатные
оси, которые обозначаются px, py, pz.
20.
• d-Орбитали определяются квантовым числом l = 2 (n≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть
характеризуются пятью вариантами ориентации в
пространстве.
d-Орбитали,
ориентированные
лопастями по осям координат, обозначаются dz² и dx²–
y², а ориентированные лопастями по биссектрисам
координатных углов – dxy, dyz, dxz. Называются
условно бабочкой.
• Семь f-орбиталей, соответствующих l = 3 (n ≥ 4),
изображаются в виде граничных поверхностей,
имеют сложную конфигурацию.
21. ms -спиновое квантовое число
ms -спиновое квантовое число• Экспериментально установленно, что электрон имеет
еще одно свойство – спин. Спиновое квантовое
число ms имеет только два значения ms = ±1/2,
определяет
собственный
момент
количества
движения электрона.
• Упрощенно спин можно представить как вращение
электрона вокруг собственной оси.
Электроны с разными ms обозначаются стрелками,
направленными вверх и
вниз .
22. Заполнение атомных орбиталей
23. Принцип наименьшей энергии
• При застройке атома каждый электрон размещаетсяна той обитали, которой соответствует минимальное
значение энергии, т.е. ближе расположенной к ядру
атома.
Принцип наименьшей энергии требует, чтобы
электроны заселяли АО в порядке увеличения
энергии электронов на этих орбиталях. Это отражает
общее правило – максимуму устойчивости системы
соответствует минимум ее энергии.
24. Принцип Паули
• В атоме не может быть двух электронов с одинаковымнабором всех четырех квантовых чисел, или данными
значениями квантовых чисел характеризуется только
один электрон.
• Отсюда: на S-уровне может быть не более двух, p- шести,
d- десяти, f- четырнадцати электронов.
• На каждом энергетическом слое должно быть 2n2 электронов.
25. Последовательность застройки электронной оболочки многоэлектронного атома подчиняется следующим эмпирическим правилам:
• при застройке на последнем слое не должно быть большевосьми электронов;
• застройка любого слоя начинается с S-уровне;
• р-уровни для элементов малых периодов периодической
системы застраиваются после S-уровней, а для элементов
больших периодов- после d-уровней предыдущего слоя;
• d-уровни предыдущего слоя застраиваются после Sорбиталей последнего энергетического слоя;
• f-уровни IV и V слоев застраиваются соответственно после
S-уровня VI и VII слоев.
26. Правило Хунда:
• суммарное спиновое число электронов данногоуровня должно быть максимальным.
Иными словами, орбитали данного уровня
заполняются сначала по одному, затем по второму
электрону. Поскольку основной запас энергии
электрона определяют квантовые числа n и l, то
последовательность застройки атомных орбиталей
определяется суммой n+l.
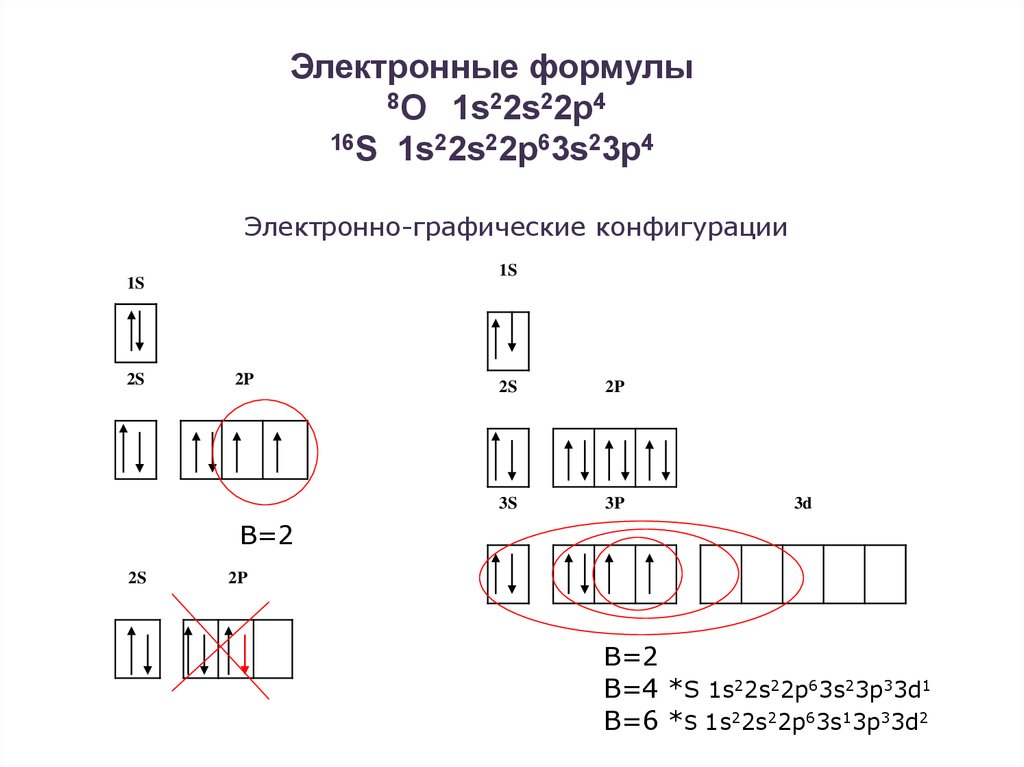
27.
Электронные формулы8О 1s22s22p4
16S 1s22s22p63s23p4
Электронно-графические конфигурации
1S
1S
2S
2P
2S
2P
3S
3P
3d
В=2
2S
2P
В=2
В=4 *S 1s22s22p63s23p33d1
В=6 *S 1s22s22p63s13p33d2
28. правилa Клечковского
1. Минимумом энергии обладают обитали снаименьшей суммой главного и побочного
квантовых чисел n+l.
• Сравним 4S-орбиталь и 3d-орбиталь
4S : n+l = 4+0 = 4,
3d : n+l = 3+2 = 5.
n 1 2 3 4
l 0 1 2 3
s p d f
В соответствии с 1 правилом Клечковского электроны в первую
очередь заполняют 4S, а потом 3d-орбиталь
29. правилa Клечковского
2. При одинаковых значениях суммы n+lменьшей энергией обладает орбиталь с
меньшем значением главного
квантового числа n, поэтому оно
заполняется раньше
• 3d: n+l =3+2=5,
• 4р: n+l =4+1=5,
т.к. сумма n+l в обоих случаях одинакова и равна 5,
то электроны заполняют вначале 3d орбиталь, для
которой главное квантовое число меньше.
30. Энергия атомных орбиталей возрастает согласно ряду
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d< 5p < 6s ≈ 4f ≈ 5d < 6p < 7s ≈ 5f ≈ 6d < 7p.
31. Периодическая система элементов
Исследуя изменение химических свойствэлементов в зависимости от величины их
относительной атомной массы (атомного веса), Д.
И. Менделеев в 1869 г. открыл закон
периодичности этих свойств:
• «Свойства элементов, а потому и
свойства образуемых ими простых и
сложных тел состоят в периодической
зависимости от величины атомных
весов элементов».
32.
• Физическая основа периодического закона былаустановлена в 1922 г. Н. Бором. Поскольку химические
свойства обусловлены строением электронных оболочек
атома, периодическая система Менделеева – это
естественная классификация элементов по электронным
структурам их атомов. Простейшая основа такой
классификации – число электронов в нейтральном атоме,
которое равно заряду ядра. Но при образовании химической
связи электроны могут перераспределяться между атомами,
а заряд ядра остается неизменным, поэтому современная
формулировка периодического закона гласит:
«Свойства элементов находятся в периодической
зависимости от зарядов ядер их атомов».
33.
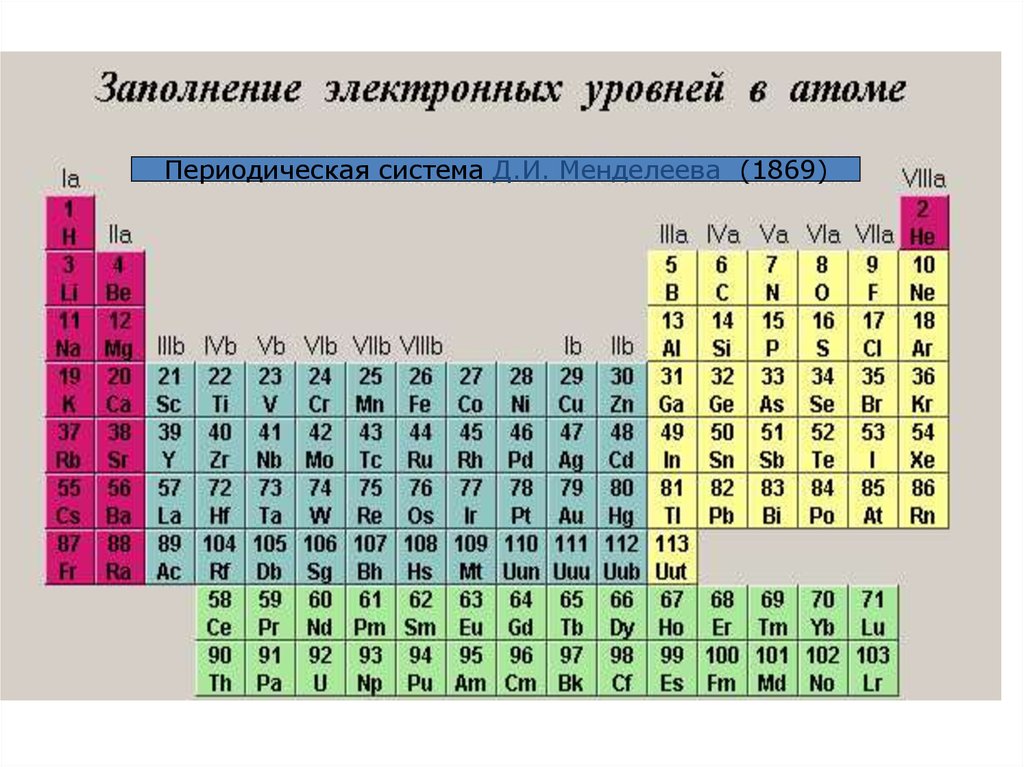
Периодическая система Д.И. Менделеева (1869)34.
• периодическая система состоит из горизонтальных ивертикальных рядов – периодов и групп.
• Период
–
горизонтальный
ряд,
имеющий
одинаковое число электронных слоев, номер
периода совпадает со значением главного
квантового числа n внешнего уровня (слоя);
• таких периодов в периодической системе семь.
• Второй и последующие периоды начинаются
щелочным элементом (ns1) и заканчивается
благородным газом(ns2np6).
35.
• По вертикали периодическая системаподразделяется на восемь групп, которые делятся
на главные – А – состоящие из s- и p-элементов, и
побочные – B-подгруппы, содержащие dэлементы.
• III B-подгруппа, кроме d-элементов, содержит по
14 4f- и 5f-элементов (4f- и 5f-семейства).
• Главные подгруппы содержат на внешнем
электронном слое одинаковое число электронов,
которое равно номеру группы
36.
• В главных подгруппах валентные электроны(электроны, способные образовывать
химические связи) расположены на s- и pорбиталях внешнего энергетического
уровня, в побочных – на s-орбиталях
внешнего и d-орбиталях предвнешнего
слоя.
• Для f-элементов валентными являются (n –
2)f, (n – 1)d- и ns-электроны.
37.
• Первый период (n = 1, l = 0) состоит из двухэлементов H (1s1) и He (1s2).
• Во втором периоде (n = 2, l = 0, 1) заполняются sи p-орбитали от Li до Ne. Элементы называются
соответственно s- и p-элементами.
• В третьем периоде появляются пять d-орбиталей
(n = 3, l = 0, 1, 2). Пока они вакантны и третий
период, как и второй, содержит восемь элементов
от Na до Ar.
38.
• четвертый период. Следующие за Ar калий и кальцийимеют внешним 4s-электроны. Появление 4sэлектронов при наличии свободных 3d-орбиталей
обусловлено экранированием ядра плотным 3s23p6электронным слоем. В связи с отталкиванием от этого
слоя внешних электронов для калия и кальция
реализуются [Ar]4s1- и [Ar]4s2-состояния. Сходство K и
Ca с Na и Mg соответственно, кроме чисто
«химического» обоснования, подтверждается также
электронными спектрами, называются электронными
аналогами.
39.
• Начиная со скандия (Z = 21) заполняется 3d-орбиталь, а вовнешнем слое остаются 4s-электроны.
• в четвертом периоде в ряду от Sc до Zn - десять 3dэлементов – переходные металлы с низшей степенью
окисления, как правило, 2, за счет внешних 4s-электронов.
Общая электронная формула этих элементов –3d1–104s1–2.
• Для хрома и меди наблюдается проскок (или провал)
электрона на d-уровень: Cr – 3d54s1,
Cu – 3d104s1. Такой проскок с ns- на (n – 1)d-уровень
наблюдается также у Mo, Ag, Au, Pt и у других элементов и
объясняется близостью энергий ns- и (n – 1)d-уровней и
стабильностью наполовину и полностью заполненных
уровней.
40.
• Дальше в четвертом периоде после десяти dэлементов появляются p-элементы от Ga (4s24p1) доKr (4s24p6)
• Пятый период повторяет четвертый – в нем также 18
элементов, и 4d-элементы, как и 3d образуют
вставную декаду (4d1–10 5s0–2).
• В шестом периоде после лантана (5d16s2) – аналога
скандия и иттрия следует четырнадцать 4f-элементов
- лантаноидов. Свойства этих элементов очень
близки, поскольку идет заполнение глубоколежащего
(n – 2)f-подуровня. Общая формула лантаноидов 4f2–
145d0–16s2. После 4f-элементов заполняются 5d- и 6pорбитали. Всего 32 элемента.
41.
• Седьмой период отчасти повторяет шестой.• 5f-элементы называются актиноидами. Их
общая формула 5f2–146d0–17s2.
• Далее следует еще шесть искусственно
полученных 6d-элементов незавершенного
седьмого периода.
42. Периодичность атомных характеристик
• орбитальный радиус. При изучении строениямолекул и кристаллов атомы и ионы можно
рассматривать как имеющие некий эффективный
радиус, зависящий от типа химической связи. Если
рассматривать только относительные величины
атомных радиусов, то легко обнаружить
периодичность их зависимости от номера элемента.
• В периодах орбитальные атомные радиусы по мере
увеличения заряда ядра Z в общем монотонно
уменьшаются из-за роста степени взаимодействия
внешних электронов с ядром.
43.
• В подгруппах радиусы в основном увеличиваютсяиз-за возрастания числа электронных оболочек
• У s- и p-элементов изменение радиусов как в
периодах, так и в подгруппах более ярко, чем у dи f-элементов, поскольку d- и f-электроны
внутренние. Уменьшение радиусов у d- и fэлементов в периодах называется d- и f-сжатием.
Следствием f-сжатия является то, что атомные
радиусы электронных аналогов d-элементов
пятого и шестого периодов практически
одинаковы:
rатома, нм
Zn – Hf
Nb – Ta
0,160 – 0,159
0,145 – 0,146
44.
• Образование ионов приводит к изменениюионных радиусов по сравнению с атомными.
При этом радиусы катионов всегда меньше, а
радиусы анионов всегда больше
соответствующих атомных радиусов.
Ковалентный радиус равняется половине
межатомного расстояния в молекулах или
кристаллах простых веществ.
45.
• Энергией ионизации атома (I)называется
количество
энергии, необходимое для
отрыва
электрона
от
невозбужденного атома или
иона.
46.
• I выражается в кДж·моль–1 или эВ·атом–1.Значения I в электронвольтах численно равны
потенциалам ионизации, выраженным в
вольтах, поскольку
E = ē·I
• Э – ē = Э+, ΔH = I1 – первый потенциал
ионизации;
• Э – ē = Э2+, ΔH = I2 – второй потенциал
ионизации и т.д.
I1 < I2 < I3 < I4...
• Энергия ионизации определяет характер и
прочность химической связи и
восстановительные свойства элементов.
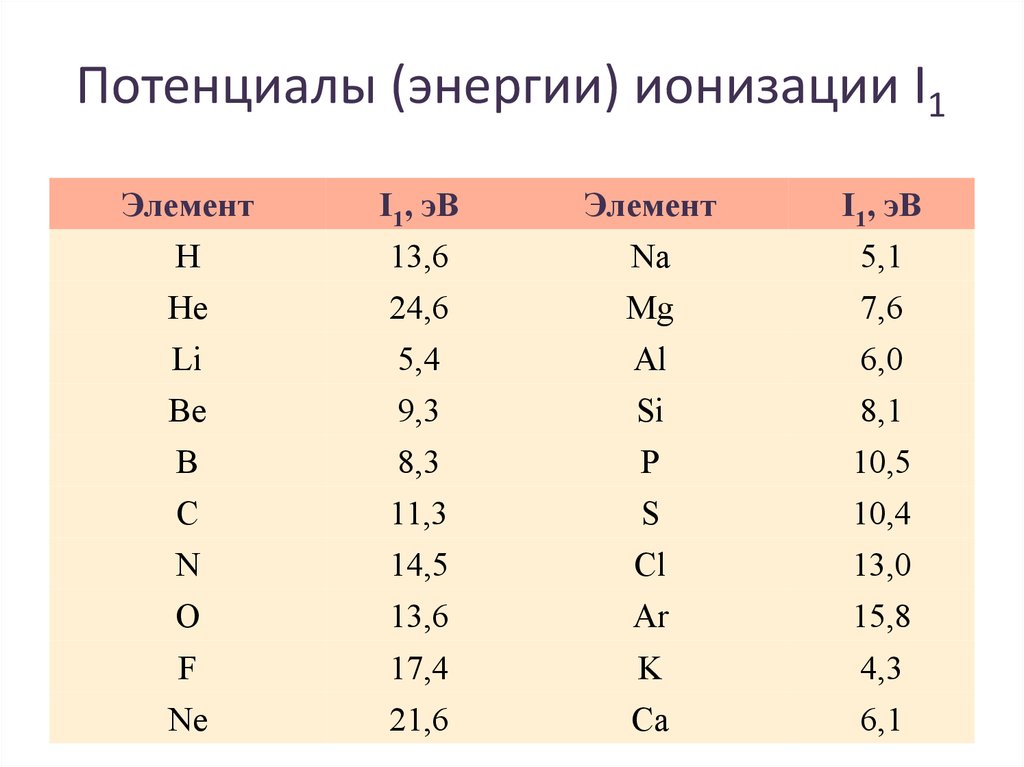
47. Потенциалы (энергии) ионизации I1
ЭлементH
He
Li
Be
B
C
N
O
F
Ne
I1, эВ
13,6
24,6
5,4
9,3
8,3
11,3
14,5
13,6
17,4
21,6
Элемент
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
I1, эВ
5,1
7,6
6,0
8,1
10,5
10,4
13,0
15,8
4,3
6,1
48.
Потенциалы ионизации нейтральных атомов.• Энергия
ионизации
изменяется периодически
по мере
заполнения
электронами
оболочек
атомов
• I1
максимален
у
элементов с полностью
заполненными
валентными оболочками
(у благородных газов),
при
переходе
к
следующему периоду I1
резко понижается – он
минимален у щелочных
металлов.
49.
• Энергия связи электрона с ядромпропорциональна Z и обратно
пропорциональна среднему (орбитальному)
радиусу оболочки. Атомные радиусы d- и fэлементов с ростом Z в периоде уменьшается
незначительно по сравнению с s- и pэлементами, поэтому их потенциалы
ионизации растут также незначительно.
• В главных подгруппах потенциалы ионизации с
ростом Z уменьшаются вследствие увеличения
числа электронных подоболочек и
экранирования заряда ядра электронами
внутренних подоболочек.
50.
• Впобочных
подгруппах
d-электроны
экранируются не только электронами
заполненных оболочек, но и внешними sэлектронами. Поэтому потенциал ионизации
d-элементов с ростом Z в подгруппе
увеличивается незначительно.
• Чем меньше потенциал ионизации, тем легче
атом отдает электрон.
• Поэтому восстановительная способность
нейтральных атомов с ростом Z в периоде
уменьшается, в главных подгруппах растет, а
в побочных – падает.
51.
• Энергия сродства к электрону (Е)– энергия,выделяющаяся при присоединении электрона
к нейтральному атому.
• Чем больше электронное сродство, тем более
сильным окислителем является данный
элемент.
• Экспериментальное определение энергии
сродства к электрону E значительно сложнее,
чем энергия ионизации.
52.
• Окислительной способностью не обладаютнейтральные атомы с устойчивыми
конфигурациями s2 и s2p6 и переходные
элементы.
• У остальных элементов в таблице
Менделеева окислительная способность
нейтральных атомов повышается слева
направо и снизу вверх.
53.
Рассмотрим кислородсодержащие кислоты хлора,в молекулах которых хлор проявляет различные
степени окисления:
+1
_
2 +1
HOCl;
хлорноватистая
кислота;
+1 +3
_2
+1 +5
_2
+1 +7
_2
HClO
HClO
;
HClO2хлорноватая
;
4.
хлорная3кислота.
кислота;
хлористая
кислота;
Усиление кислотных свойств, повышение устойчивости
Усиление окислительной активности
54. Электроотрицательность (ЭО)
• Для более полной характеристики тенденцииэлемента к присоединению или отдаче электронов
введено понятие электроотрицательности (ЭО)
ЭО= 1/2 (I + Е )
• В периодах электроотрицательность растет, а в
группах уменьшается с ростом Z, то есть растет от
Cs к F по диагонали периодической системы. Это
обстоятельство до некоторой степени определяет
диагональное сходство элементов.
55.
H2,1
Электроотрицательность элементов
Li
1,0
Be
1,5
B
2,0
C
2,5
N
3,0
O
3,5
F
4,0
Na
0,9
Mg
1,2
Al
1,5
Si
1,8
P
2,1
S
2,5
Cl
3,0
Ga
1,6
Ge
1,8
As
2,0
Se
2,4
Br
2,8
In
1,7
Sn
1,8
Sb
1,9
Te
2,1
I
2,5
Tl
1,8
Pb
1,9
Bi
1,9
Po
2,0
At
2,2
K
0,8
Rb
0,8
Cs
0,7
Ca
1,0
Sr
1,0
Ba
0,9
Sc 1,3
Ti 1,5
V 1,6
Cr 1,6
Mn 1,5
Fe
Co
Ni
Cu
Zn
1,8
1,9
1,9
1,9
1,6
Y 1,2
Zr 1,4
Nb 1,6
Mo 1,8
Tc 1,9
Ru
Rn
Pd
Ag
Cd
2,2
2,2
2,2
1,9
1,7
La
Hf
Ta
W
Re
Os 2,2
Ir 2,2
Pt 2,2
Au 2,4
Hg 1,9
1,0
1,3
1,5
1,7
1,9
Ce-Lu
1,0–1,2
56.
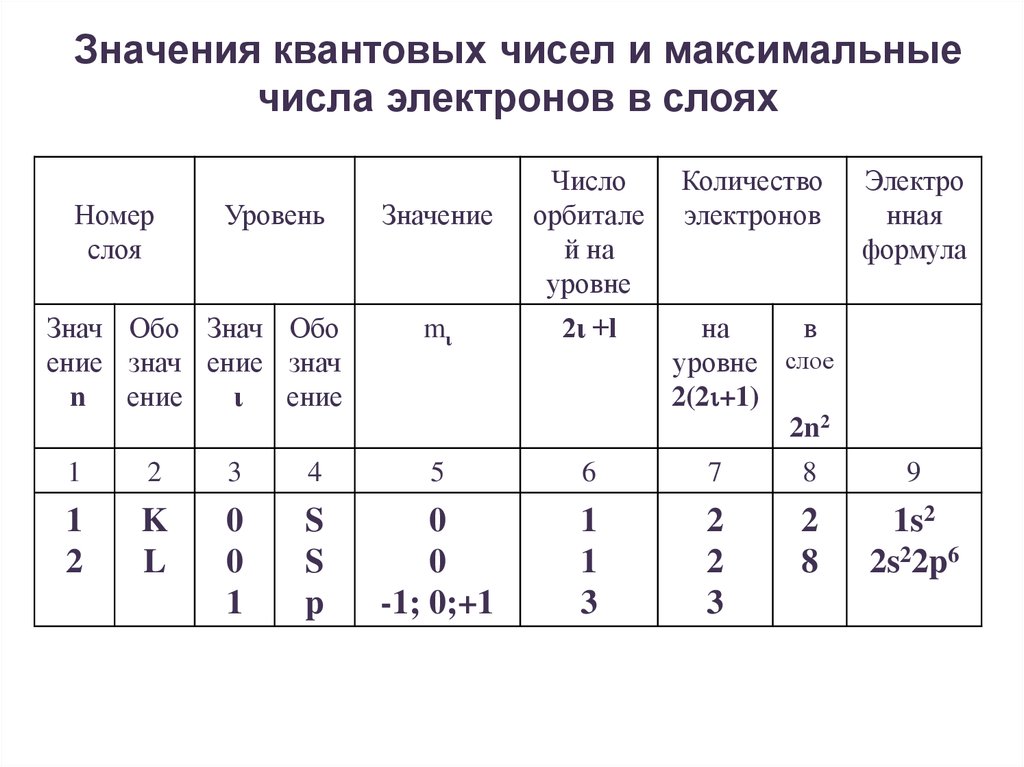
Значения квантовых чисел и максимальныечисла электронов в слоях
Номер
слоя
Уровень
Знач Обо Знач Обо
ение знач ение знач
n ение
ι
ение
Число
орбитале
й на
уровне
Количество
электронов
mι
2ι +l
на
в
уровне слое
2(2 +1)
2n2
Значение
Электро
нная
формула
1
2
3
4
5
6
7
8
9
1
2
K
L
0
0
1
S
S
p
0
0
-1; 0;+1
1
1
3
2
2
3
2
8
1s2
2s22p6
57.
3M
0
1
2
S
p
d
0
-1; 0;+1
-2; -1;
0+1;+2
1
3
5
2
6
10
18
3s23p6
3d10
4
N
0
1
2
3
S
p
d
f
0
-1; 0;+1
-2; -1;
0+1;+2
-3;-2;-1; 0;
+1;+2;+3
1
3
5
7
2
6
10
14
32
4s24p6
4d104f14
58. Домашнее задание
1.2.
3.
4.
5.
6.
7.
8.
Что характеризует и какие значения принимает главное квантовое число?
Сколько максимально электронов находится на уровне n = 3?
Что характеризует и какие значения принимает орбитальное квантовое
число (l)? Какую форму электронного облака имеет p-электрон? Могут ли pэлектроны находиться на первом энергетическом уровне?
Какое квантовое число характеризует собственный магнитный момент
электрона? Какие значения оно принимает? Сколько электронов может
быть на одной атомной орбитали?
Какое максимальное число электронов может находится на fэнергетическом подуровне атома? Почему?
Какое максимальное число электронов может находится на dэнергетическом подуровне атома? Почему?
Какое максимальное число электронов может находится на p-подуровне
атома. Почему?
Какие значения принимает магнитное квантовое число (ml) при l = 3? Что
характеризуют эти значения?
Что называется энергией ионизации атомов?
59.
1. Как изменяются величины энергий ионизации у элементов главных ипобочных подгрупп (по вертикали) и у d-элементов (по горизонтали)?
2. Сформулируйте правило Клечковского.
3. Сформулируйте свойства Паули.
4. Как меняются окислительные способности и кислотные свойства в ряду:
HClO, HClO3, HClO4?
5. Сформулируйте правило Гунда.
6. Как меняется восстановительная способность и сила кислот в ряду:H2S, H2Se,
H2Te? Сформулируйте принцип Паули.
7. Сформулируйте правило Гунда.
8. Как и почему изменяется энергия сродства к электрону в пределах периода
при увеличении заряда ядра атомов? Для каких элементов величина энергии
сродства к электрону имеет максимальное значение?
9. Как и почему изменяется энергия ионизации в пределах периода при
увеличении заряда ядра атомов? Как изменяются величины энергий
ионизации у элементов главных и побочных подгрупп (по вертикали) и у
d и f-элементов по горизонтали?
60.
1. Напишите современную формулировку периодическогозакона
Д.И.
Менделеева.
2. Как меняются окислительные способности и кислотные свойства в ряду: HClO,
HClO3, HClO4?
3. Напишите полную электронную формулу атома элемента с порядковым
номером 40. Сколько свободных d-орбиталей содержится у данного атома.
4. Напишите электронную формулу атомов ниобия (41Nb) и сурьмы (51Sb)
Распределите валентные электроны указанных атомов по атомным орбиталям и
укажите электронные семейства. Какой элемент имеет наиболее сильно
выраженные металлические свойства
5. Валентные электроны атома распределены следующим образом: 3s23p6 .
Напишите полную электронную формулу атома этого элемента. Укажите заряд
ядра атома.
6. Распределите валентные электроны атома хлора по атомным орбиталям для
нормального и возбужденного состояния атома.
7. Сколько свободных f-орбиталей содержится в атоме с порядковым номером 60?
Используя правило Гунда, распределите валентные электроны данного атома по
орбиталям и укажите электронное семейство.
8. Какие орбитали атома заполняются электронами в первую очередь: 4s или 3d; 5s
или 4p. Почему?
9. На
основании электроотрицательности атомов определите,
какое из
перечисленных газообразных водородных соединений наиболее прочно: NH3,
PH3, AsH3, SbH3, BiH3 ?
61. Химическая связь
62.
• Образование из атомов молекул, молекулярныхионов, ионов, кристаллических, аморфных и других
веществ сопровождается уменьшением энергии по
сравнению с невзаимодействующими атомами. При
этом минимальной энергии соответствует
определенное расположение атомов относительно
друг друга, которому отвечает существенное
перераспределение электронной плотности.
• Силы, удерживающие атомы в новых образованиях,
получили обобщенное название «химическая связь».
• Важнейшие виды химической связи: ковалентная,
ионная, металлическая, водородная,
межмолекулярная.
63.
• Согласно электронной теории валентности,химическая связь возникает за счет
перераспределения электронов валентных
орбиталей, в результате чего возникает
устойчивая электронная конфигурация
благородного газа (октет) за счет образования
ионов (В. Коссель) или образования общих
электронных пар (Г. Льюис).
64. Коссель Вальтер (4.I.1888–22.V.1956)
Немецкий физик. Основные исследования посвящены
развитию электронных представлений в химии.
Предложил (1916) статическую электронную теорию
строения атомов и молекул, согласно которой:
а) атомы благородных газов обладают особенно
устойчивой восьмиэлектронной внешней оболочкой
(атом гелия – двухэлектронной);
б) атомы других элементов во внешней оболочке имеют
неполный электронный октет;
в) образование химических соединений происходит
вследствие перехода электронов от атома одного
элемента к атому другого и появления ионной
химической связи, т. е. благодаря электростатическому
притяжению.
Наиболее устойчивыми должны быть те соединения, в
которых валентные электроны распределяются так, чтобы
каждый атом был окружен оболочкой, имитирующей
электронную оболочку благородного газа. Гипотеза
Косселя легла в основу теории ионной связи.
65. Льюис Гильберт (23.X.1875–23.III.1946)
• Льюис Гильберт Ньютон Американскийфизикохимик. Основные работы посвящены
химической термодинамике и теории
строения вещества. Определил свободную
энергию многих соединений. Ввел понятие
термодинамической активности. Уточнил
формулировку закона действующих масс.
Развил (1916) теорию ковалентной
химической связи. Его концепция
обобщенной электронной пары оказалась
очень плодотворной для органической
химии. Предложил (1926) новую теорию
кислот как акцепторов пары электронов и
оснований как доноров пары электронов.
Ввел (1929) термин «фотон».
66.
• Химическая связь характеризуется энергией и длиной.• Мерой прочности связи служит энергия, затрачиваемая на
разрушение связи, или выигрыш в энергии при образовании
соединения из отдельных атомов (Eсв.). (На разрыв связи H–H
затрачивается 435кДж·моль–1 , а на атомизацию метана CH4 –
1648 кДж·моль–1, в этом случае EC–H = 1648 : 4 = 412 кДж.)
• Длина связи (нм) – расстояние между ядрами в том или ином
соединении. (Обычно чем больше длина связи, тем меньше ее
энергия.)
• Химическая связь обычно изображается черточками,
соединяющими взаимодействующие атомы; каждая черта
эквивалентна обобщенной паре электронов.
• В соединениях, содержащих более двух атомов, важной
характеристикой является валентный угол, образуемый
химическими связями в молекуле и отражающий ее геометрию.
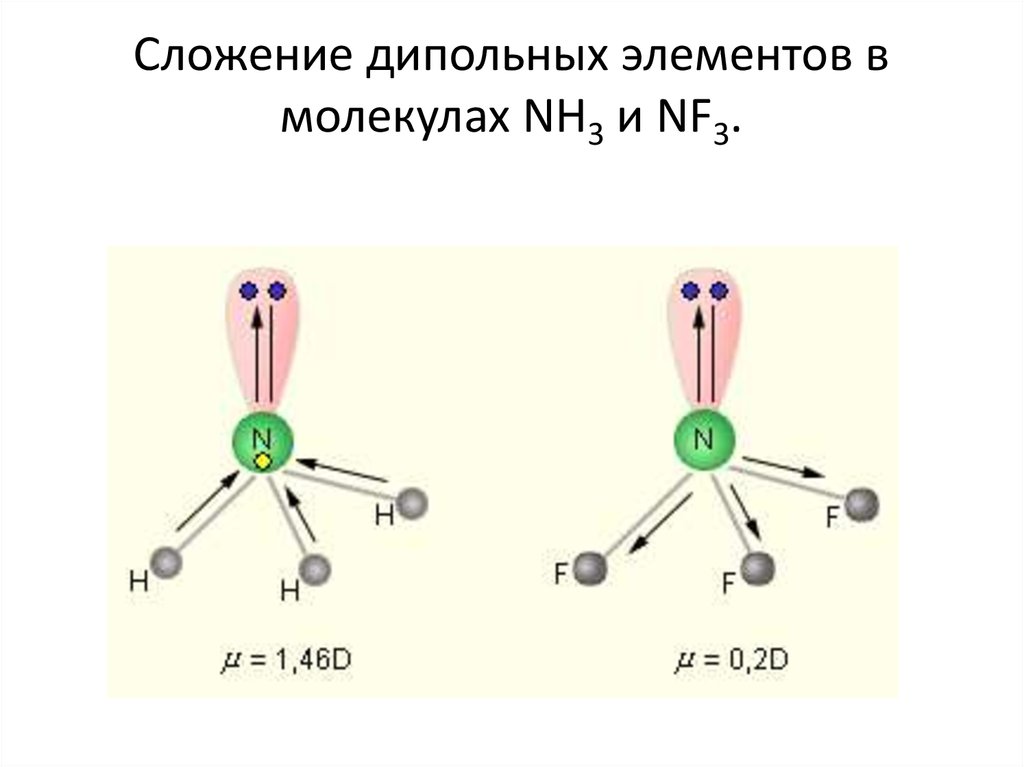
67. Сложение дипольных элементов в молекулах NH3 и NF3.
Рисунок 3.1.68. Полярность молекулы
определяется разностью электроотрицательностей атомов,образующих двухцентровую связь, геометрией молекулы,
наличием неподеленных электронных пар, так как часть
электронной плотности в молекуле может быть локализована
не в направлении связей.
• Полярность связи выражается через ее ионную составляющую,
то есть через смещение электронной пары к более
электроотрицательному атому.
• Полярность связи может быть выражена через ее дипольный
момент μ, равный произведению элементарного заряда на
длину диполя
μ = e·l
• Полярность молекулы выражается через ее дипольный
момент, который равен векторной сумме всех дипольных
моментов связей молекулы.
69.
• Диполь – система из двух равных, но противоположных познаку зарядов, находящихся на расстоянии l друг от друга.
• Дипольный момент измеряется в кулон·метрах (Кл·м) или в
дебаях (D); 1D = 0,333·10–29 Кл·м.
• Все эти факторы следует учитывать. Например, для линейной
молекулы CO2 μ = 0, но для SO2
μ = 1,79 D вследствие ее
углового строения. Дипольные моменты NF3 и NH3 при
одинаковой гибридизации атома азота (sp3), примерно
одинаковой полярности связей N–F и N–H (ОЭО
N = 3;
ОЭО F = 4; ОЭО H = 2,1) и сходной геометрии молекул
существенно различаются, поскольку дипольный момент
неподеленной пары электронов азота при векторном
сложении в случае NH3 увеличивает μ молекулы, а в случае NF3
уменьшает его
70. Структуры и формы молекул угловая, линейная, пирамидальная
NH3N
H 2O
H 107.30
O
O
H
104.50
CO2
H
H
C
1800
H
O
71. Типы химических связей
Ковалентная связь – наиболее общий видхимической связи, возникающий за счет
обобществления электронной пары
посредством обменного механизма, когда
каждый из взаимодействующих атомов
поставляет по одному электрону, или по
донорно-акцепторному механизму, если
электронная пара передается в общее
пользование одним атомом (донор) другому
атому (акцептору)
72. механизмы образования ковалентной связи
а)Обменный
б) донорно-акцепторный
[ ]
+
73. Ионная связь
• – частный случай ковалентной, когда образовавшаясяэлектронная пара полностью принадлежит более
электроотрицательному атому, становящемуся
анионом.
• ионную связь обусловленна электростатическим
притяжением положительных и отрицательных ионов.
• Взаимодействие ионов противоположного знака не зависит от
направления, а кулоновские силы не обладают свойством
насыщености.
74.
• Поэтому каждый ион в ионном соединениипритягивает такое число ионов противоположного
знака, чтобы образовалась кристаллическая
решетка ионного типа.
• В ионном кристалле нет молекул. Каждый ион
окружен определенным числом ионов другого
знака (координационное число иона).
• Ионные пары могут существовать в газообразном
состоянии в виде полярных молекул.
• В газообразном состоянии NaCl имеет дипольный
момент ~3·10–29 Кл·м, что соответсвует смещению
0,8 заряда электрона на длину связи 0,236 нм от
Na к Cl, т.е. Na0,8+Cl0,8–.
75. Металлическая связь
• возникает в результате частичной делокализациивалентных электронов, которые достаточно
свободно движутся в решетке металлов,
электростатически
взаимодействуя
с
положительно заряженными ионами. Силы связи
не локализованы и не направлены, а
делокализированные электроны обусловливают
высокую тепло- и электропроводность.
76. Водородная связь.
• Ее образование обусловлено тем, что в результатесильного смещения электронной пары к
электроотрицательному атому атом водорода,
обладающей эффективным положительным зарядом,
может взаимодействовать с другим
электроотрицательным атомом (F, O, N, реже Cl, Br, S).
Энергия такого электростатического взаимодействия
составляет 20–100 кДж·моль–1. Водородные связи могут
быть внутри- и межмолекулярными.
Внутримолекулярная водородная связь образуется,
например, в ацетилацетоне и сопровождается
замыканием цикла
77.
• Исключительно важную роль водороднаясвязь играет в биологических
макромолекулах, таких неорганических
соединениях как H2O, H2F2, NH3.
• За счет водородных связей вода
характеризуется столь высокими по
сравнению с H2Э (Э = S, Se, Te) температурами
плавления и кипения. Если бы водородные
связи отсутствовали, то вода плавилась бы при
–100°С, а кипела при –80°С.
78. Ван-дер-ваальсова (межмолекулярная) связь
– наиболее универсальный вид межмолекулярной связиобусловлен дисперсионными силами
(индуцированный диполь – индуцированный диполь),
индукционным взаимодействием (постоянный
диполь-индуцированный диполь) и ориентационным
взаимодействием (постоянный диполь – постоянный
диполь). Энергия ван-дер-ваальсовой связи меньше
водородной и составляет 2–20 кДж·моль–1.
79. Химическая связь в твердых телах
• Свойства твердых веществ определяются природойчастиц, занимающих узлы кристаллической решетки и
типом взаимодействия между ними.
• Твердые аргон и метан образуют атомные и
молекулярные кристаллы соответственно. Поскольку
силы между атомами и молекулами в этих решетках
относятся к типу слабых ван-дер-ваальсовых, такие
вещества плавятся при довольно низких температурах.
Большая часть веществ, которые при комнатной
температуре находятся в жидком и газообразном
состоянии, при низких температурах образуют
молекулярные кристаллы.
80.
• Ионные кристаллы, содержащие многоатомныеионы, имеют более низкие температуры
плавления; так для NaCl tпл.= 801°C, а для NaNO3
tпл.= 311°C.
• Температуры плавления ионных кристаллов
выше, чем атомных и молекулярных, поскольку
электростатические силы, действующие между
ионами, намного превышают слабые ван-дерваальсовые силы.
• Ионные соединения более твердые и хрупкие.
Такие кристаллы образуются элементами с сильно
различающимися электроотрицательностями
(например, галогениды щелочных металлов).
81.
• В ковалентных кристаллах решеткапостроена из атомов, соединенных
ковалентной связью, поэтому эти
кристаллы обладают высокими твердостью,
температурой плавления и низкими теплои электропроводностью.
82.
• Кристаллические решетки, образуемыеметаллами, называются металлическими. В
узлах таких решеток находятся положительные
ионы металлов, в межузлиях – валентные
электроны (электронный газ).
• Наибольшую температуру плавления из металлов
имеют d-элементы, что объясняется наличием в
кристаллах этих элементов ковалентной связи,
образованной неспаренными d-электронами,
помимо металлической, образованной sэлектронами.
83. Типы кристаллических решеток
• атомная,примером служит алмаз
84. ионная
-+
-
+
+
-
+
-
-
+
-
+
+
-
+
-
примером служит поваренная соль
85. металлическая
++
+
+
+
+
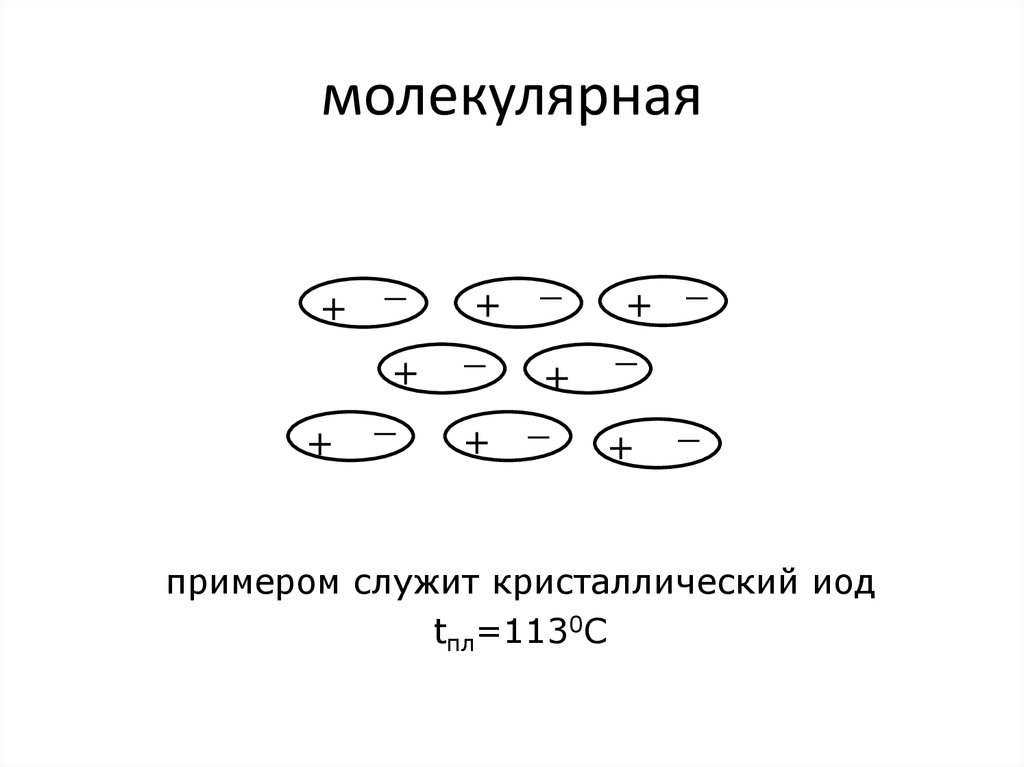
86. молекулярная
++
_
+
_
+
_
_
+
_
+
+ _ +
_
_
примером служит кристаллический иод
tпл=1130С
87. Кварц – кристаллическая форма оксида кремния
88. Метод валентных связей (МВС)
• основан на предположении, чтохимическая связь осуществляется
одной или несколькими
электронными парами,
локализованными между
взаимодействующими атомами.
89. Виды и кратность связи Направленность ковалентной химической связи
• В зависимости от направленияперекрывания электронных
облаков различают σ (сигма) и
(пи) связи.
90. σ – связь возникает при перекрывании орбиталей вдоль линии, соединяющей ядра взаимодействующих атомов. Схематическое изображение:
S-PP-P
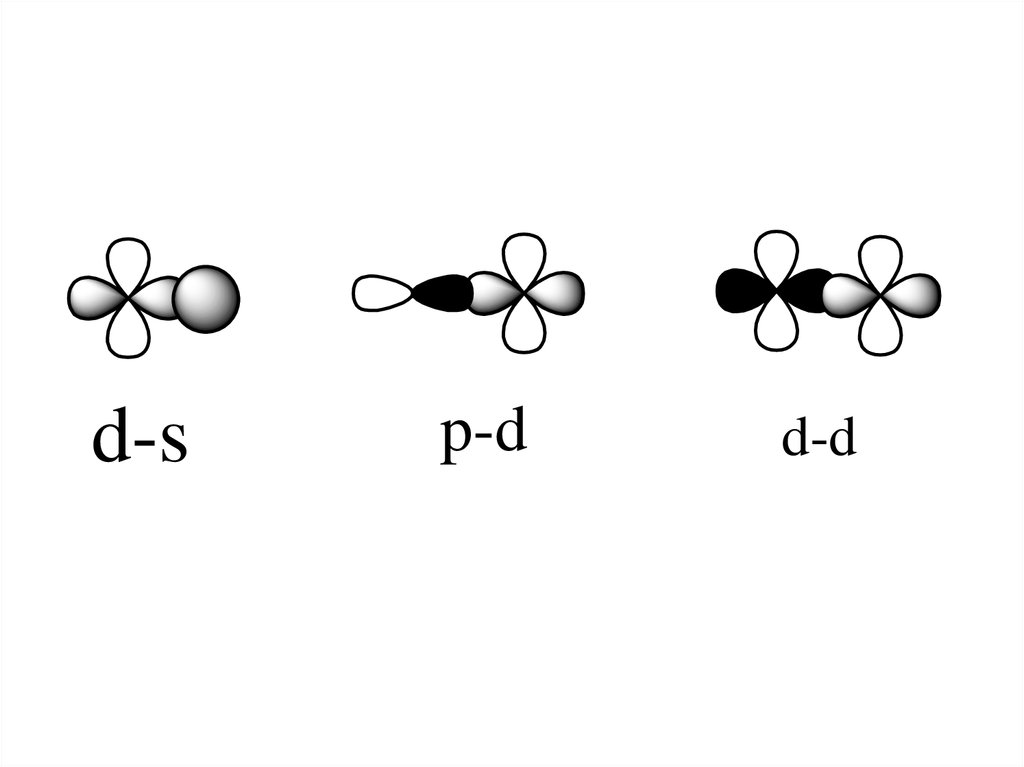
91.
d-sp-d
d-d
92.
-связь возникает при перекрывании двух
орбиталей, расположенных перпендикулярно линии,
соединяющей ядра атомов. Она характеризуется
двумя областями перекрывания по обе стороны этой
линии, поэтому возможны молекулы с краткими
сведениями (двойными и тройными).
• - связь образуется при перекрывании р- , d- и fорбиталей на прямой перпендикулярной линии связи.
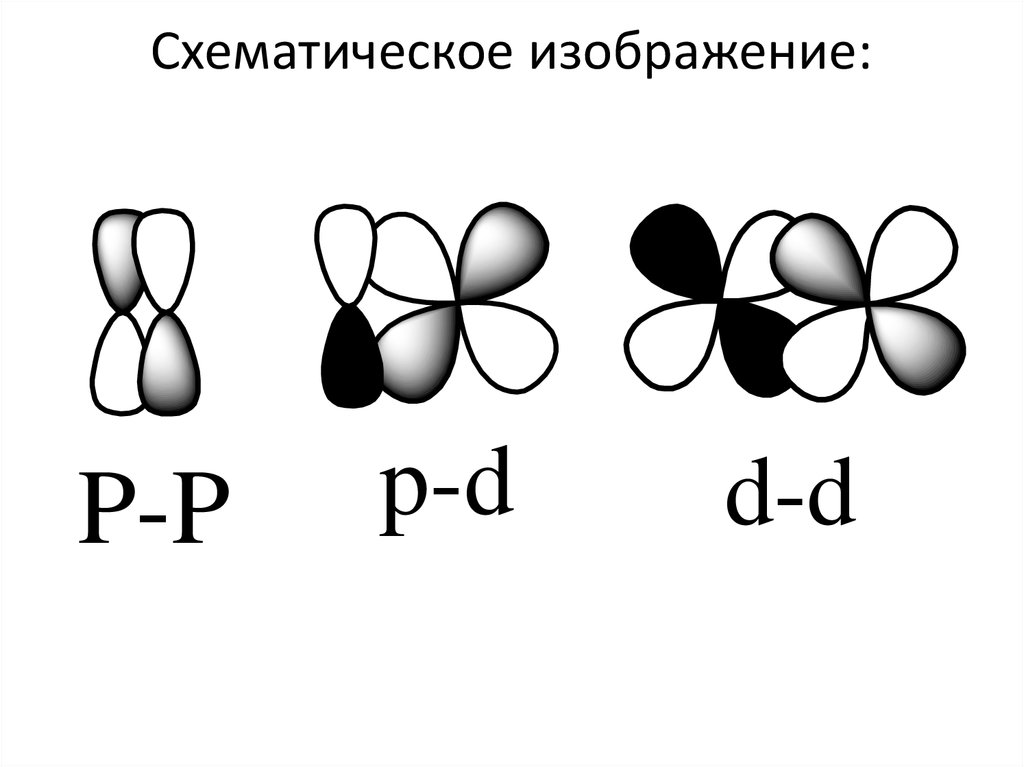
93. Схематическое изображение:
P-Pp-d
d-d
94.
• Энергетически σ и – связи неравноценны Е <Еσ.
• Разрыв – связи происходит первой.
• - связь может возникнуть только совместно с связью.
• Число связей соединяющих 2 атома, называется
кратностью связи.
• Кратность связи в молекулах H – H, H2C=CH2, N= N
соответственно равна 1, 2, 3.
95. Свойства ковалентной связи
• Насыщаемость – это способность атома использовать всесвои валентные возможности.
• Валентность – это свойство атома элемента
присоединять или замещать определенное число атомов
другого элемента. Количественно она определяется
номером группы в периодической системе Д.И.
Менделеева, т.е. от единицы до восьми.
• Мерой валентности может служить число химических
связей, образуемых данным атомом с другими атомами. В
представлении метода валентных связей числовое
значение валентности равно числу ковалентной связей,
которые образует атом.
96.
• Направленность. Атомные орбитали направлены впространстве, следовательно, и химические связи,
возникающие при перекрывании атомных орбиталей,
имеют также определенную направленность.
• Направленность и валентный угол обусловливают
геометрию молекулы. При изучении геометрии молекул
было обнаружено два противоречия:
• 1. отклонение реальных валентных углов от теоретически
ожидаемых;
• 2. равноценность связей, образованных энергетически
неравноценными орбиталями. Для объяснения этих
противоречий в химию была ведена концепция
гибридизации.
97. гибридизация
• Гибридизация АО – это смешивание ивыравнивание АО, образующих -связи, по форме
и энергии.
• Т.е, это состояние центрального атома, когда из n
неравноценных орбиталей образуется столько же
равноценных, но гибридных орбиталей.
• Гибридная орбиталь имеет форму искаженной
гантели. Различают несколько типов
гибридизации:
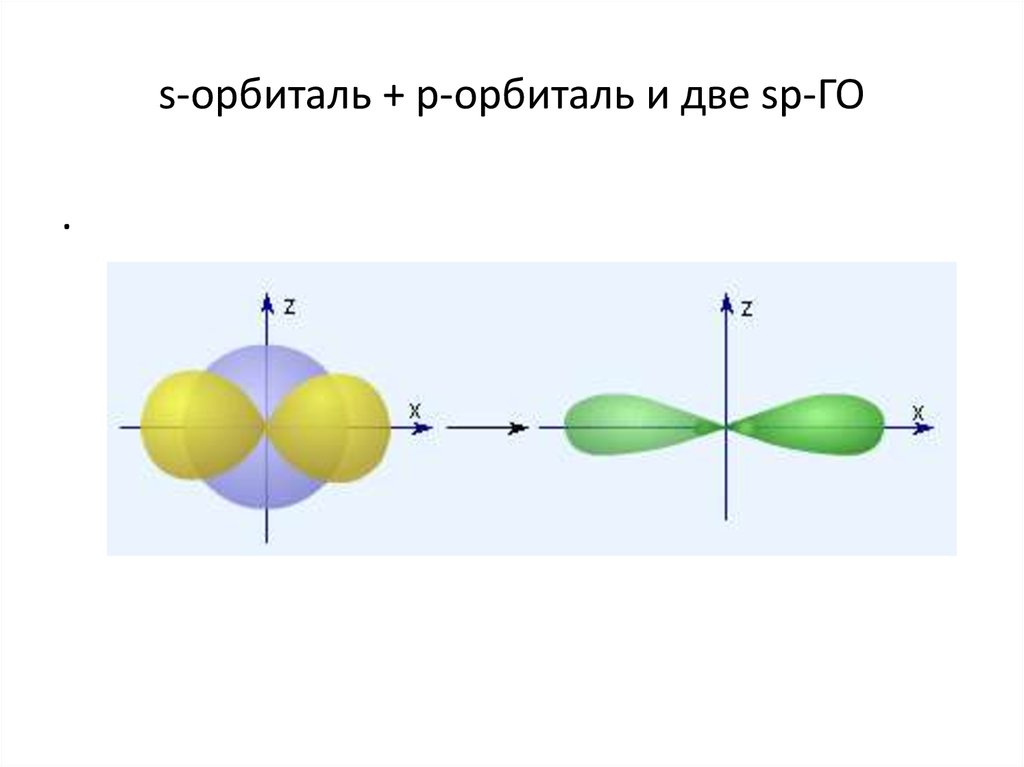
98. SP- гибридизация
гибридныe орбитали (ГО), которыепредставляют собой линейную
комбинацию АО данного атома (s- и p-АО
Be, B, C), обладают одинаковыми
энергией и формой, определенной
ориентацией в пространстве
(симметрией). Так s- и p-орбитали дают
две sp-ГО, расположенные под углом
180° относительно друг друга.
99. s-орбиталь + p-орбиталь и две sp-ГО
.100. SP2- гибридизация В молекуле AlCl3 гибридные орбитали из АО алюминия (одной s и двух p), называются sp2-орбиталями, они полностью эквивалентны энер
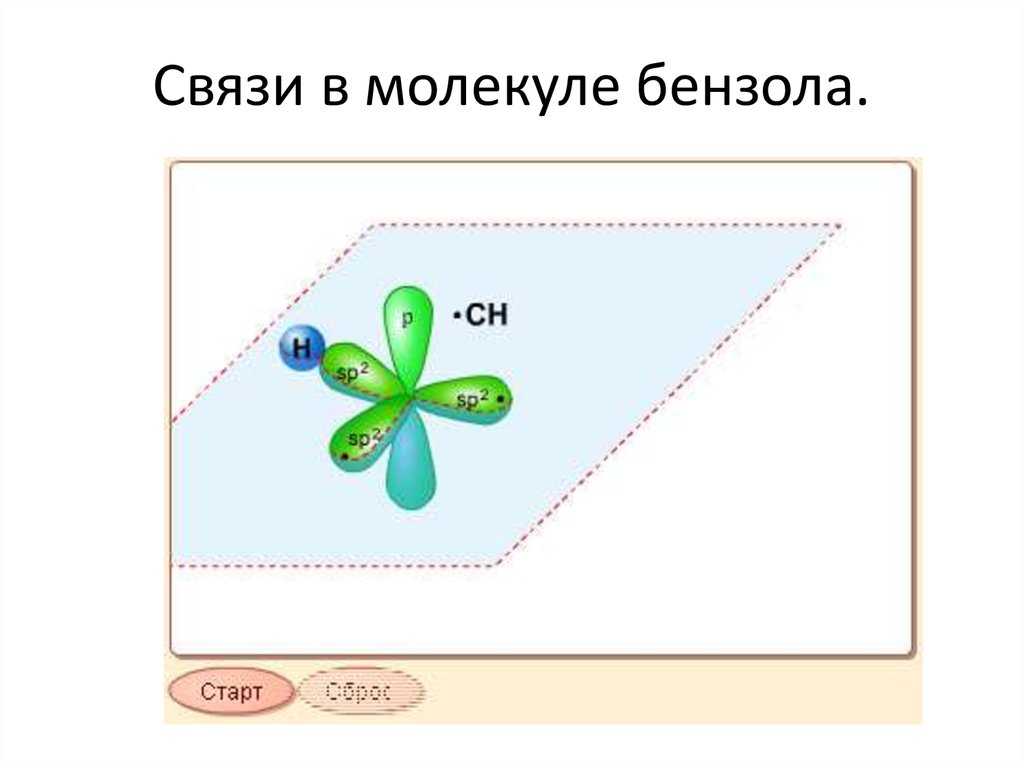
SP2- гибридизацияВ молекуле AlCl3 гибридные орбитали из АО алюминия (одной s и
двух p), называются sp2-орбиталями, они полностью эквивалентны
энергетически и пространственно направлены к вершинам
треугольника. Валентный угол - 1200
101. Связи в молекуле бензола.
.102.
Основные положения теории гибридизации :• Введение гибридных орбиталей служит для описания
направленных локализованных связей. Гибридные
орбитали обеспечивают максимальное перекрывание
АО в направлении локализованных σ-связей.
• Число гибридных орбиталей равно числу АО,
участвующих в гибридизации.
103.
• Гибридизуются близкие по энергии валентные АОнезависимо от того, заполнены они в атоме полностью,
наполовину или пусты.
В гибридизации участвуют АО, имеющие общие признаки
симметрии.
• гибридные орбитали дают молекулы с углами 180°, 120°,
109°28', 90°. Это правильные геометрические фигуры. Такие
молекулы образуются, когда все периферические атомы в
многоэлектронной молекуле (или ионе) одинаковы и их
число совпадает с числом гибридных орбиталей. Однако,
если число гибридных орбиталей больше числа связанных
атомов, то часть гибридных орбиталей заселена
электронными парами, не участвующими в образовании
связи, – несвязывающими или неподеленными
электронными парами.
104.
линейная180°
H–Be–H,
sp
HC≡CH
180°
105.
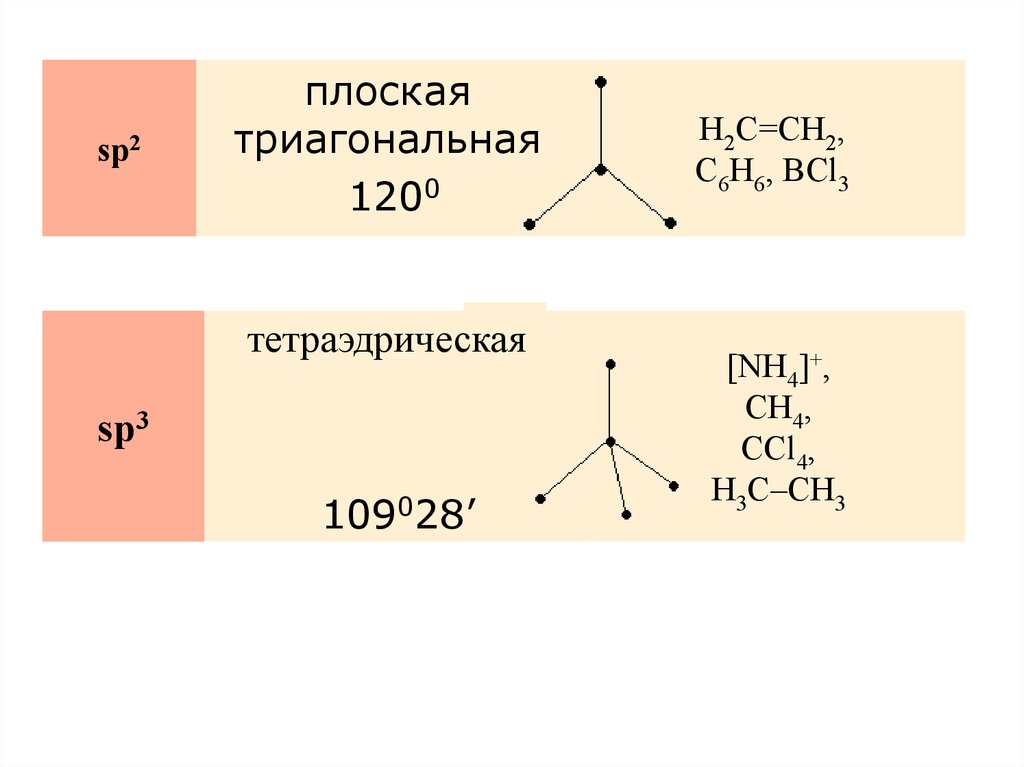
sp2плоская
триагональная
120°
1200
H2C=CH2,
C6H6, BCl3
109°28'
тетраэдрическая
sp3
109028’
[NH4]+,
CH4,
CCl4,
H3C–CH3
106.
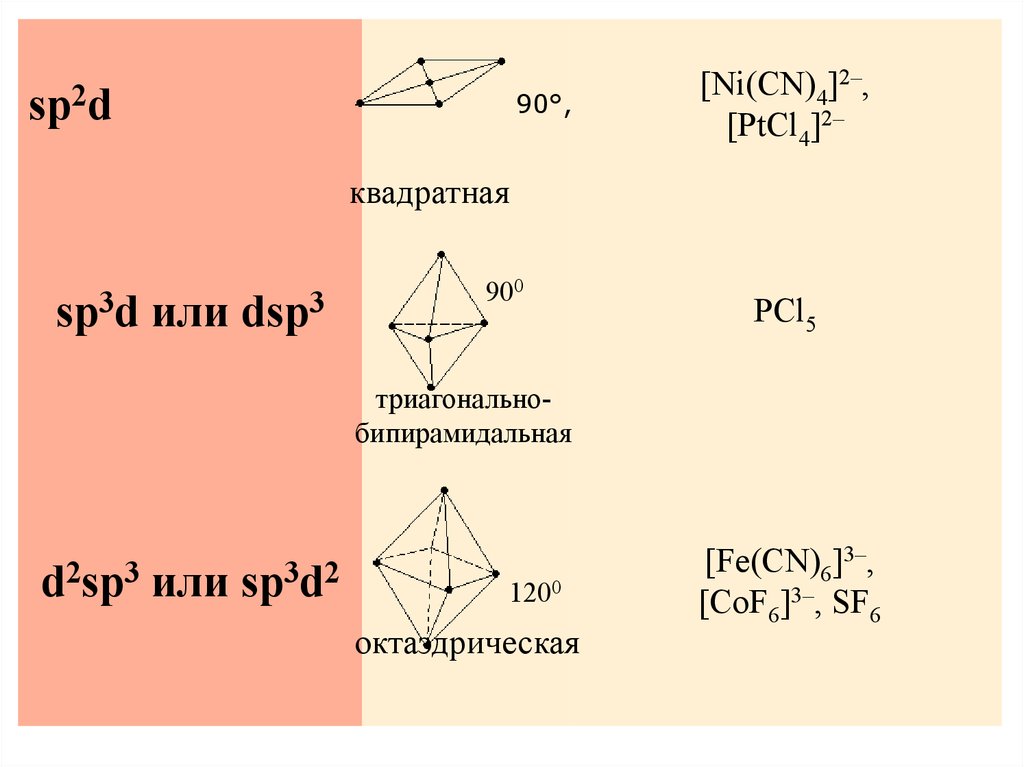
sp2d90°,
[Ni(CN)4]2–,
[PtCl4]2–
квадратная
sp3d или dsp3
900
PCl5
триагональнобипирамидальная
d2sp3 или sp3d2
120°
1200
октаэдрическая
[Fe(CN)6]3–,
[CoF6]3–, SF6
107.
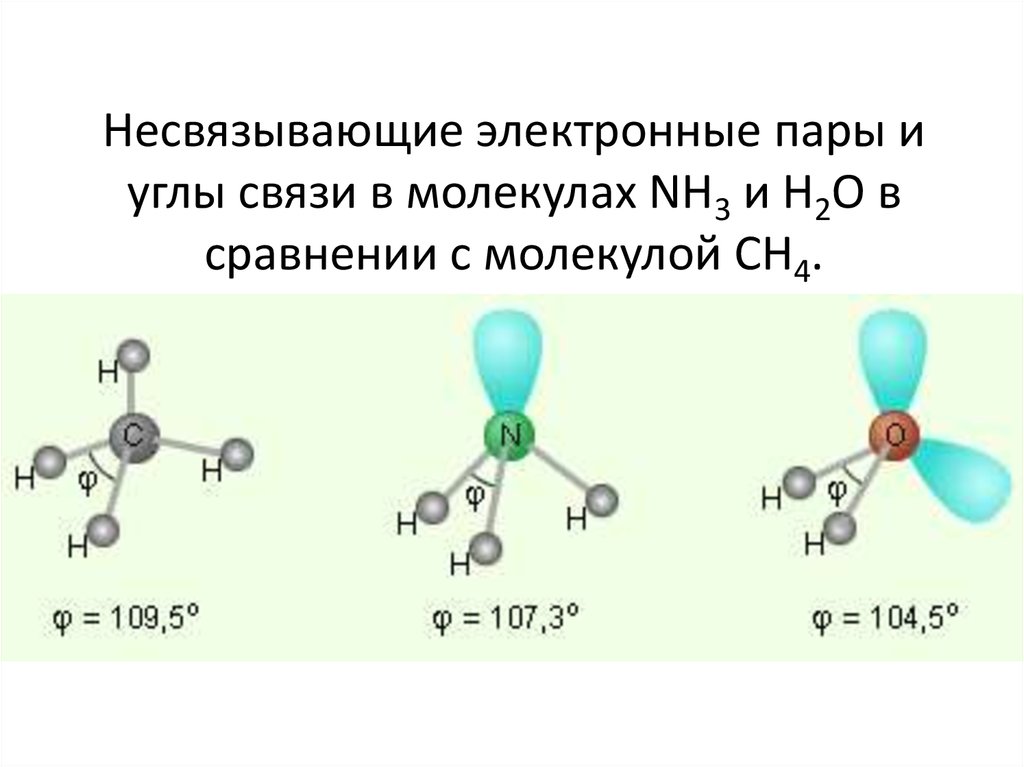
• Pассмотрим молекулы NH3 и H2O.• Атомы азота и кислорода склонны к sp3гибридизации. У азота на sp3-ГО, кроме трех
связывающих пар электронов, образующих
связь с тремя атомами водорода, остается
одна несвязывающая пара. Именно она,
занимая одну sp3-ГО, искажает угол связи H–
N–H до 107,3°.
• В молекуле H2O таких несвязывающих пар
две, и угол
H–O–H равен104,5°
108. Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4.
Рисунок 3.17.109. Метод Гиллеспи–Найхолма
• метод основан на том, что реальная геометрия молекулыопределяется не только гибридизацией АО, но и числом
двухэлектронных двухцентровых связей (связывающих
электронных пар) и наличием неподеленных электронных пар (Е).
• Тогда при одинаковой гибридизации молекула метана
соответствует формуле CH4, аммиака – NH3E, воды – H2OE2. При
этом каждая молекула представляет собой геометрическую
фигуру, вписанную в сферу.
• Молекула будет иметь минимум энергии, если все связывающие
электронные пары равноудалены друг от друга на поверхности
сферы. Неподеленная электронная пара занимает на сфере
большую площадь, что приводит к уменьшению валентного угла
тем больше, чем больше в молекуле неподеленных электронных
пар E.
• Рассмотрим структуры молекул от трехатомных до семиатомных
110.
111. Комплексные соединения
• Многие положительно заряженные ионы (Cu2+,Ag+) обладают способностью присоединять ионы
противоположного знака (Сl–, СN–) или полярные
молекулы (NН3, Н2О). Образующиеся частицы
(Сu(СN)42-, Аg(NН3)2+) называют комплексными
ионами.
• Соединения, в состав которых входят
комплексные ионы, – это комплексные
соединения.
112. Примеры комплексных соединений:
K2[Cu(CN)4],[Аg(NН3)2]Cl,
[Ni(NH3)6]Cl2,
K2[HgI4],
[Cr(H2O)6]Cl3.
113.
• Центральное положение в комплексном соединениизанимает ион металла – комплексообразователь,
или центральный ион.
• Вокруг центрального иона располагаются
(координируются) молекулы или кислотные остатки –
лиганды.
• Число лигандов вокруг центрального иона – это
координационное число.
• Так, в приведенных выше аммиачном комплексе
никеля(II) и аквакомплексе хрома(III)
координационные числа равны шести, в цианидном
комплексе меди и йодидном комплексе ртути
координационные числа равны четырем.
114.
Строение комплексных и простой солей:а – [CoCl2(H2O)4]•2H2O
две молекулы H2O, находящиеся во
внешней координационной сфере,
не показаны;
б – CoCl2•2H2O
в – CoCl2
Многие положительно заряженные
ионы (Cu2+, Ag+)
обладают способностью
присоединять ионы
противоположного знака
(Сl–, СN–)
или полярные молекулы (NН3, Н2О).
Образующиеся частицы называются
комплексными ионами: Сu(СN)4 2-,
Аg(NН3)2+ –.
115.
• При наличии у атомов одной из молекулсвободной орбитали, а у атомов другой
молекулы - электронной пары между этими
молекулами может возникнуть
взаимодействие по донорно-акцепторному
механизму.
116.
• лиганды являются донорами электронов .Например, NН3, Н2О, NO - нейтральные
полярные молекулы, или анионы (Сl–, СN–,
OH-, N02-) .
• ион металлов (Cu2+, Ni2+, Fe2+, Fe3+), ионы
неметаллов (B3+, Si4+) –
комплексообразователи является
акцепторами электронов, т.е.
предоставляет свои свободные орбитали.
117.
• Заряд комплексного иона может быть:а) положительным:
[Cu (NH3)4]2+Cl2 – координирующее число=4
б) отрицательным:
K3[Fe (CN)6]3- – координирующее число=6
в) нулевым:
• [Pt (NH3)2CL4] – координирующее число=6
При диссоциации протекает поэтапно:
• (первичная): К3[Fe (CN)6] ↔3K+ + [Fe (CN)6]3• (вторичная):[Fe (CN)6]3- ↔ Fe3+ + 6CNОпределяется величиной нестойкости (Кнест.). Чем меньше эта
величина, тем устойчивее комплексное соединение.
Fe CN
3
K нестойк
6
Fe CN
3
6
118. Задание
• 1. написать электронную формулу иэлектронно-графическую
• 2.определить валентные возможности атома
• 3.определить семейство
• 4.назвать электронные аналоги

































































































 Химия
Химия








