Похожие презентации:
Химическая связь
1. Тема: Химическая связь
2. Что такое химическая связь?
Под химическойсвязью
понимают
взаимодействие
атомов,
которое связывает
их в молекулы, ионы, радикалы,
кристаллы, и обусловливает
устойчивость указанных частиц
как целого.
3. Ионная химическая связь
это связь, образовавшаяся за счет электростатического притяжения катионов канионам. Ионной связи соответствует
ионная кристаллическая решетка.
Задание:
Выпишите формулы веществ с ионной связью и
составьте для них схемы образования:
РСl3; С2Н2; ССl4; MgCl2; СН4; K3N; NaBr.
4. Вопросы на засыпку:
Чем обусловлена устойчивость ионов Na+и Cl- по сравнению с нейтральными атомами Na и Cl (для ответа на вопрос составьте
схемы строения названных атомов и ионов)?
Каким характером должны обладать элементы, связанные ионной связью?
Может ли ионная связь образоваться
между сложными ионами? Приведите
примеры.
5.
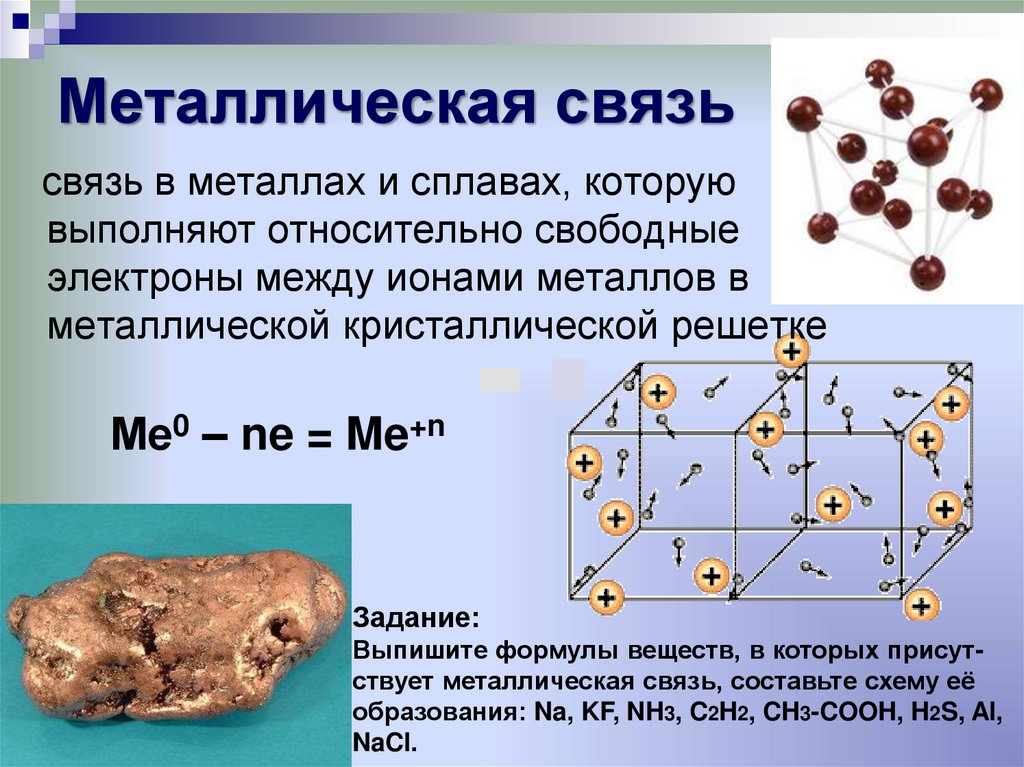
Металлическая связьСхема образования
металлической связи:
Ме0 – ne = Me+n
и металлическая кристаллическая
решетка
6. Металлическая связь
связь в металлах и сплавах, которуювыполняют относительно свободные
электроны между ионами металлов в
металлической кристаллической решетке
Ме0 – ne = Me+n
Задание:
Выпишите формулы веществ, в которых присутствует металлическая связь, составьте схему её
образования: Na, KF, NH3, C2H2, CH3-COOH, H2S, Al,
NaCl.
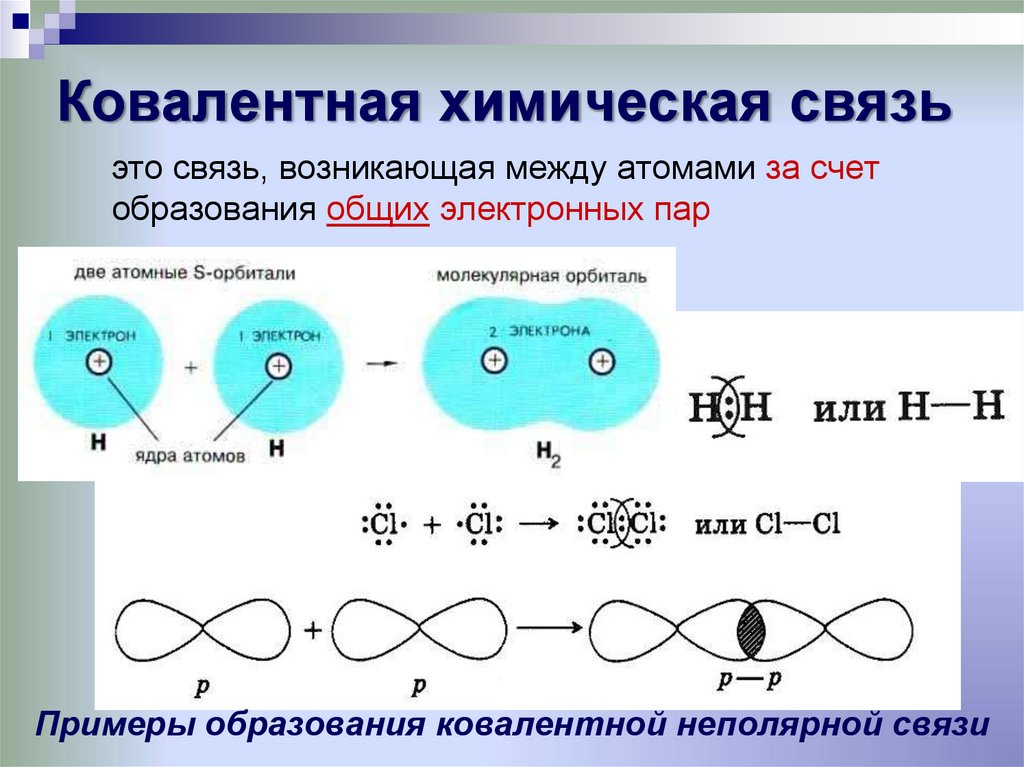
7. Ковалентная химическая связь
это связь, возникающая между атомами за счетобразования общих электронных пар
Примеры образования ковалентной неполярной связи
8.
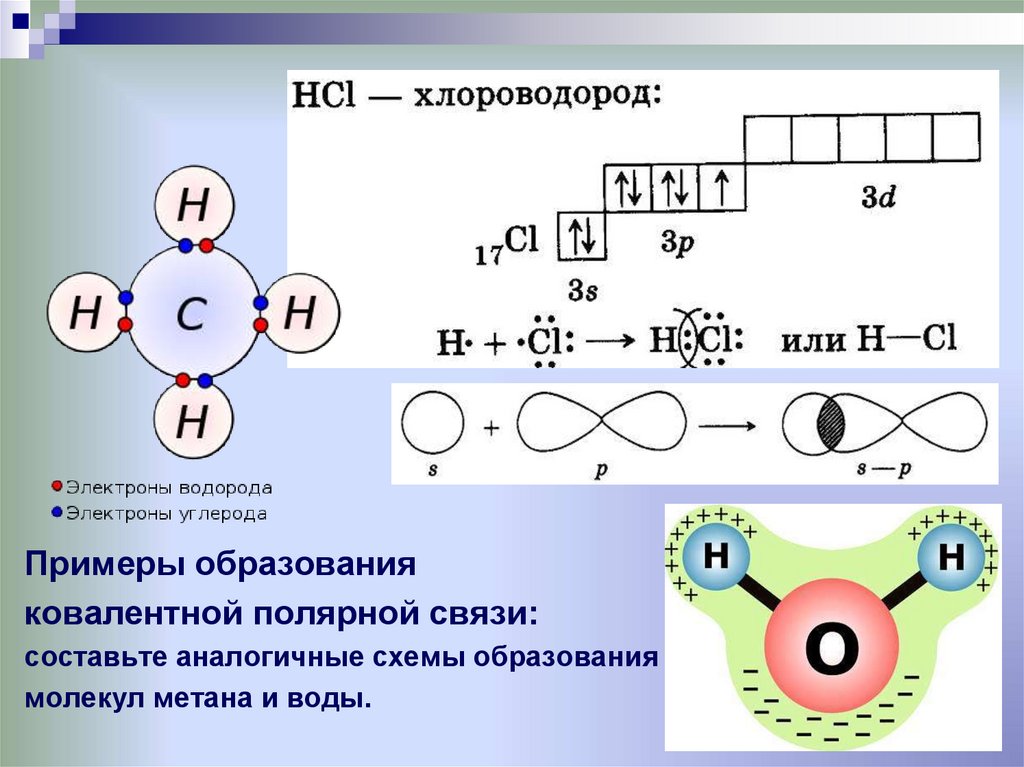
Примеры образованияковалентной полярной связи:
составьте аналогичные схемы образования
молекул метана и воды.
9. Полярность ковалентной связи -
Полярность ковалентной связи это степень смещенности общих электронныхпар к одному из связанных ими атомов
Неполярная ковалентная связь
образуется между атомами с
одинаковой ЭО
H H
Полярная ковалентная связь
образуется между атомами с
разной ЭО
Электроотрицательность (ЭО)
— свойство атомов оттягивать к
себе валентные электроны от других
атомов
H Br
10. Полярность ковалентной связи
зависит от разности электроотрицательностисвязанных атомов
H - I
ЭО
∆ЭО
2,1
2,5
0,4
H - Br
2,1
2,8
0,7
H - Cl
2,1
3,0
0,9
Полярность связей и молекул увеличивается
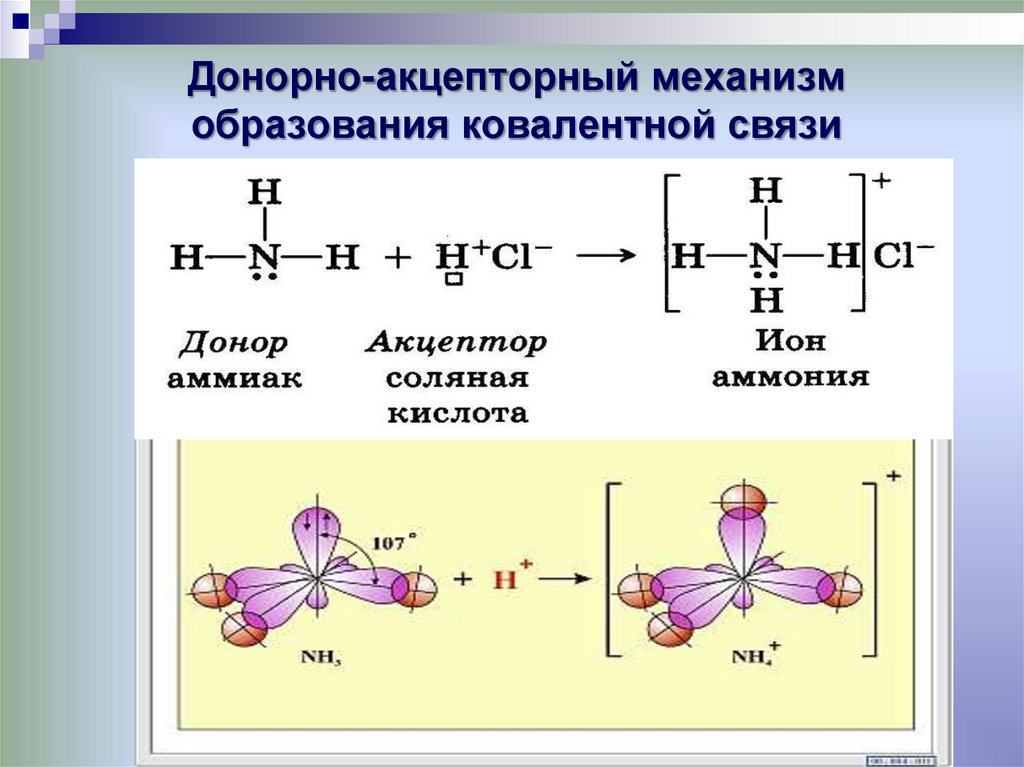
11. Донорно-акцепторный механизм образования ковалентной связи
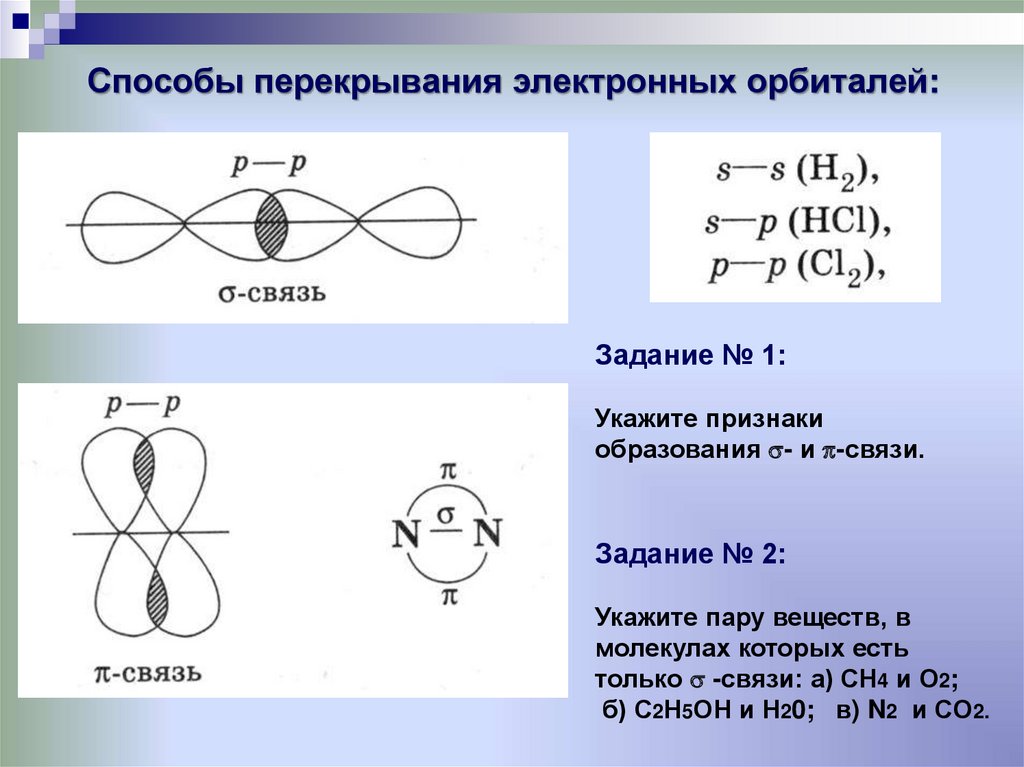
12. Способы перекрывания электронных орбиталей:
Задание № 1:Укажите признаки
образования - и -связи.
Задание № 2:
Укажите пару веществ, в
молекулах которых есть
только -связи: а) СН4 и О2;
б) С2Н5ОН и Н20; в) N2 и CO2.
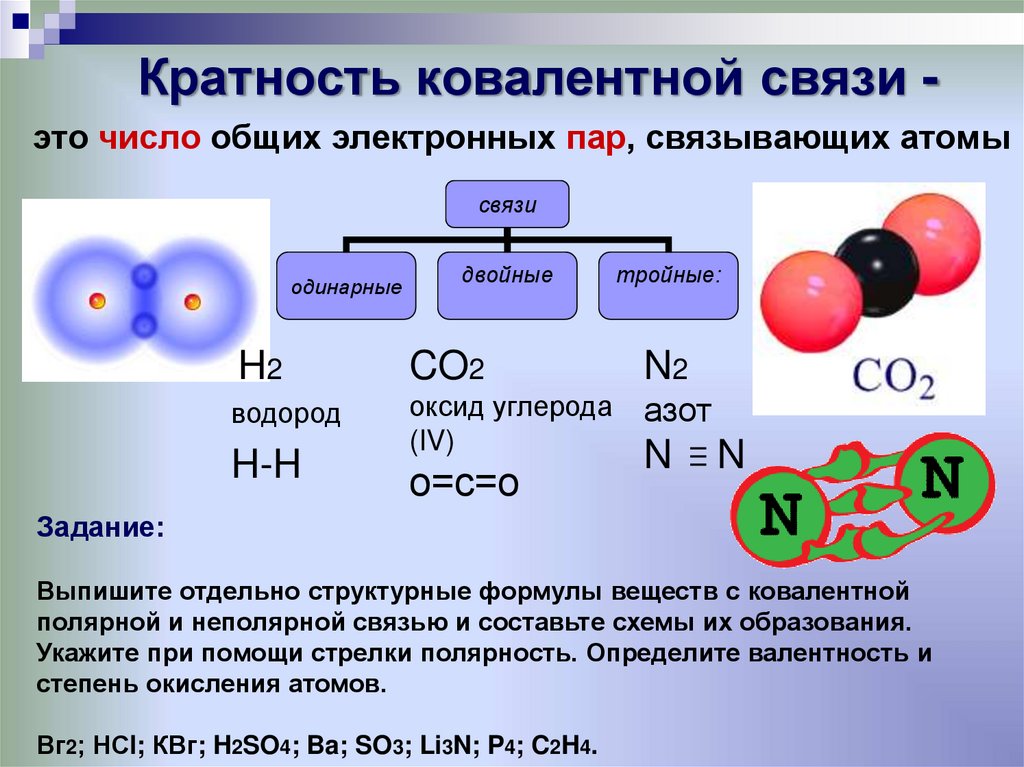
13. Кратность ковалентной связи -
Кратность ковалентной связи это число общих электронных пар, связывающих атомысвязи
одинарные
двойные
тройные:
H2
CO2
N2
водород
оксид углерода
(IV)
азот
H-H
о=с=о
N
N
Задание:
Выпишите отдельно структурные формулы веществ с ковалентной
полярной и неполярной связью и составьте схемы их образования.
Укажите при помощи стрелки полярность. Определите валентность и
степень окисления атомов.
Вг2; НСl; КВг; H2SO4; Ba; SO3; Li3N; P4; C2H4.
14. Кристаллические вещества с ковалентным типом связи
атомная кристаллическаярешетка, отличается
высокой прочностью,
твердостью,
тугоплавкостью
алмаз
другие примеры:
Si, B, Ge,
SiC- карборунд,
SiO2 - кварц (песок)
графит
15. Кристаллические вещества с ковалентным типом связи
молекулярнаякристаллическая решетка,
вещества нестойкие,
легкоплавкие, летучие
Примеры:
Н2О - лед, P4, S8, I2
СО2 (твердый) – «сухой» лед
СО2
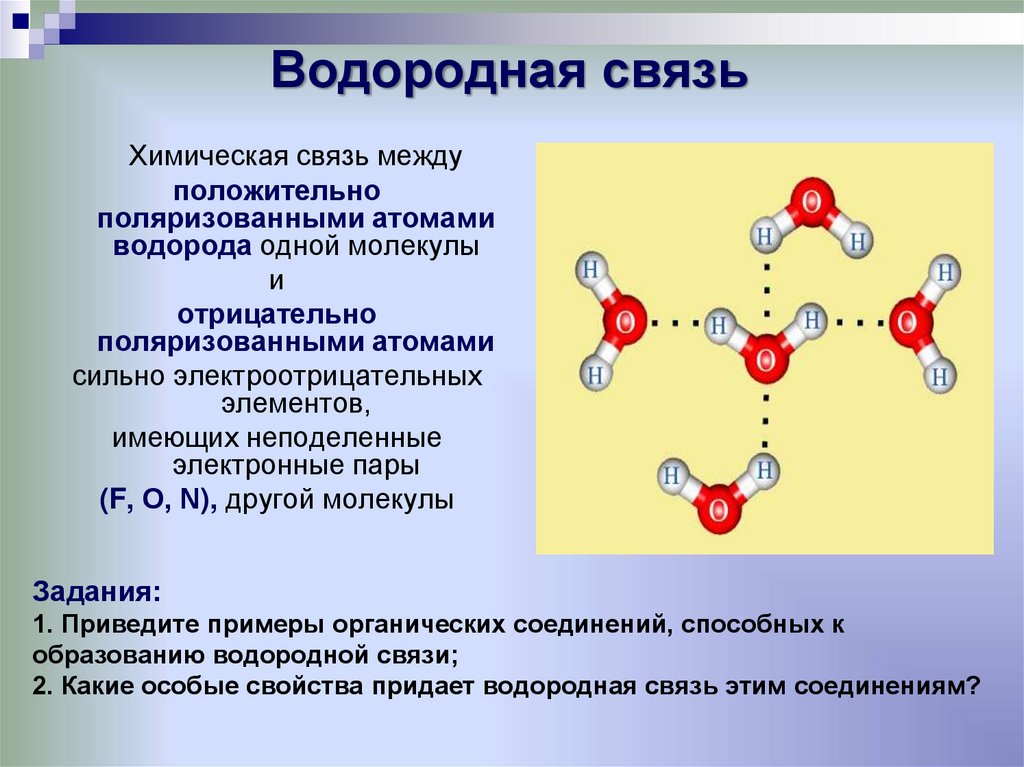
16. Водородная связь
Химическая связь междуположительно
поляризованными атомами
водорода одной молекулы
и
отрицательно
поляризованными атомами
сильно электроотрицательных
элементов,
имеющих неподеленные
электронные пары
(F, О, N), другой молекулы
Задания:
1. Приведите примеры органических соединений, способных к
образованию водородной связи;
2. Какие особые свойства придает водородная связь этим соединениям?
17. Влияние типа кристаллической решетки на свойства вещества:
ВеществоТип крист.
решетки
Свойства
вещества
Все соли, щелочи,
некоторые оксиды
ИОННАЯ
твердые, прочные,
тугоплавкие, нелетучие
твердые, прочные,
тугоплавкие, нелетучие,
нерастворимые
Алмаз C, бор В,
гермaний Ge,
кремний Si, SiO2, Al2O3
Все металлы
(ионная связь)
АТОМНАЯ
(ковалентная
связь)
МЕТАЛЛИЧЕСКАЯ
(металлическая
связь)
Лед, «сухой» лед, все
твердые газы, иод,
сера, фосфор,
кислоты, органические
вещества
МОЛЕКУЛЯРНАЯ
(ковалентная
связь)
ковкие, пластичные,
электро- и теплопроводные
непрочные,
легкоплавкие, летучие; при
обычных условиях могут
быть Г, Ж и Т
18. Задания:
1. Определите типы химических связей междуатомами в веществах:
CaВг2; НСl; К; H2SO4; BaO; SO2; LiNО3; S8; C2H2; Na; HCОOК.
2. Установите черты сходства между ионной и
ковалентной полярной связью; между металлической
и ионной связью.
3. Приведите примеры веществ, в которых
присутствуют разные типы химической связи.
4. Приведите примеры перехода одного типа
химической связи в другую.
19. Проверьте себя:
1.1.
2.
3.
4.
Ионная: CaВг2; BaO; LiNО3; HCОOК.
Металлическая: К; Na.
Ковалентная полярная: НСl; H2SO4; SO2; C2H2.
Ковалентная неполярная: S8.
При образовании ионной и ковалентной полярной связи происходит перемещение электронов между взаимодействующими атомами.
Ионную связь можно рассматривать как предельный случай
ковалентной полярной связи.
2. В металлической и ионной связи происходит электростатическое
взаимодействие разноимённо заряженных частиц.
2.
1.
3.
NaOH, K2SO4, NH4Cl, H2O2, Na2O2, CH2=CH2, CH3-COONa.
1.
4.
2.
При электролитической диссоциации в воде соединений с ковалентной полярной связью ( HCl) ковалентная связь переходит в
ионную.
При испарении металлов металлическая связь превращается в
ковалентную неполярную (в парАх существуют молекулы Na2).
20. ВЫВОД:
Причиной единствавсех типов и видов
химической связи
служит их одинаковая
природа –
электронноядерное
взаимодействие.
21. Самостоятельная работа
Для указанных веществ приведите электронные иструктурные (где это необходимо) формулы, укажите тип
связи, значения валентностей и (или) степеней
окисления элементов. Какие кристаллические решетки
будут образовывать данные вещества? Какие их
свойства можно предсказать исходя из строения
молекул?
Вариант 1
Вариант 2
Вариант 3
Вариант 4
F2, C2H5OH,
KBr, H2O
N2, CH3COH,
LiF, NH3
O2 , C 2 H 6 ,
NaI, HCl
Cl2, CH3COOH,
LiCl, H2S
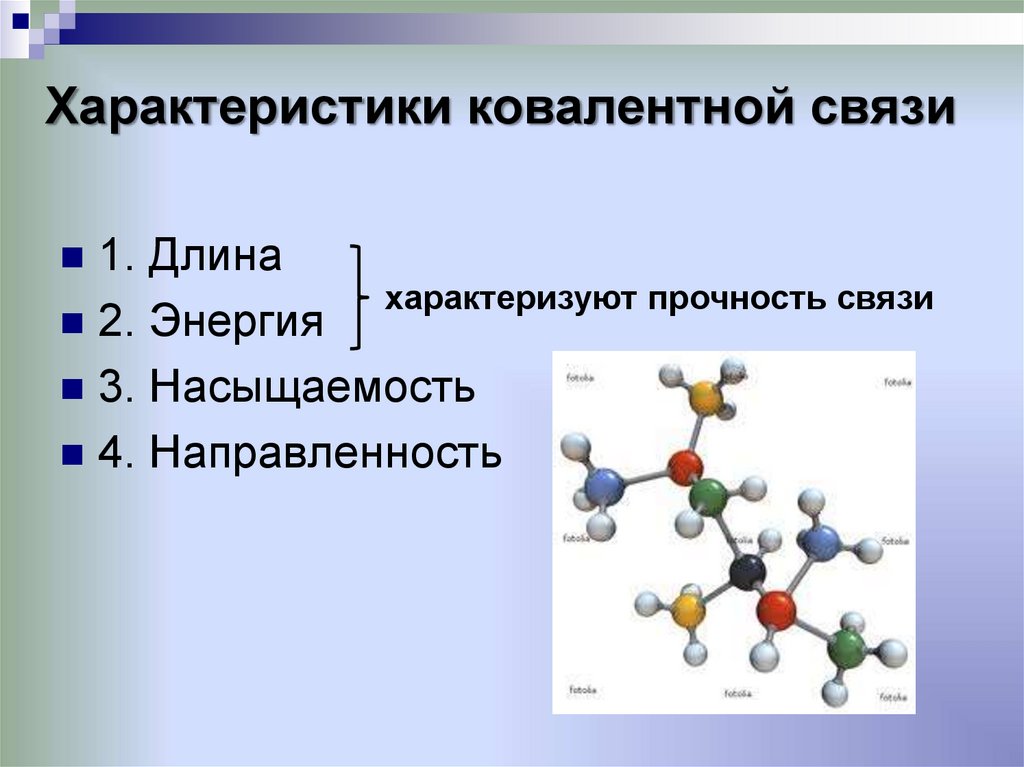
22. Характеристики ковалентной связи
1. Длинахарактеризуют прочность связи
2. Энергия
3. Насыщаемость
4. Направленность
23. 1. Длина связи – межъядерное расстояние, нм (10-9м)
Зависит А) от способа перекрывания орбиталейН-Н (s-s)
Cl-Cl (p-p)
0,074 нм
436 кДж/моль
0,198 нм
242 кДж/моль
Б) от кратности связи
С
С
0,154 нм
348 кДж/моль
длина
энергия
С
С
0,134 нм
627 кДж/моль
В) от радиуса атома
H-F
H-Cl
0,092 нм
565 кДж/моль
С
0,128 нм
431 кДж/моль
С
0,120 нм
810 кДж/моль
H-Br
H-I
0,141 нм
364 кДж/моль
0,160 нм
297 кДж/моль
24. 2. Энергия связи – энергия, необходимая для разрыва связи в расчете на 1 моль вещества.
Зависит от тех же факторов, что и длина связи (способаперекрывания орбиталей, кратности связи, радиуса
атомов).
Н
Н
С
Н
Н +
hv
Cl
Cl
Н
Н
С Cl + H
Cl + Q
Н
Можно рассчитать тепловой эффект реакции, пользуясь
величинами энергии связей:
Q = EC-Cl + EH-Cl - EC-H - ECl-Cl
25. 3. Насыщаемость связи -
3. Насыщаемость связи образование атомом определенного количестваковалентных связей, ограниченного числом
валентных электронов (как неспаренных, так и
НЭП).
1. Вспомните, чем определяются валентные
возможности атомов химических элементов?
2. Приведите примеры возможных валентностей
для элементов: C и Si, N и P, O и S, F и Cl.
3. Какие из названных элементов не проявляют
валентность, равную номеру группы?
4. Как вы думаете, обладают ли ионная и
металлическая связь насыщаемостью. Почему?
26. Проверьте себя:
1. Валентные возможности атомов химических элементовопределяются:
А) Числом неспаренных (валентных) электронов на внешнем
энергетическом уровне;
Б) Наличием свободных орбиталей;
В) Наличием НЭП.
2. Валентность:
CIV и SiIV, NIII и PIII,V
OII и SII,IV,VI, FI и ClI,III,V,VII.
3. Элементы N, O и F не проявляют валентность, равную номеру группы
(максимально – 4!)
4. Ионная и металлическая связь не обладают свойством
насыщаемости, т.к. электростатические силы действуют равномерно
вокруг ядра.
27. 4. Направленность связи -
4. Направленность связи определённая локализация её впространстве, определяет
геометрию молекулы.
Направленность напрямую связана с
гибридизацией орбиталей.
Гибридизация обеспечивает:
А) эквивалентность орбиталей;
Б) наибольшее их перекрывание;
В) максимальное удаление в
пространстве друг от друга.
Ионная и металлическая
связь не обладают
свойствами
направленности и
локализации в
пространстве
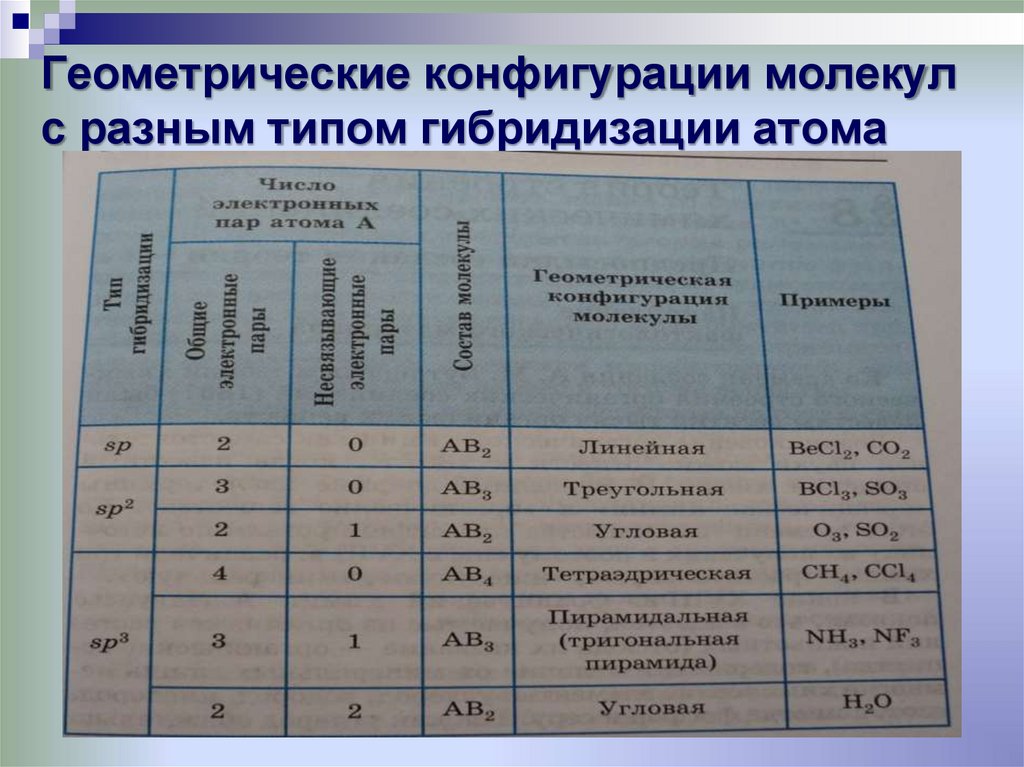
28. Геометрические конфигурации молекул с разным типом гибридизации атома
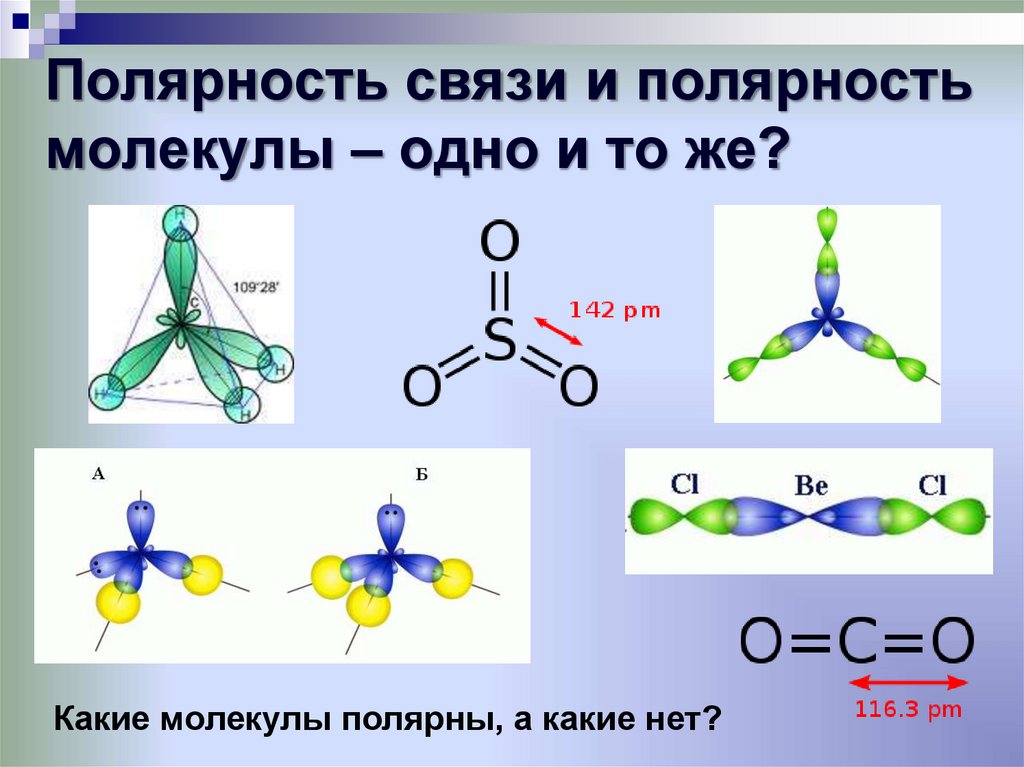
29. Полярность связи и полярность молекулы – одно и то же?
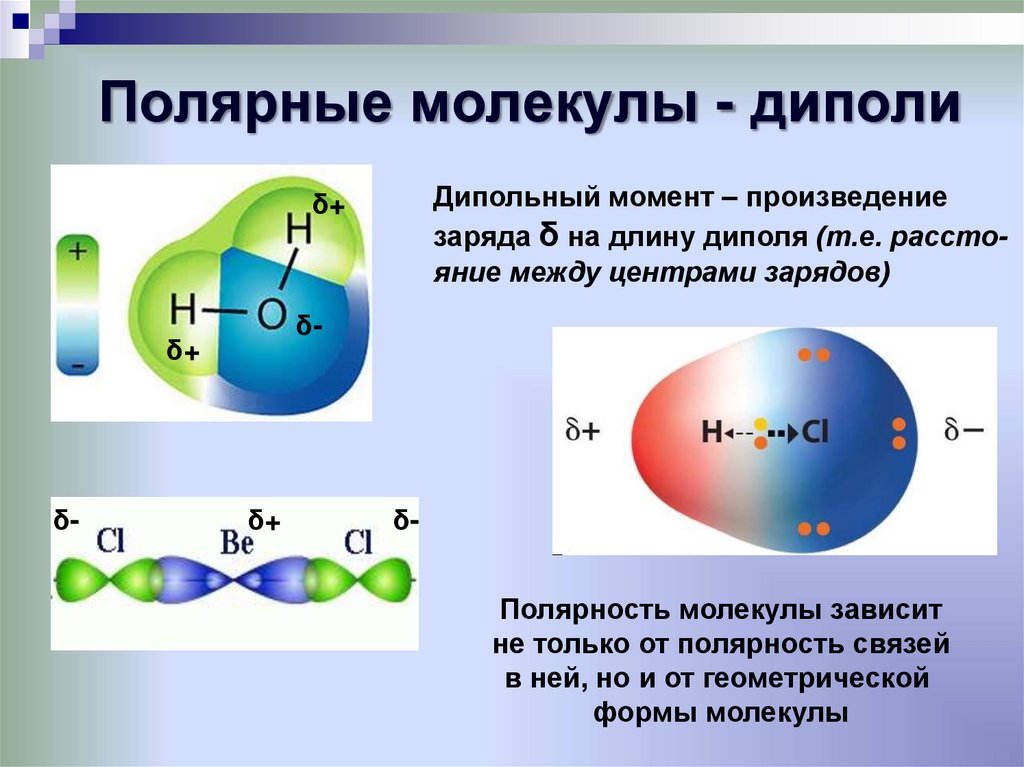
Какие молекулы полярны, а какие нет?30. Полярные молекулы - диполи
Дипольный момент – произведениезаряда δ на длину диполя (т.е. расстояние между центрами зарядов)
δ+
δ-
δ+
δ-
δ+
δ-
Полярность молекулы зависит
не только от полярность связей
в ней, но и от геометрической
формы молекулы
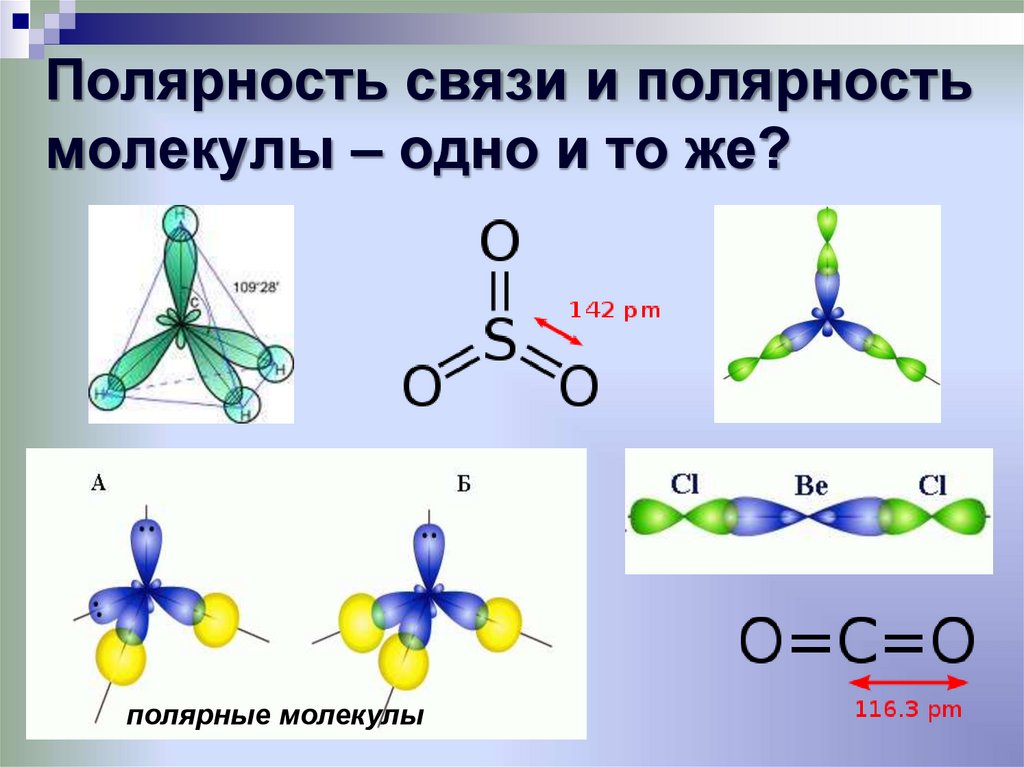
31. Полярность связи и полярность молекулы – одно и то же?
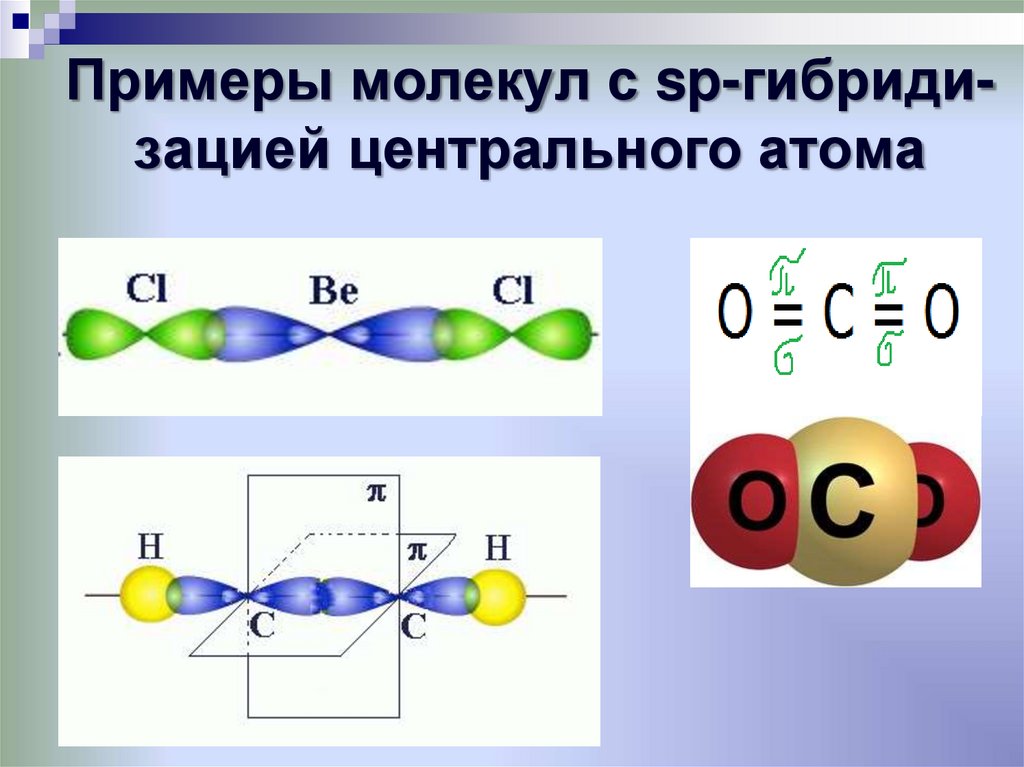
полярные молекулы32. Примеры молекул с sp-гибриди-зацией центрального атома
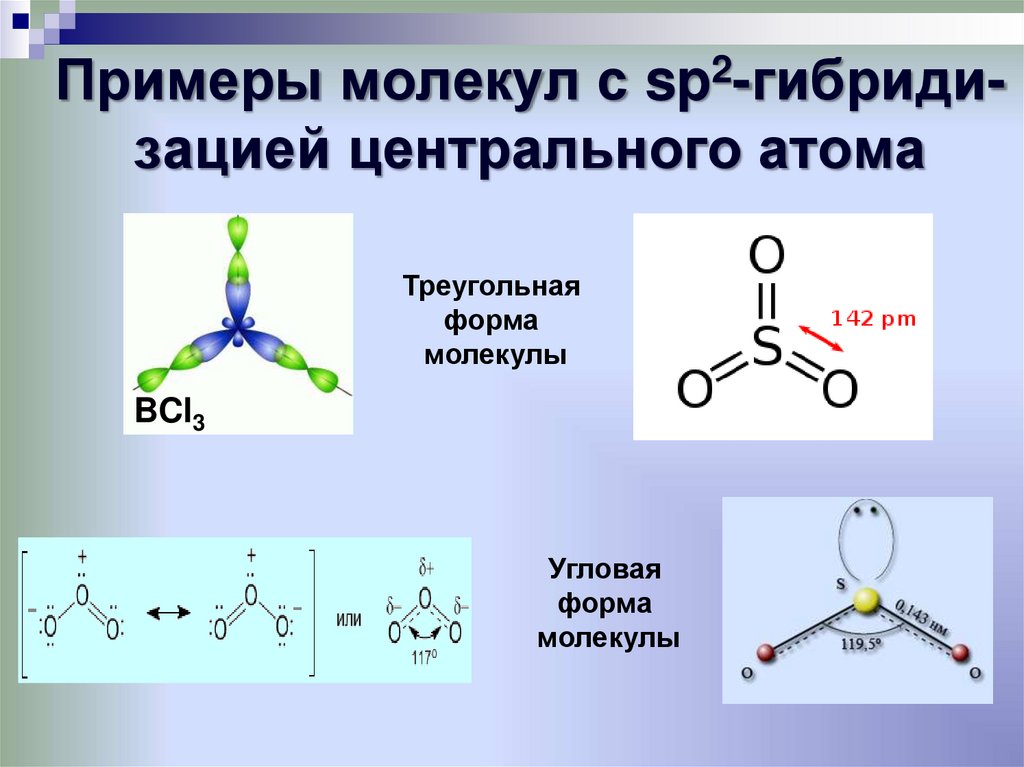
Примеры молекул с sp-гибридизацией центрального атома33. Примеры молекул с sp2-гибриди-зацией центрального атома
Примеры молекул с sp2-гибридизацией центрального атомаТреугольная
форма
молекулы
BCl3
Угловая
форма
молекулы
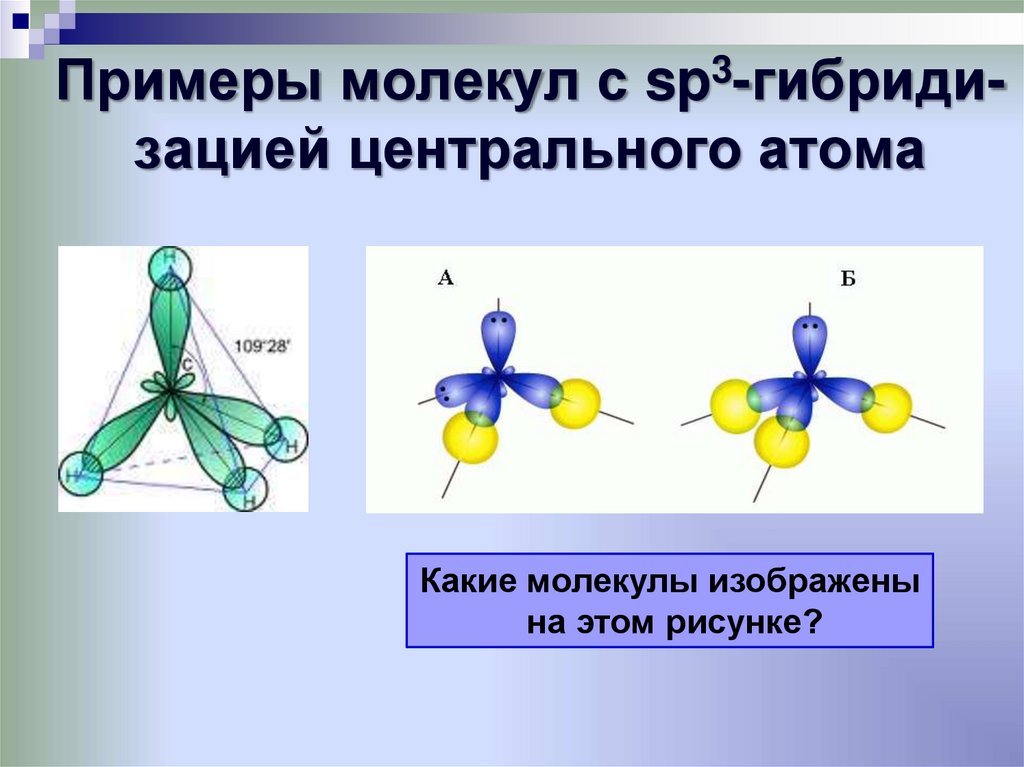
34. Примеры молекул с sp3-гибриди-зацией центрального атома
Примеры молекул с sp3-гибридизацией центрального атомаКакиеАмолекулы
Н2О,
Бизображены
– NH3
на этом рисунке?



















 Химия
Химия








