Похожие презентации:
Растворы. Качественный и количественный состав растворов
1.
Учение о РастворахРаствор – это термодинамически устойчивая гомогенная система
переменного состава, состоящая из двух или более компонентов.
2.
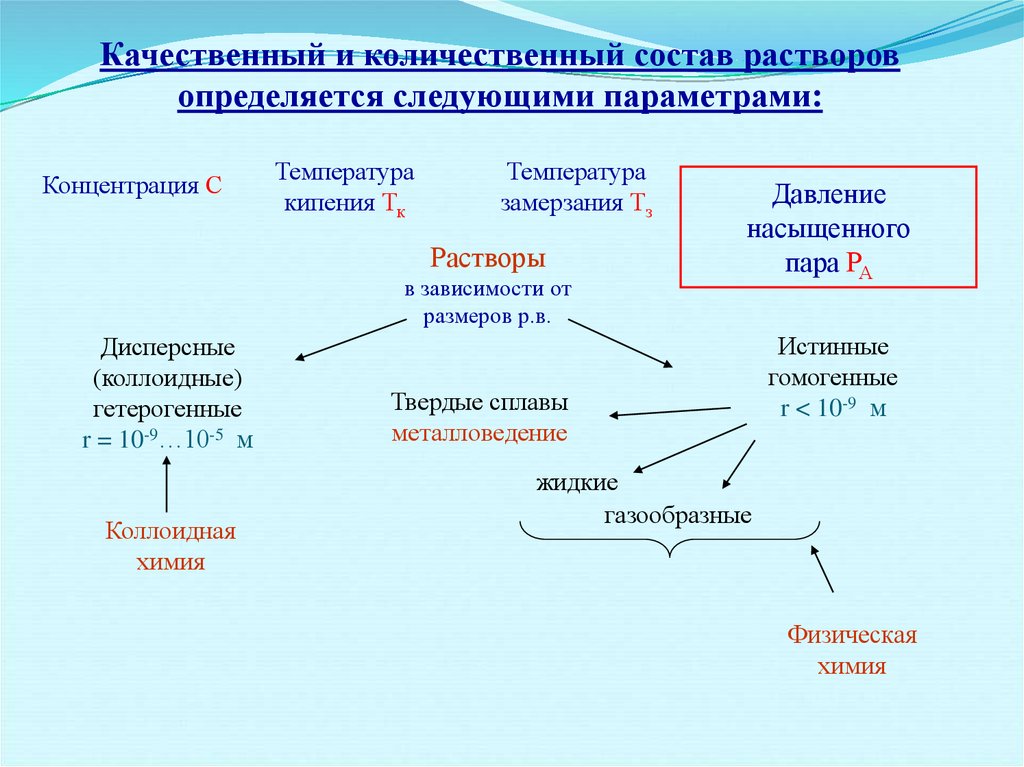
Качественный и количественный состав растворовопределяется следующими параметрами:
Концентрация С
Температура
кипения Тк
Температура
замерзания Тз
Растворы
в зависимости от
размеров р.в.
Дисперсные
(коллоидные)
гетерогенные
r = 10-9…10-5 м
Коллоидная
химия
Давление
насыщенного
пара РА
Твердые сплавы
металловедение
Истинные
гомогенные
r < 10-9 м
жидкие
газообразные
Физическая
химия
3.
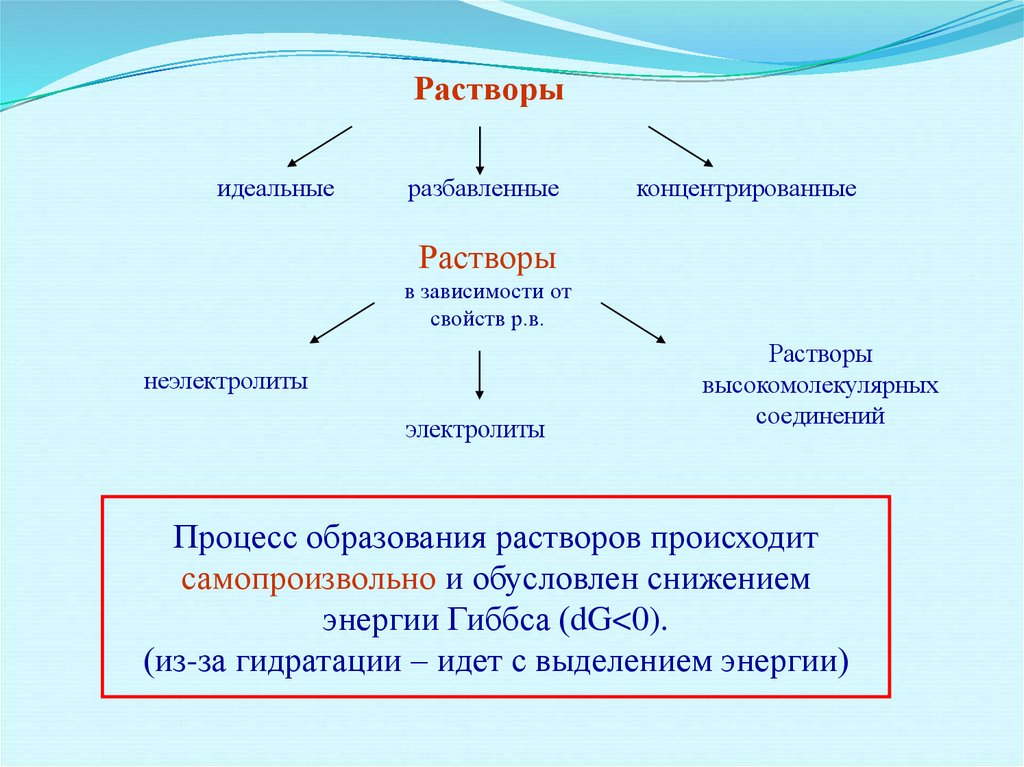
Растворыидеальные
разбавленные
концентрированные
Растворы
в зависимости от
свойств р.в.
неэлектролиты
электролиты
Растворы
высокомолекулярных
соединений
Процесс образования растворов происходит
самопроизвольно и обусловлен снижением
энергии Гиббса (dG<0).
(из-за гидратации – идет с выделением энергии)
4.
Давление насыщенного пара над раствором.Закон Рауля.
РА0
А
РА0 - давление насыщенного пара над чистым растворителем
РА
А+В
РА – давление насыщенного пара над раствором
РА0 ≠ PА
парциальное давление насыщенного пара компонента раствора Pio
пропорционально его мольной доле в растворе Ni :
Pi Pio N iж
(1) – Закон Рауля (1887 г.)
где Pio - давление насыщенного пара над чистым компонентом i при Niж =1.
5.
Рассмотрим бинарный идеальный раствор, состоящий из летучих компонентов А и В инаходящийся в равновесии со своим паром. В соответствии с законом Рауля парциальное
давление насыщенного пара каждого компонента при любой заданной температуре
пропорционально его мольной доле в растворе:
PА = PАо NАж ,
(2)
PВ = PВо NВж
(3)
где NАж , NBж - мольные доли компонентов А и В в растворе;
PАo, PBo - давление насыщенного пара над чистыми веществами
А и В (при NАж = 1 и NBж = 1).
N А 1 NВ
(4)
Подставив (4) в (2), получим (5)
РА0 РА
NB
0
РА
(5) – Закон Рауля
6.
Относительное понижение давления пара растворителя над раствором равно мольнойдоле растворенного вещества.
Общее давление насыщенного пара над раствором равно:
Р = РАо NАж + PВо NВж;
P = PАо (1 - NВо) + PВо NВж;
P = PАо + (PВо - PАо) NВж .
(6)
Растворы, для которых закон Рауля выполняется при всех концентрациях и
температурах, называются идеальными. Они образуются веществами, близкими по
свойствам. Примерами растворов, близких к идеальным, могут служить смеси: бензол
- толуол, гексан - гептан, хлорбензол - бромбензол и др.
Большинство растворов отклоняется от закона Рауля, т.е. они являются
неидеальными. Очень многие растворы подчиняются закону Рауля лишь при малых
концентрациях.
7.
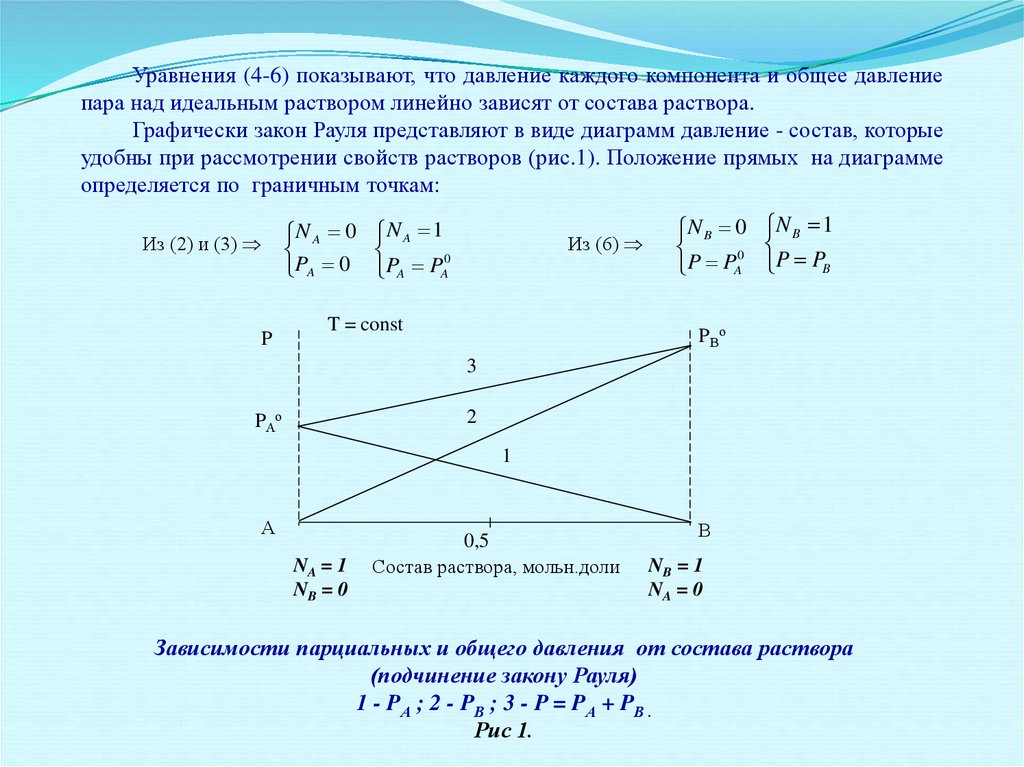
Уравнения (4-6) показывают, что давление каждого компонента и общее давлениепара над идеальным раствором линейно зависят от состава раствора.
Графически закон Рауля представляют в виде диаграмм давление - состав, которые
удобны при рассмотрении свойств растворов (рис.1). Положение прямых на диаграмме
определяется по граничным точкам:
Из (2) и (3)
P
N A 0 N A 1
0
PA 0 PA PA
Из (6)
T = const
N B 0 N B 1
0
P
P
P PB
A
PВо
3
PАо
2
1
А
NA = 1
NB = 0
0,5
Состав раствора, мольн.доли
В
NB = 1
NA = 0
Зависимости парциальных и общего давления от состава раствора
(подчинение закону Рауля)
1 - PА ; 2 - PВ ; 3 - P = PА + PВ .
Рис 1.
8. Для неидеальных летучих смесей закон Рауля выполняется только для растворителя и только в области предельно-разбавленных растворов
Испарение растворенного вещества в области предельно-разбавленных растворов подчиняется закону Генри
9.
Закон ГенриPB=PB0 NB;
PB0 = КГ;
В идеальном растворе Закон
Генри совладает с Законом
Рауля – для растворенного
вещества.
РB = КГ NB; (7)
Или NB = КГ’ PB (7’)
где
1
K
KГ
1
Г
Для газов: при небольших Р
растворимость газов пропорциональна Р
(Т , NB ; P , NB )
Примеры:
Н2 – 0,0016 г/100г H2O
(8) N2 – 0,002 г/100г H2O
O2 – 0,0045 г/100г H2O
NH3 – 55,4
Больше из-за
HCl – 73,4
химического
SO2 – 12,13
взаимодействия
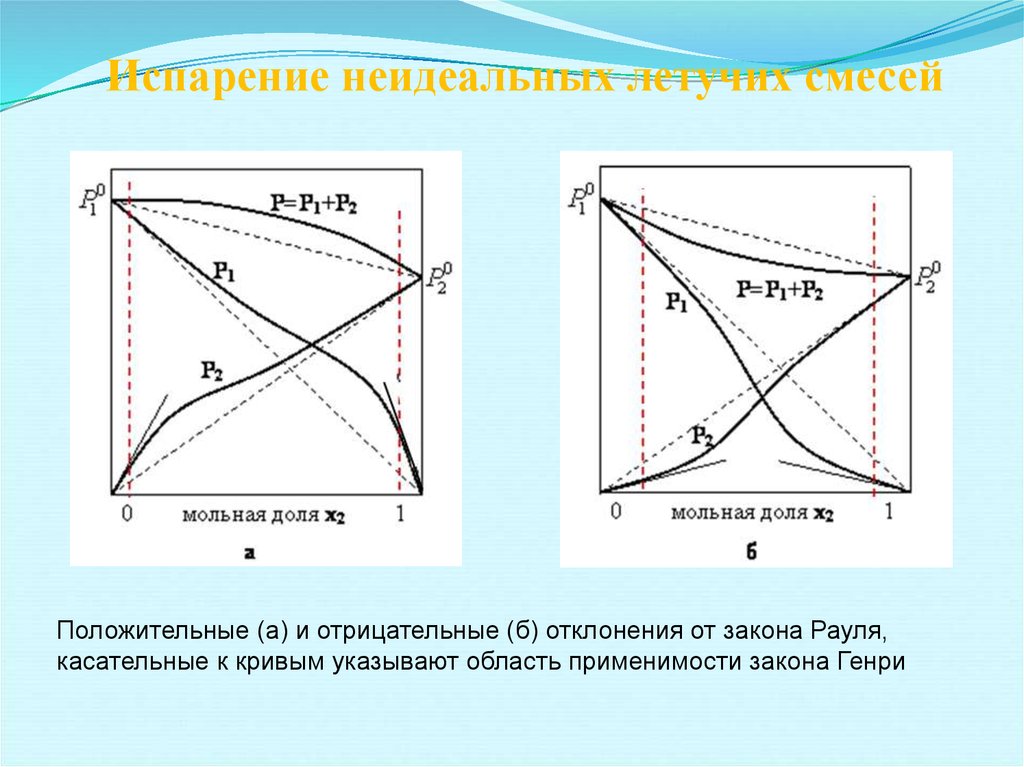
10. Испарение неидеальных летучих смесей
Положительные (а) и отрицательные (б) отклонения от закона Рауля,касательные к кривым указывают область применимости закона Генри
11.
Отклонения от закона РауляРеальные растворы
Идеальные растворы
T = const
P
PВ
о
P
«+»
T = const
«-»
PВ
о
P
T = const
3
PАо
2
PВо
PАо
PАо
1
А
0,5
FА-В = FА-А = FВ-В
H = 0
V = 0
В
А
0,5
В
FА-В < FА-А
FА-В < FВ-В
H > 0
V > 0
Р
«+» образование раствора
затруднено
А
В
0,5
FА-В > FА-А
FА-В > FВ-В
H < 0
V < 0
Р
«-» образование раствора
облегчено
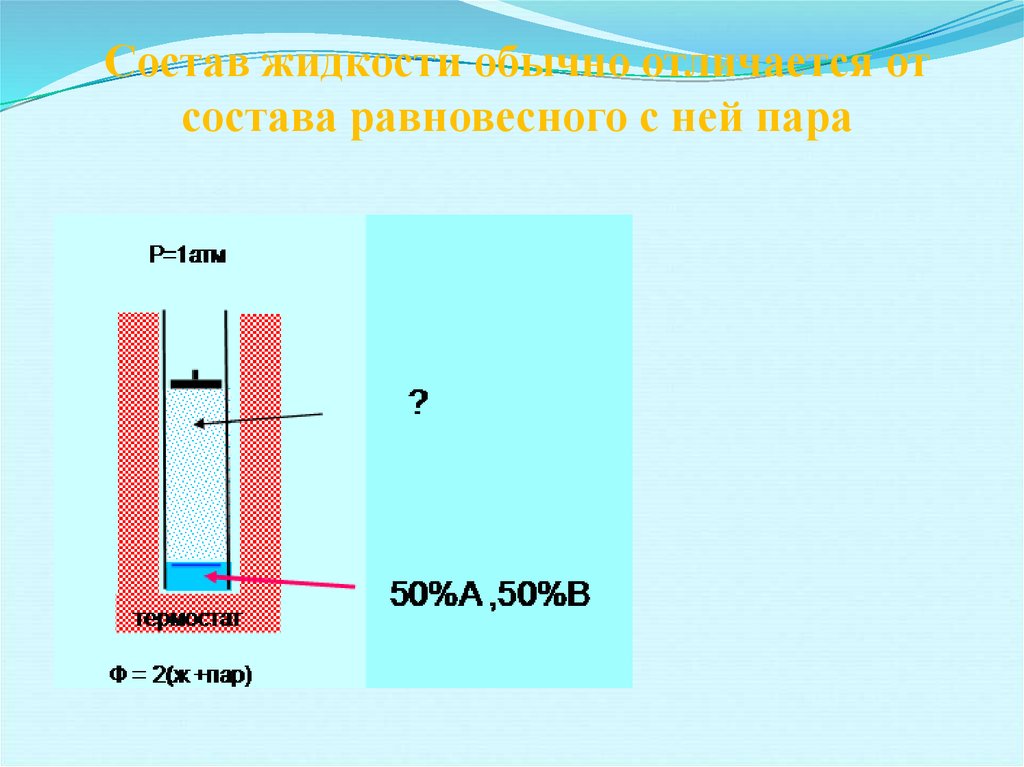
12. Состав жидкости обычно отличается от состава равновесного с ней пара
13.
Соотношение между составом пара и составом жидкостиВ общем случае состав пара отличается от состава идеального жидкого раствора.
Для нахождения взаимосвязи между ними воспользуемся уравнениями Дальтона и Рауля.
PB P N Bn
PB PB0 N Bж
(8)
тогда мольная доля компонента В в паре:
N Bп
P N
PAo ( P P ) N Bж (10)
o
B
o
B
ж
B
o
A
(9)
PB
N
P
п
B
( PBo / PBo ) N Bж
N o
PA / PBo ( PBo / PBo ) N Bж ( PAo / PBo ) N Bж
п
B
Если РВо > Рао т.е. В-более летучий и
обозначить РАо/РВо= , имеем
N Bж
( PAo / PBo ) (1 N Bж ) N Bж
ж
N
B
N Bп
.
ж
ж
(1 N B ) N B
(11)
(12)
Для случая < 1, следовательно, знаменатель уравнения (12) меньше 1, тогда:
N Bn N Bж ,
(13)
т.е. пар содержит больше более летучего компонента.
14.
Новый тип диаграммДавление насыщенного пара –
состав ( Р = f (N) при Т = const);
T = const
P
PВо
ж
I
L
ж⇄ п
M п N
PАо
Температура кипения –
состав (Ткип = f (N) при P = const) .
P = const
T
II
TАо
PМ
D
А
NA = 1
В
А
NB = 1
x1
TD
TВо
ж
I
II
x2
состав
F
Е
пар
x1
пар
ж⇄п
состав
NA = 1
x2
В
NB = 1
Правило рычага, например, для системы, характеризуемой точкой D:
mп
DE
mж DF
I закон
Коновалова
(15)
Пар по сравнению с равновесной жидкостью богаче чем компонентом,
добавлением которого в систему повышает общее давление пара или понижает
Ткип смеси при данном внешнем Р (т.е. пар богаче более летучим компонентом).
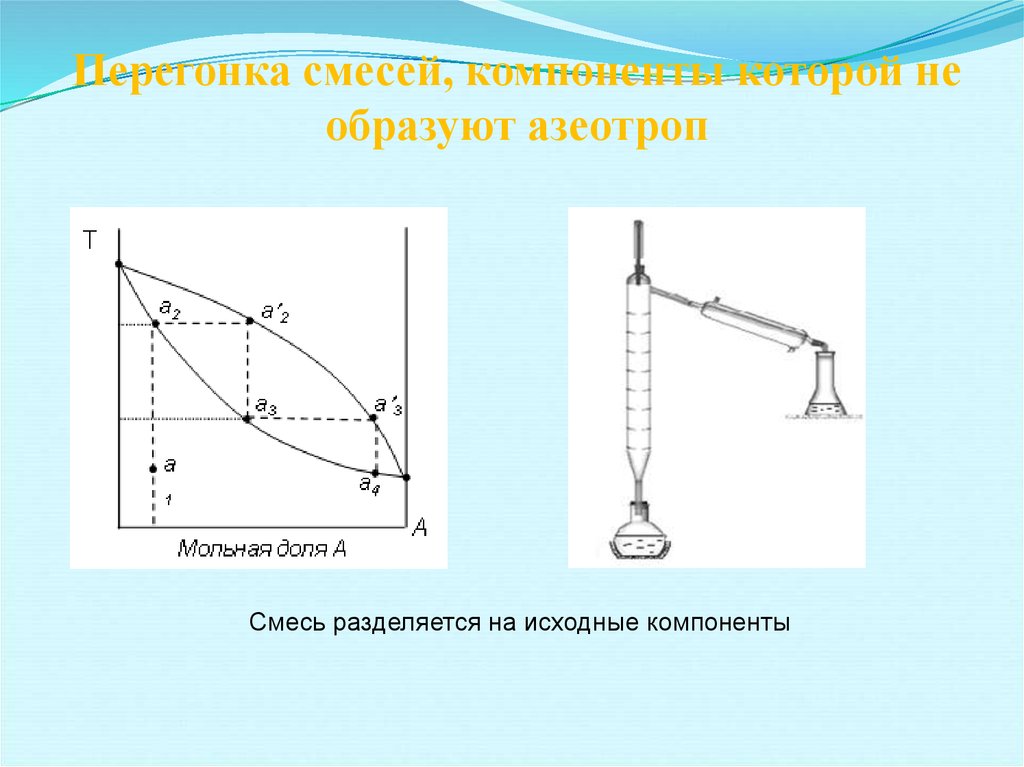
15. Перегонка смесей, компоненты которой не образуют азеотроп
Смесь разделяется на исходные компоненты16.
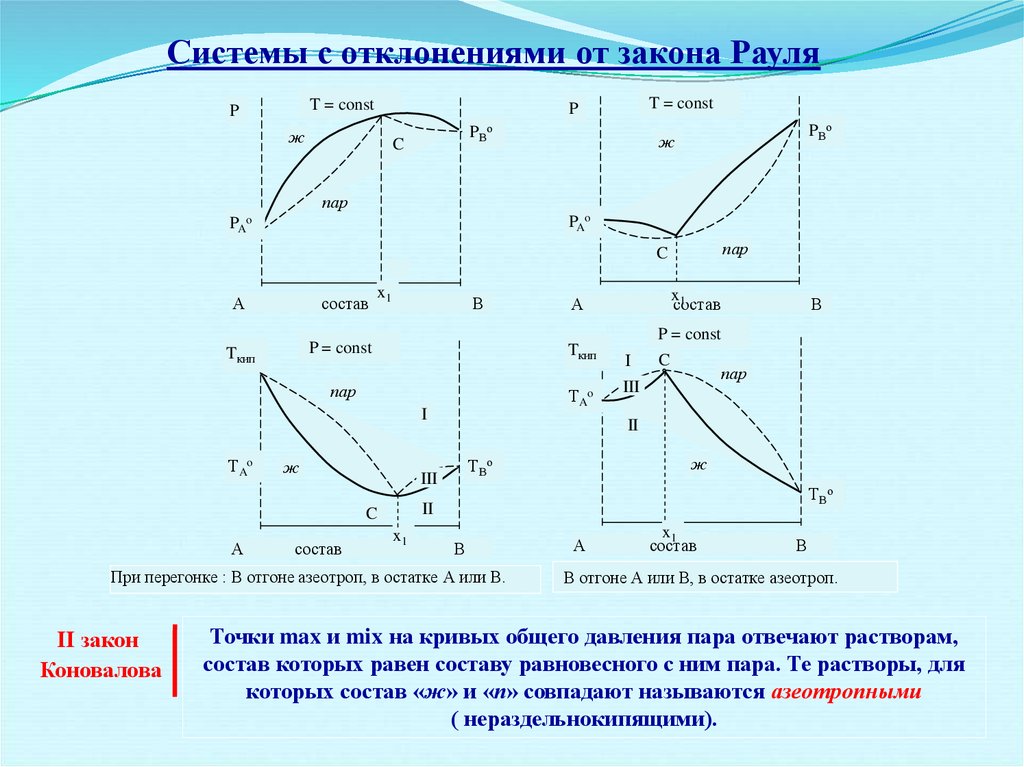
Системы с отклонениями от закона РауляT = const
P
T = const
P
ж
PВо
C
PВо
ж
пар
PAo
PAo
пар
C
x1
А
состав
В
Tкип
P = const
Tкип
пар
ТAo
ж
состав
C
пар
III
ж
ТВо
ТВо
II
x1
В
При перегонке : В отгоне азеотроп, в остатке А или В.
II закон
Коновалова
I
II
III
C
А
В
P = const
I
ТAo
x1
состав
А
А
x1
состав
В
В отгоне А или В, в остатке азеотроп.
Точки max и mix на кривых общего давления пара отвечают растворам,
состав которых равен составу равновесного с ним пара. Те растворы, для
которых состав «ж» и «п» совпадают называются азеотропными
( нераздельнокипящими).
17. Перегонка смесей, компоненты которой образуют азеотроп
Смесь разделяется на азеотроп и один из чистых компонентов18.
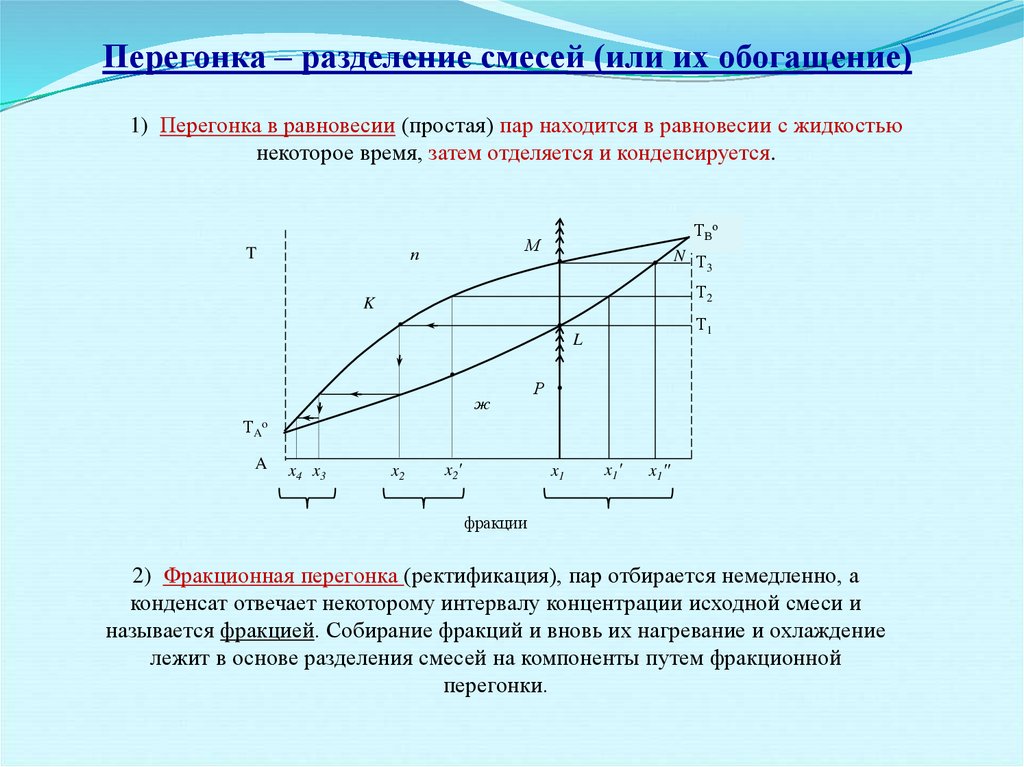
Перегонка – разделение смесей (или их обогащение)1) Перегонка в равновесии (простая) пар находится в равновесии с жидкостью
некоторое время, затем отделяется и конденсируется.
М
п
T
ТВо
N Т
3
Т2
K
Т1
L
ж
Р
ТAo
A
x4 x3
x2
x2′
x1
x1′
x1′′
фракции
2) Фракционная перегонка (ректификация), пар отбирается немедленно, а
конденсат отвечает некоторому интервалу концентрации исходной смеси и
называется фракцией. Собирание фракций и вновь их нагревание и охлаждение
лежит в основе разделения смесей на компоненты путем фракционной
перегонки.
19.
Схема фракционной перегонки жидких летучих смесей сазеотропом
P = const
T
Т
P = const
пар
Таз.кип.
ТВ
пар
ТA
ТA
Таз.кип.
ТВ
ж
ж
А
x1
азеотроп
а
x2
В
А
x1
x2
азеотроп
б
В
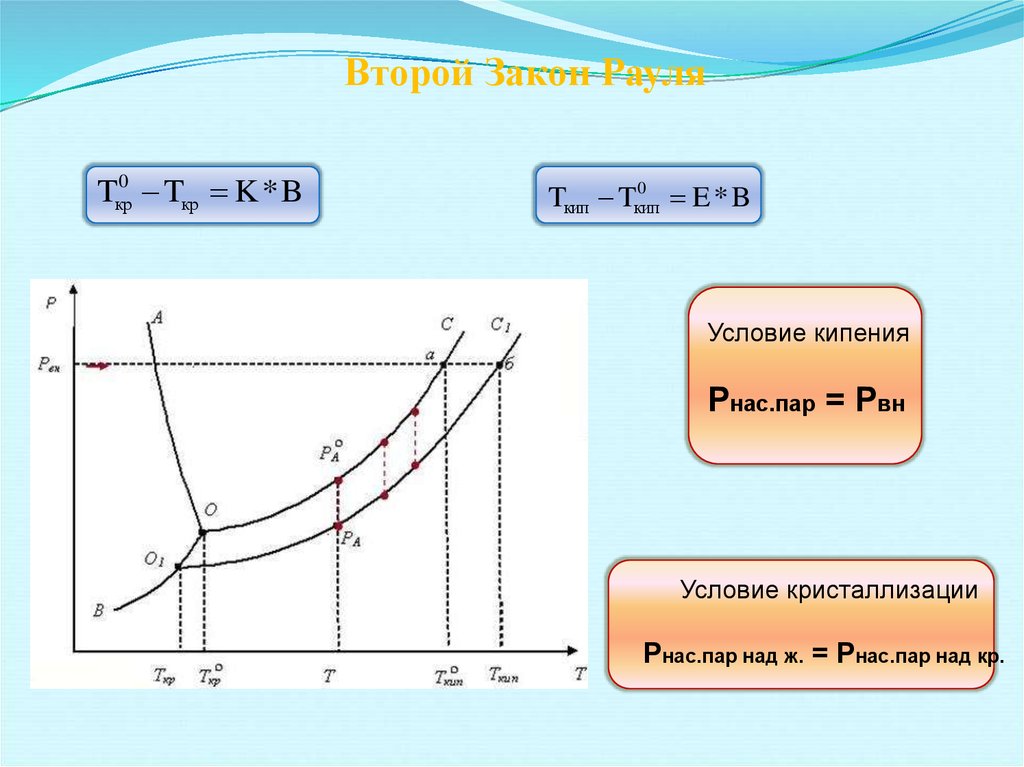
20. Второй Закон Рауля
Tкр0 Tкр K * B0
Tкип Tкип
E*B
Условие кипения
Рнас.пар = Рвн
Условие кристаллизации
Рнас.пар над ж. = Рнас.пар над кр.
21.
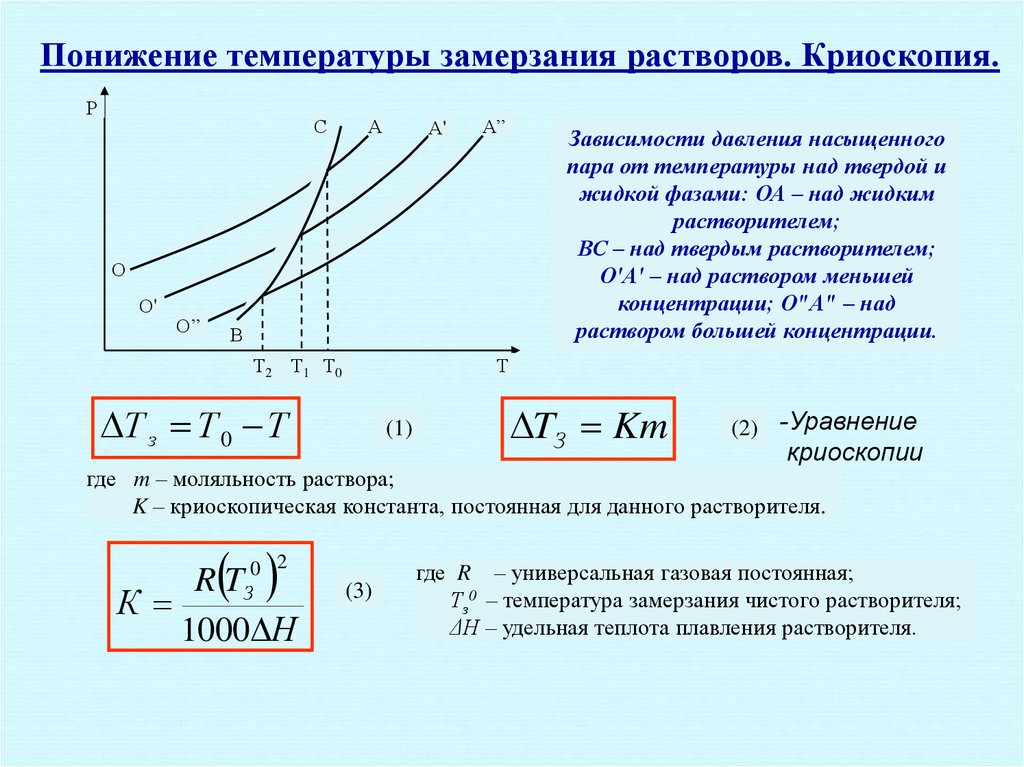
Понижение температуры замерзания растворов. Криоскопия.Р
С
А
А'
А’’
О
О'
О’’
В
Зависимости давления насыщенного
пара от температуры над твердой и
жидкой фазами: ОА – над жидким
растворителем;
ВС – над твердым растворителем;
О′А' – над раствором меньшей
концентрации; О"А" – над
раствором большей концентрации.
Т
Т2 Т1 Т0
Т з Т 0 Т
(1)
TЗ Km
(2) -Уравнение
криоскопии
где m – моляльность раствора;
K – криоскопическая константа, постоянная для данного растворителя.
0 2
З
RT
К
1000 Н
(3)
где R – универсальная газовая постоянная;
Тз0 – температура замерзания чистого растворителя;
ΔН – удельная теплота плавления растворителя.
22.
g 2 1000m
g1 M 2
g 2 1000
M2 K
g1 TЗ
(4)
(5)
Для разбавленных растворов электролитов в уравнение криоскопии (3) вводят
изотонический коэффициент Вант - Гоффа i:
TЗ iKm,
(6)
-Общее уравнение
криоскопии
который определяется по уравнению:
i 1 1
(7)
где α – степень диссоциации растворенного вещества;
ν – число ионов, образующихся из одной молекулы.
Tз
i
Km
(8)
i 1
1
(9)
Физико-химический метод изучения свойств разбавленных растворов,
основанный на измерении понижения температур замерзания раствора по сравнению
с температурой замерзания чистого растворителя, называется криоскопическим или
криоскопией, а уравнение (2) называют уравнением криоскопии.
23. Криометрия – метод исследования, основанный на измерении температур кристаллизации растворов исследуемого вещества в подходящих раство
Криометрия – метод исследования, основанный на измерениитемператур кристаллизации растворов исследуемого вещества
в подходящих растворителях
Рис 1. – Прибор для
криометрических измерений
24. Условие кипения
Жидкость закипит, если давление пара в пузырькестанет равным внешнему давлению
25.
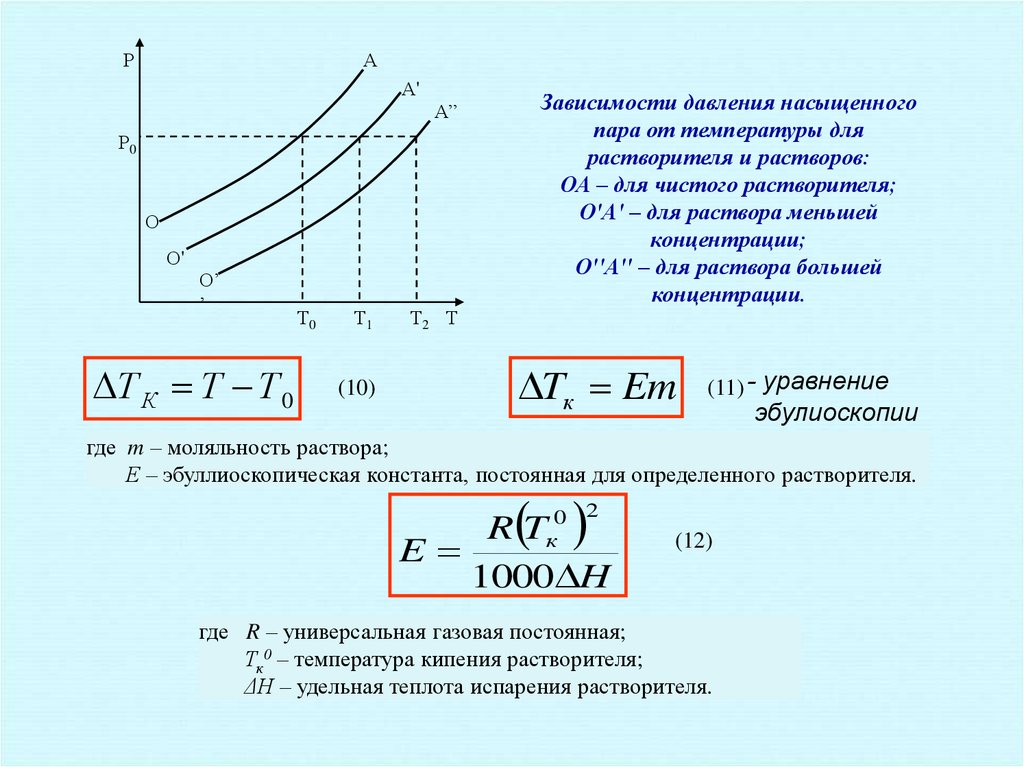
РА
А'
А’’
Р0
О
О'
О’
’
Т К Т Т 0
Т0
Т1
(10)
Т2 Т
Зависимости давления насыщенного
пара от температуры для
растворителя и растворов:
ОА – для чистого растворителя;
О'А' – для раствора меньшей
концентрации;
О''А'' – для раствора большей
концентрации.
Tк Em
(11) - уравнение
эбулиоскопии
где m – моляльность раствора;
Е – эбуллиоскопическая константа, постоянная для определенного растворителя.
0 2
к
RT
E
1000 H
(12)
где R – универсальная газовая постоянная;
Тк0 – температура кипения растворителя;
ΔН – удельная теплота испарения растворителя.
26.
g 2 1000m
M 2 g1
(13)
где М2 – молекулярная масса растворенного вещества.
M2 E
g 2 1000
Tк g1
Tк iEm
(14)
(15)
- общее уравнение
эбулиоскопии
где i – изотонический коэффициент Вант - Гоффа.
Tк
i
Em
(16)
Физико-химический метод исследования свойств жидких растворов, основанный
на измерении повышения температур кипения раствора, по сравнению с
температурой кипения чистого растворителя, называется эбулиоскопическим
или эбулиоскопией, а уравнение (11) – уравнением эбулиоскопии.
27. Эбулиоскопия – метод исследования, основанный на измерениях температур кипения растворов
28. Растворы в биологии и биотехнологии
Растворами являются все биожидкости организма (кровь,лимфа, моча, желчь, слюна). Законы для растворов применимы к
биосистемам, но имеют свои особенности.
Биожидкости – это растворы солей, белков, углеводов,
липидов.
Вода – это всеобщий растворитель, необходимый для
жизнедеятельности всех биосистем.
Концентрационный гомеостаз – постоянный состав
биожидкости в организме, участвующей в транспорте кислорода
и питательный веществ.
В пищевых технологиях при консервировании используют
большое количество сахара и соли. В этих условиях идет
плазмолиз и микроорганизмы становятся нежизнеспособными.
Изотонический раствор – 0,9% раствор NaCl.
Это заменитель крови, т..к. осмотические давления у них
одинаковые. Если π > πизот., то это гипертонический раствор (2%),
если π < πизот., то это гипотонический раствор (1%)
29. Законы для растворов
Закон ГенриОписывает влияние внешнего давления на растворимость
газа (при снижение внешнего давления содержание
кислорода снижается – «кессонная болезнь»).
Закон Нернста – Шилова
Позволяет прогнозировать доступность
препаратов к клеткам в живых организмах
лекарственных
Диффузия и осмос
Скорость диффузии определяет упругость и эластичность
клеток (в воде клетки набухают (гемолиз), а в крепких
растворах солей сморщиваются (плазмолиз)).
30. Экстракция
В различных пищевых технологиях, производстве БАВ,эфирных масел, ароматизаторов часто возникает необходимость
извлечь вещество из раствора, удалить из него примеси или
увеличить концентрацию растворенных веществ. Это
достигается различными способами экстракции.
Экстракцию из растворов применяют для разделения
близкокипящих жидкостей с малой летучестью и высокой
температурой кипения или для тех веществ, которые
имеют температуру разложения меньше, чем температуру
кипения.
Пример:
1) Антибиотики (пенициллин и др.) нельзя концентрировать
выпариванием. Их экстрагируют бутил- (или этил-) ацетатом,
которые потом отгоняют.
2) Уксусную, бензойную и др. кислоты выделяют из водных
растворов экстракцией.
3) Выделяют из водных растворов металлы (уран, торий,
цирконий, галлий и др.)



















 Биология
Биология Физика
Физика Химия
Химия








