Похожие презентации:
Коллигативные свойства растворов
1. Коллигативные свойства растворов
2.
Коллигативными называются свойства растворов,зависящие от типа растворителя и концентрации
растворенного вещества, но не зависящие от природы
частиц растворенного вещества.
Коллигативные
свойства проявляются в условиях
равновесия двух фаз:
1) относительное понижение давления пара растворителя
над раствором;
2) понижение температуры замерзания раствора по
сравнению с чистым растворителем;
3) повышение температуры кипения раствора;
4) осмотическое давление.
3. Понижение температура замерзания растворов. Криоскопия.
Криоскопия – метод изучения свойств растворов,основанный на измерении температур замерзания
раствора и растворителя.
При охлаждении разбавленного раствора до температуры
замерзания из него начинает кристаллизоваться чистый
растворитель.
Температура замерзания ТЗ (ТПЛ ) – температура, при
которой раствор данного состава находится в равновесии
с кристаллами чистого растворителя.
Растворы замерзают при более низких Т, чем чистый
растворитель. Понижение ТЗ является следствием
понижения давления пара растворителя над раствором.
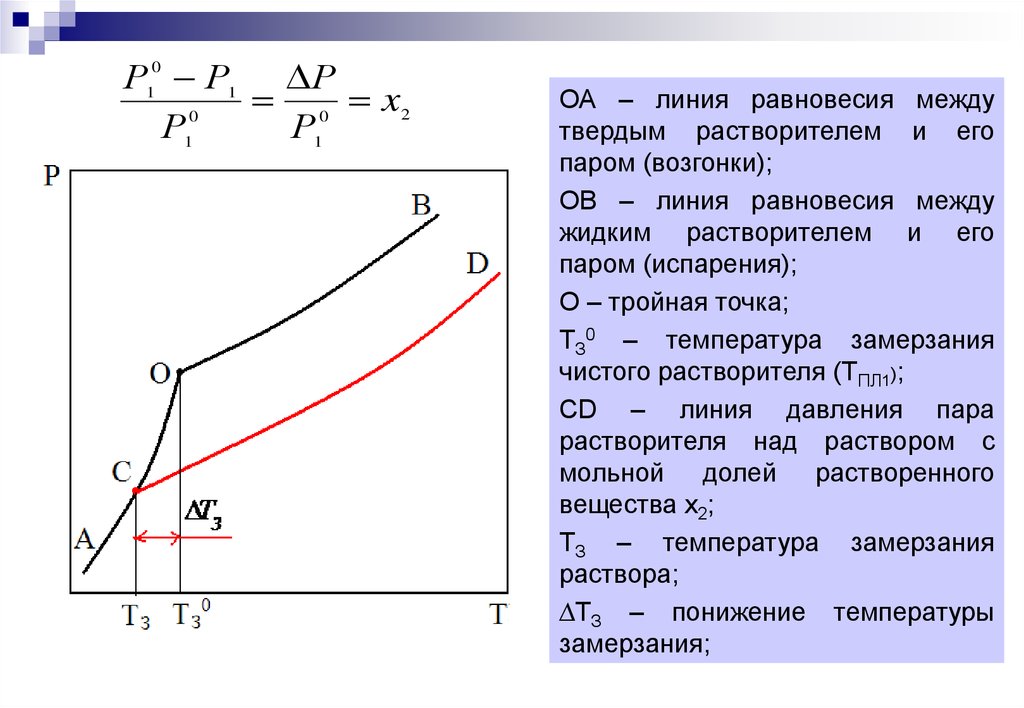
4.
Р10 Р1 Р0 x2
0
Р1
Р1
ОА – линия равновесия между
твердым растворителем и его
паром (возгонки);
ОВ – линия равновесия между
жидким растворителем и его
паром (испарения);
О – тройная точка;
ТЗ0 – температура замерзания
чистого растворителя (ТПЛ1);
CD – линия давления пара
растворителя над раствором с
мольной долей растворенного
вещества х2;
ТЗ – температура замерзания
раствора;
∆ТЗ – понижение температуры
замерзания;
5.
Т З K КР m2
R TПЛ
M1
1
К КР
H ПЛ1 1000
m 1 Т З K КР
6. Повышение температуры кипения растворов. Эбулиоскопия.
Эбулиоскопия – методизучения
свойств
растворов, основанный на
измерении
температур
кипения
раствора
и
растворителя.
Растворы,
содержащие
нелетучие растворенные
вещества,
кипят
при
более
высоких
температурах чем чистые
растворители.
7.
2R TКИП
M1
1
К ЭБ
H ИСП1 1000
8.
Для разбавленных растворов электролитов:Т З i K КР m
Т КИП i KЭБ m
i 1 1
Для реальных растворов :
Т З K КР аm
Т КИП KЭБ аm
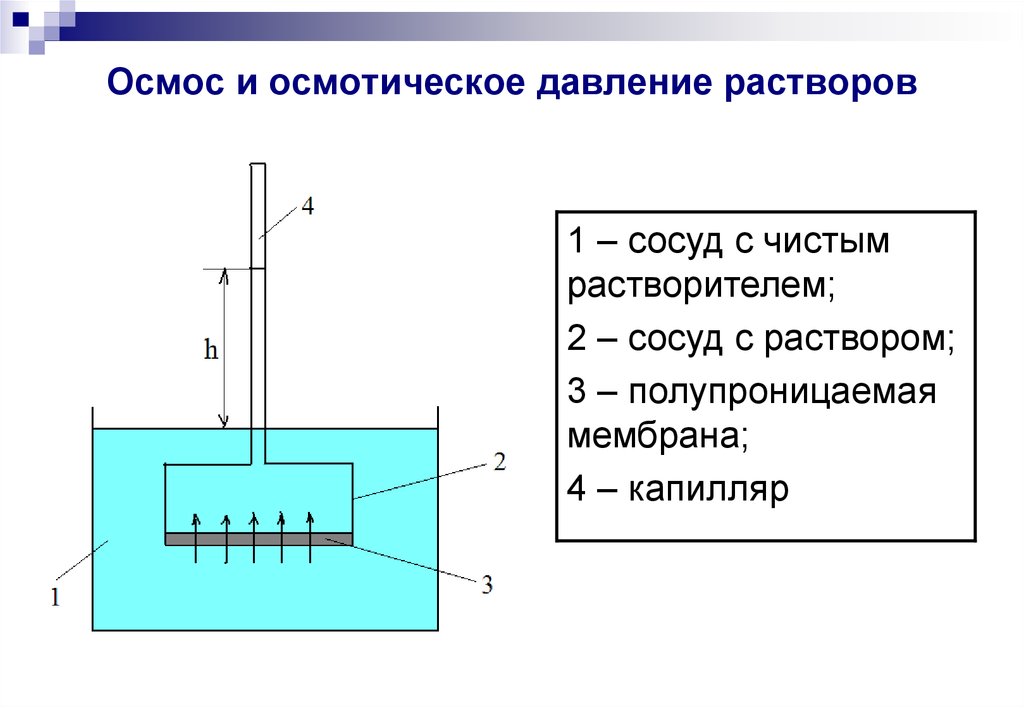
9. Осмос и осмотическое давление растворов
1 – сосуд с чистымрастворителем;
2 – сосуд с раствором;
3 – полупроницаемая
мембрана;
4 – капилляр
10.
Осмос–
процесс
самопроизвольного переноса
растворителя
через
полупроницаемую мембрану
из чистого растворителя в
раствор
или
из
более
разбавленного раствора в
концентрированный.
Система
является
неравновесной,
т.к.
химический
потенциал
растворителя в растворе
(фаза II) меньше, чем в
чистом растворителе (фаза I)
1 1
II
I
11.
Осмотическое давление (π) равно гидростатическомудавлению столба жидкости высотой h:
(1)
CM RT
n2
m2
m2 RT
RT
RT M 2
V
M 2V
V
(2)
(3)
(4)
(5)
12.
Растворы с одинаковым осмотическим давлениемназываются
изоосмотическими
или
изотоническими.
Раствор с большим осмотическим давлением –
гипертонический, с меньшим – гипотонический.
В тканях растений π = 5-20 атм, у растений
пустыни - до 170 атм.
Кровь, лимфа, тканевые жидкости человека
имеют π = 7,7 атм при 370С. Физиологический
раствор NaCl должен быть изоосмотичен крови и
иметь концентрацию 0,15 моль/л = 0,9%.
13. Растворение вещества в двух несмешивающихся растворителях.
Закон распределения.Экстракция.
14.
С3К II
C3
I
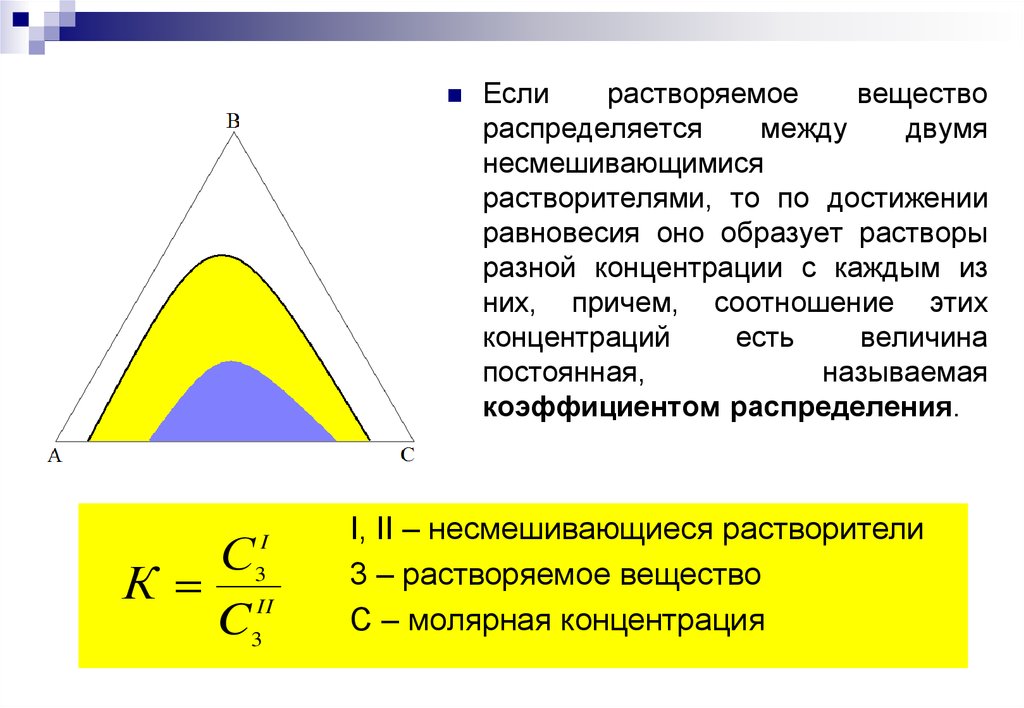
Если
растворяемое
вещество
распределяется
между
двумя
несмешивающимися
растворителями, то по достижении
равновесия оно образует растворы
разной концентрации с каждым из
них, причем, соотношение этих
концентраций
есть
величина
постоянная,
называемая
коэффициентом распределения.
I, II – несмешивающиеся растворители
3 – растворяемое вещество
С – молярная концентрация
15.
3I 3II30 I RT ln C3I 30 II RT ln C3II
RT ln C3I RT ln C3II 30 II 30 I
(1)
С3I
30
ln II
C3
RT
С3I
30
еxp
K
II
C3
RT
(4)
(2)
(3)
(5)
К – константа равновесия процесса растворения вещества
в двух растворителях, зависит только от температуры.
х3
К II
х3
I
а3
К II
а3
I
16.
С I 1 IК II
C 1 II
(6)
(С I ) n
К
C II
(7)
ln C n ln C ln K
ln C II
tg
n
I
ln C
II
I
(8)
n >1 – диссоциация молекул
n < 1 – ассоциация молекул
M 3II
n
M 3I
(9)
17.
Закон Генри – частный случайзакона
распределения,
характеризующий
растворимость
газов
в
жидкостях.
Рi
КГ Ж
xi
fi
КГ Ж
xi
КГ – константа равновесия
процесса
распределения
в
системе жидкость – пар;
ХiЖ – концентрация
насыщенного раствора газа в
жидкой фазе (растворимость).
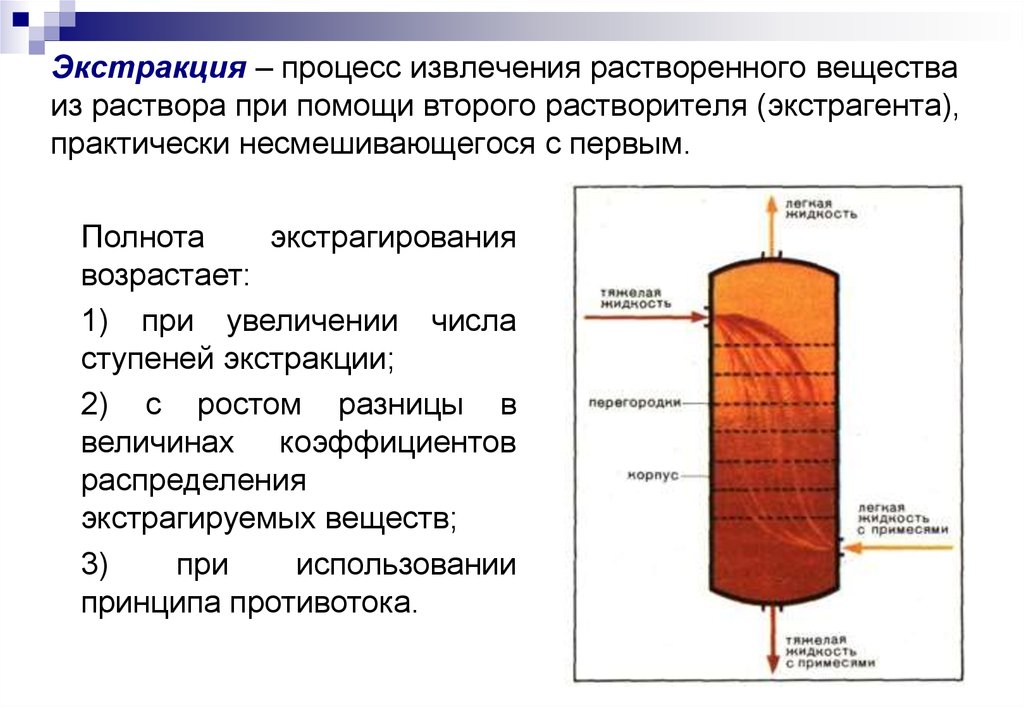
18. Экстракция – процесс извлечения растворенного вещества из раствора при помощи второго растворителя (экстрагента), практически несмешива
Экстракция – процесс извлечения растворенного веществаиз раствора при помощи второго растворителя (экстрагента),
практически несмешивающегося с первым.
Полнота
экстрагирования
возрастает:
1) при увеличении числа
ступеней экстракции;
2) с ростом разницы в
величинах коэффициентов
распределения
экстрагируемых веществ;
3)
при
использовании
принципа противотока.
19. Экспериментальные методы определения активности и коэффициента активности
1) Для растворителя:по закону Рауля
Р1
а1
а1 0 ; 1
Р1
х1
криоскопически или эбулиоскопически
H ПЛ1 . Т З
ln а1
RТТ ПЛ1
осмометрически
H ИСП1. Т КИП
ln а1
RТТ КИП1
20.
2) Для растворенного вещества:по давлению пара летучего растворенного вещества
(закон Рауля)
Р
а
а2
; 2
0
2
2
Р2
х2
Р2
а2
КГ
по закону Генри
по закону распределения
а2
К II ;
a2
I
I
a2
K II
C2
















 Химия
Химия








