Похожие презентации:
Реальные газы. Жидкости. Твердые тела
1. Реальные газы. Жидкости. Твердые тела
Модель реального газа.Уравнение Ван-дер-Ваальса
2.
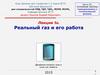
F0
Модель идеального газа
взаимодействие
упругим ударом
r0
r
Модель реального газа
F
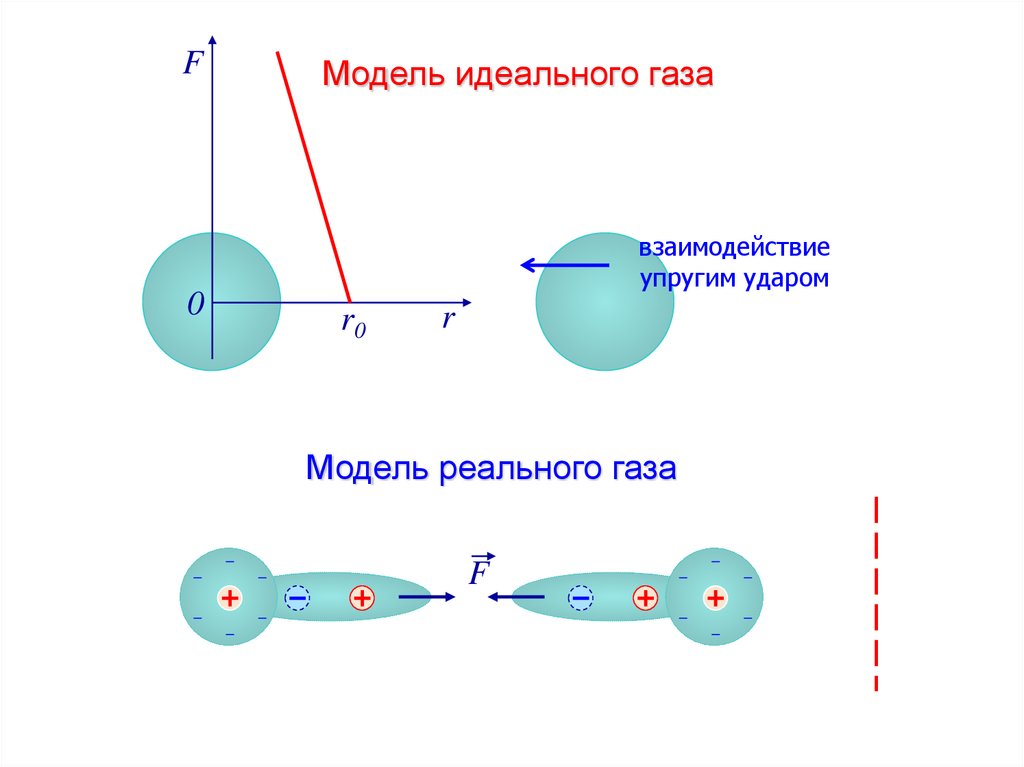
3.
FМодель идеального газа
взаимодействие
упругим ударом
0
r0
r
Модель реального газа
F
4. Сила взаимодействия F и потенциальная энергия взаимодействия Eр двух молекул
5.
Модель идеального газа:pV
M
RT
Модель Ван-дер-Ваальса
p p мол V b
M
RT
( p pст pвнут p мол )
p мол
a
2;
V
b ~ Vмол
Уравнение Ван-дер-Ваальса
a
M
RT
p 2 V b
V
Ван-дер-Ваальс
(van der Waals) Ян
(1837 – 1923)
6. Реальные газы. Жидкости. Твердые тела
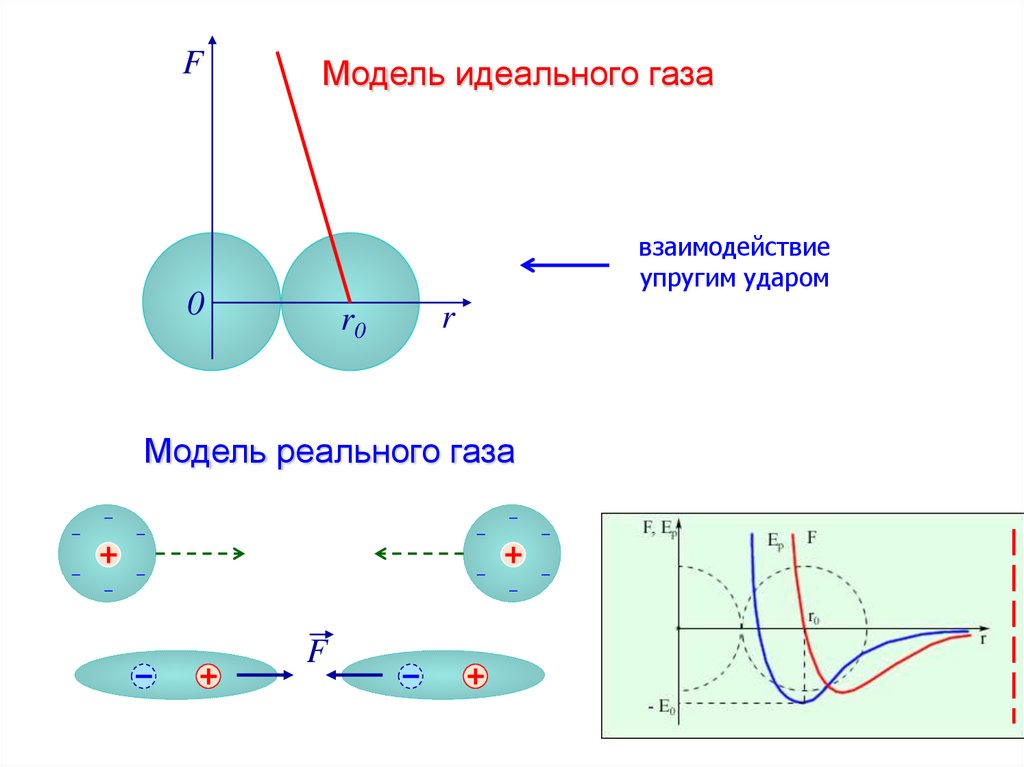
Конденсация реального газа.Изотермы Ван-дер-Ваальса
7.
Изотермы реального газар
р = const
p
Q
Q
Q
изотермы реального газа
T2
T1
V
T2 >T1
8. Водяной пар (1) и вода (2). Молекулы воды увеличены примерно в 5·107 раз.
Водяной пар (1) и вода (2). Молекулыводы увеличены примерно в 5·107 раз.
9.
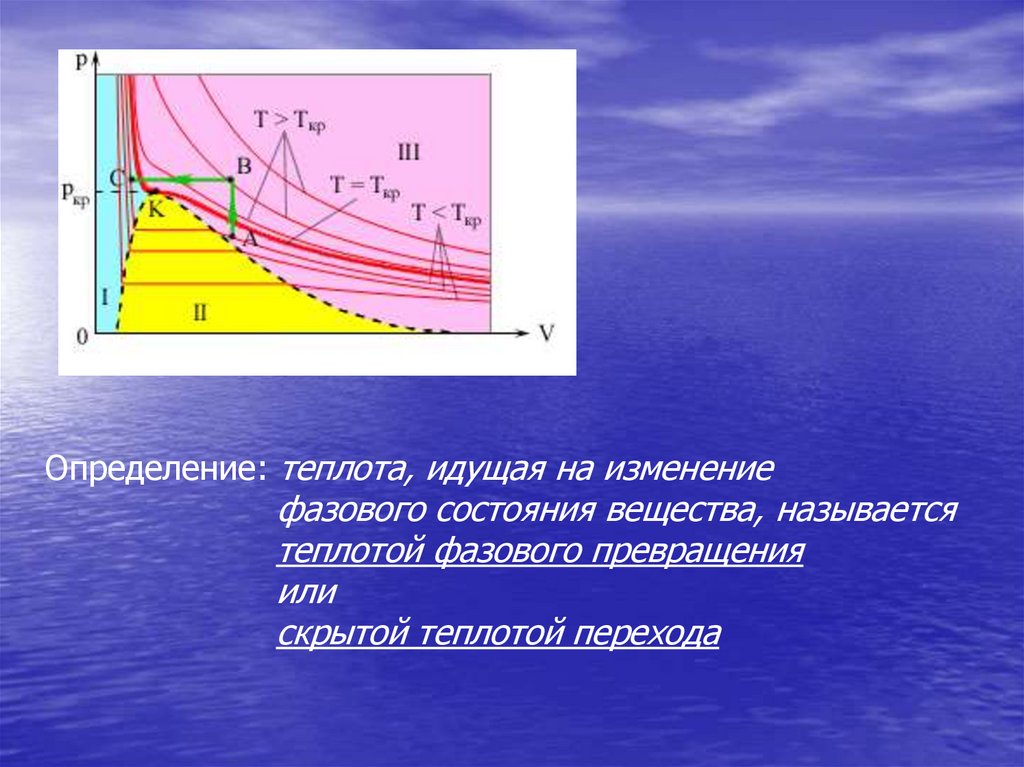
Область I – жидкость,p
область II – двухфазная система
«жидкость + насыщенный пар»,
Ткр
III
K
область III –
газообразное вещество.
T >Tкр
K – критическая точка
T < Tкр
I
II
V
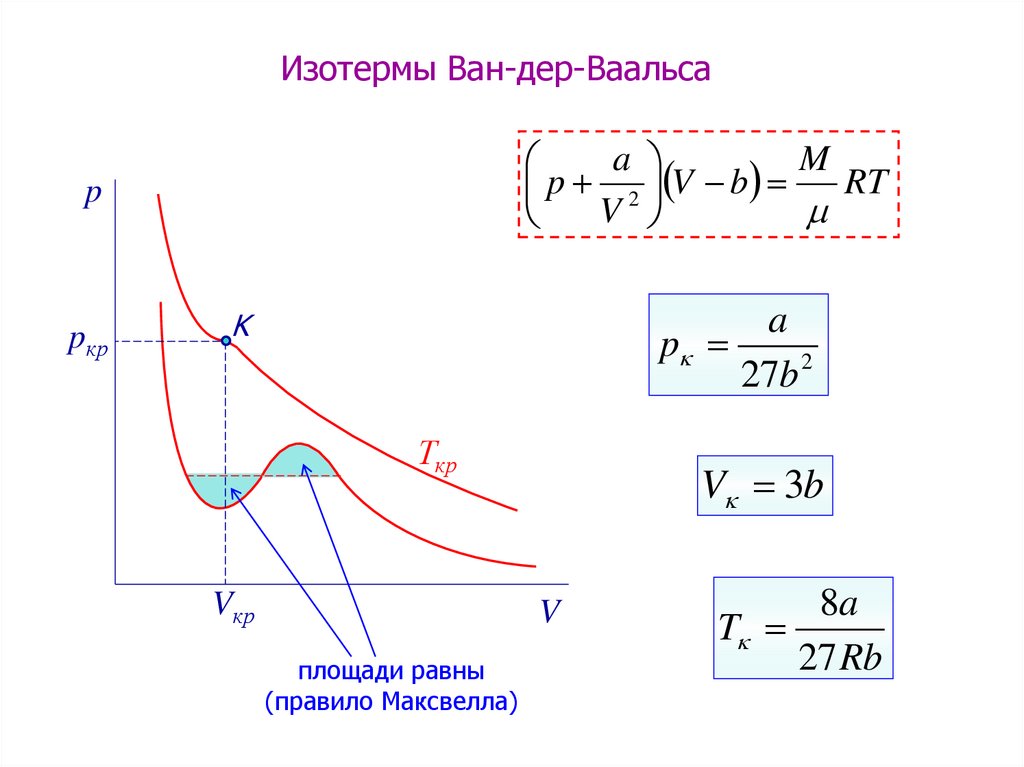
10.
Изотермы Ван-дер-Ваальсаa
M
RT
p 2 V b
V
p
pкр
a
p
27b 2
K
Ткр
Vкр
V 3b
V
площади равны
(правило Максвелла)
8a
T
27 Rb
11. Реальные газы. Жидкости . Твердые тела
Область двухфазных состояний.Равновесие фаз.
Критическое состояние
12.
pТкр
В двухфазном состоянии II:
III
ргаз рнас ~ T
K
газ
I
II
Vж
При T Tкрит :
V
Vж Vгаз ; ж газ
Vгаз
ρ
М
М
; ж
Vгаз
Vж
ρж
При T Tкрит :
ж газ кр
ρкр
ρг
Tкр
T
13.
Определение: теплота, идущая на изменениефазового состояния вещества, называется
теплотой фазового превращения
или
скрытой теплотой перехода
14.
Диаграмма состоянияV=const
Кривая плавления
Тв
Ж
1
Кривая
сублимации
3
2
4
Газ
Кривая
испарения
15.
р2
К
Ж
Тв
Тр
1
Газ
Т
16. Реальные газы. Жидкости . Твердые тела
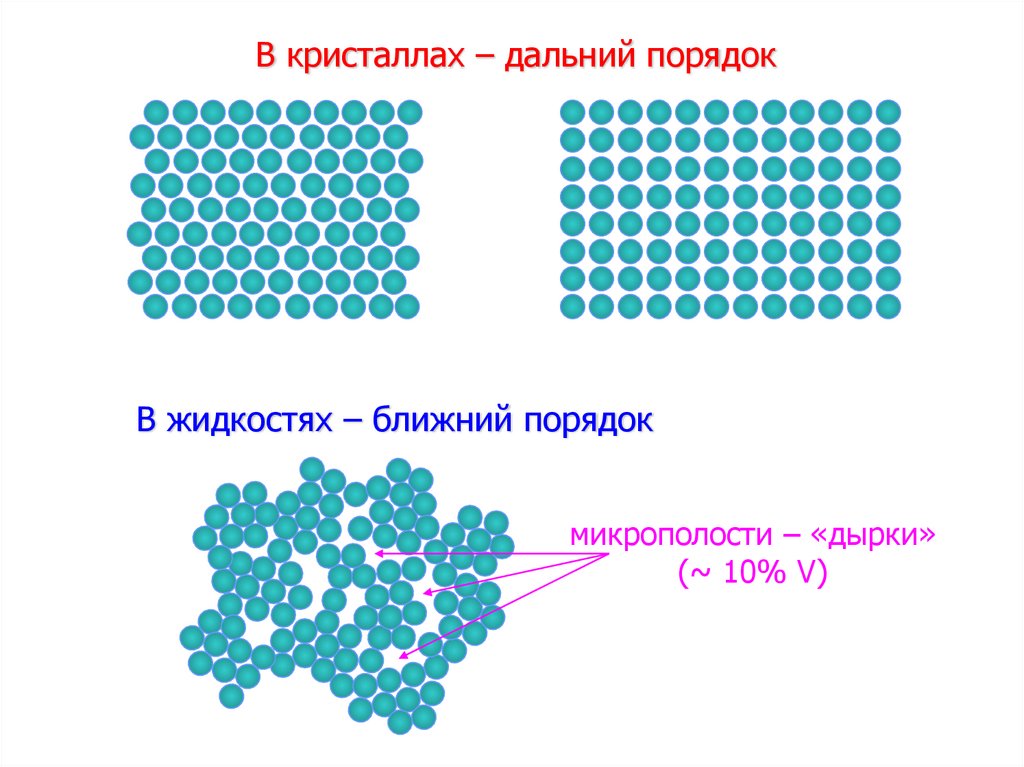
Дырочная модель жидкости17.
В кристаллах – дальний порядокВ жидкостях – ближний порядок
микрополости – «дырки»
(~ 10% V)
18.
τ – время оседлой жизниτ ~ 10 - 8 c
τ0 – средний период
колебаний молекул
около положения
равновесия
τ/ τ0 ~ 103-105
0e
W
kT
W – энергия активации
1. t >> τ - перескоки в сторону действия силы:
текучесть жидкости.
2. t << τ - жидкость ведет себя как упругая среда:
сопротивляется не только изменению объема,
но и формы.
19. Реальные газы. Жидкости . Твердые тела
Кристаллы.Классическая теория теплоемкости
кристаллов. Закон Дюлонга-Пти
20.
Кристаллическая решетка поваренной соли21.
Простые кристаллические решетки:1 – простая кубическая решетка;
2 – гранецентрированная кубическая решетка;
3 – объемноцентрированная кубическая решетка;
4 – гексагональная решетка.
22.
Движение атомов в кристаллеy
x
z
23.
Движение атомов в кристаллеy
x
z
24.
Fкол
r
3
2 kT 3kT
2
U мол N A 3kT
NA k R
U мол 3RT
dU мол
dQ dQмол
cV
dT
dT
dT
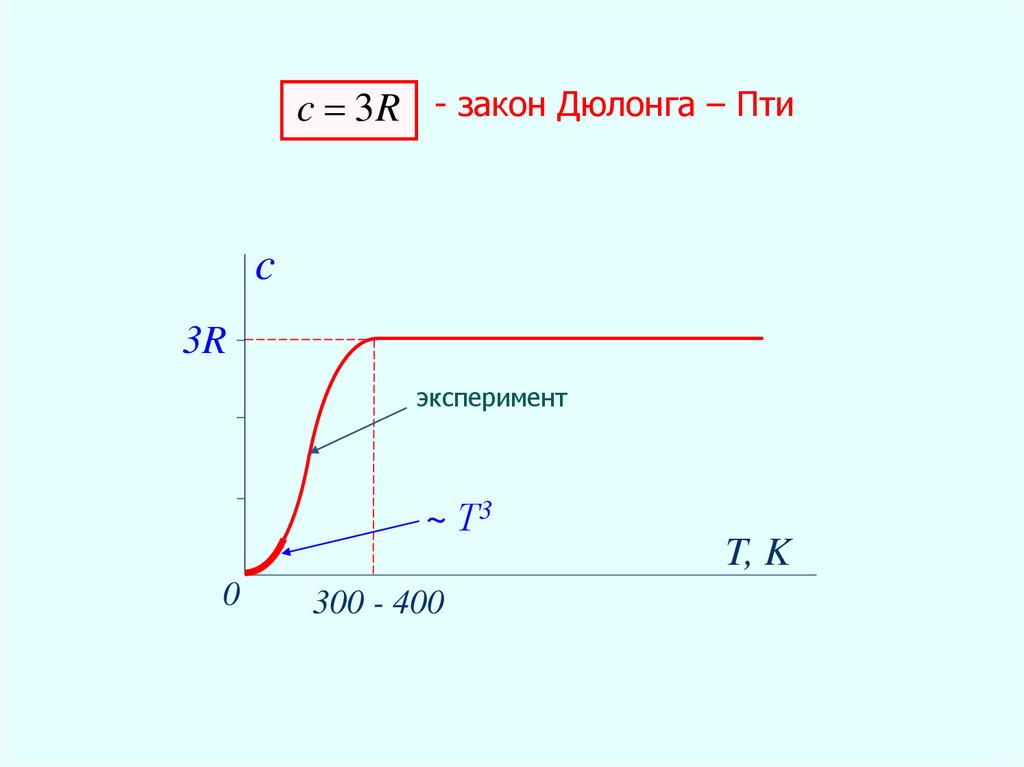
c 3R - закон Дюлонга
– Пти
Дюлонг
Пьер Луи
(1785 – 1838)
Пти
Алекси Терез
(1791 – 1820)
25.
c 3R - закон Дюлонга – Птиc
3R
эксперимент
~ Т3
0
300 - 400
T, K


















 Физика
Физика