Похожие презентации:
Третий закон термодинамики
1.
III ЗАКОН ТЕРМОДИНАМИКИХарактеризует свойства системы вблизи абсолютного нуля.
Существует в виде трёх постулатов:
1. Постулат Планка
(задаёт точку отсчёта для энтропии)
2. Тепловая теорема Нернста
3. Принцип недостижимости абсолютного нуля
2.
1. ПОСТУЛАТ ПЛАНКАЭнтропия идеального кристаллического тела при абсолютном нуле равна нулю:
(1)
Для неидеальных существуют отклонения, но они невелики.
Следствие из постулата (1):
Изменение энтропии твёрдого тела при температуре Т равно абсолютному
значению S при заданной температуре:
(2)
Для вещества в газообразном состоянии надо учитывать изменение энтропии при фазовых переходах:
(3)
3.
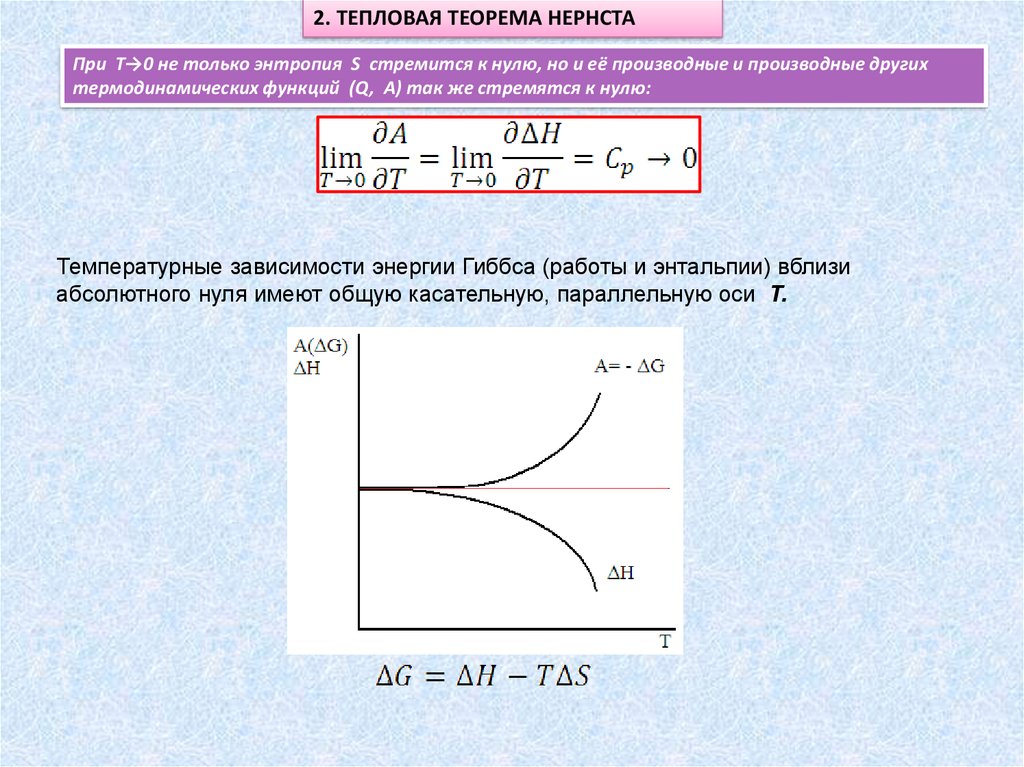
2. ТЕПЛОВАЯ ТЕОРЕМА НЕРНСТАПри Т→0 не только энтропия S стремится к нулю, но и её производные и производные других
термодинамических функций (Q, A) так же стремятся к нулю:
Температурные зависимости энергии Гиббса (работы и энтальпии) вблизи
абсолютного нуля имеют общую касательную, параллельную оси T.
4.
3. ПРИНЦИП НЕДОСТИЖИМОСТИ АБСОЛЮТНОГО НУЛЯКонечным числом операций невозможно отнять всю теплоту от тела,
охлаждая его до абсолютного нуля (нельзя достичь температуры равной
абсолютному нулю)
СВЯЗЬ III ЗАКОНА ТЕРМОДИНАМИКИ СО СТАТИСТИЧЕСКИМ ХАРАКТЕРОМ II ЗАКОНА
– уравнение Больцмана
Система осуществляется единственным образом – при отсутствии теплового
движения, т.е. при T=0
5.
ЗНАЧЕНИЕ III НАЧАЛА ТЕРМОДИНАМИКИВозможность рассчитывать абсолютные значения энтропии
Для химических реакций ∆ST находится алгебраическим суммированием абсолютных энтропий
веществ, входящих в реакцию по уравнению (4):
(4)
Рассчитанные значения энтропий веществ при T=298K , P=1атм. приводятся в справочнике (для других
функций только изменение ∆H, S , ∆G)
Для реакции:
Для
Получаем:
(5)
С учётом зависимости Ср =f(T):
(6)




 Физика
Физика








