Похожие презентации:
Второй закон термодинамики. Энтропия. (Лекция 3)
1. Второй закон термодинамики. Энтропия
Энтропия:основные определения
Изменение энтропии в
различных процессах:
изохорном
изобарном
изотермическом
адиабатическом
Энтропия фазового перехода:
правило Трутона
1
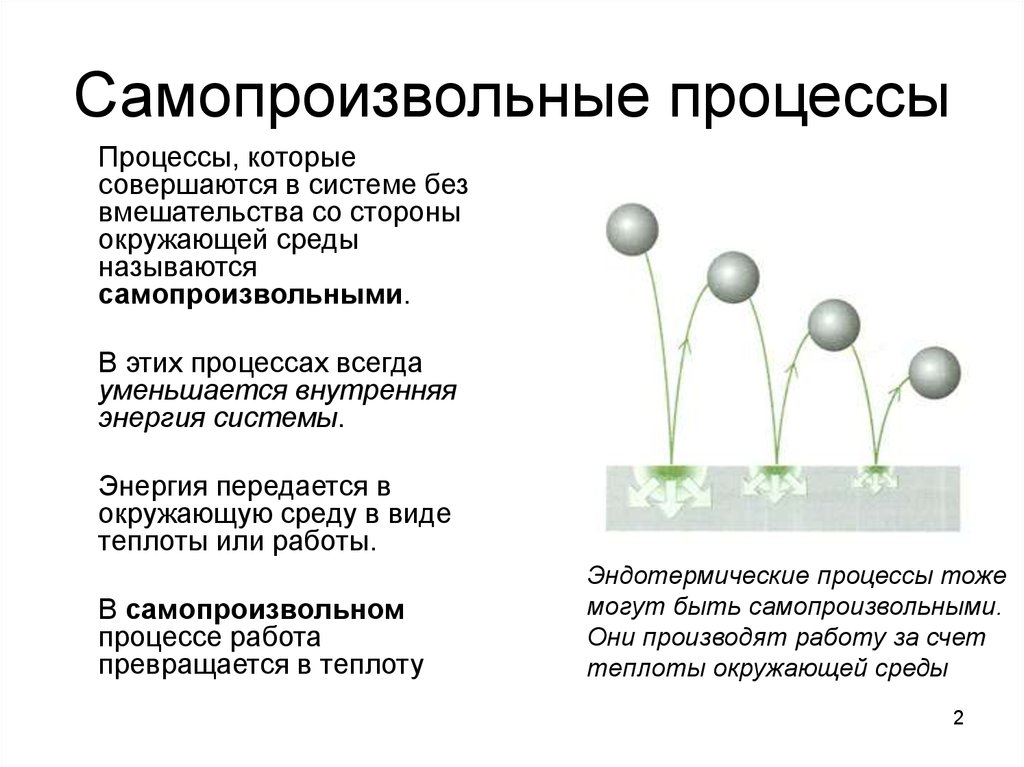
2. Самопроизвольные процессы
Процессы, которыесовершаются в системе без
вмешательства со стороны
окружающей среды
называются
самопроизвольными.
В этих процессах всегда
уменьшается внутренняя
энергия системы.
Энергия передается в
окружающую среду в виде
теплоты или работы.
В самопроизвольном
процессе работа
превращается в теплоту
Эндотермические процессы тоже
могут быть самопроизвольными.
Они производят работу за счет
теплоты окружающей среды
2
3. Самопроизвольные процессы Рассеяние энергии
34. Второй закон термодинамики Определение
Невозможно протекание самопроизвольногопроцесса, в котором теплота превращается в
работу. Только превращение работы в теплоту
может быть единственным результатом
самопроизвольного процесса.
(Томсон)
4
5. Несамопроизвольные процессы
Процессы, которые немогут совершаться в
системе без
вмешательства со
стороны окружающей
среды называются
несамопроизвольными.
Для этих процессов
необходима передача
энергии из окружающей
среды в виде теплоты
или работы
В каких системах могут
протекать
несамопроизвольные
процессы:
– открытых
– закрытых
– изолированных ?
Приведите примеры
несамопроизвольных
процессов
5
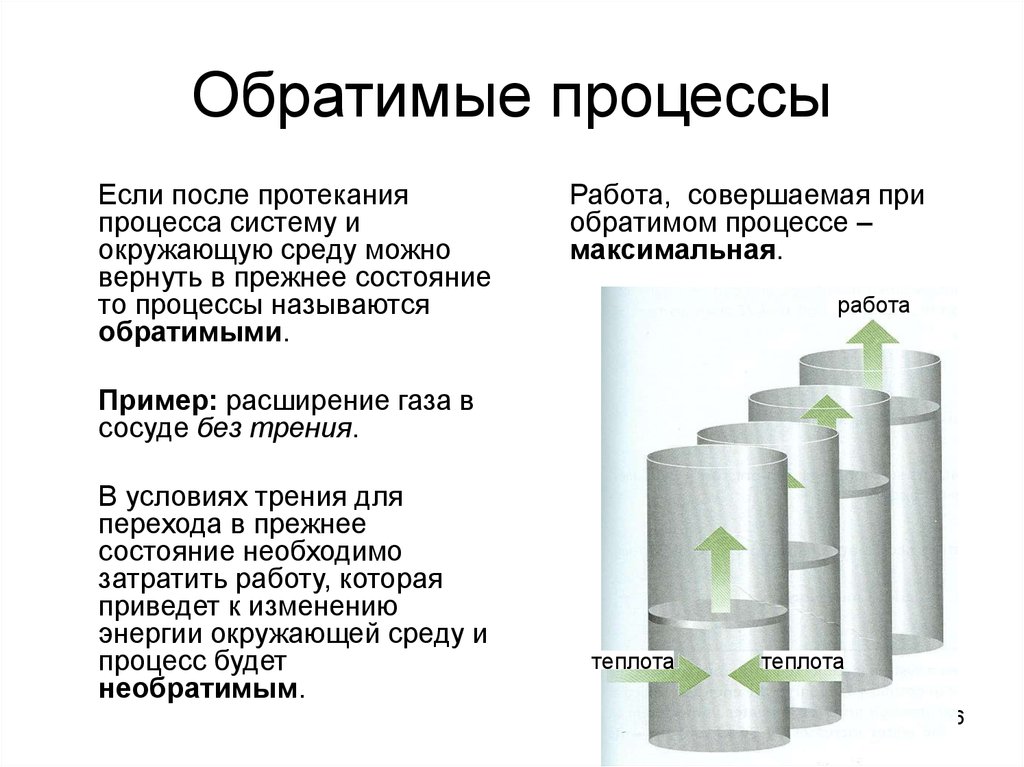
6. Обратимые процессы
Если после протеканияпроцесса систему и
окружающую среду можно
вернуть в прежнее состояние
то процессы называются
обратимыми.
Работа, совершаемая при
обратимом процессе –
максимальная.
работа
Пример: расширение газа в
сосуде без трения.
В условиях трения для
перехода в прежнее
состояние необходимо
затратить работу, которая
приведет к изменению
энергии окружающей среду и
процесс будет
необратимым.
теплота
теплота
6
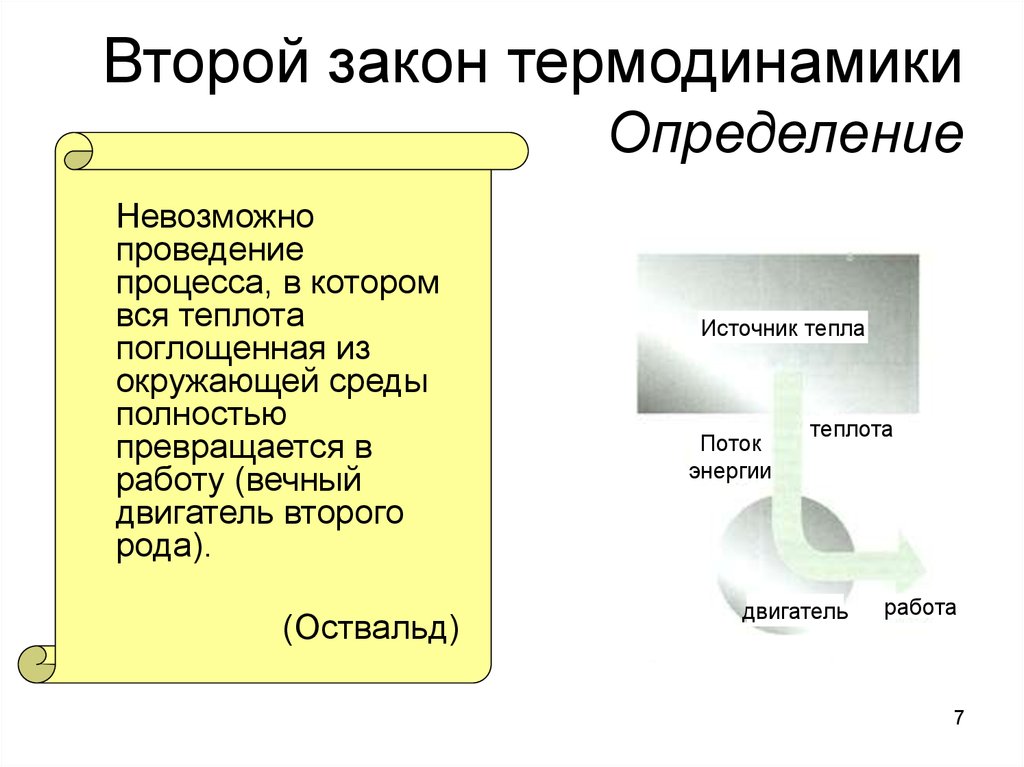
7. Второй закон термодинамики Определение
Невозможнопроведение
процесса, в котором
вся теплота
поглощенная из
окружающей среды
полностью
превращается в
работу (вечный
двигатель второго
рода).
(Оствальд)
Источник тепла
Поток
энергии
теплота
двигатель
работа
7
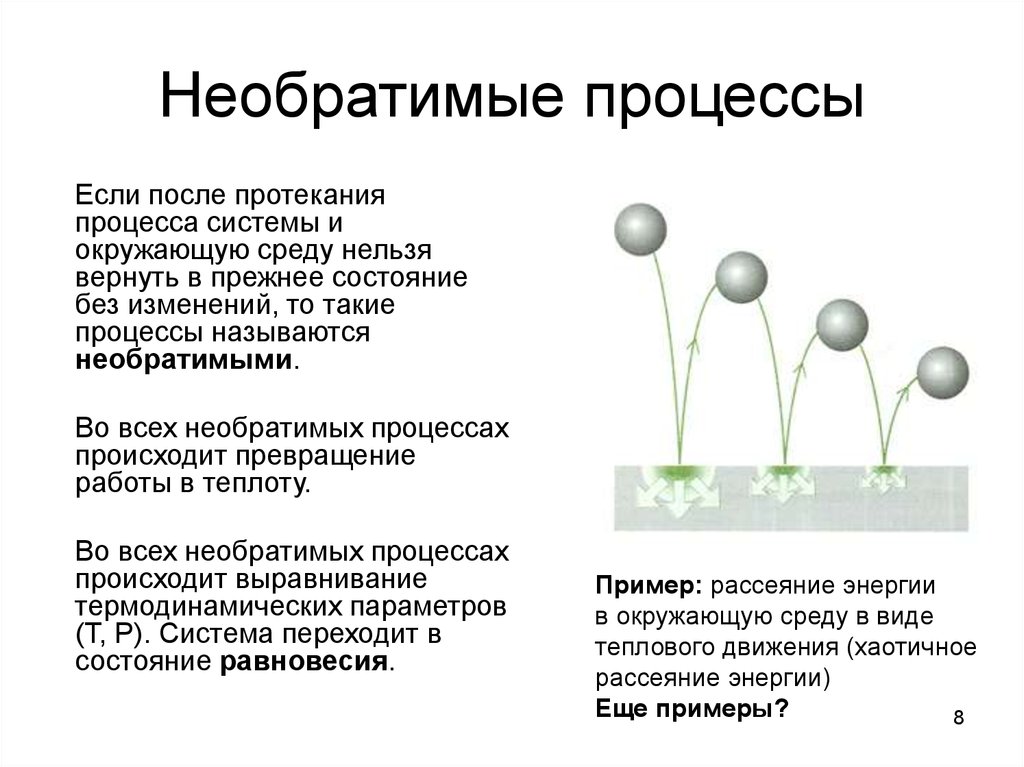
8. Необратимые процессы
Если после протеканияпроцесса системы и
окружающую среду нельзя
вернуть в прежнее состояние
без изменений, то такие
процессы называются
необратимыми.
Во всех необратимых процессах
происходит превращение
работы в теплоту.
Во всех необратимых процессах
происходит выравнивание
термодинамических параметров
(Т, Р). Система переходит в
состояние равновесия.
Пример: рассеяние энергии
в окружающую среду в виде
теплового движения (хаотичное
рассеяние энергии)
Еще примеры?
8
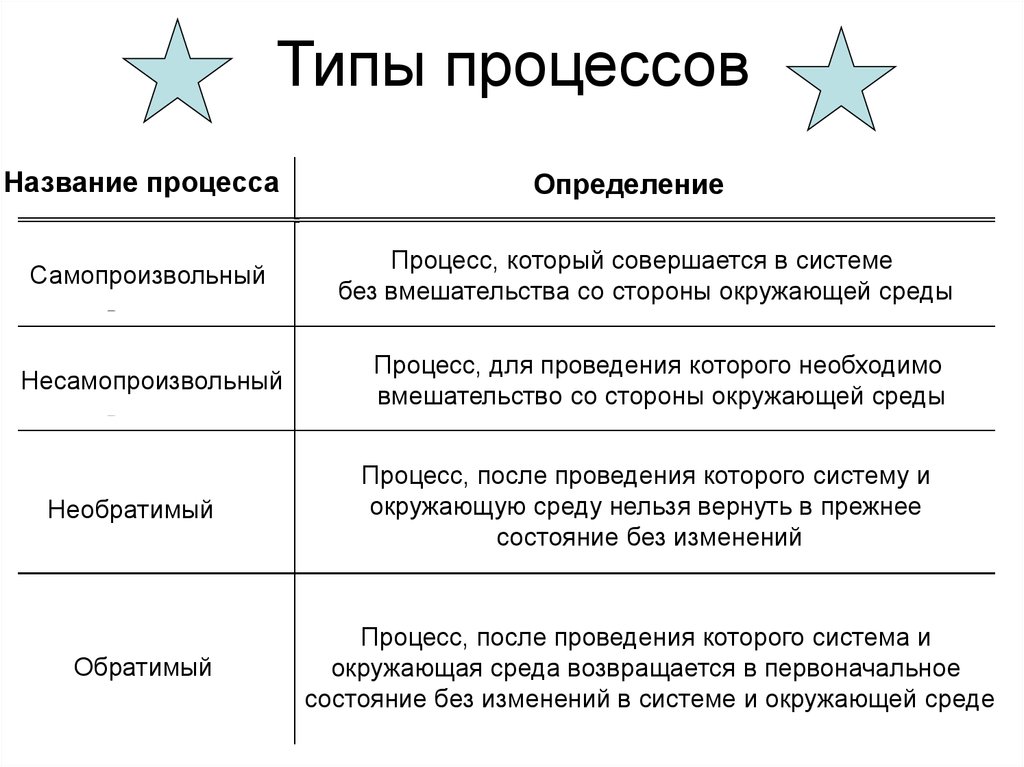
9. Типы процессов
Название процессаСамопроизвольный
Несамопроизвольный
Необратимый
Обратимый
Определение
Процесс, который совершается в системе
без вмешательства со стороны окружающей среды
Процесс, для проведения которого необходимо
вмешательство со стороны окружающей среды
Процесс, после проведения которого систему и
окружающую среду нельзя вернуть в прежнее
состояние без изменений
Процесс, после проведения которого система и
окружающая среда возвращается в первоначальное
состояние без изменений в системе и окружающей среде
9
10. Принцип Каратеодори
• Для прямого процесса: Q= U+ W1
• Для обратного процесса:
U = W2
U
Q>0
2
U2
1
Q=0
U1
Q = (W1 + W2) > 0
В термодинамической
системе могут быть
такие состояния,
которых невозможно
достигнуть
адиабатическим путем
(без передачи теплоты)
Процесс 2 невозможен (из
определения второго
закона термодинамики)
Сообщение теплоты к
системе меняет энтропию
S = f(Q)
10
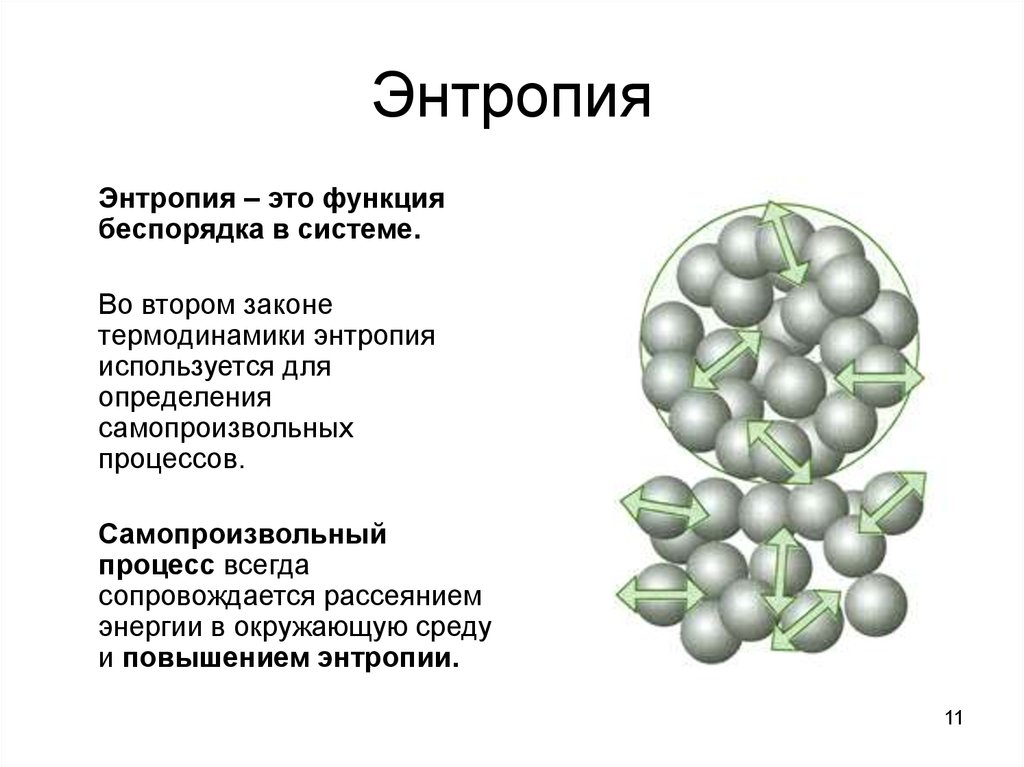
11. Энтропия
Энтропия – это функциябеспорядка в системе.
Во втором законе
термодинамики энтропия
используется для
определения
самопроизвольных
процессов.
Самопроизвольный
процесс всегда
сопровождается рассеянием
энергии в окружающую среду
и повышением энтропии.
11
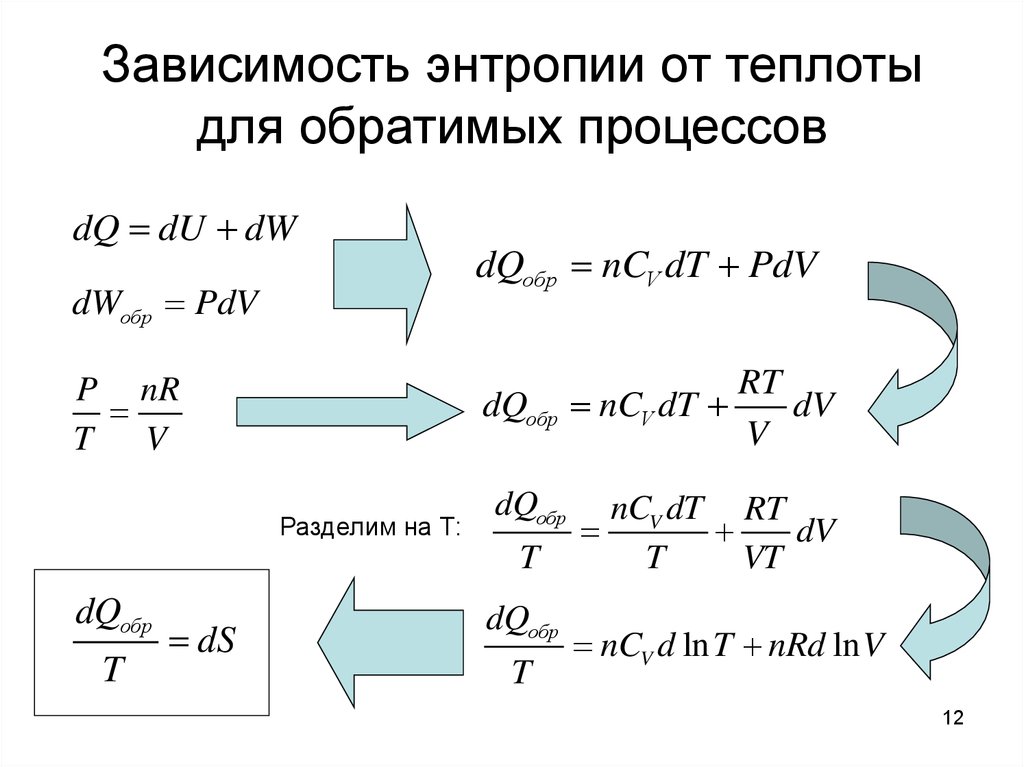
12. Зависимость энтропии от теплоты для обратимых процессов
dQ dU dWdWобр PdV
P nR
T
V
dQобр nCV dT PdV
dQобр
Разделим на Т:
dQобр
T
dQобр
T
dS
dQобр
T
RT
nCV dT
dV
V
nCV dT RT
dV
T
VT
nCV d ln T nRd ln V
12
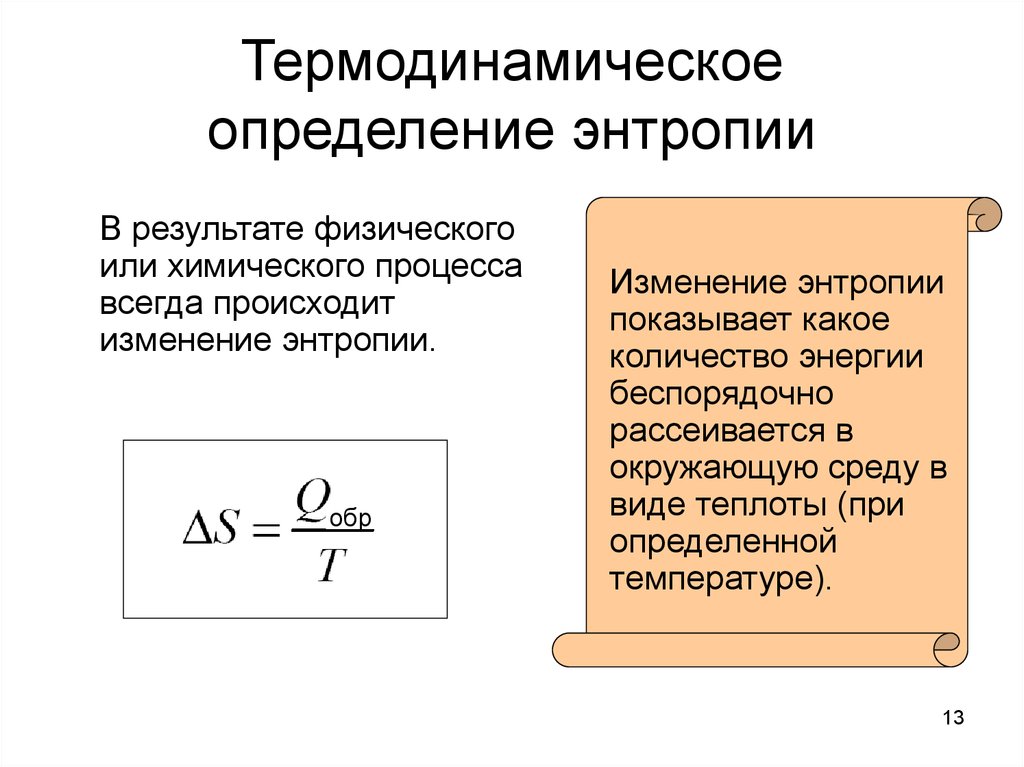
13. Термодинамическое определение энтропии
В результате физическогоили химического процесса
всегда происходит
изменение энтропии.
обр
Изменение энтропии
показывает какое
количество энергии
беспорядочно
рассеивается в
окружающую среду в
виде теплоты (при
определенной
температуре).
13
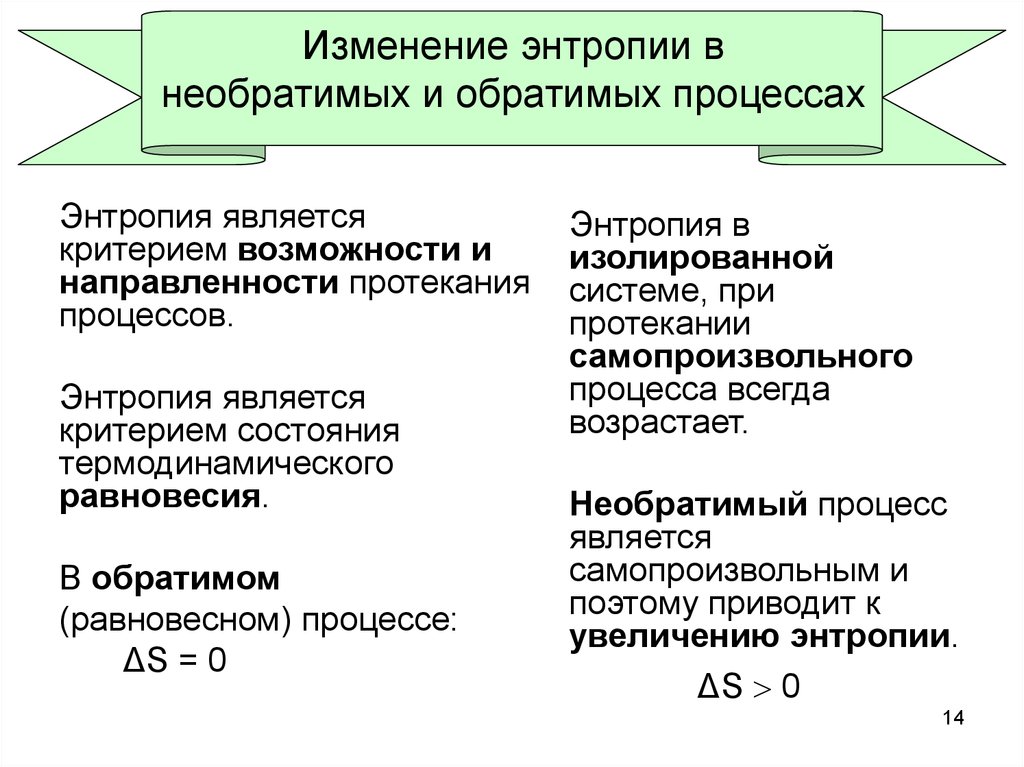
14. Изменение энтропии в необратимых и обратимых процессах
Энтропия являетсякритерием возможности и
направленности протекания
процессов.
Энтропия является
критерием состояния
термодинамического
равновесия.
В обратимом
(равновесном) процессе:
ΔS = 0
Энтропия в
изолированной
системе, при
протекании
самопроизвольного
процесса всегда
возрастает.
Необратимый процесс
является
самопроизвольным и
поэтому приводит к
увеличению энтропии.
ΔS 0
14
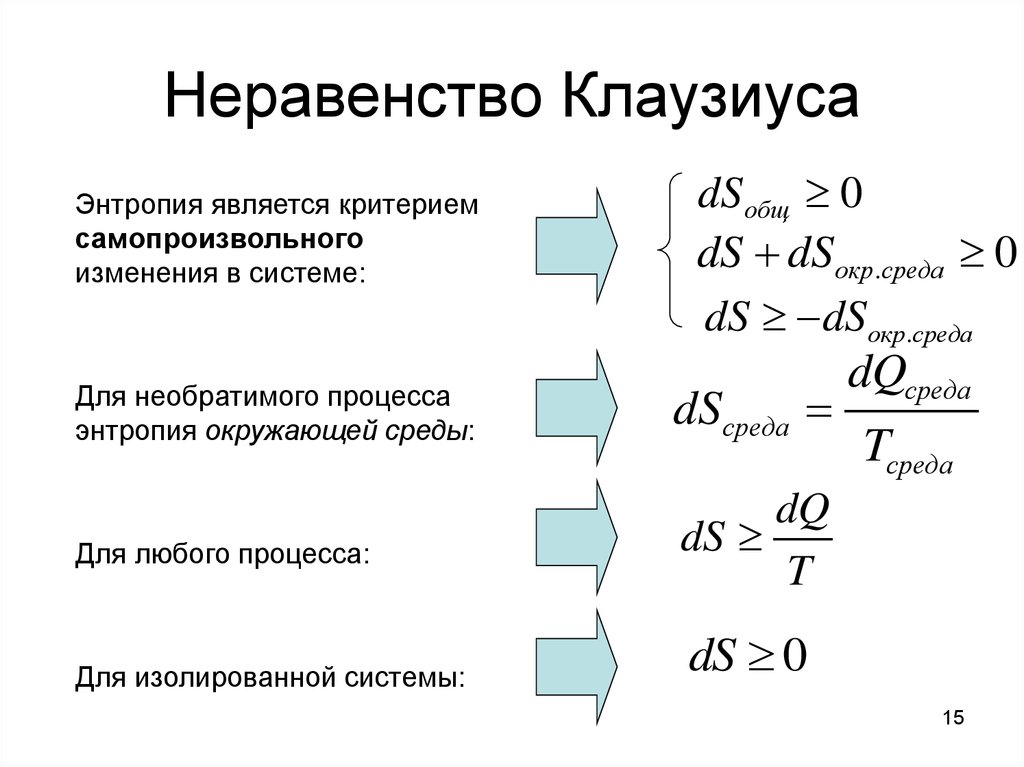
15. Неравенство Клаузиуса
Энтропия является критериемсамопроизвольного
изменения в системе:
dS общ 0
dS dSокр.среда 0
dS dSокр.среда
Для необратимого процесса
энтропия окружающей среды:
dSсреда
Для любого процесса:
dQ
dS
T
Для изолированной системы:
dQсреда
Tсреда
dS 0
15
16. Применение неравенства Клаузиуса
Пример 1. Неравновесныйадиабатический процесс
dQ 0
dS 0
Для любого типа самопроизвольного процесса
энтропия возрастает.
Теплота не передается в окружающую среду
dS общ 0
dSокр.среда 0
16
17. Применение неравенства Клаузиуса
Пример 2. Необратимый изотермическийпроцесс (Т = const)
dU 0
dQ dW
если газ расширяется самопроизвольно в вакуум:
dW 0
dQ 0
dS 0
dSокр.среда 0
17
18. Применение неравенства Клаузиуса
Пример 3. Необратимое охлаждениеисточник энергии:
dS
холодильник:
Источник энергии
dQ
dS
Tcold
dQ
Thot
Общее изменение энтропии:
1 1
dS
dQ
Tc
Th
Tc Th
Th Tc
dS dQ
Th Tc
T
T
c h
dQ
dQ
dS 0
Вывод: необратимое охлаждение
является самопроизвольным процессом
холодильник
18
19. Второй закон термодинамики Определение
Невозможно проведение процесса, вкотором теплота передается от
холодного тела к горячему. Только
передача теплоты от горячего тела к
холодному может быть единственным
результатом самопроизвольного
процесса.
(Клаузиус)
19
20. Расчет энтропии
Термодинамическоеопределение энтропии:
обр
Энтропия каждого состояния
системы относительно
какого-либо выбранного
состояния определяется:
обр
Энтропия – функция
состояния.
Поэтому можно рассчитать
изменение энтропии между
начальным и конечным
состоянием системы.
обр
20
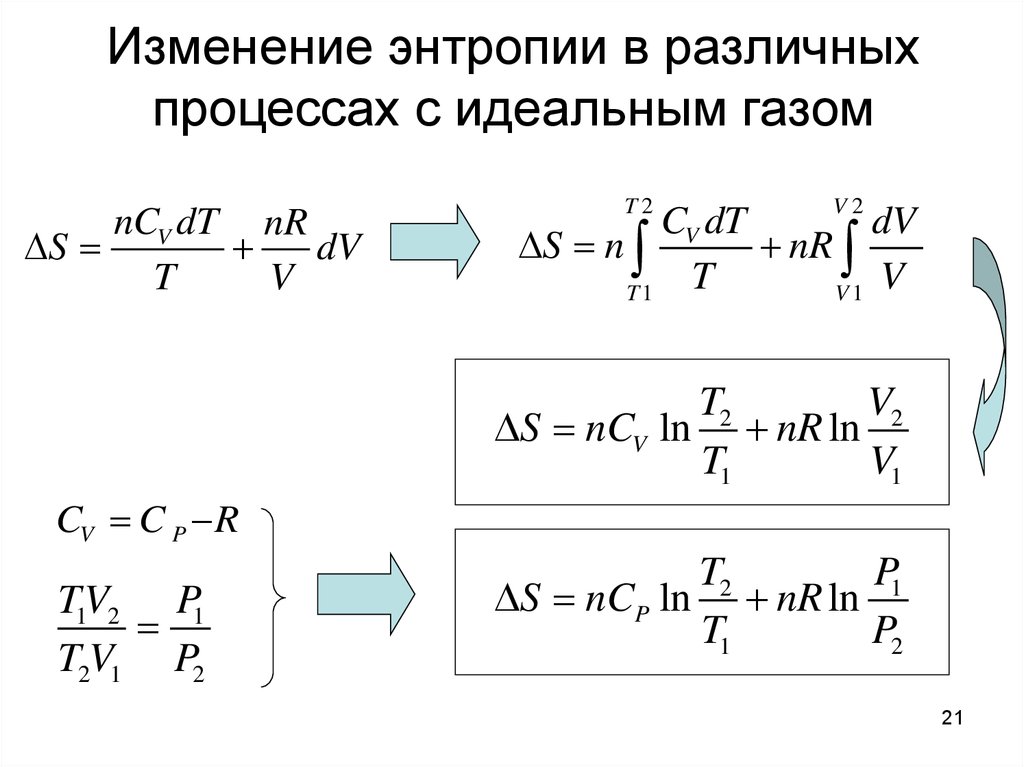
21. Изменение энтропии в различных процессах с идеальным газом
nCV dT nRS
dV
T
V
T2
V2
CV dT
dV
S n
nR
T
V
T1
V1
T2
V2
S nCV ln nR ln
T1
V1
CV C P R
TV
P1
1 2
T2V1 P2
T2
P1
S nCP ln nR ln
T1
P2
21
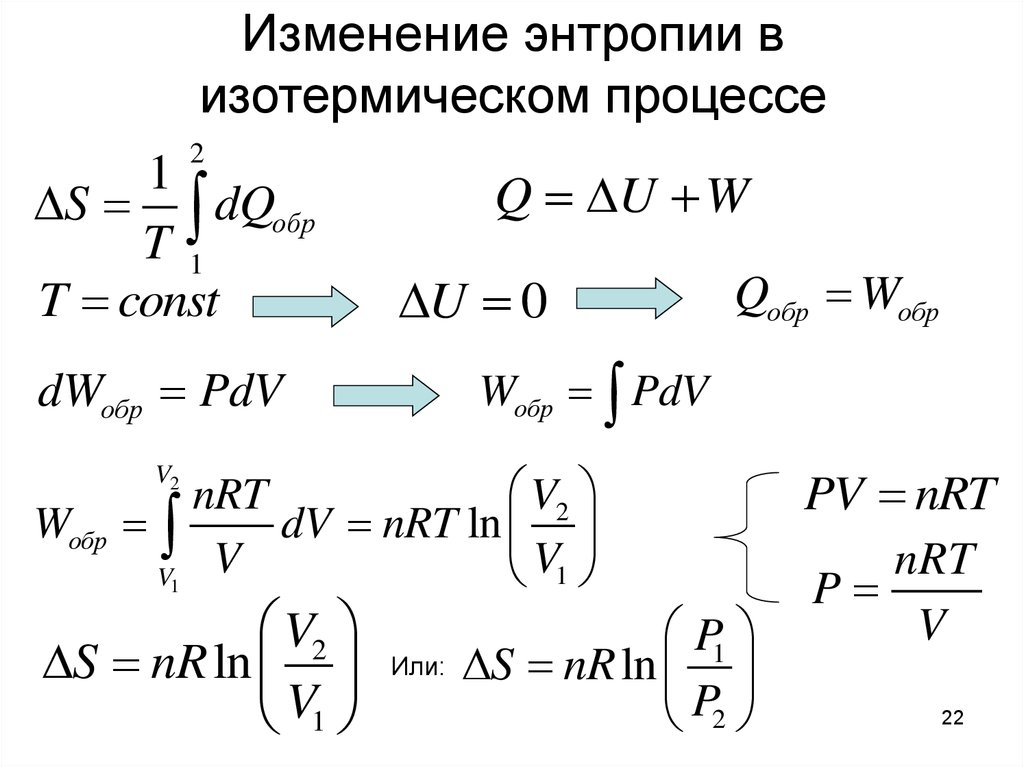
22. Изменение энтропии в изотермическом процессе
21
S dQобр
T1
T const
Q U W
U 0
Wобр PdV
dWобр PdV
PV nRT
nRT
P
V
P1
S nR ln
22
P2
V2
nRT
dV nRT ln
V
V1
V1
V2
Wобр
V2
S nR ln
V1
Qобр Wобр
Или:
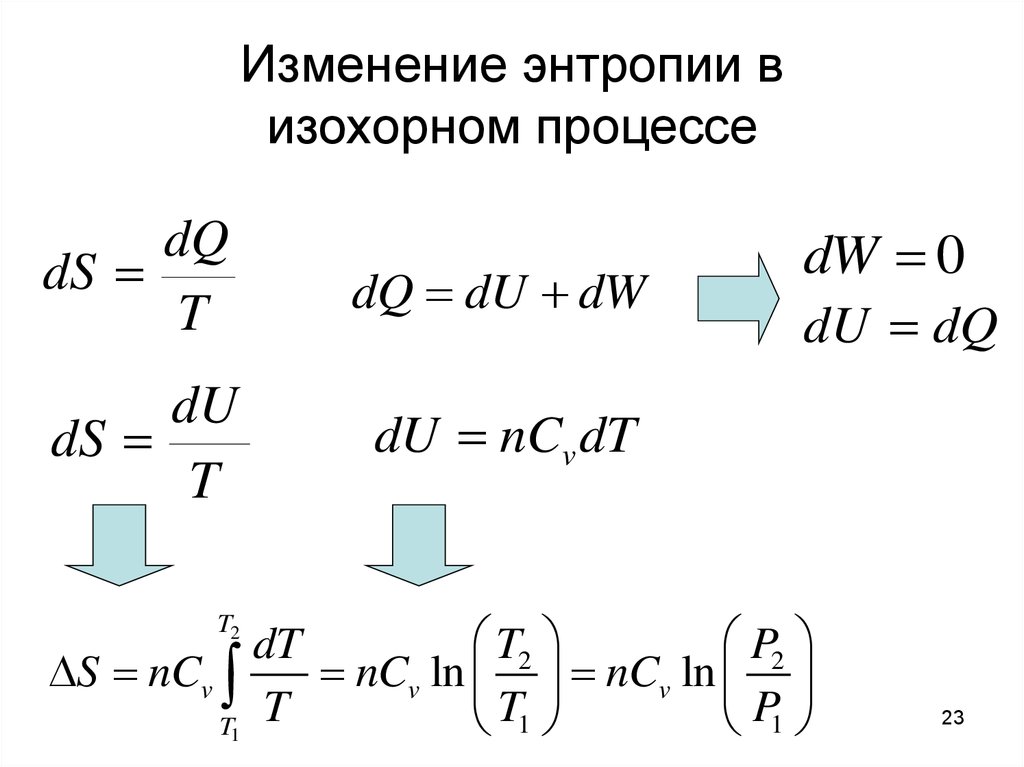
23. Изменение энтропии в изохорном процессе
dQdS
T
dQ dU dW
dU
dS
T
dU nCv dT
dW 0
dU dQ
T2
P2
dT
S nCv
nCv ln nCv ln
T
T1
P1
T1
T2
23
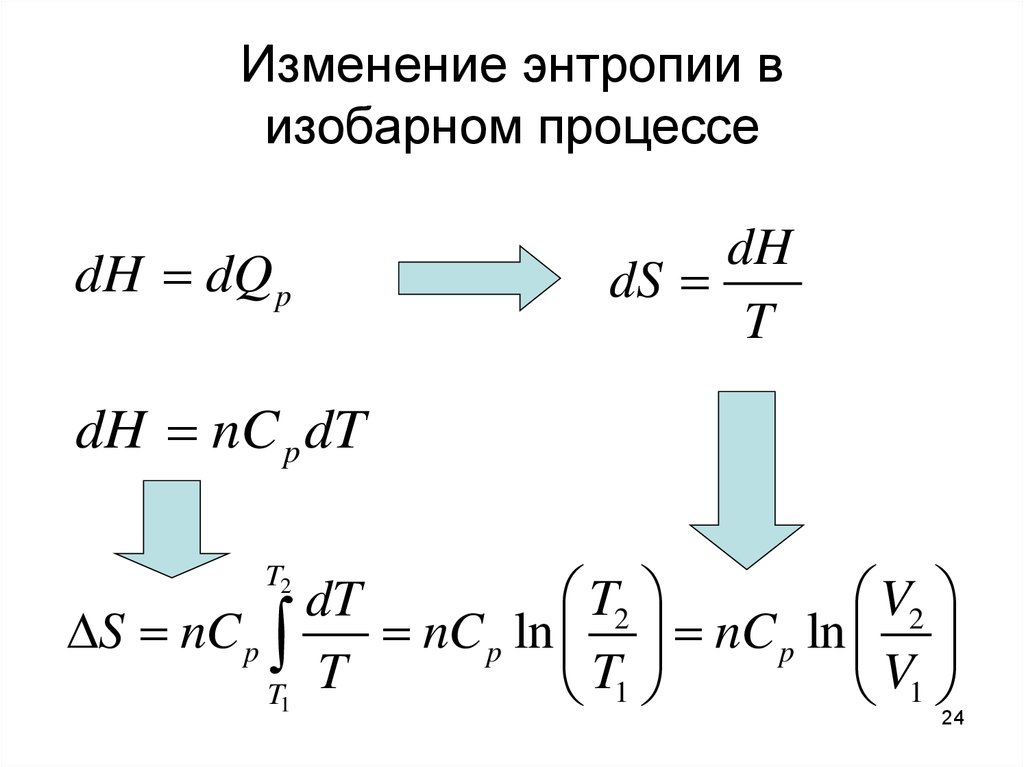
24. Изменение энтропии в изобарном процессе
dH dQ pdH
dS
T
dH nC p dT
T2
V2
dT
S nC p
nC p ln nC p ln
T
T1
V1
T1
T2
24
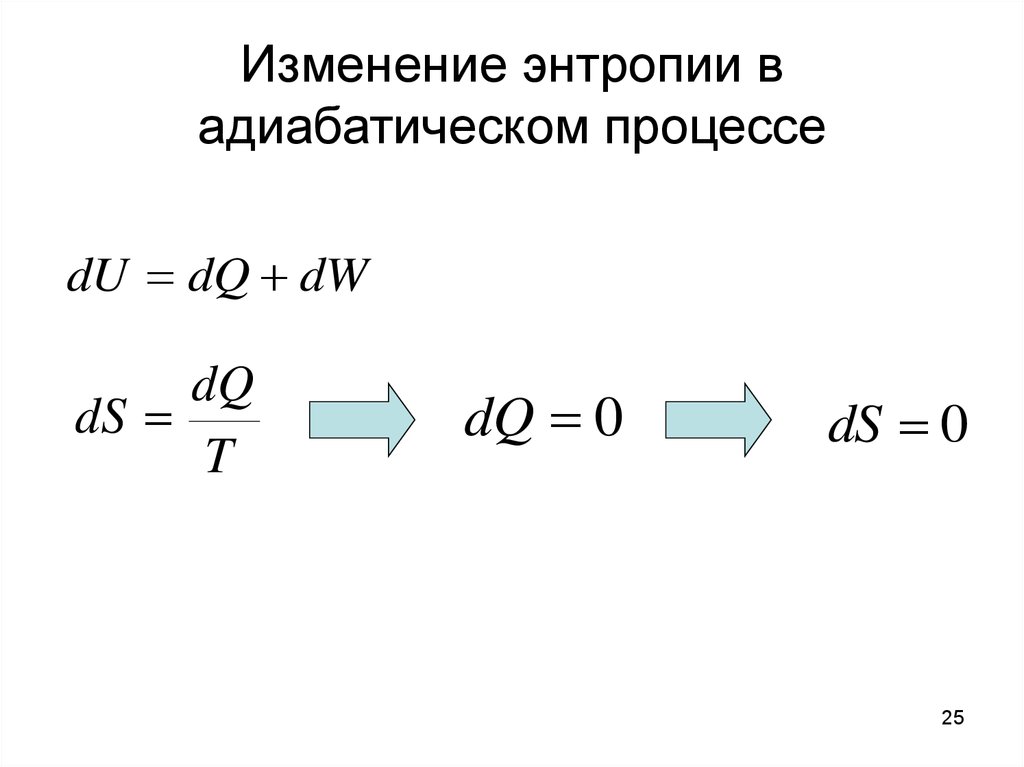
25. Изменение энтропии в адиабатическом процессе
dU dQ dWdQ
dS
T
dQ 0
dS 0
25
26. Изменение энтропии при фазовом переходе
Процессы:• кристаллизация
• кипение
• испарение
• плавление
• конденсация
• сублимация
• возгонка
исп
плав
плав
исп
Чему равно изменение энтропии?
26
27. Правило Трутона
При постоянном давлении:Q фп H
Изменение молярной энтропии:
Правило Трутона
фп S
фп H
Tфп
Экзотермические процессы ( фп H 0 ): - кристаллизация
- конденсация
dS 0
- сублимация
Эндотермические процессы ( фп H 0 ): - плавление
- испарение
dS 0
27
- возгонка
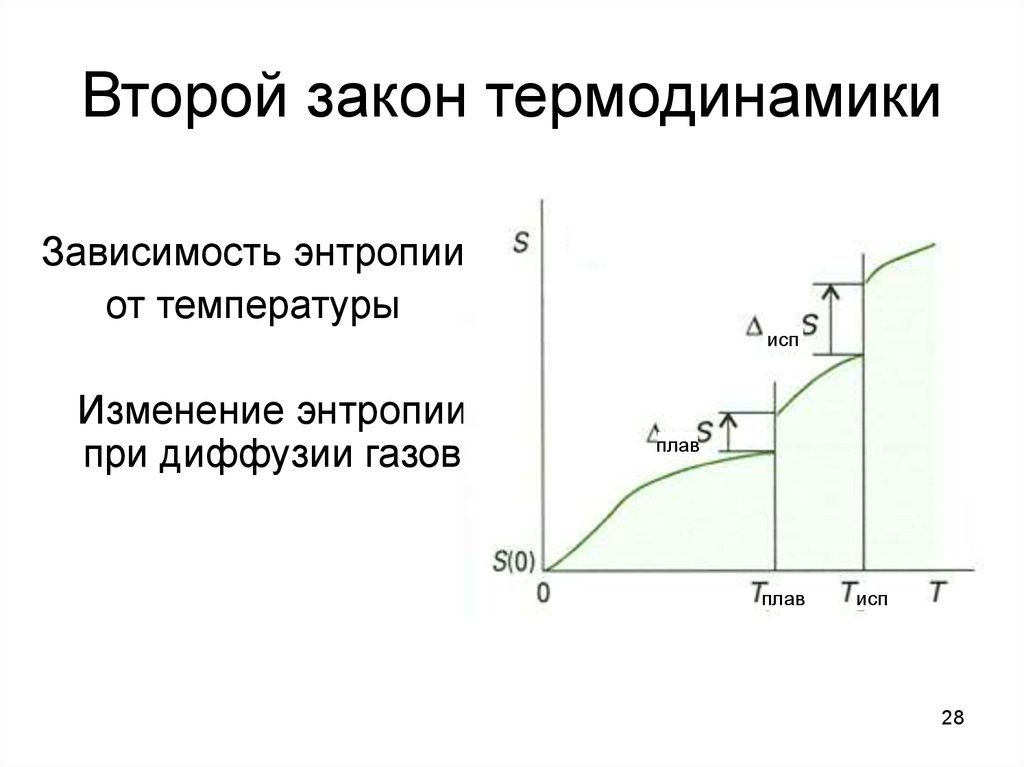
28. Второй закон термодинамики
Зависимость энтропииот температуры
исп
Изменение энтропии
при диффузии газов
плав
плав
исп
28
29. Зависимость энтропии от температуры
P=
const:
S (T )
T
1
dQ
dS
T
S (T1 )
T1
dQ
dS
T
T2
S T2 S T1
Cp
T1
S (T2 )
S (T1 )
2
T2
dS
T1
Cp
T
T
dT
dQ dH C p dT
C p a bT cT 2 c T 2 ...
T2
S T2 S T1
dT
если Cp = const:
T1
T2
dT
S T2 S T1 C p
S T1 C p ln
T
T1
T1
Cp
T
dT
T2
29
30. Зависимость энтропии от температуры
V = const:dQ
dS
S (T2 )
dQ dU Cv dT
T
T2
Cv
dS dT
T
S (T1 )
T1
T2
Cv
S T2 S T1 dT
T
T1
T2
dT
если Cv = const: S T2 S T1 Cv
T T
1
T2
S T2 S T1 Cv ln
T1
30
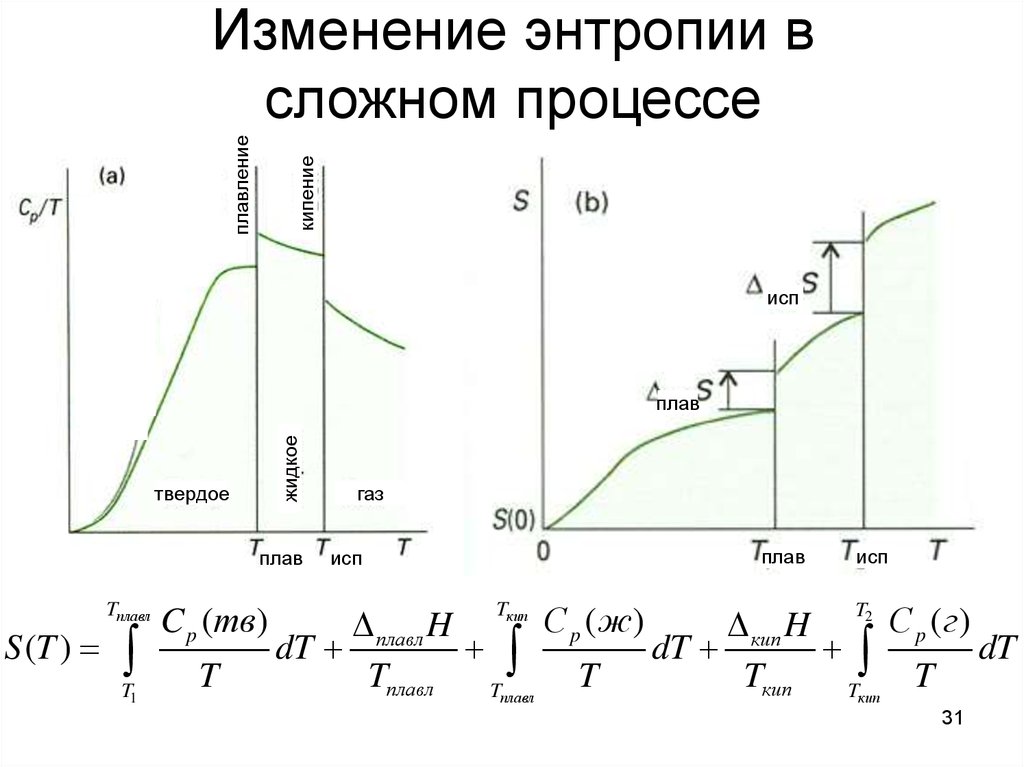
31. Изменение энтропии в сложном процессе
кипениеплавление
Изменение энтропии в
сложном процессе
исп
жидкое
плав
твердое
плав
S (T )
Tплавл
T1
C p (тв )
T
газ
исп
плав
исп
Tкип
T2
C p ( ж)
C p (г)
плавл H
кип H
dT
dT
dT
Tплавл
T
Tкип
T
Tплавл
Tкип
31
32. Изменение энтропии при диффузии газов
Диффузия – это самопроизвольный необратимый процессV1 V2
S1 n1R ln
V1
V1 V2
S2 n2 R ln
V2
n1
V1
x1
n1 n2 V1 V2
n2
V2
x2
n1 n2 V1 V2
Xi – мольная доля
Sобщ
Sобщ
V1 V2
V1 V2
S1 S2 R n1 ln
n2 ln
V1
V2
R n1 ln x1 n2 ln x2
32
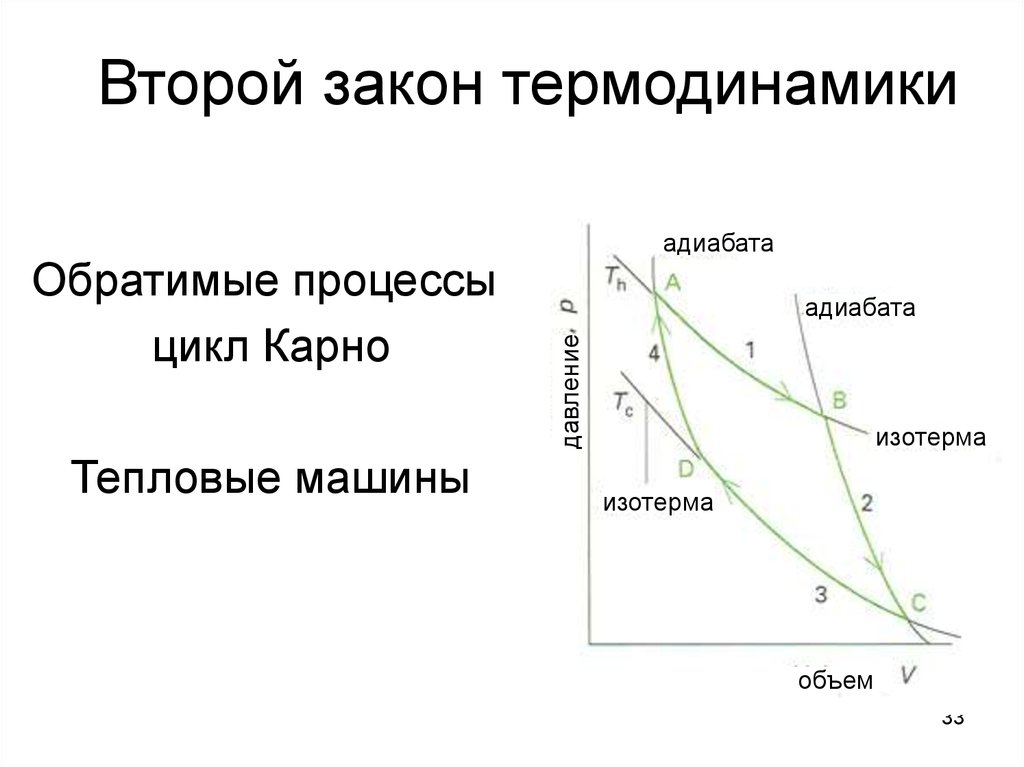
33. Второй закон термодинамики
Тепловые машиныадиабата
давление
Обратимые процессы:
цикл Карно
адиабата
изотерма
изотерма
объем
33
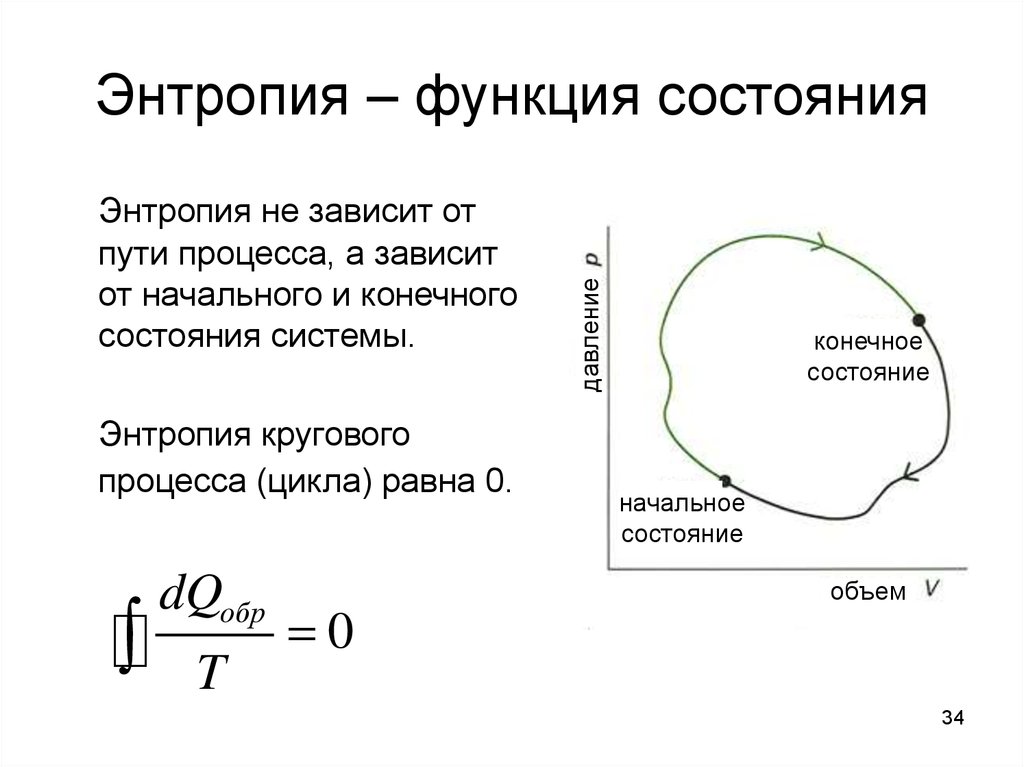
34. Энтропия – функция состояния
Энтропия не зависит отпути процесса, а зависит
от начального и конечного
состояния системы.
Энтропия кругового
процесса (цикла) равна 0.
dQобр
T
0
давление
Энтропия – функция состояния
конечное
состояние
начальное
состояние
объем
34
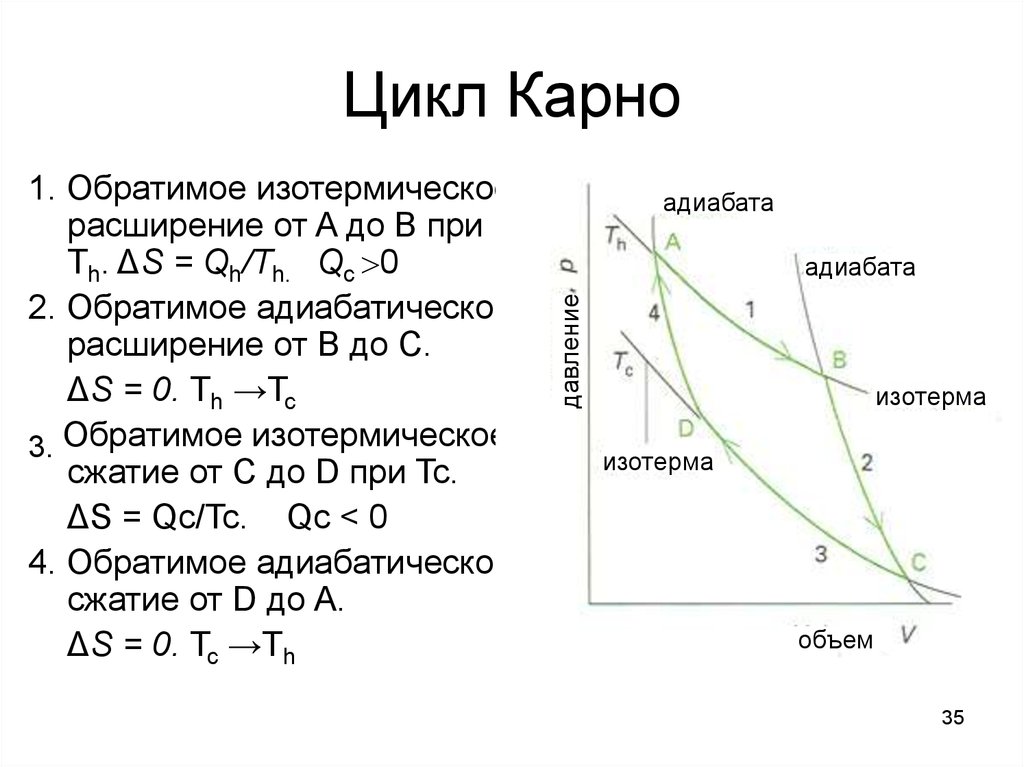
35. Цикл Карно
адиабатаадиабата
давление
1. Обратимое изотермическое
расширение от A до B при
Th. ΔS = Qh/Th. Qc 0
2. Обратимое адиабатическое
расширение от B до C.
ΔS = 0. Th →Tc
3. Обратимое изотермическое
сжатие от C до D при Tc.
ΔS = Qc/Tc. Qc < 0
4. Обратимое адиабатическое
сжатие от D до A.
ΔS = 0. Tc →Th
изотерма
изотерма
объем
35
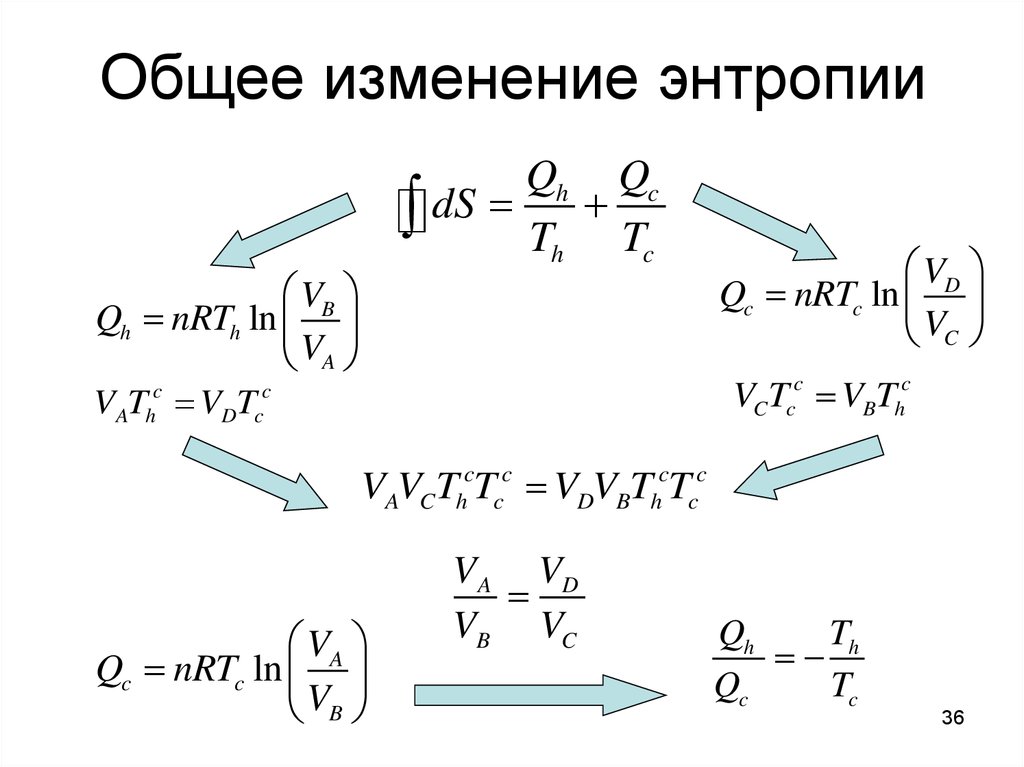
36. Общее изменение энтропии
Qh QcdS Th Tc
VB
Qh nRTh ln
VA
VCTcc VBThc
V T V T
c
A h
VD
Qc nRTc ln
VC
c
D c
VAVCThcTcc VDVBThcTcc
VA
Qc nRTc ln
VB
VA VD
VB VC
Qh
Th
Qc
Tc
36
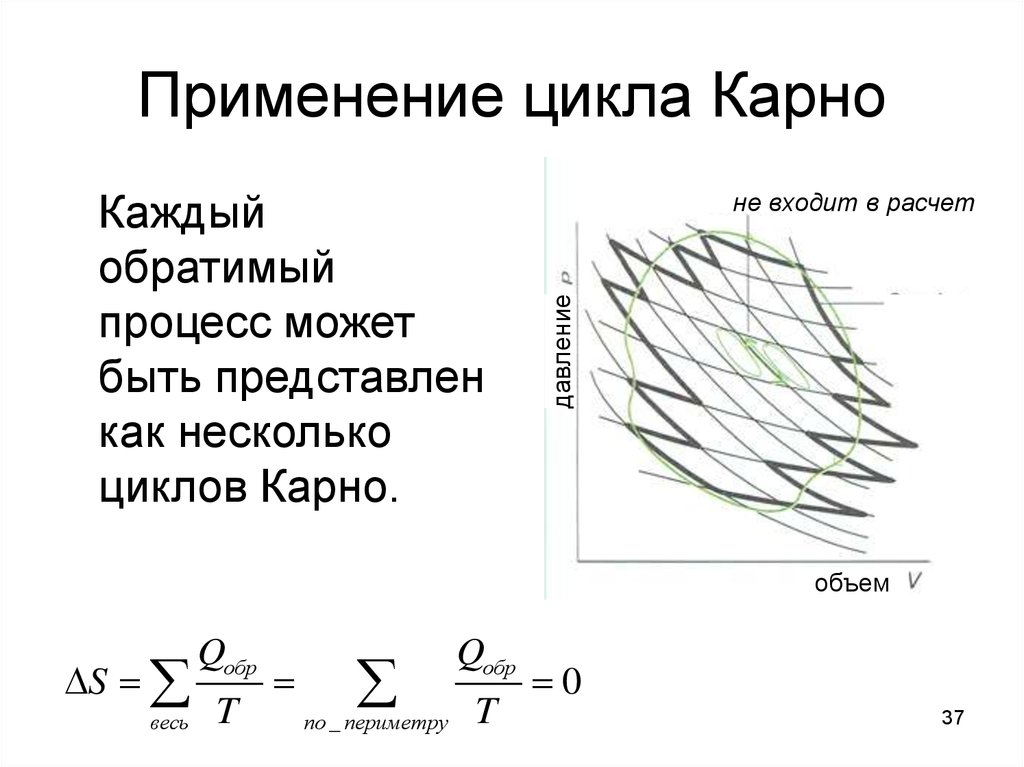
37. Применение цикла Карно
не входит в расчетдавление
Каждый
обратимый
процесс может
быть представлен
как несколько
циклов Карно.
объем
S
весь
Qобр
T
по _ периметру
Qобр
T
0
37
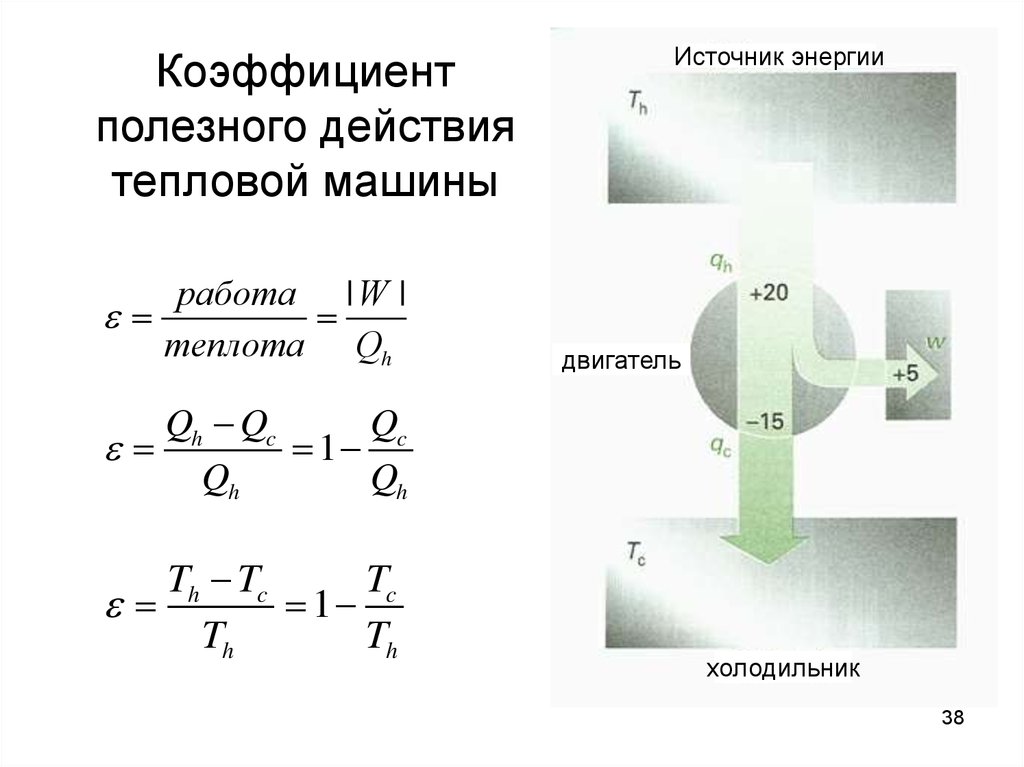
38. Коэффициент полезного действия тепловой машины
работа | W |теплота Qh
Источник энергии
двигатель
Qh Qc
Qc
1
Qh
Qh
Th Tc
Tc
1
Th
Th
холодильник
38
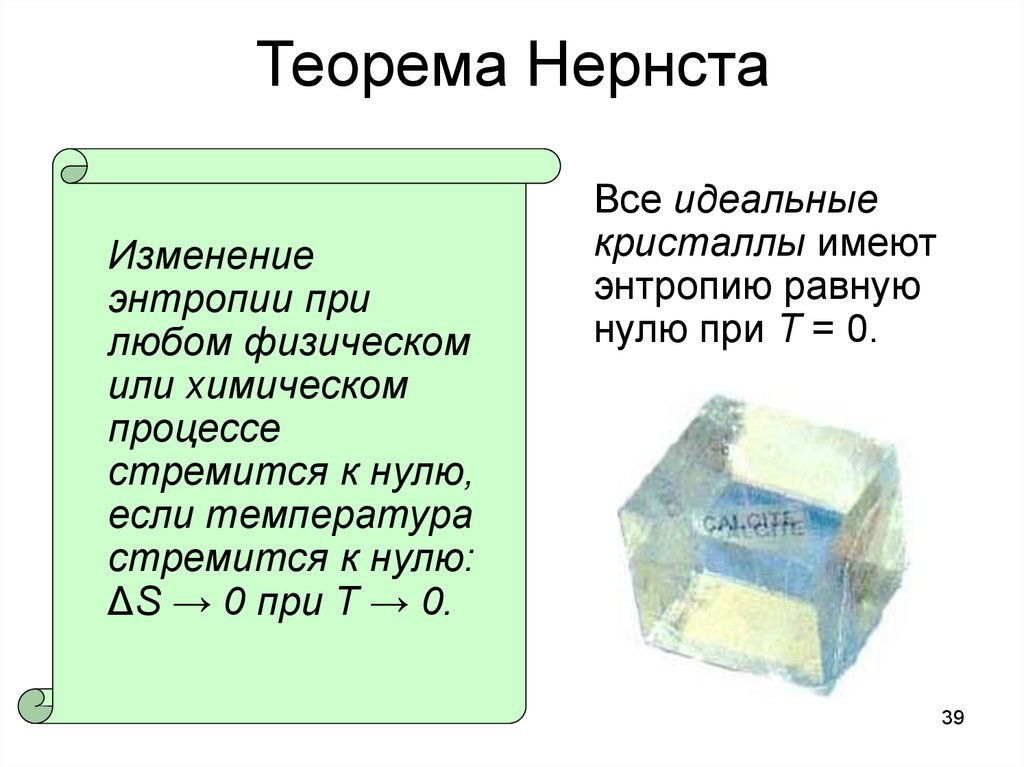
39. Теорема Нернста
Изменениеэнтропии при
любом физическом
или химическом
процессе
стремится к нулю,
если температура
стремится к нулю:
ΔS → 0 при T → 0.
Все идеальные
кристаллы имеют
энтропию равную
нулю при T = 0.
39
40. Третий закон термодинамики
Если энтропию каждого элемента вего наиболее стабильном состоянии
принять равной нулю при T = 0, тогда
каждое вещество обладает
положительной энтропией, которая
при T = 0 становится равной нулю.
40
41. Энтропия химической реакции
Стандартная энтропияхимической реакции ΔS° это разность между суммой
молярных энтропий
продуктов и реагентов в
стандартном состоянии
(с учетом стехиометрических
коэффициентов):
продукты
реагенты
41
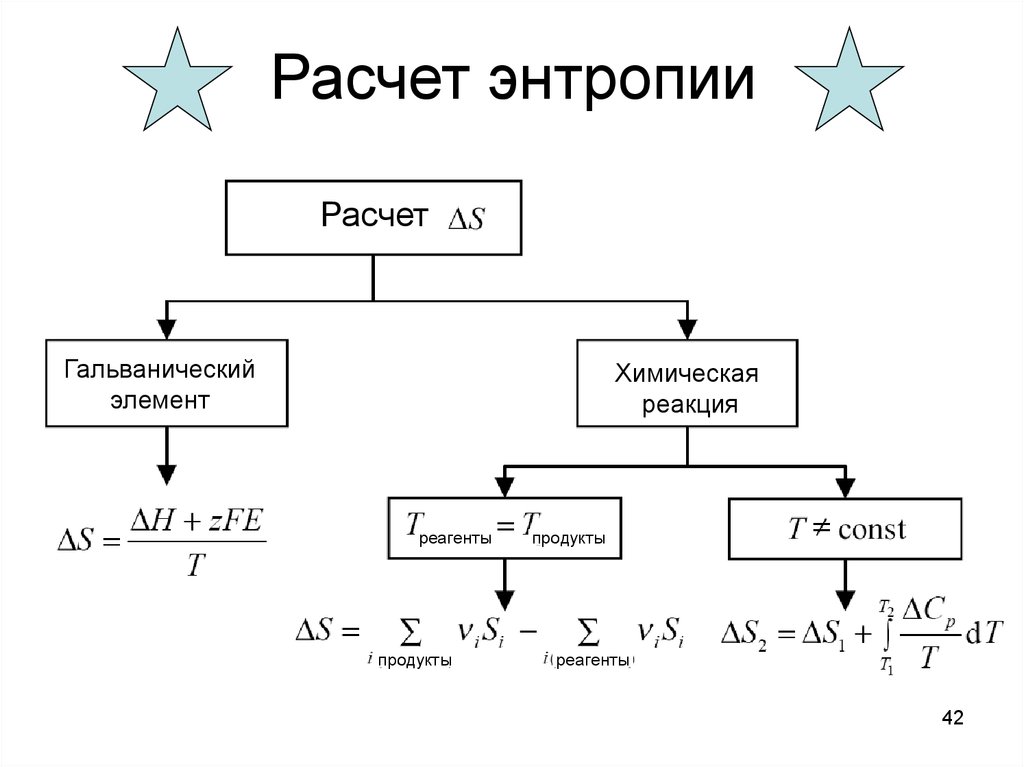
42. Расчет энтропии
РасчетГальванический
элемент
Химическая
реакция
реагенты
продукты
продукты
реагенты
42
43. Критерий самопроизвольного процесса
Неравенство Клаузиуса:dQ
dS
0
T
V, U = const:
dU
dS
0
T
dSU ,V 0
TdS dU
V, S = const:
dU S ,V 0
• В изолированной системе при
постоянном объеме и постоянной
внутренней энергии энтропия
увеличивается если процесс
самопроизвольный.
• Если энтропия и объем системы
постоянны, внутренняя энергия
уменьшается в самопроизвольном
процессе.
• Если энтропия системы постоянна,
то должно быть увеличение
энтропии в окружающей среде,
которое достигается при
уменьшении энергии системы, т.к.
энергия системы передается в
окружающую среду в виде теплоты.
43
44. Критерий самопроизвольного процесса
Неравенство Клаузиуса:dQ
dS
0
T
P, H = const:
dH
dS
0
T
dS H ,V 0
P, S = const:
TdS dH
dH S , P 0
Энтропия системы при
постоянном давлении и при
постоянной энтальпии
увеличивается (при этом не
происходит изменения энтропии
в окружающей среде)
• Если энтропия и давление
системы постоянны, то
энтальпия системы уменьшается
(при этом происходит
увеличение энтальпии в
окружающей среде, которое
достигается при увеличении
энергии системы, т.к. энергия
системы передается из
окружающей среды в систему в
виде теплоты. )
44

















 Физика
Физика








