Похожие презентации:
Кислород
1.
2. Содержание темы: «Кислород»
Кислород вприроде
Открытие
кислорода
Химический элемент
и простое вещество
Физические
свойства
кислорода
Получение
кислорода
Химические
свойства
Применение
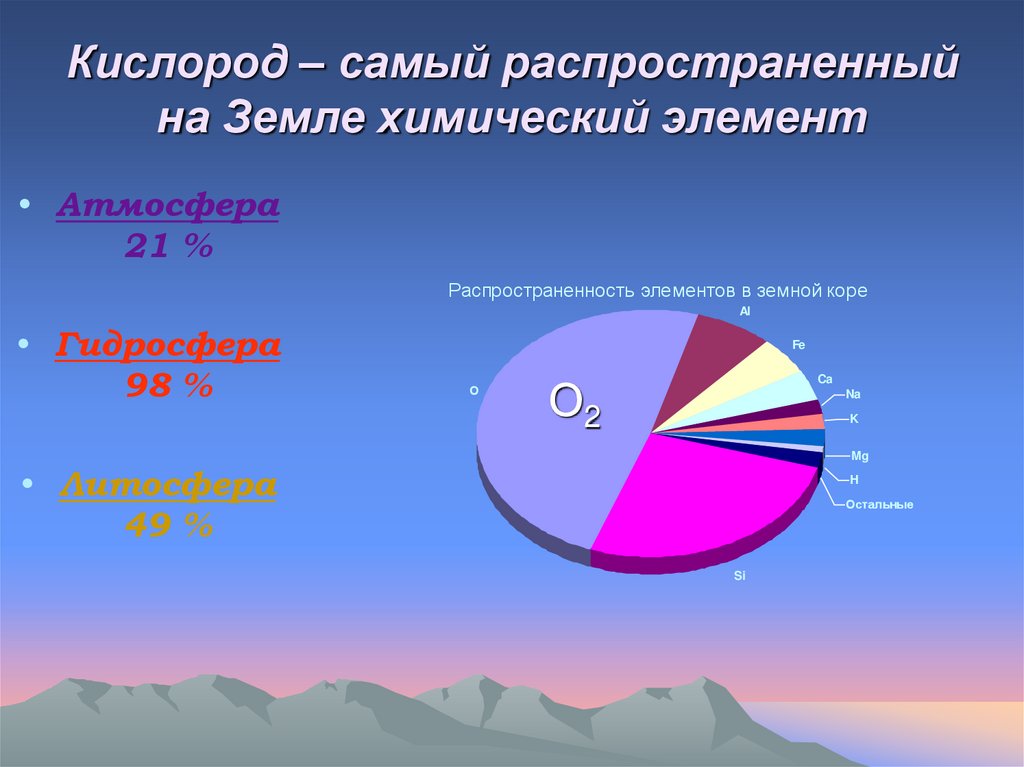
3. Кислород – самый распространенный на Земле химический элемент
• Атмосфера21 %
Распространенность элементов в земной коре
Al
• Гидросфера
98 %
Fe
О
Ca
О2
Na
K
Mg
• Литосфера
49 %
H
Остальные
Si
4. Задача
В настоящее время численность населения земногошара приблизилась к 6-ти миллиардной отметке,
количество кислорода в земной атмосфере 1015 тонн.
Сколько атмосферного кислорода по массе приходится
на одного жителя планеты? (Общее число жителей
планеты - 6 • 109)
Решение:
1015
m(общ)
=
m (O) =
n(общ)
= 1,67 • 105 т/ чел
6 •109
Ответ:
На одного жителя планеты приходится 167000 тонн
атмосферного кислорода (О2)
5. Кислород почти одновременно был открыт двумя выдающимися химиками:
ДжозефПристли
Карл
Шееле
Официально открытие кислорода датируется
1 августа 1774 года
6.
Современное название кислородудал
Антуан
Лавуазье
оксюс – «кислый»
генао – «рождаю»
7.
Кислород – химическийэлемент
Группа
Подгруппа
Период
Порядковый номер
Относительная
атомная масса
VI
Главная
II
16
16
Строение атома
Z = 8 , ē =8, р+ = 8,
n0 = 16-8 = 8
Валентность
II
8.
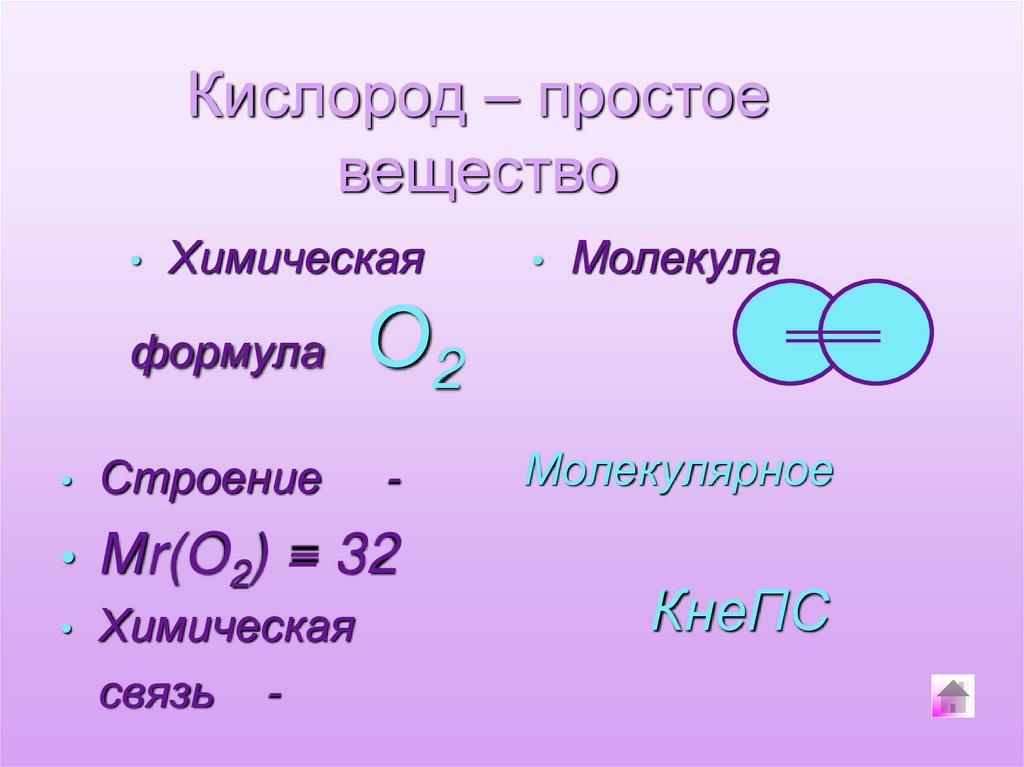
Кислород – простоевещество
Химическая
формула
Молекула
О2
Строение
Мr(O2) = 32
Химическая
связь -
-
Молекулярное
КнеПС
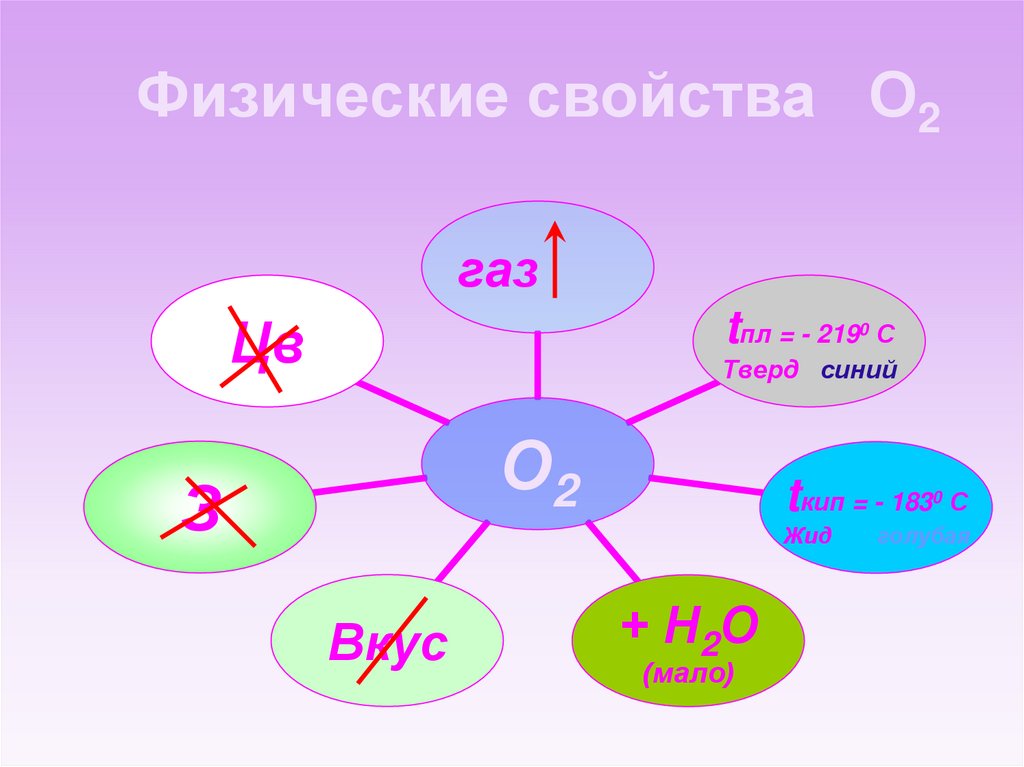
9. Физические свойства О2
газtпл = - 219
Цв
С
Тверд синий
0
О2
З
tкип = - 183
0
Жид
Вкус
+ Н2О
(мало)
С
голубая
10. Аллотропные модификации
3О2 → 2О3кислород
О3 → О + О2
озон
ат омарный
кислород
сильный
окислит ель
озон
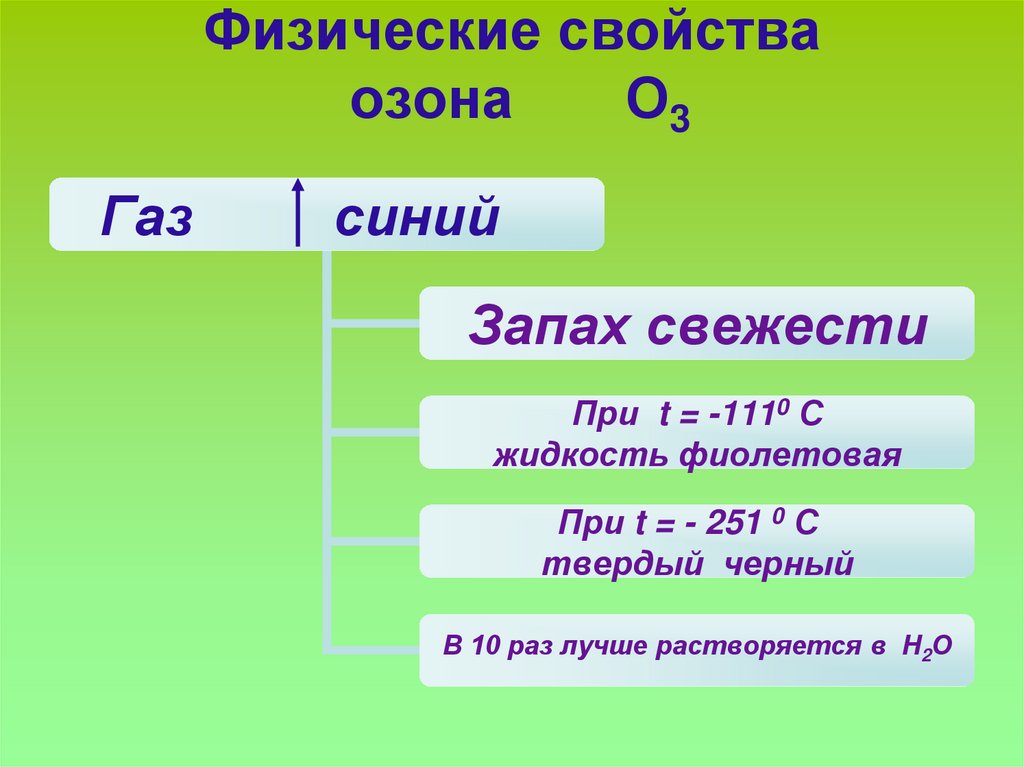
11. Физические свойства озона О3
Газсиний
Запах свежести
При t = -1110 С
жидкость фиолетовая
При t = - 251 0 С
твердый черный
В 10 раз лучше растворяется в Н2О
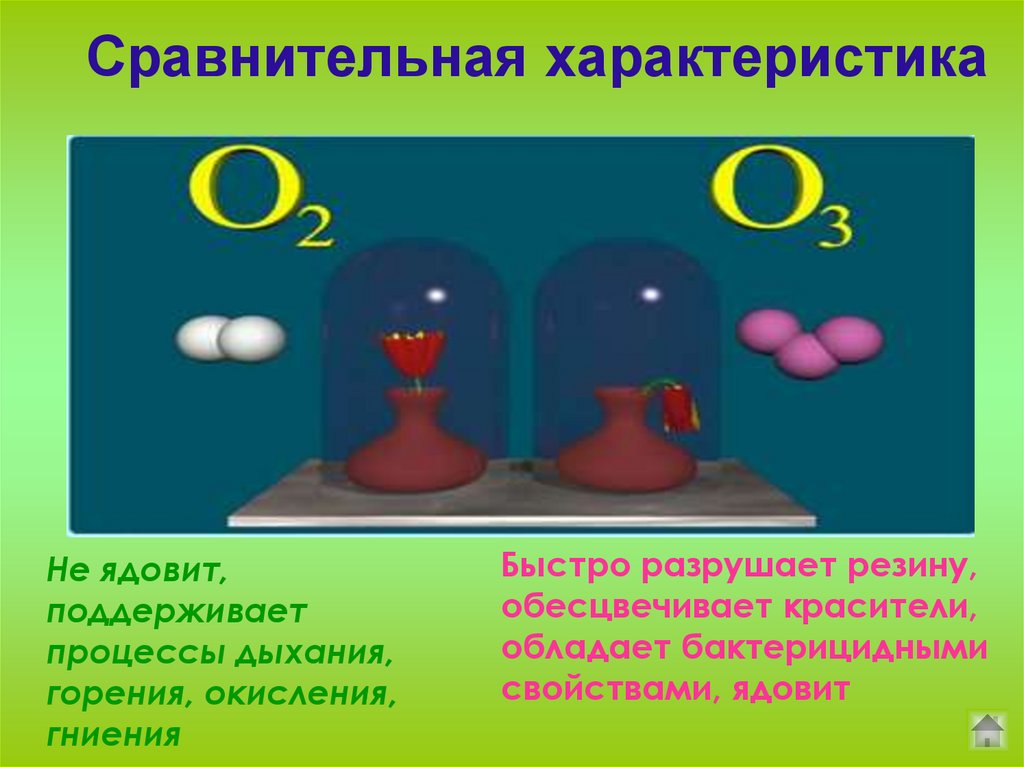
12.
Сравнительная характеристикаНе ядовит,
поддерживает
процессы дыхания,
горения, окисления,
гниения
Быстро разрушает резину,
обесцвечивает красители,
обладает бактерицидными
свойствами, ядовит
13.
ГДЕ КИСЛОРОД ?В природе
В
промышленности
В
лаборатории
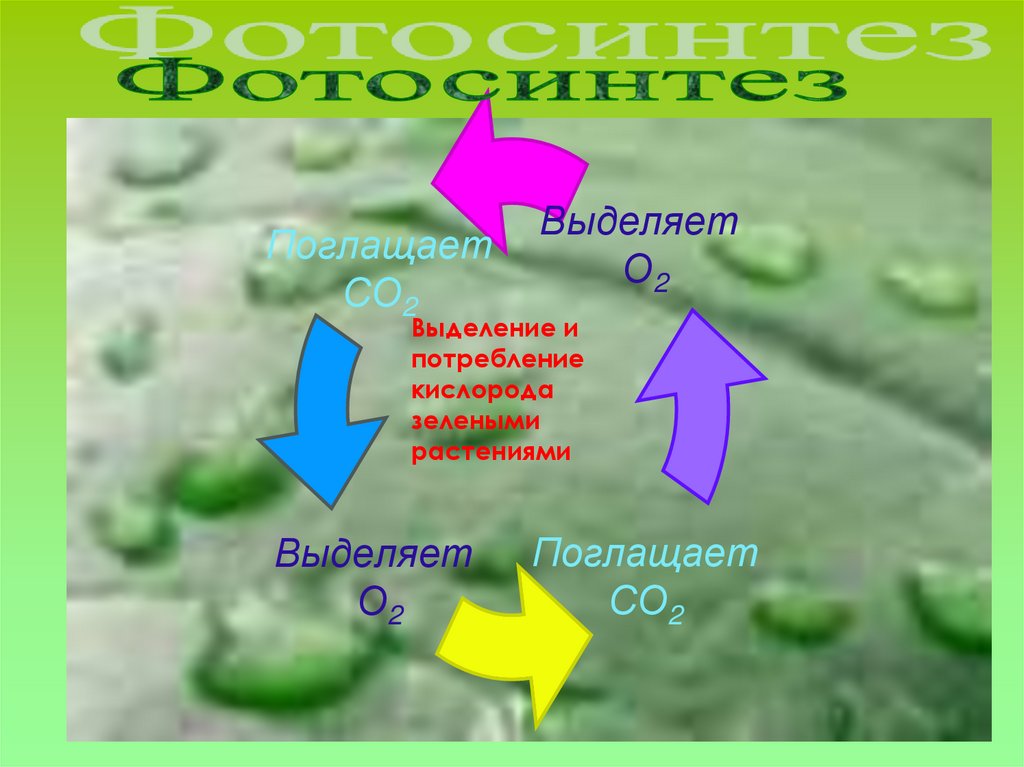
14.
ПоглащаетСО2
Выделяет
О2
Выделение и
потребление
кислорода
зелеными
растениями
Выделяет
О2
Поглащает
СО2
15. В промышленности кислород получают
Из жидкоговоздуха
Электролизом
воды
2 Н 2О = 2 Н 2 + О 2
16. В лаборатории кислород получают
2 KClO3 2 KCl + 3 O22 KMnO4 K2MnO4 + MnO2 + O2
17. Способы собирания
Вытеснениемводы
Вытеснением
воздуха
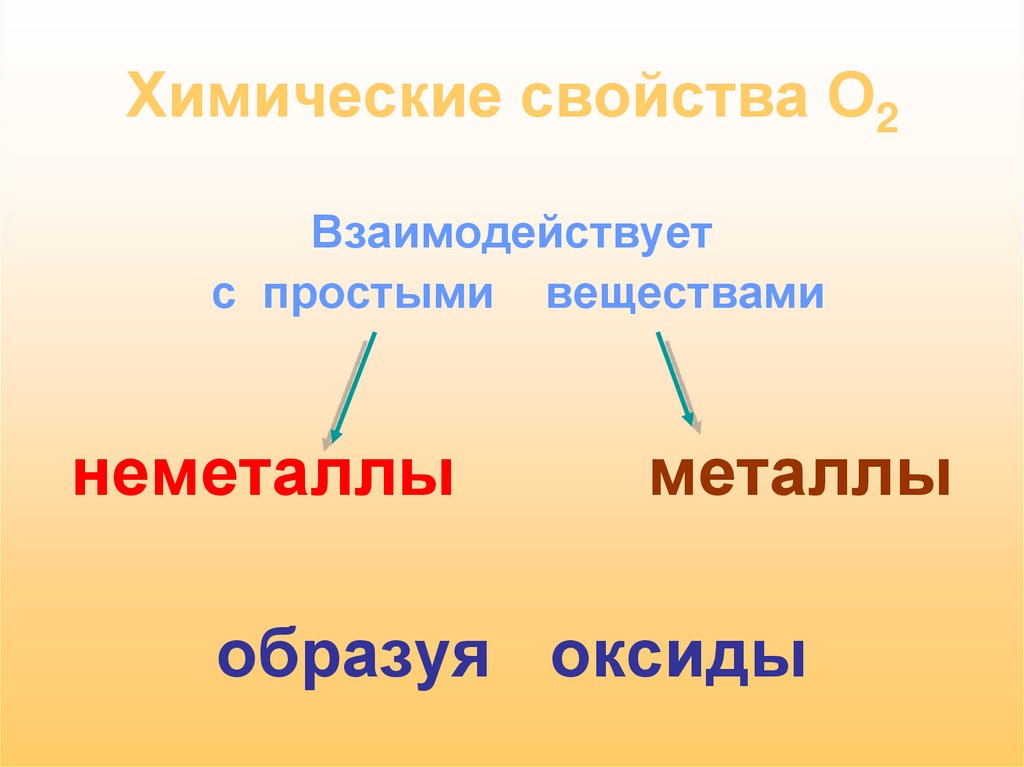
18. Химические свойства О2
Взаимодействуетс простыми веществами
неметаллы
металлы
образуя оксиды
19. Неметаллы
СЕРАСЕРА
S + O2→SO2
СЕРА
СЕРА
20. Неметаллы
Горение фосфораФосфор
4 P + 5 O2 → 2 P2O5
21. Металлы
железо3 Fe + 2 O2 Fe3O4
ржавчина
железо
железо
22. Металлы
2 Са + О 2 → 2 СаОнегашеная известь
кальций
23. Сложные вещества
С3Н8 + 5 О2→3 СО2 + 4 Н2ОПри горении
сложных веществ
образуется столько
продуктов,
сколько элементов было
в сложном веществе.
















 Химия
Химия








