Похожие презентации:
Структурная организация белков. Методы изучения структуры белков
1.
Лекция №2.Структурная организация
белков.
Методы изучения структуры
белков.
Типы связей встречающихся в
белковой молекуле.
Понятие о молекулярной
патологии.
2. История изучения
Антуан Франсуа де Фуркруа,основоположник изучения белков
Белки были выделены в отдельный класс
биологических молекул в XVIII веке в
результате работ французского химика
Антуана Фуркруа и других учёных, в
которых было отмечено свойство белков
коагулировать (денатурировать) под
воздействием нагревания или кислот. В то
время были исследованы такие белки, как
альбумин («яичный белок»), фибрин
(белок из крови) и глютен из зерна
пшеницы. Голландский химик Геррит
Мульдер провёл анализ состава белков и
выдвинул гипотезу, что практически все
белки имеют сходную эмпирическую
формулу. Термин «протеин» для
обозначения подобных молекул был
предложен в 1838 году сотрудником
Мульдера Якобом Берцелиусом.
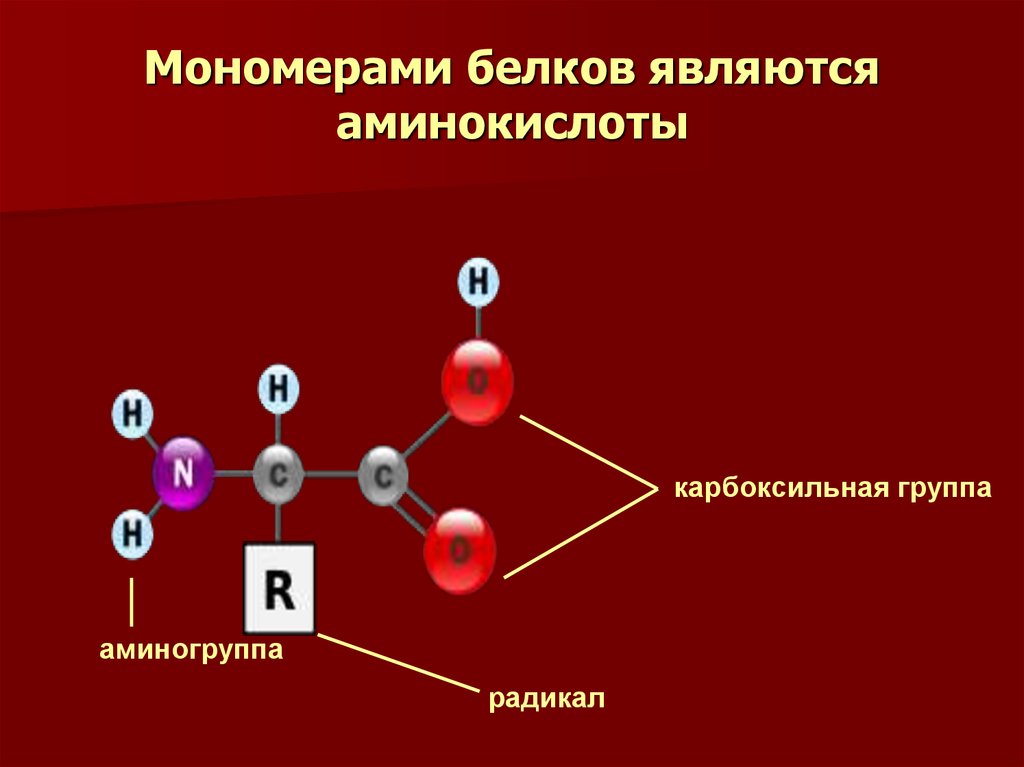
3. Мономерами белков являются аминокислоты
карбоксильная группааминогруппа
радикал
4. Олигопептиды содержат до 20 амк (среди них различают ди-, три-, тетра- и т.д. пептиды); Полипептиды содержат от 20 до 50 амк; Белки – полипептидные
цепи, объединяющиеболее 50 амк., и имеющие молекулярную массу
свыше 6 тыс.
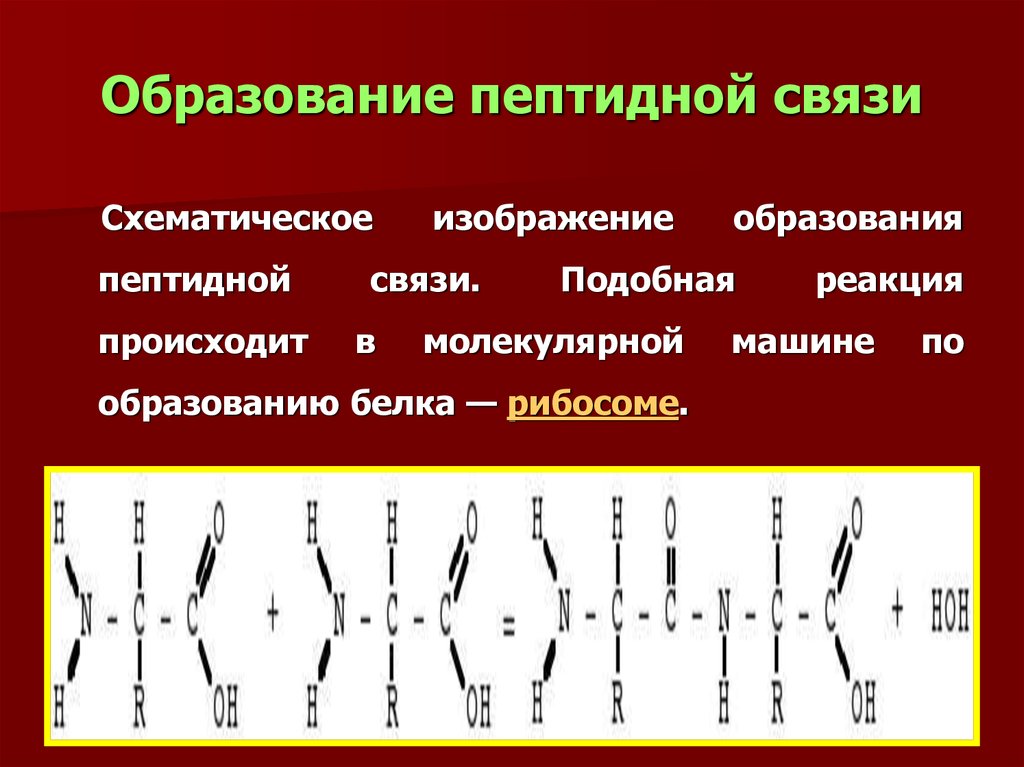
5. Образование пептидной связи
Схематическоепептидной
происходит
изображение
связи.
в
образования
Подобная
молекулярной
образованию белка — рибосоме.
реакция
машине
по
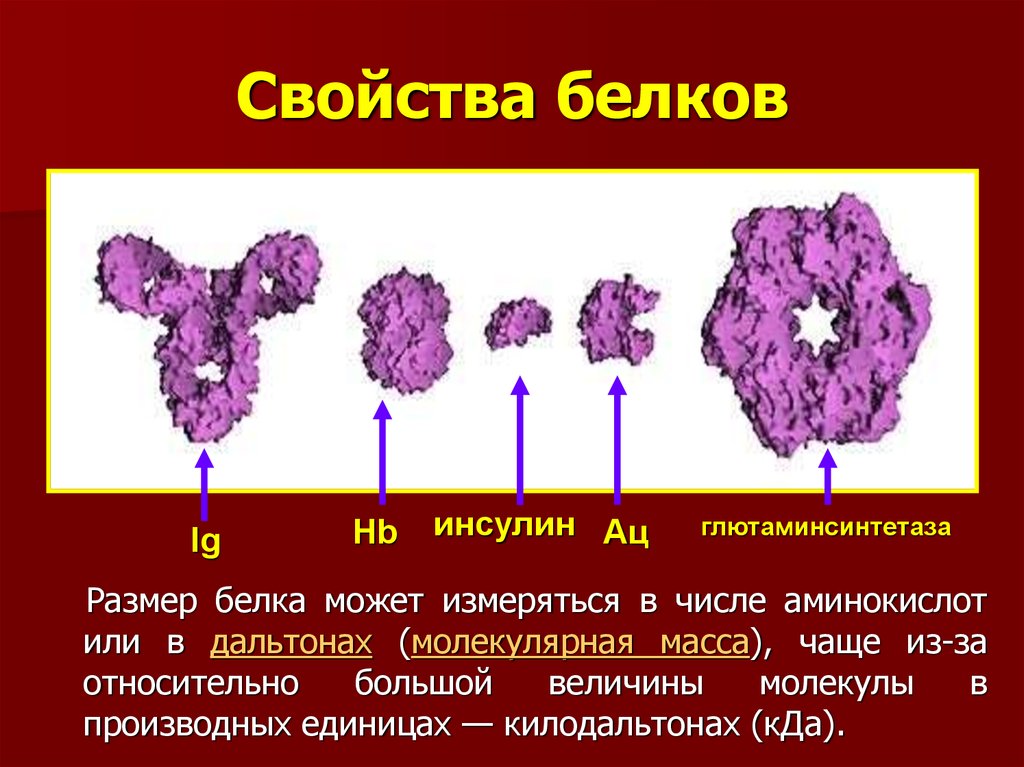
6. Свойства белков
IgHb
инсулин Ац
глютаминсинтетаза
Размер белка может измеряться в числе аминокислот
или в дальтонах (молекулярная масса), чаще из-за
относительно
большой
величины
молекулы
в
производных единицах — килодальтонах (кДа).
7. - Амфотерность - Способность к ионизации в растворе - Характерной константой белков является рI – изоэлектическая точка - Хорошо растворимы
в воде- Способность к денатурации
8. Классификация белков
1.-
2.
-
3.
-
По химическому строению
простые;
сложные;
По выполняемой функции
белки-ферменты
белки-гормоны
белки-рецепторы
структурные белки
защитные белки
сократительные белки
По форме
глобулярные
фибриллярные
9. Классификация белков
4.По молекулярной массе
-
низкомолекулярные
высокомолекулярные
5.
По локализации в клетке
-
цитоплазматические
лизосомальные
ядерные и т.д.
6.
По локализации в организме
-
белки крови
белки печени
белки сердца и т.д.
-
-
10. Классификация белков
4.По молекулярной массе
-
низкомолекулярные
Высокомолекулярные
5.
По локализации в клетке
-
цитоплазматические
лизосомальные
ядерные и т.д.
6.
По локализации в организме
-
белки крови
белки печени
белки сердца и т.д.
-
-
11. Классификация белков
7.По возможности адаптативно
регулировать количество данных белков
-
белки, синтезирующиеся с постоянной скоростью
(конститутивные)
белки, синтез которых может усиливаться при воздействии
факторов внешней среды (индуцибельные)
-
8.
По продолжительности жизни
-
очень быстро обновляющиеся
очень медленно обновляющиеся
-
9.
По схожим участкам первичной структуры
и родственным функциям
-
семейства белков
12. Первичная структура
Это порядок чередования амк в полипептидной цепи(или цепях) и местоположение дисульфидных связей.
Т.о., полипептидная цепь на одном конце содержит
свободную аминогруппу (N-конец), а на другом –
карбоксильную группу (С-конец). За начало цепи
принимается ее N-конец, т.к. отсюда начинается отчет
амк
(это
совпадает
с
направлением
синтеза
полипептидной цепи на рибосоме).
Аминогруппа на N-конце иногда может быть
ацетилированной (СН3-СО-NH-…), а карбоксильная группа
– амидированной. Модификации С-конца более редки по
сравнению с N-концом.
Название
отдельных
пептидов
образуются
в
соответствии с составляющими их амк остатками, начиная
с N-конца. При этом в названиях всех амк, за
исключением последней, меняется окончание на «ил».
Например, L-аланил-L-цистеил-L-метионин
-
13. При этом сначала активируется карбоксильная группа одной амк, а затем она соединяется с аминогруппой др. амк. Наиболее распространена в пр
При этом сначала активируется карбоксильнаягруппа одной амк, а затем она соединяется с
аминогруппой др. амк.
Наиболее распространена в природе транс-
пептидная связь, реже встречается менее
устойчивая цис-пептидная связь.
Пептидная связь является частично двойной
(40%)частично одинарной (60%). Время жизни
одинарной связи несколько больше, чем двойной.
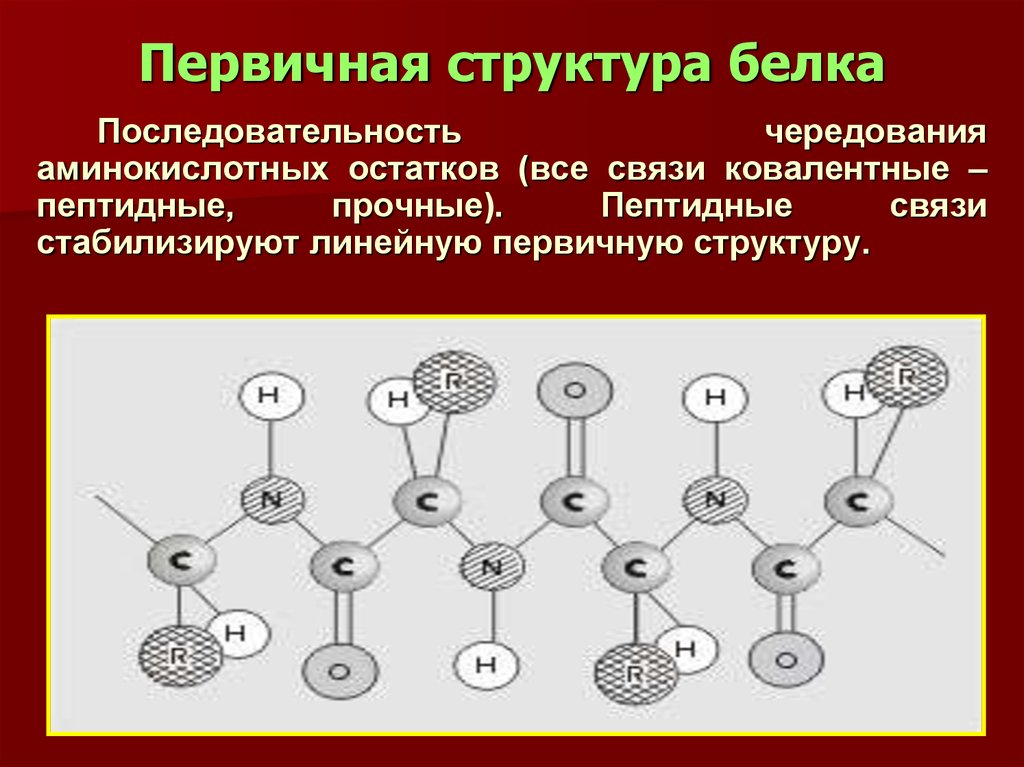
14. Первичная структура белка
Последовательностьчередования
аминокислотных остатков (все связи ковалентные –
пептидные,
прочные).
Пептидные
связи
стабилизируют линейную первичную структуру.
15. Особенности первичной структуры
HR
O
H
C
N
C
C
C
N
O
H
H
R
В остове полипептидной
цепи чередуются
жесткие структуры
(плоские пептидные
группы) с относительно
подвижными участками
(-СНR), которые
способны вращаться
вокруг связей.
Такие особенности
полипептидной цепи
влияют на укладку ее в
пространстве.
16. Особенности пептидной связи
1. Компланарность– все атомы, входящие в пептидную
группу находятся в одной плоскости;
2. Способность существовать в 2-х резонансных формах
(кето- или енольной форме);
3. Транс-положение заместителей по отношению к С-Nсвязи;
4. Способность к образованию водородных связей,
причем каждая из пептидных групп может образовывать 2
водородные связи с др.группами, в т.ч. и пептидными.
Исключение составляют пептидные группы пролина и
гидроксипролина. Они способны образовать только 1
пептидную связь. Это сказывается на формировании
вторичной структуры белка. В местах нахождения данных
амк полипептидная цепь легко изгибается, т.к. не
удерживается, как обычно, водородной связью.
17. Последовательность изучения первичной структуры белков.
Расщепление полипептидной цепи белка на болеекороткие фрагменты по определенным положениям в
его последовательности (разрыв дисульфидных
мостиков и модификация остатков цистеина);
Установление порядка чередования амк в
полученных фрагментах-пептидах;
Определение расположения пепдитов с известной
амк последовательностью в белковой молекуле.
Самой начальной процедурой является определение
числа полипептидных нитей в белковой молекуле протомеров
18. Роль слабых взаимодействий в образовании пространственной структуры биополимеров
Пространственная организация макромолекул иклеточных структур осуществляется в основном при
помощи химических связей, значительно более слабых,
чем ковалентные.
Атомы,
связанные
ковалентно,
способны
к
дополнительным слабым взаимодействиям с другими
атомами как в пределах одной молекулы, так и с
атомами близлежащих молекул.
Слабые взаимодействия участвуют в образовании
формы молекул (белков, нуклеиновых кислот), их
пространственной структуры и определяют степень
прочности последней.
19. К слабым взаимодействиям относят:
Водородные связи – внутри-имежмолекулярные (эти связи формируют
гидрофильные радикалы);
Ионные связи – образуют полярные
(заряженные) радикалы;
Ван-дер-Ваальсовы силы – гидрофобные силы
притяжения;
Гидрофобные взаимодействия – образуют
гидрофобные радикалы;
Дисульфидные связи – образуются при
сближении 2-х радикалов цистеина
20. Вторичная структура белка.
Идея о том, что вторичная структурабелков — результат образования
водородных связей между
аминокислотами, была высказана
Уильямом Астбери в 1933 году, но
Лайнус Полинг считается первым
учёным, который смог успешно
предсказать вторичную структуру
белков.
Форма полипептидной цепи в
пространстве; белковая цепь закручена
в спираль за счет множества
водородных связей.
Различают 3 типа вторичной
структуры:
1.ά-спираль;
2.β-структура;
3.беспорядочный клубок
21. ά-спираль
Водородные связи формируют трехмернуювторичную структуру белка и образуются
между карбонильной (>С=О) и иминогруппами
(=NH)
пептидного
остова.
Эти
связи
образуются очень упорядоченно, формируя
спираль, и ориентированы вдоль ее оси. На
виток
спирали
укладывается
3,6
аминокислотных остатка (водородные связи
образуются между 1-й и 4-й аминокислотами,
преимущественно с короткими боковыми
цепями). Расстояние между амк остатками
равно 0,15 нм.
ά-Спираль
представляет
собой
самый
жесткий
тип
вторичной
структуры
и
преобладает во многих белках.
Пролин и амк с длинными
радикалами нарушают
спиралевидную укладку.
22. Спираль-клубочек
Содержание ά-спирали в белках неодинаково иявляется
индивидуальной
особенностью
каждой
белковой молекулы. Глобулярные белки имеют степень
спирализации порядка 60-70%. Спирализованные
участки чередуются с хаотическими клубками; в
результате денатурации переходы спираль-клубок
увеличиваются. Спирализация цепи затруднена в тех
случаях, когда одноименно заряженные амк остатки
располагаются в непосредственной близости др. от др.,
т.к. происходит сильное взаимное отталкивание, что
препятствует образованию водородных связей, и в тех
случаях, когда в амк остатках имеются большие
размеры радикалов (сер, тре, лей), а также при
наличие в полипептидной цепи пролина, у которого
атом азота входит в состав жесткого кольца, что
препятствует вращению вокруг связи N-Cά.
23. Основные особенности ά-спирали
1.Спиральная конфигурация полипептидной цепи имеет
винтовую симметрию (напоминает растянутую спираль
электрической плитки);
2.
Образование водородных связей между пептидными
группами каждого первого и четвертого амк остатков;
3.
Регулярность витка спирали;
4.
Равнозначность всех амк остатков не зависимо от строения
их боковых радикалов;
5.
Боковые радикалы амк не участвуют в образовании άспирали.
6.
Период регулярности ά-спирали равен 5 виткам или 18 амк
остаткам; длина одного периода составляет 2,7 нм.
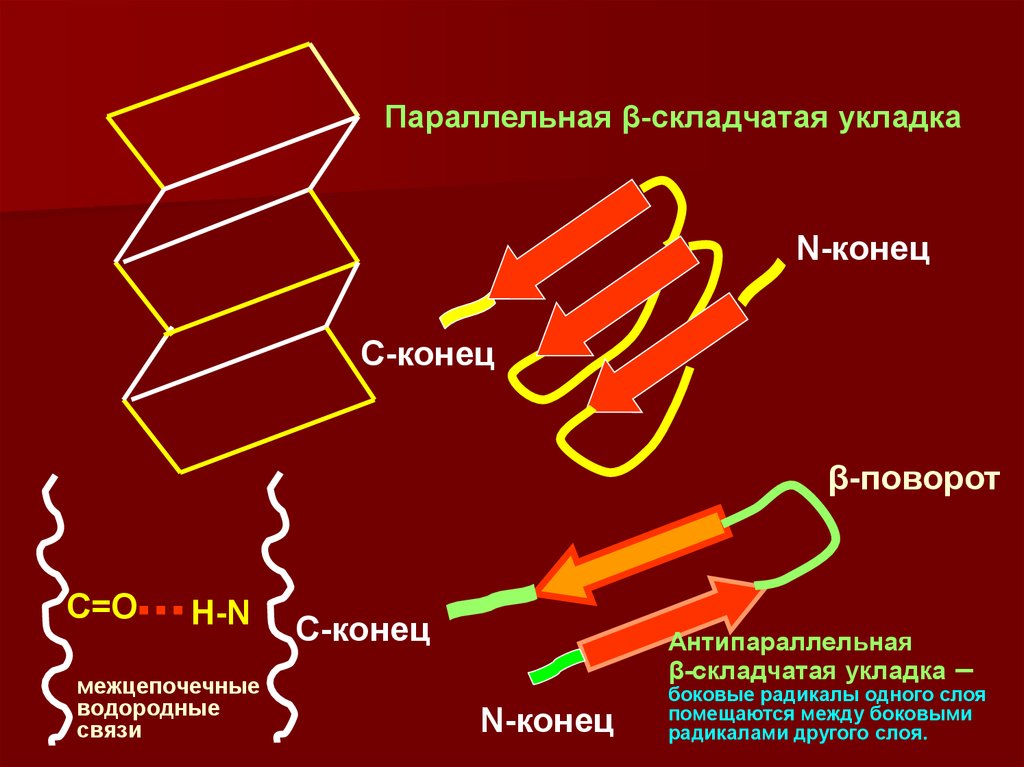
24. β-структура –
Складчатого типа, водородные связи образуются менеесистемно, формируя гофрированную структуру из
полипептидной цепи. При этом участки цепи идут либо в
одном, либо в противоположном направлении.
β-структура встречается реже, чем ά-спираль. На схемах
изображается в виде широкой плоской стрелки,
отмечающей направление от N- к С-концу цепи. Расстояние
между соседними амк остатками по оси составляет 0,35
нм., т.е. в 3 раза больше, чем в ά-спирали, число остатков
на виток равно 2. В отрезке полипептидной цепи,
образующей β-структуру, находится от 3 до 7 амк остатков,
а сама β-структура состоит из 2-6 цепей, хотя их число
может быть и большим. Поверхность β-структуры может
быть плоской или левозакрученной таким образом, чтобы
угол между отдельными отрезками цепи составлял 20-250.
25.
Параллельная β-складчатая укладкаN-конец
С-конец
β-поворот
С=О
Н-N
межцепочечные
водородные
связи
С-конец
Антипараллельная
β-складчатая укладка
N-конец
–
боковые радикалы одного слоя
помещаются между боковыми
радикалами другого слоя.
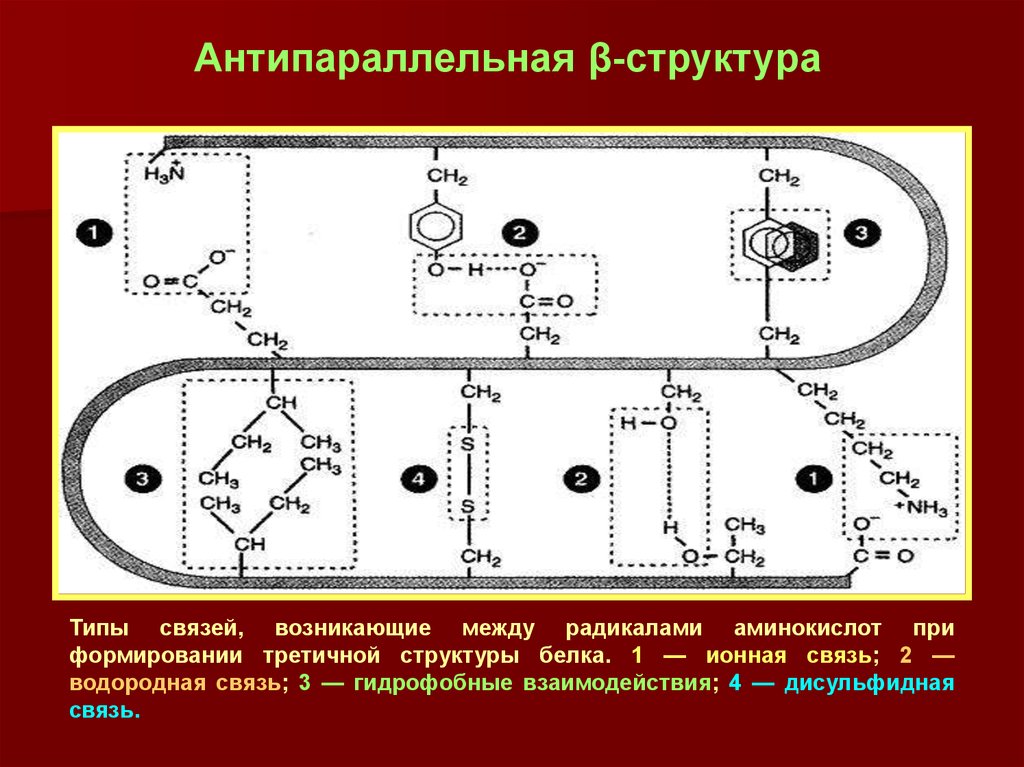
26.
Антипараллельная β-структураТипы связей, возникающие между радикалами аминокислот при
формировании третичной структуры белка. 1 — ионная связь; 2 —
водородная связь; 3 — гидрофобные взаимодействия; 4 — дисульфидная
связь.
27. В случае параллельного расположения β-структуры водородные связи менее прочны по сравнению с таковыми при антипараллельном расположении
В случае параллельного расположения β-структурыводородные связи менее прочны по сравнению с
таковыми при антипараллельном расположении амк
остатков. В отличие ά-спирали, насыщенной
водородными связями, каждый участок полипептидной
цепи в β-структуре открыт для образования
дополнительных водородных связей, причем в
антипараллельной структуре эти связи более
стабильны. В белках возможны переходы от ά-спирали
к β-структурам и обратно вследствии перестройки
водородных связей. Такой переход обнаружен в
кератине – белке волос.
Стабильность вторичных структур определяется
межпептидными водородными связями.
28. β- изгиб. Глобулярные белки имеют шарообразную форму во многом благодаря тому, что для полипептидной цепи характерно наличие петель, зигза
β- изгиб. Глобулярные белки имеютшарообразную форму во многом благодаря тому,
что для полипептидной цепи характерно наличие
петель, зигзагов, шпилек, причем направление
цепи может изменяться даже на 1800. В последнем
случае имеет место β-изгиб. Этот изгиб напоминает
по форме шпильку для волос и стабилизируется
одной водородной связью. Фактором,
препятствующим его образованию, могут быть
большие боковые радикалы, и поэтому, довольно
часто наблюдается включение в него наименьшего
амк остатка – глицина. Эта конфигурация всегда
оказывается на поверхности белковой глобулы, в
связи с чем β-изгиб принимает участие во
взаимодействии с другими полипептидными
цепями.
29. Беспорядочный клубок
Не имеет регулярной структуры, водородные связиобразуются бессистемно. Такие участки обычно
небольшие; в этом месте молекулы цепь может
изгибаться, меняя направление.
Содержание участков, имеющих различные типы
вторичной структуры, в белках может сильно
различаться, что обусловлено первичной
структурой полипептидной цепи.
Чаще всего в белках присутствуют все 3 типа
вторичной структуры (например, фермент
лактатдегидрогеназа)
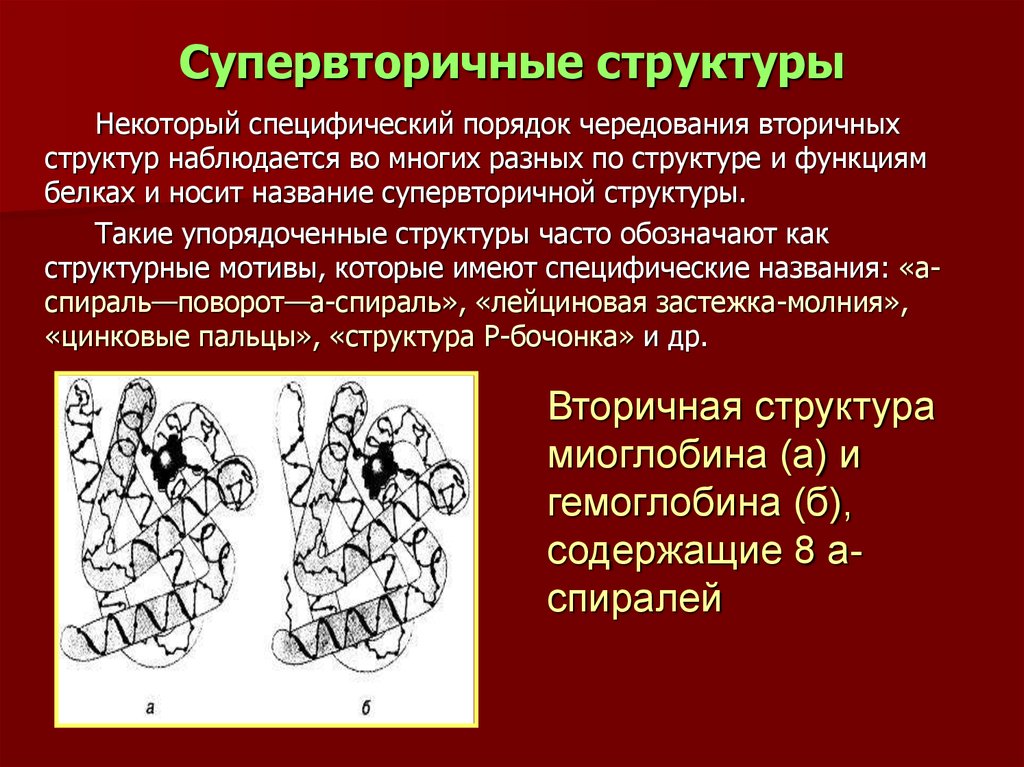
30. Супервторичные структуры
Некоторый специфический порядок чередования вторичныхструктур наблюдается во многих разных по структуре и функциям
белках и носит название супервторичной структуры.
Такие упорядоченные структуры часто обозначают как
структурные мотивы, которые имеют специфические названия: «аспираль—поворот—а-спираль», «лейциновая застежка-молния»,
«цинковые пальцы», «структура Р-бочонка» и др.
Вторичная структура
миоглобина (а) и
гемоглобина (б),
содержащие 8 аспиралей
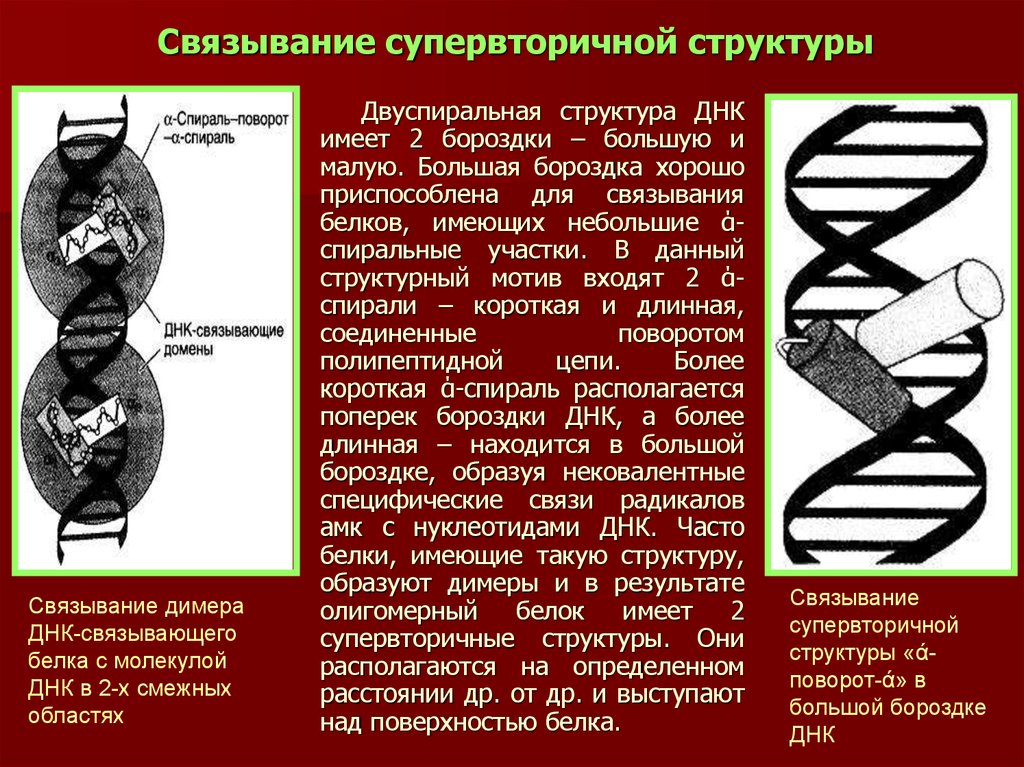
31. Связывание супервторичной структуры
Связывание димераДНК-связывающего
белка с молекулой
ДНК в 2-х смежных
областях
Двуспиральная структура ДНК
имеет 2 бороздки – большую и
малую. Большая бороздка хорошо
приспособлена для связывания
белков, имеющих небольшие άспиральные участки. В данный
структурный мотив входят 2 άспирали – короткая и длинная,
соединенные
поворотом
полипептидной
цепи.
Более
короткая ά-спираль располагается
поперек бороздки ДНК, а более
длинная – находится в большой
бороздке, образуя нековалентные
специфические связи радикалов
амк с нуклеотидами ДНК. Часто
белки, имеющие такую структуру,
образуют димеры и в результате
олигомерный белок имеет 2
супервторичные структуры. Они
располагаются на определенном
расстоянии др. от др. и выступают
над поверхностью белка.
Связывание
супервторичной
структуры «άповорот-ά» в
большой бороздке
ДНК
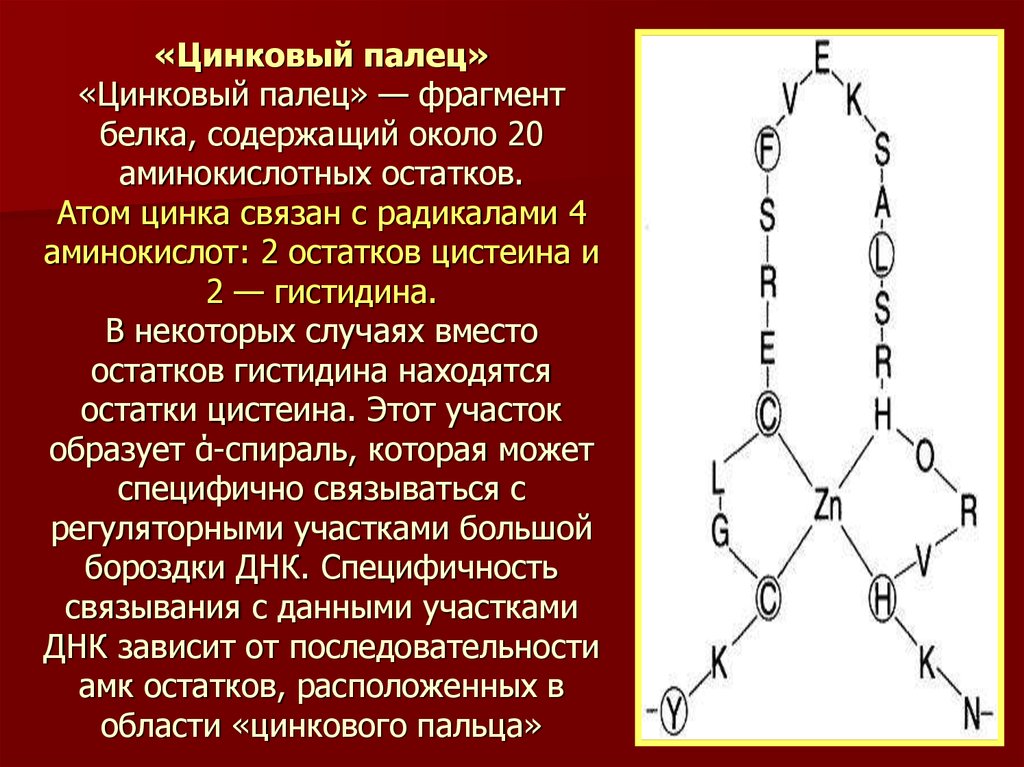
32. «Цинковый палец» «Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков. Атом цинка связан с радикалами 4 аминокис
«Цинковый палец»«Цинковый палец» — фрагмент
белка, содержащий около 20
аминокислотных остатков.
Атом цинка связан с радикалами 4
аминокислот: 2 остатков цистеина и
2 — гистидина.
В некоторых случаях вместо
остатков гистидина находятся
остатки цистеина. Этот участок
образует ά-спираль, которая может
специфично связываться с
регуляторными участками большой
бороздки ДНК. Специфичность
связывания с данными участками
ДНК зависит от последовательности
амк остатков, расположенных в
области «цинкового пальца»
33. Домены
Это более сложные уровниорганизации вторичной
структуры. Они представляют
собой обособленные
глобулярные участки,
соединенные др. с другом
короткими, так называемыми
«шарнирными участками»
полипептидной цепи.
Доменом называют часть
молекулы по структуре
напоминающей
самостоятельный
глобулярный белок.
Супервторичная структура
типа бочонка.
а — триозофосфатизомераза;
б — домен пируваткиназы
34. Доменная организация характерна для многих белков. В этих белках находится, как правило несколько структурных доменов, каждый из которых с
Доменная организация характерна для многихбелков. В этих белках находится, как правило
несколько структурных доменов, каждый из
которых состоит из 200 амк остатков.
В некоторых белках (Ig, сериновые
протеиназы), структурные домены сходны по
своей первичной структуре, что указывает на
возможный механизм дубликации
соответствующих генов. В др. белках
(гемоглобин) имеются определенные различия.
По строению домены в белках разделяют на
несколько групп в зависимости от содержания в
них ά-спиралей и β-структур.
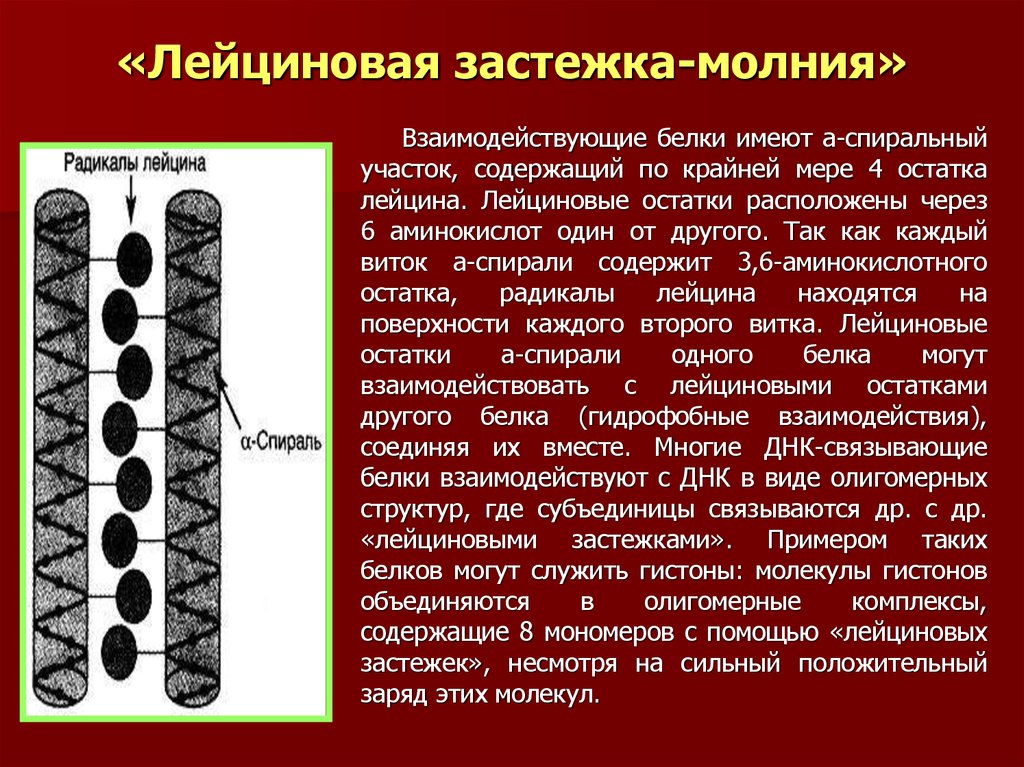
35. «Лейциновая застежка-молния»
Взаимодействующие белки имеют а-спиральныйучасток, содержащий по крайней мере 4 остатка
лейцина. Лейциновые остатки расположены через
6 аминокислот один от другого. Так как каждый
виток а-спирали содержит 3,6-аминокислотного
остатка,
радикалы
лейцина
находятся
на
поверхности каждого второго витка. Лейциновые
остатки
а-спирали
одного
белка
могут
взаимодействовать с лейциновыми остатками
другого белка (гидрофобные взаимодействия),
соединяя их вместе. Многие ДНК-связывающие
белки взаимодействуют с ДНК в виде олигомерных
структур, где субъединицы связываются др. с др.
«лейциновыми застежками». Примером таких
белков могут служить гистоны: молекулы гистонов
объединяются
в
олигомерные
комплексы,
содержащие 8 мономеров с помощью «лейциновых
застежек», несмотря на сильный положительный
заряд этих молекул.
36. Резюме:
Водородные связи уязвимы, особенно приобразовании вторичной структуры, т.к. СООН-группы
и NH2-группы могут взаимодействовать не только
между собой, но и с водой (оказалось, что вторичная
структура является достаточно устойчивой только
при образовании компактной белковой глобулы).
Формирование вторичной структуры обусловленно
последовательностью амк остатков в полипептидной
цепи. Боковые радикалы, взаимодействуя др. с др.,
индуцируют процесс образования пространственной
структуры, наиболее стабильной ее конформации.
При этом оказалось возможным предсказать тип
вторичной структуры наиболее точно для ά-спирали,
чем для β-структуры.
37. Линейные полипептидные цепи индивидуальных белков за счет взаимодействия функциональных групп аминокислот приобретают определенную про
• Линейные полипептидные цепи индивидуальныхбелков за счет взаимодействия функциональных групп
аминокислот приобретают определенную
пространственную трехмерную структуру, или
конформацию. В глобулярных белках различают два
основных типа конформации пептидных цепей –
вторичную и третичную.
• Все молекулы индивидуального белка, имеющие
идентичную первичную структуру, приобретают в
растворе одинаковую конформацию.
Таким образом, характер пространственной укладки
пептидной цепи определяется амк составом и их
чередованием. Следовательно, конформация такая же
специфическая характеристика индивидуального белка,
как и первичная структура.
38. Третичная структура белка
Это реальная трехмернаяконфигурация, которую принимает в
пространстве закрученная спираль
(за счет гидрофобных связей); у
некоторых белков имеются S-S-связи
(бисульфидные).
По форме третичной структуры
белки делятся на глобулярные (άструктура) и фибриллярные (βструктура). Однако конфигурация
третичной структуры не дает
основания думать, что
фибриллярные белки имеют только
β-структуру, а глобулярные – άспираль.
39.
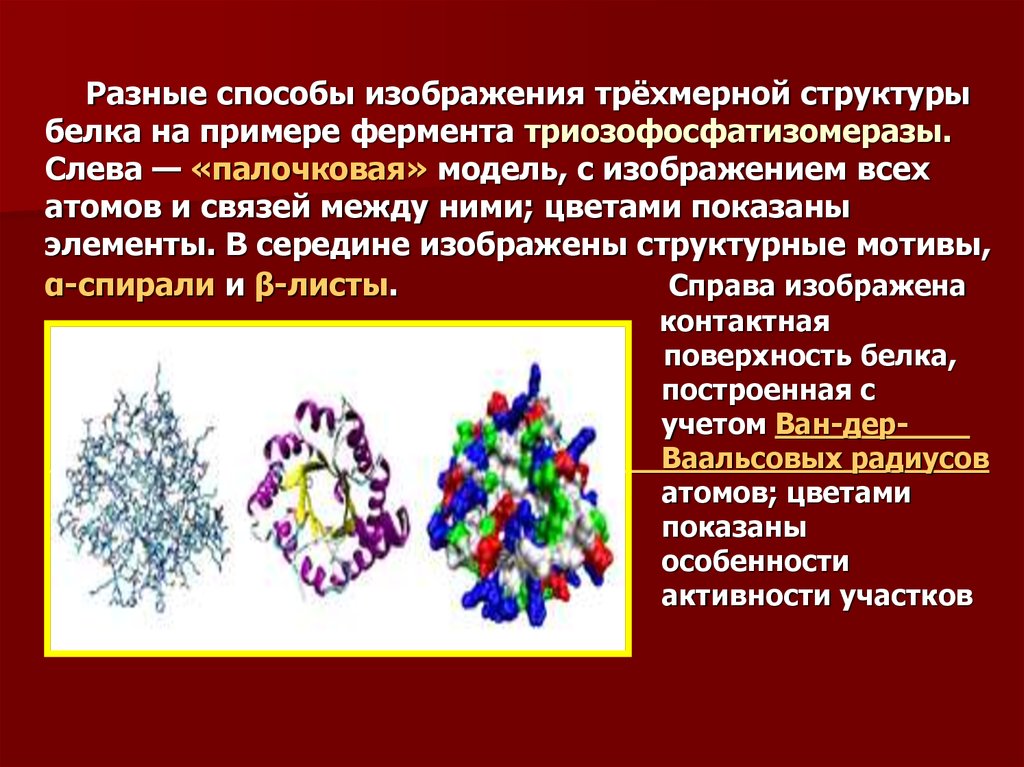
Разные способы изображения трёхмерной структурыбелка на примере фермента триозофосфатизомеразы.
Слева — «палочковая» модель, с изображением всех
атомов и связей между ними; цветами показаны
элементы. В середине изображены структурные мотивы,
α-спирали и β-листы.
Справа изображена
контактная
поверхность белка,
построенная с
учетом Ван-дерВаальсовых радиусов
атомов; цветами
показаны
особенности
активности участков
40. Связи, стабилизирующие третичную структуру белка
1.Ковалентные - сильные:
дисульфидные (-S-S-боковые радикалы цис);
изопептидные или псевдопептидные –
между аминогруппой лиз, арг, и
карбоксильной группой боковых радикалов амк
асп, глу, аминолимонной кислот (отсюда и
название);
эфирные (редко встречающиеся) – между
СООН-группами дикарбоновых амк (асп, глу) и
ОН-группой гидроксиаминокислот (сер, тре)
41. 2. Полярные – слабые: водородные – между группой –NH2, -OH,-SH бокового радикала одной амк и СООН-группой другой; ионные (электростатические или
солевые)– между –NH3+ лиз, арг, гис и группой СОО- асп
и глу кислот;
неполярные (ван-дер-ваальсовы) –
образуются между углеводородными
радикалами амк. Эти связи способствуют
формированию гидрофобного ядра из
неполярных радикалов внутри белковой
глобулы.
42. Особенности организации третичной структуры.
Конформация третичной структуры полипептидной цепиопределяется свойствами боковых радикалов входящих в
нее амк (которые не оказывают заметного влияния на
формирование первичной и вторичной структур) и
микроокружением, т.е. средой. При укладке полипептидная
цепь белка стремится принять энергетически выгодную
форму, характеризующуюся минимумом свободной
энергии. Поэтому неполярные R-амк остатков, «избегая»
воды, образуют как бы внутреннюю часть третичной
структуры белка. Полипептидная цепь изгибается в
трехмерном пространстве; при ее изгибах нарушается
вторичная спиральная конформация. Изгибы цепи
образуются в слабых точках (пролин, гидроксипролин,
глицин). Только правильная пространственная укладка
белка делает его активным.
43. Четвертичная структура белковой молекулы
Если белок состоит только из одной полипептиднойцепи, то он имеет только третичную структуру. Но
есть белки, состоящие из нескольких полипептидных
цепей, каждая из которых имеет третичную структуру.
Для таких белков введено понятие четвертичной
структуры.
Белок с четвертичной структурой называется
олигомером, а его полипептидные цепи с третичной
структурой – протомерами или субъединицами.
При четвертичном уровне организации белки
сохраняют
основную
конфигурацию
третичной
структуры (глобулярную или фибриллярную).
44. Четвертичная структура белка
Этовзаимное
расположение
нескольких полипептидных цепей в
составе единого белкового комплекса.
Белковые молекулы, входящие в
состав
белка
с
четвертичной
структурой, образуются на рибосомах
по
отдельности
и
лишь
после
окончания синтеза образуют общую
надмолекулярную структуру (можно
считать её и молекулой, если между
разными полипептидными цепями,
как это нередко бывает, образуются
дисульфидные мостики). В состав
белка с четвертичной структурой
могут входить как идентичные, так и
различающиеся
полипептидные
цепочки.
45. Стабилизация четвертичной структуры белков.
В стабилизации четвертичной структуры принимаютучастие те же типы взаимодействий, что и в стабилизации
третичной. Контакты между поверхностями субъединиц
возможны только за счет полярных групп амк остатков,
т.к. при формировании третичной структуры каждой из
полипептидных цепей боковые радикалы неполярных амк
(составляющих большую часть всех протеиногенных амк)
спрятаны внутри субъединицы.
Между
их
полярными
группами
образуются
многочисленные ионные, водородные и дисульфидные
связи, которые прочно удерживают субъединицы в виде
организованного комплекса.
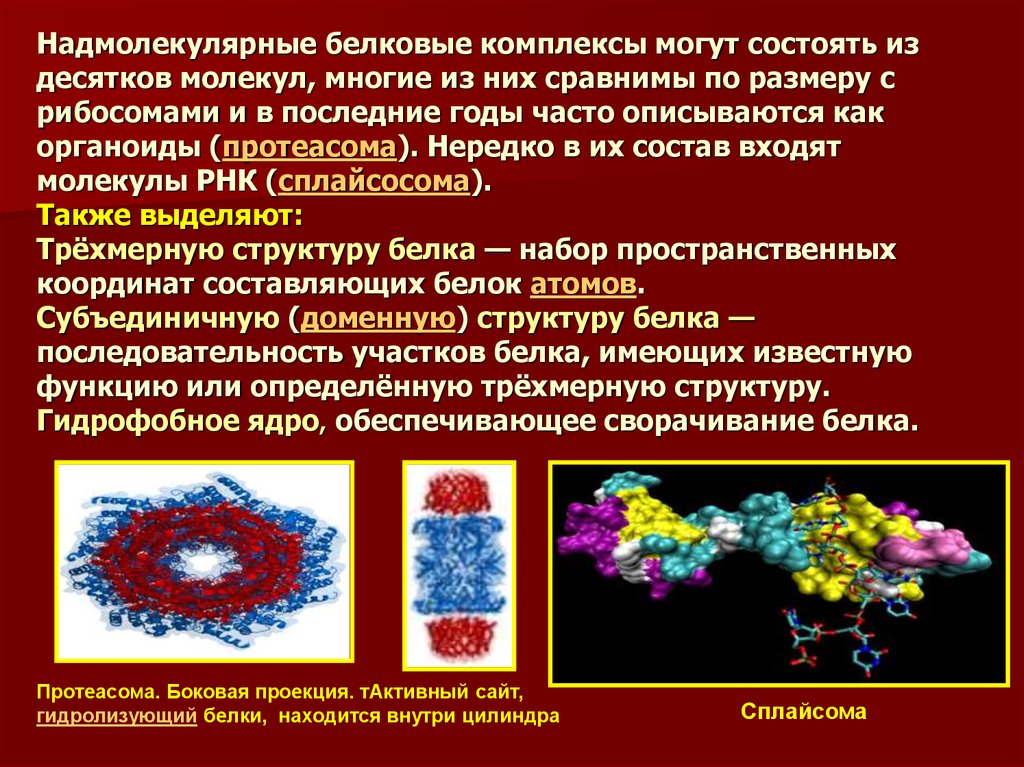
46. Надмолекулярные белковые комплексы могут состоять из десятков молекул, многие из них сравнимы по размеру с рибосомами и в последние годы ч
Надмолекулярные белковые комплексы могут состоять издесятков молекул, многие из них сравнимы по размеру с
рибосомами и в последние годы часто описываются как
органоиды (протеасома). Нередко в их состав входят
молекулы РНК (сплайсосома).
Также выделяют:
Трёхмерную структуру белка — набор пространственных
координат составляющих белок атомов.
Субъединичную (доменную) структуру белка —
последовательность участков белка, имеющих известную
функцию или определённую трёхмерную структуру.
Гидрофобное ядро, обеспечивающее сворачивание белка.
Протеасома. Боковая проекция. тАктивный сайт,
гидролизующий белки, находится внутри цилиндра
Сплайсома
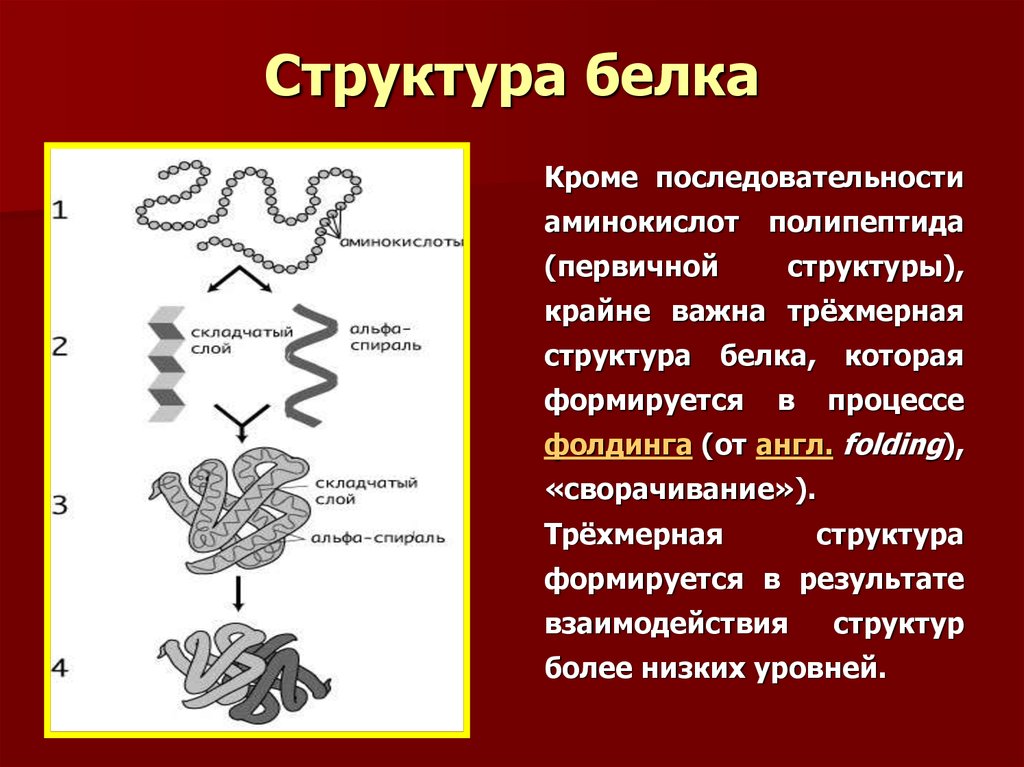
47. Структура белка
Кроме последовательностиаминокислот
(первичной
полипептида
структуры),
крайне важна трёхмерная
структура белка, которая
формируется
в
процессе
фолдинга (от англ. folding),
«сворачивание»).
Трёхмерная
структура
формируется в результате
взаимодействия
структур
более низких уровней.
48. Функции белков.
Структурная функция Структурные белки, такие как коллаген иэластин обеспечивают фиброзную основу соединительных
тканей у животных. Белки входят в состав клеточных мембран.
Также белки формируют цитоскелет, обеспечивающий
поддержание формы клетки и участвующий во
внутриклеточном транспорте.
Каталитическая функция Ферменты (энзимы), которые служат
катализаторами химических реакций в организме. Известно
несколько тысяч ферментов, среди них, наример, пепсин,
расщепляет белки в процессе пищеварения.
Защитная функция Белки, составляющие имунную систему,
защищают организм от патогенов, путем генерации имунного
ответа. Примеры — антитела (иммуноглобулины),
нейтрализующие бектрии, вирусы или чужеродные белки,
фибриногены и тромбины, участвующие в свёртывании крови.
Регуляторная функция Полипептидные (белковые) гормоны и
цитокины. Примеры — инсулин, который регулирует
концентрацию глюкозы в крови и фактор некроза опухолей,
который передает сигналы воспаления.
49.
Энергетическая функция– Как запасной источник энергии. При полном расщеплении 1
г белка выделяется 17,6кДж энергии.
Запасная (резервная) функция белков
– К таким белкам относятся так называемые резервные
белки, являющиеся источниками питания для развития
плода. Ряд других белков несомненно используется в
организме в качестве источника аминокислот, которые в
свою очередь являются предшественниками биологически
активных веществ, регулирующих процессы метаболизма.
Рецепторная функция
– В мембрану клетки встроены белки, способные изменять
свою третичную структуру в ответ на действие факторов
внешней среды. Так происходит прием сигналов из
внешней среды и передача информации в клетку.
Моторная и сократительные функции
– Целый класс моторных белков, участвует в сокращении
мышц (миозин), активном и направленном
внутриклеточном транспорте (кинезин, динеин).
Транспортная функция Транспортные белки, такие как гемоглобин,
который переносит кислород из легких к остальным тканям и
углекислый газ от тканей к легким.
50. Основные представители простых белков
Альбумины – состоят из 1 полипептидной цепи (575 амк,преобладают асн, глн); мМ=69 kDa; глобулярный белок,
содержится в плазме крови и в яичном белке; выполняемые
функции – транспортная и питательная
Глобулины – состоят из 3-х фракций (ά-, β- и y-), каждая из
которых является гетерогенной и состоят из нескольких белков.
Глобулины крови плохо растворимы в воде; мМ=150 kDa;
выполняемые функции – защитная
Гистоны – ядерные белки, играют важную роль в регуляции
генной активности; найдены во всех эукариотических клетках и
разделены на 5 классов (h1,h2,h3,h4,h5), которые различаются по
мМ (от11 до 22 kDa) и амк составу (различия касаются лиз и
арг)
Протамины – (+) заряженные ядерные белки, мМ от 10 до
12 kDa; принимают участие в регуляции генной активности. В
основном состоят из основных амк, за счет чего
взаимодействуют с НК посредством ионных связей.






































 Биология
Биология