Похожие презентации:
Информационные макромолекулы
1. Информационные макромолекулы
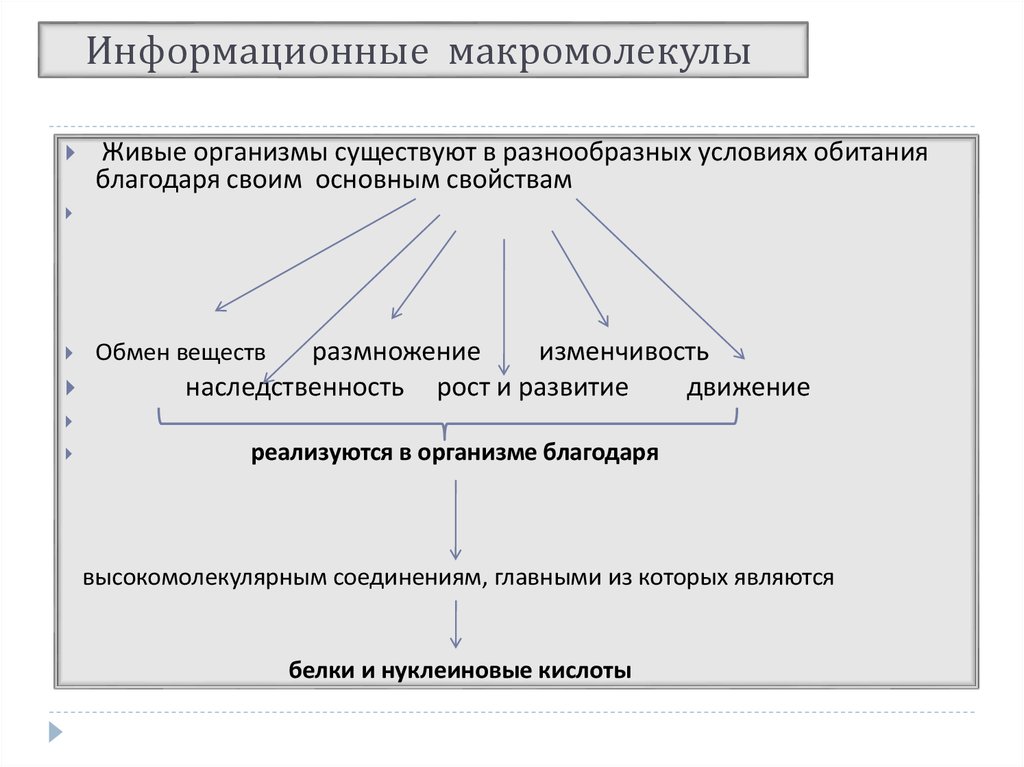
Живые организмы существуют в разнообразных условиях обитанияблагодаря своим основным свойствам
размножение
изменчивость
наследственность рост и развитие
движение
Обмен веществ
реализуются в организме благодаря
высокомолекулярным соединениям, главными из которых являются
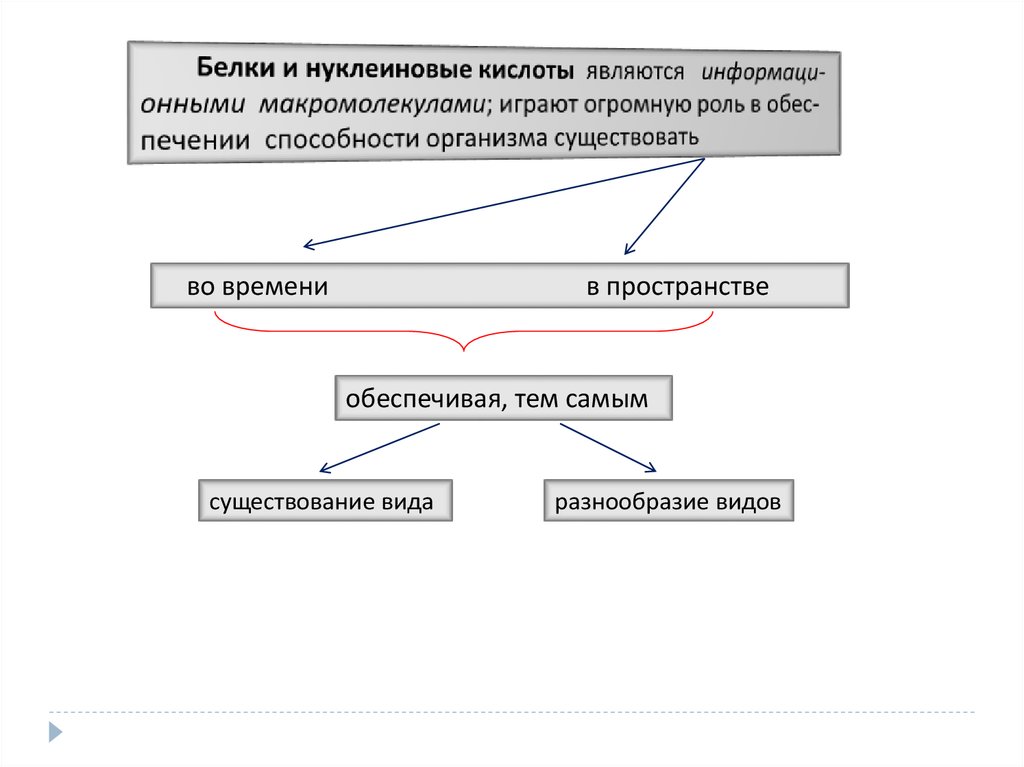
белки и нуклеиновые кислоты
2.
во временив пространстве
обеспечивая, тем самым
существование вида
разнообразие видов
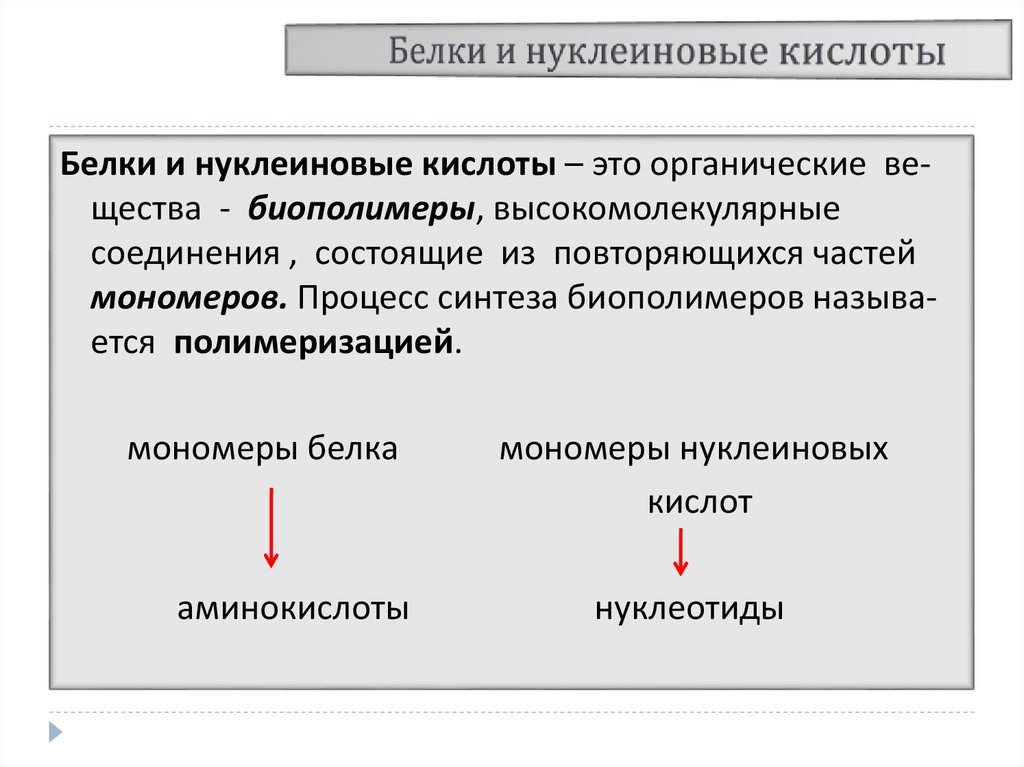
3. Белки и нуклеиновые кислоты
– это органические вещества - биополимеры, высокомолекулярныесоединения , состоящие из повторяющихся частей
мономеров. Процесс синтеза биополимеров называется полимеризацией.
мономеры белка
аминокислоты
мономеры нуклеиновых
кислот
нуклеотиды
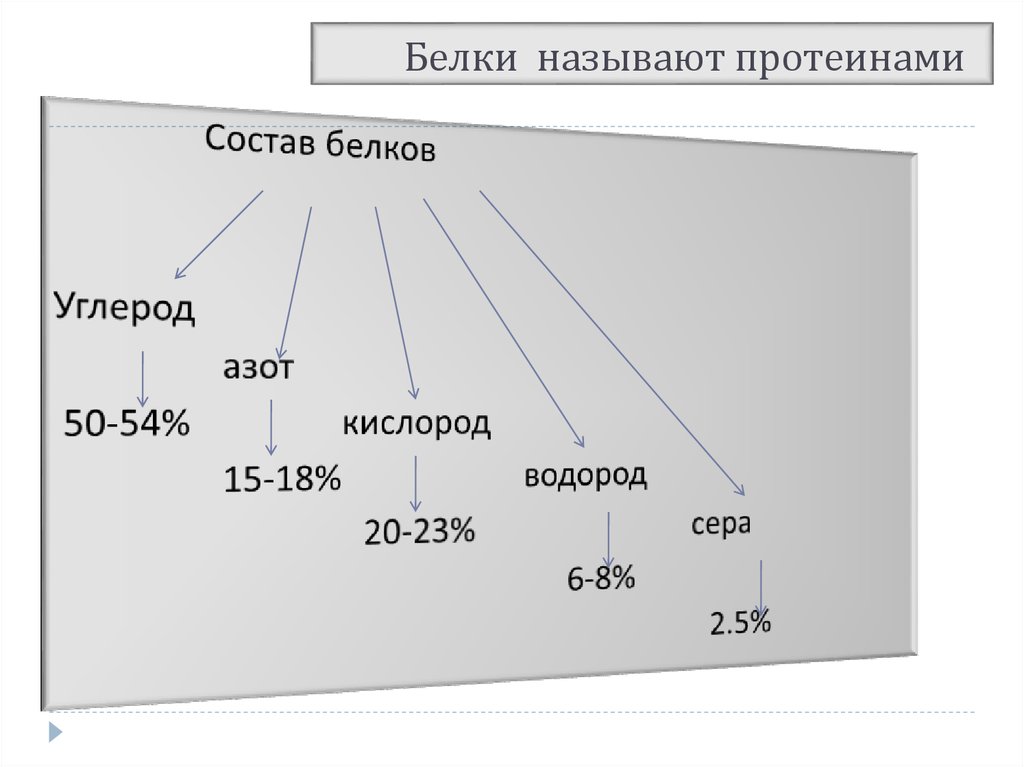
4. Белки называют протеинами
5. Аминокислоты
R│
H2 N — Сα — СООН
│
H
водород
амидная
группа
радикал
карбоксильная
группа
α-углерод
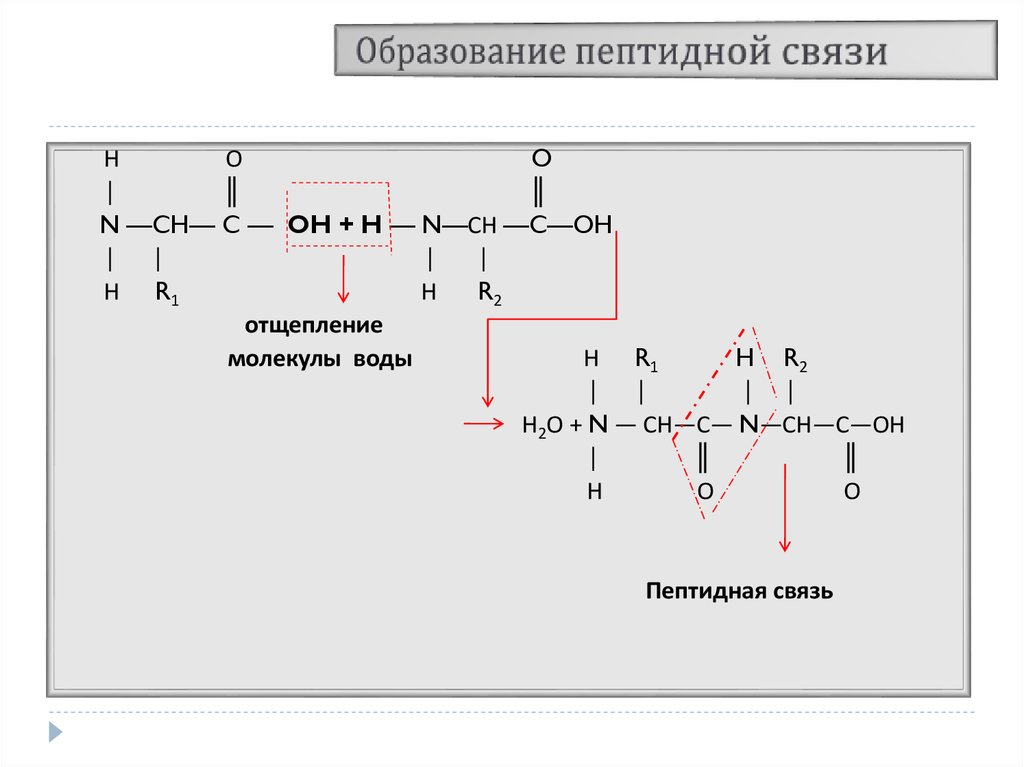
6. Образование пептидной связи
НО
O
│
║
║
N —CH— C — OH + H — N—СН —C—OH
│ │
│
│
Н R1
Н
R2
отщепление
молекулы воды
Н R1
H R2
│ │
│ │
Н2О + N ― СН―С― N―СН―С―ОН
│
║
║
Н
О
О
Пептидная связь
7.
Пептидная связь характеризуется следующими свойствами:1. 4 атома пептидной связи лежат в одной плоскости
(рис.7а);
2. Атомы -О- и -Н- пептидной связи имеют
трансориентацию;
3. Длина С-N-связи имеет частично двойной
характер, поэтому она короче, чем другие связи пептидной
цепи и малоподвижна. Вращение вокруг оси С-N
практически невозможно, что связано с особенностями
электронного строения связи.
8.
Пептидная связь характеризуется следующими свойствами:1. 4 атома пептидной связи лежат в одной плоскости
(рис.7а);
2. Атомы -О- и -Н- пептидной связи имеют
трансориентацию;
3. Длина С-N-связи имеет частично двойной
характер, поэтому она короче, чем другие связи пептидной
цепи и малоподвижна. Вращение вокруг оси С-N
практически невозможно, что связано с особенностями
электронного строения связи.
9. Стереометрическая модель пептидной связи
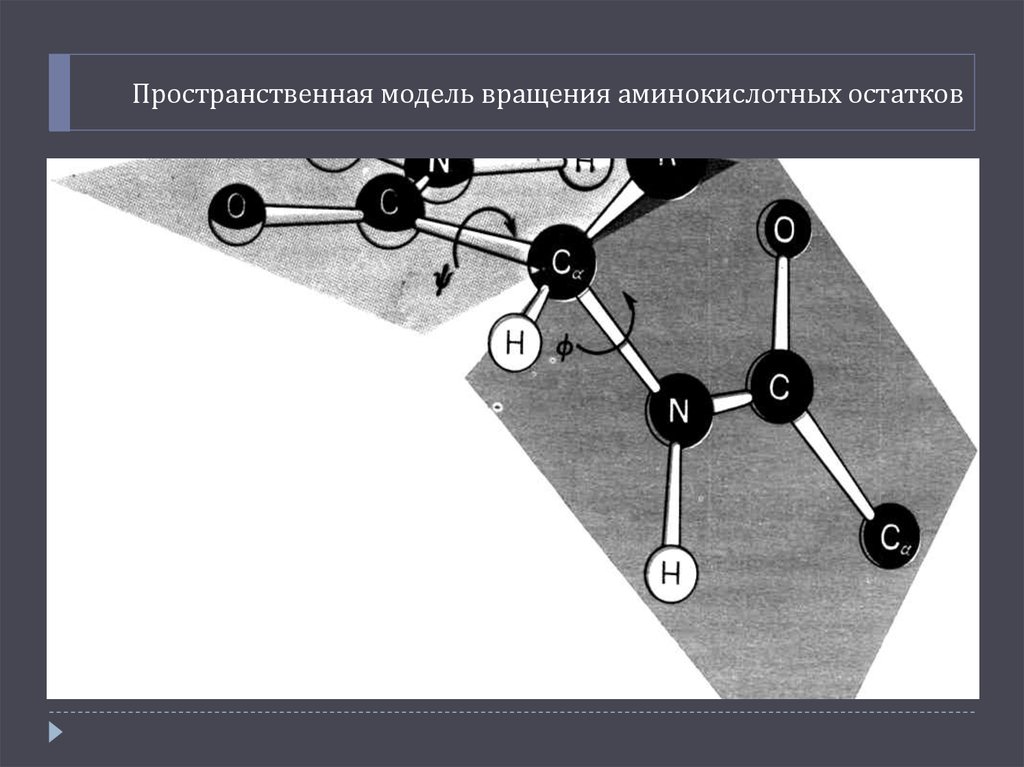
10. Пространственная модель вращения аминокислотных остатков
11. Пептиды
Соединения, в которых аминокислоты соединены пептидными связями,называется пептидами:
олигопептиды (содержат до 10 аминокислот),
полипептиды (до 10 аминокислот) и
белки (свыше 100 аминокислот).
мономеры полипептида называют аминокислотными остатками.
В каждом полипептиде на одном конце имеется аминокислотный остаток
со свободной аминогруппой (-NH2) и называется N-концевым, а на
другом – со свободной карбоксильной гру ппой (-СООН) и называется
C-концевым.
Пептиды пишутся, читаются и нумеруются с N-конца; аминокислотные
остатки обозначаются символами. Например:
Аla-Tyr-Ley-Ser-……….-Cys
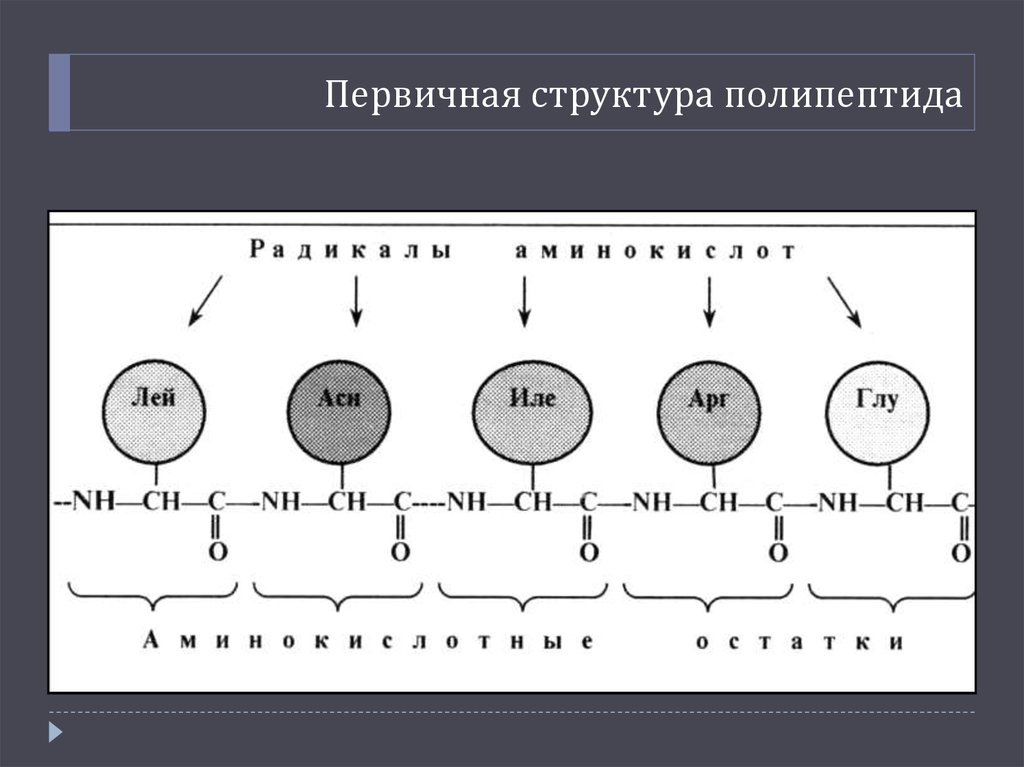
12. Первичная структура полипептида
13. Α-спираль вторичной структуры полипептида
В α-спирали NH-группа одного остатка аминокислоты соединяется водороднойсвязью с СО-группой пятого от нее остатка . В итоге образуется спираль, где на 1
виток приходится в среднем 3,6 аминокислотных остатков, шаг спирали равен
0,54мм, диаметр спирали - 0,5мм. Водородные связи ориентированы вдоль оси спирали
.
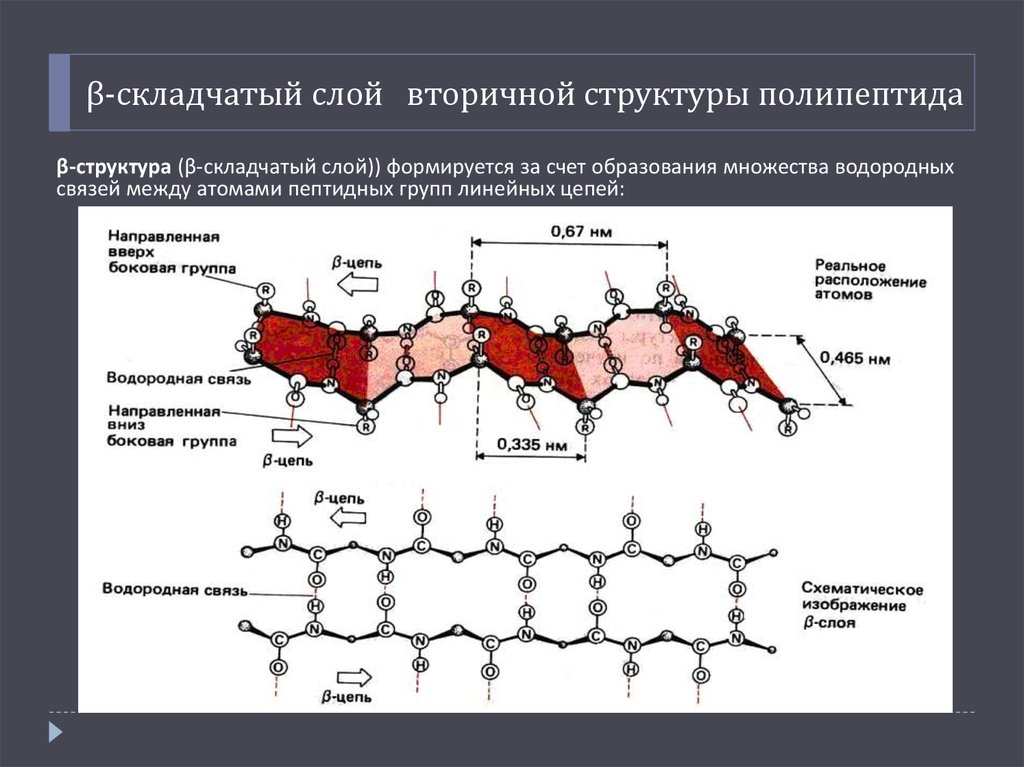
14. β-складчатый слой вторичной структуры полипептида
β-структура (β-складчатый слой)) формируется за счет образования множества водородныхсвязей между атомами пептидных групп линейных цепей:
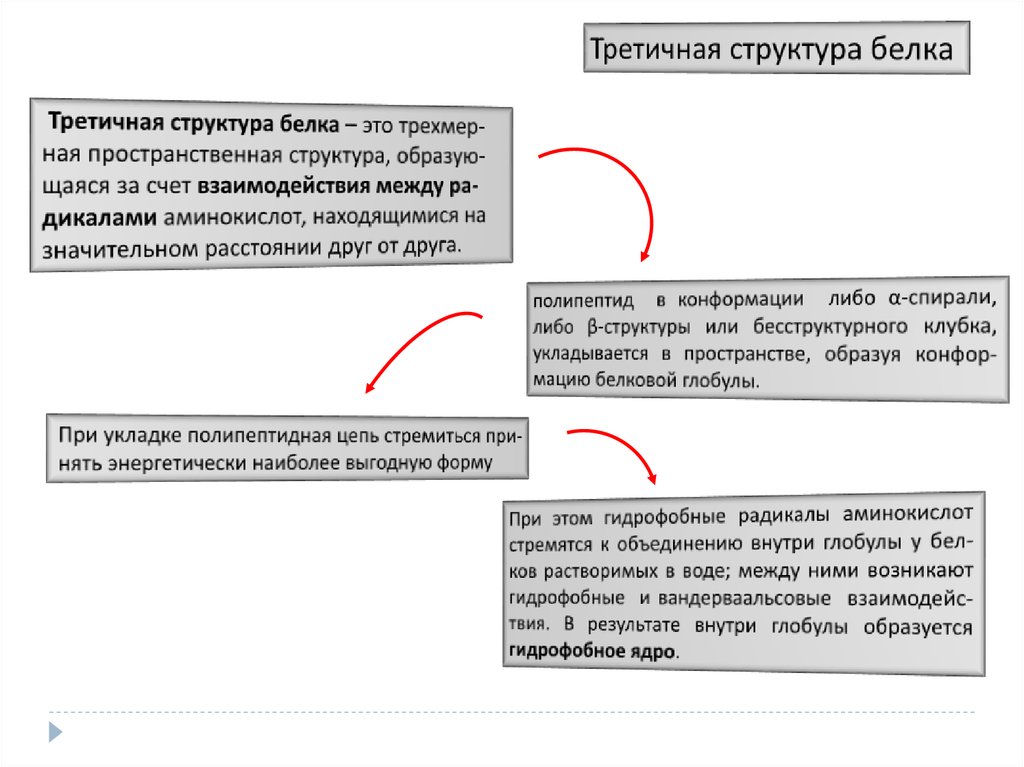
15. Третичная структура белка
– это трехмерная прост ранственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, находящимися на значительном расстоянии друг от друга.При этом, полипептид в конформации либо α-спирали,
либо
β-структуры
или
бесструктурного
клубка,
укладывается в пространстве, образуя конформацию
белковой глобулы. При укладке полипептидная цепь
стремиться принять энергетически наиболее выгодную
форму При этом гидрофобные радикалы аминокислот
стремятся к объединению внутри глобулы у белков
растворимых в воде; между ними возникают гидрофобные
и вандерваальсовые взаимодействия. В результате внутри
глобулы образуется гидрофобное ядро.
16.
17.
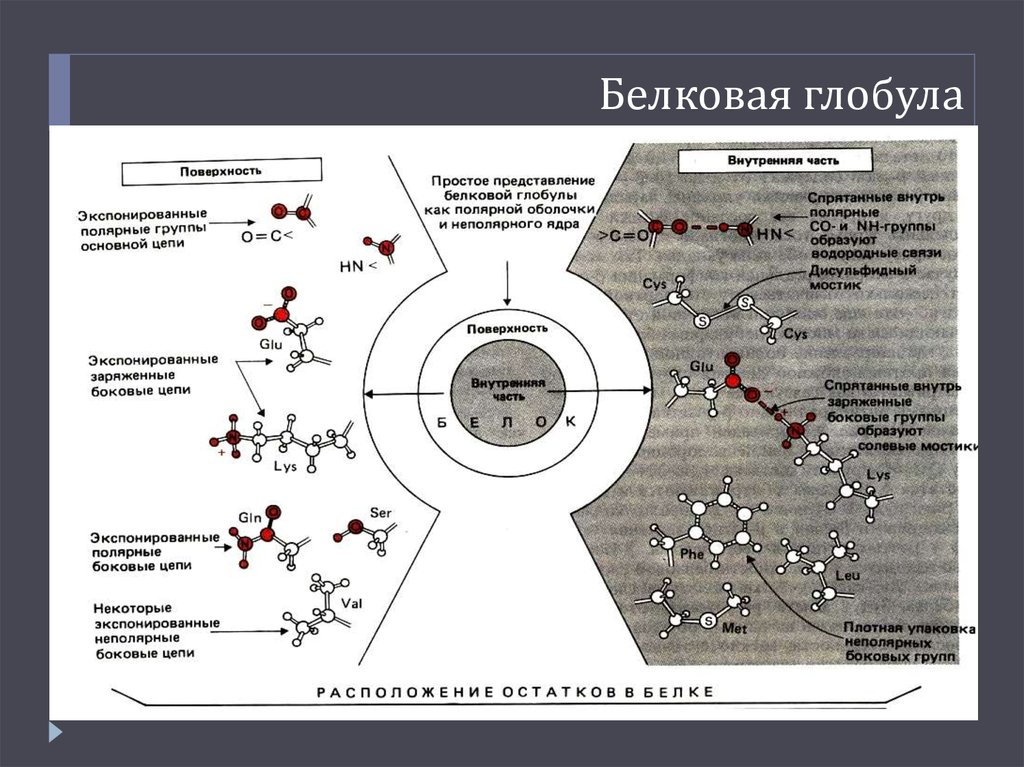
18. Белковая глобула
19. Супервторичная структура белка
Белок с мотивом «спираль-виток-спираль»: а - α-спираль белка, содержащая 3домена; b - домены связываются с большими бороздками спирали ДНК.
20.
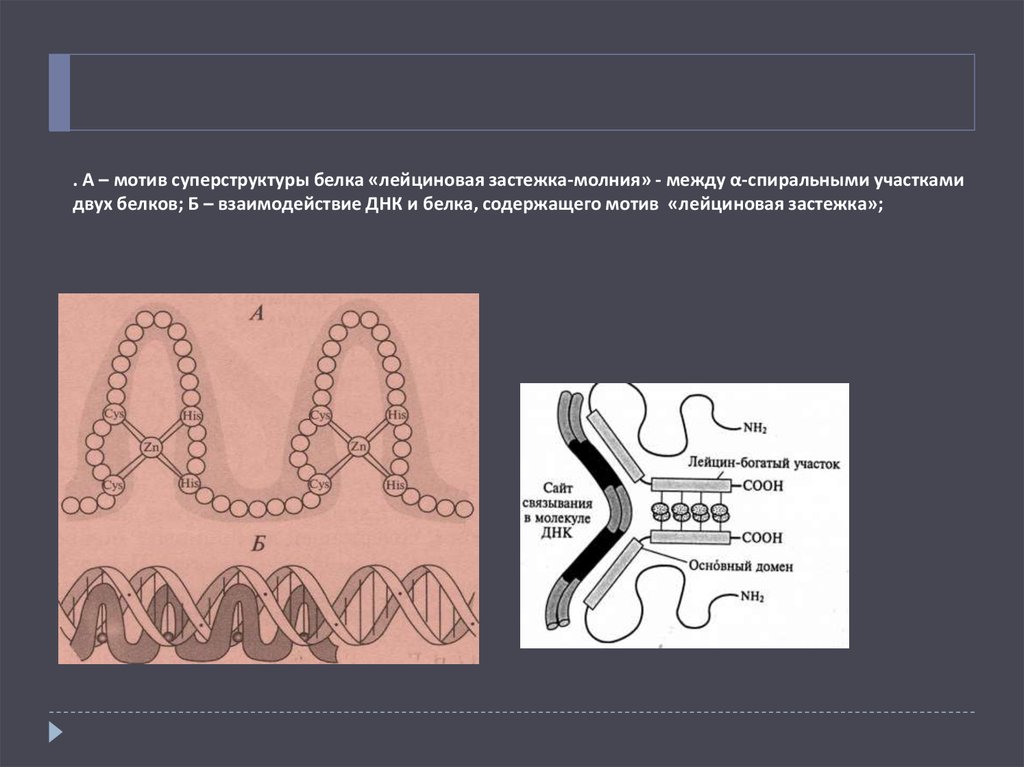
. А – мотив суперструктуры белка «лейциновая застежка-молния» - между α-спиральными участкамидвух белков; Б – взаимодействие ДНК и белка, содержащего мотив «лейциновая застежка»;
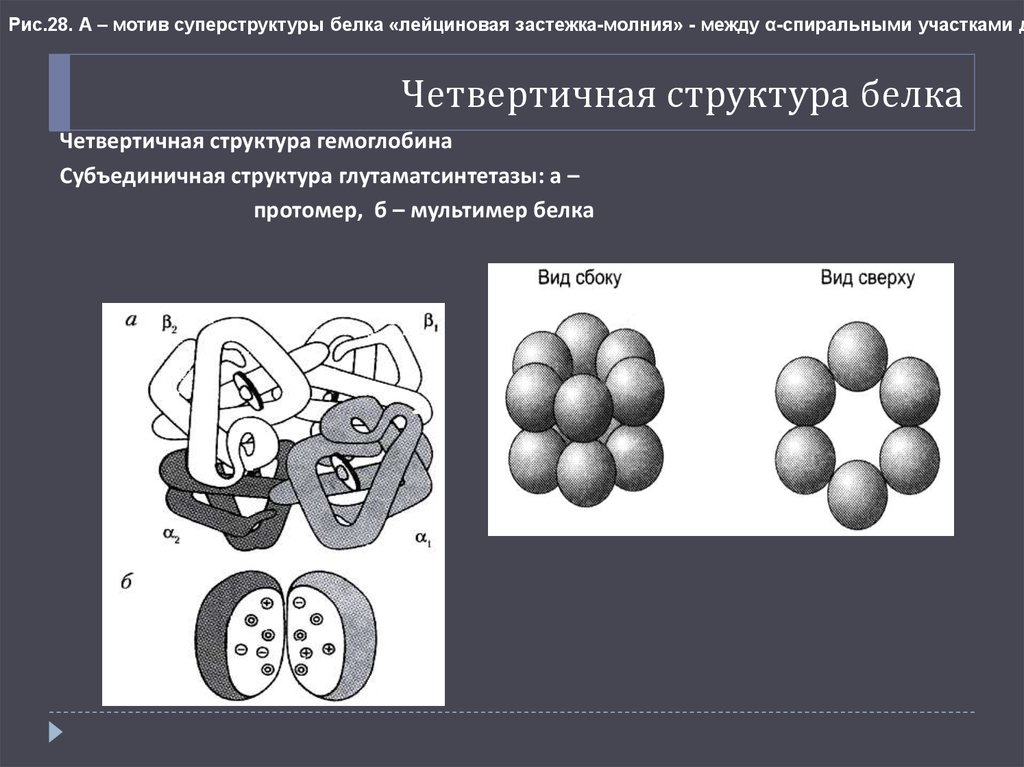
21. Четвертичная структура белка
Рис.28. А – мотив суперструктуры белка «лейциновая застежка-молния» - между α-спиральными участками дЧетвертичная структура белка
Четвертичная структура гемоглобина
Субъединичная структура глутаматсинтетазы: а –
протомер, б – мультимер белка
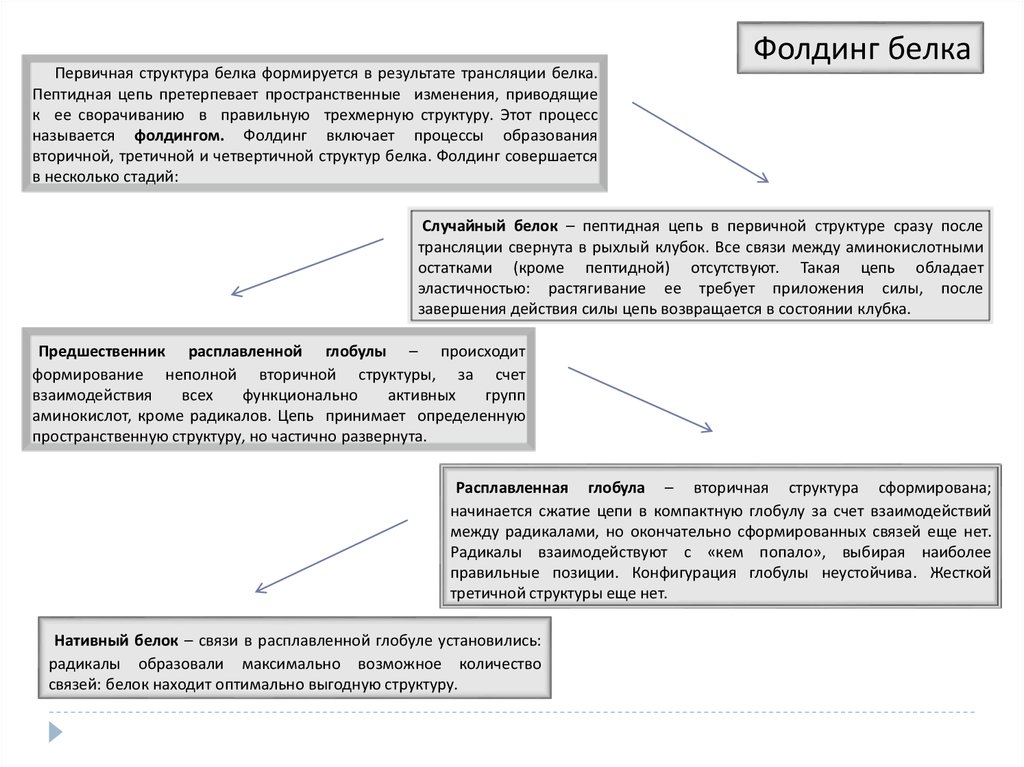
22. Фолдинг белка
Первичная структура белка формируется в результате трансляции белка. Пептидная цепьпретерпевает пространственные изменения, приводящие к ее сворачиванию в правильную
трехмерную структуру. Этот процесс называется фолдингом. Фолдинг включает процессы
образования вторичной, третичной и четвертичной структур белка. Фолдинг совершается в
несколько стадий:
Случайный белок – пептидная цепь в первичной структуре сразу после трансляции свернута
в рыхлый клубок. Все связи между аминокислотными остатками (кроме пептидной)
отсутствуют. Такая цепь обладает эластичностью: растягивание ее требует приложения силы,
после завершения действия силы цепь возвращается в состоянии клубка.
Предшественник расплавленной глобулы – происходит формирование неполной вторичной
структуры, за счет взаимодействия всех функционально активных групп аминокислот, кроме
радикалов. Цепь принимает определенную пространственную структуру, но частично
развернута.
Расплавленная глобула – вторичная структура сформирована; начинается сжатие цепи в
компактную глобулу за счет взаимодействий между радикалами, но окончательно
сформированных связей еще нет. Радикалы взаимодействуют с «кем попало», выбирая
наиболее правильные позиции. Конфигурация глобулы неустойчива. Жесткой третичной
структуры еще нет.
Нативный белок – связи в расплавленной глобуле установились: радикалы образовали
максимально возможное количество связей: белок находит оптимально выгодную структуру.
23.
Первичная структура белка формируется в результате трансляции белка.Пептидная цепь претерпевает пространственные изменения, приводящие
к ее сворачиванию в правильную трехмерную структуру. Этот процесс
называется фолдингом. Фолдинг включает процессы образования
вторичной, третичной и четвертичной структур белка. Фолдинг совершается
в несколько стадий:
Фолдинг белка
Случайный белок – пептидная цепь в первичной структуре сразу после
трансляции свернута в рыхлый клубок. Все связи между аминокислотными
остатками (кроме пептидной) отсутствуют. Такая цепь обладает
эластичностью: растягивание ее требует приложения силы, после
завершения действия силы цепь возвращается в состоянии клубка.
Предшественник расплавленной глобулы – происходит
формирование неполной вторичной структуры, за счет
взаимодействия
всех
функционально
активных
групп
аминокислот, кроме радикалов. Цепь принимает определенную
пространственную структуру, но частично развернута.
Расплавленная глобула – вторичная структура сформирована;
начинается сжатие цепи в компактную глобулу за счет взаимодействий
между радикалами, но окончательно сформированных связей еще нет.
Радикалы взаимодействуют с «кем попало», выбирая наиболее
правильные позиции. Конфигурация глобулы неустойчива. Жесткой
третичной структуры еще нет.
Нативный белок – связи в расплавленной глобуле установились:
радикалы образовали максимально возможное количество
связей: белок находит оптимально выгодную структуру.
24. Классификация белков
Белки можно классифицировать:по форме (глобулярные и фибриллярные),
по молекулярной массе (низко-, высокомолекулярные и др.);
по химическому строению (отсутствие или наличию небелковой
части): простые и сложные;
по функциям и локализации в клетке (ядерные, цитоплазматические,
лизосомальные, митохондриальные и др.),
по возможности регулировать синтез белков (конститутивные, синтез
которых идет с постоянной скоростью и индуцибельные, синтез
которых возрастает при воздействии факторов среды),
по продолжительности жизни в клетке (очень быстро
обновляющиеся, менее чем через час и медленно обновляющиеся в
течении недель и месяцев),
по схожим участкам первичной структуры и родственным функциям
(семейства белков): гемоглобины, иммуноглобулины, гистоны, серины.
25.
Некоторые сложные белкиБелки
Металлопротеины
Фосфопротеины
Гемопротеины
Флавопротеины
Гликопротеины
Протеогликаны
Липопротеины
Нуклеопротеины
Рибонуклеопротеины (рибосомы
др.)
Дезоксирибонуклеопротеины
(хроматин)
Простетическая группа
Ионы металлов
Н3РО4
Гем (ферропротопорфирин)
Флавиннуклеотиды (прозводственные
рибофлавина В12)
Моносахариды и олигосахариды
Гликозаминглюканы
(мукополисахариды)
Триглицериды и сложные липиды
и РНК
ДНК
26. Виды азотистых оснований
27.
Пуриновые и пиримидиновые основанияСтроение пентоз
28.
Нуклеиновые кислоты – высокомолекулярные органические соединения биополимеры, мономерами которых является нуклеотиды.Нуклеотиды являются нуклеозидфосфатами и содержат 3 химически
различных
компонента: гетероциклическое
азотистое основание,
моносахарид(пентозу) и остаток фосфорной кислоты
нуклеозидфосфат
остаток
фосфорной
кислоты
азотистое основание
моносахарид (пентозу)
29.
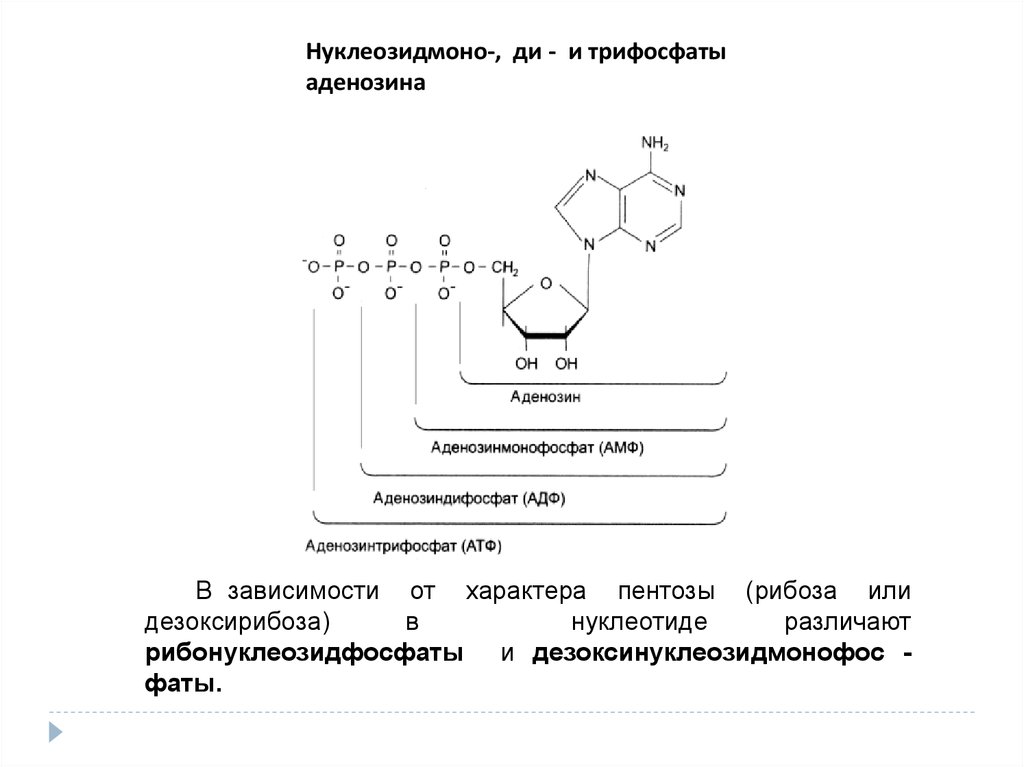
Нуклеозидмоно-, ди - и трифосфатыаденозина
В зависимости от характера пентозы (рибоза или
дезоксирибоза)
в
нуклеотиде
различают
рибонуклеозидфосфаты и дезоксинуклеозидмонофос фаты.
30.
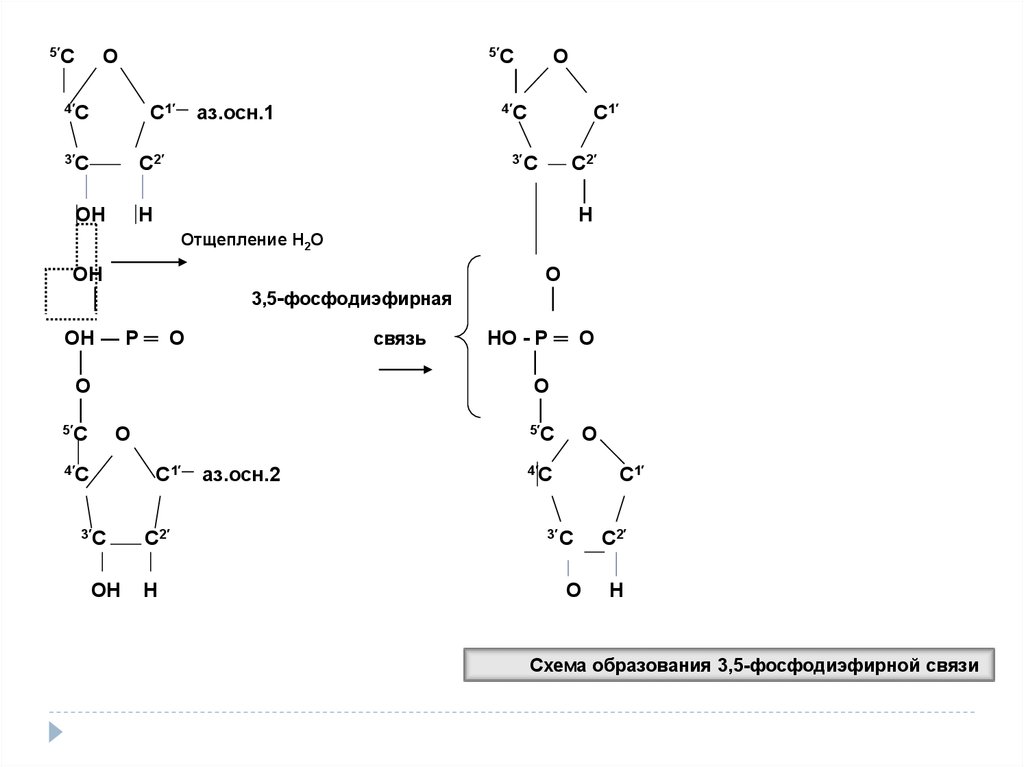
5′СО
5′С
О
│
4′С
С1′― аз.осн.1
3′С
4′С
С2′
ОН
С1′
3′ С
С2′
│
Н
Н
Отщепление Н2О
ОН
│
3,5-фосфодиэфирная
ОН ― Р ═ О
│
О
│
5′С
О
4′С
С1′― аз.осн.2
3′С
ОН
С2′
Н
связь
О
│
НО - Р ═ О
│
О
│
5′С
О
4′С
С1′
3′ С
О
С2′
Н
Схема образования 3,5-фосфодиэфирной связи
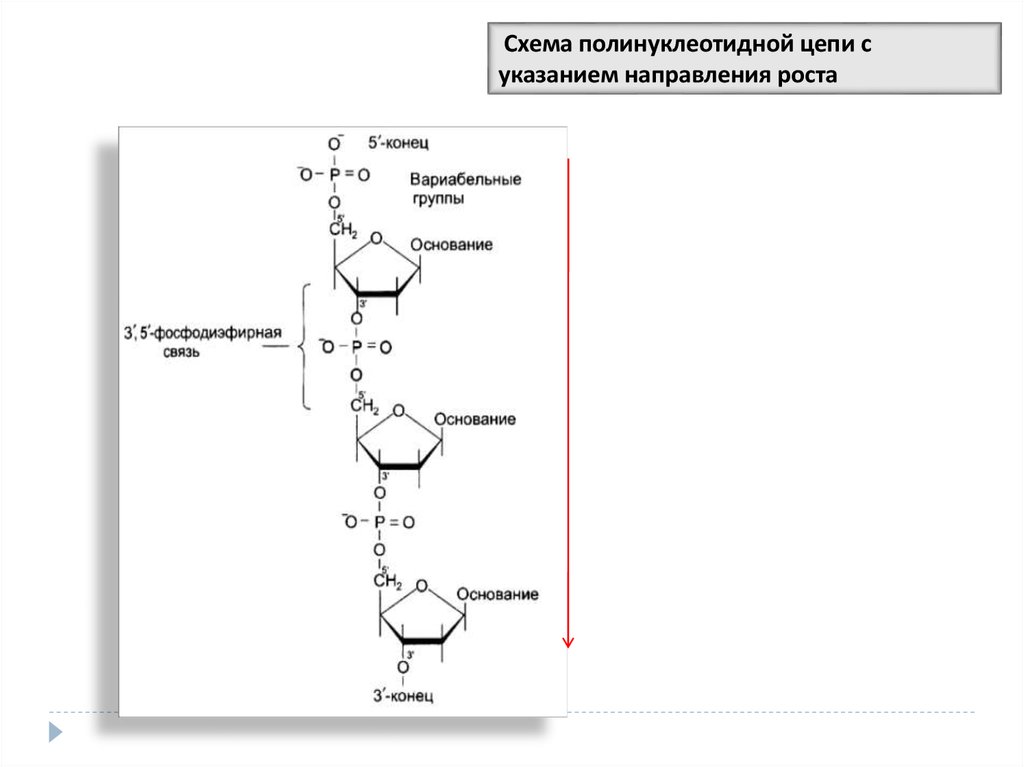
31.
Схема полинуклеотидной цепи суказанием направления роста
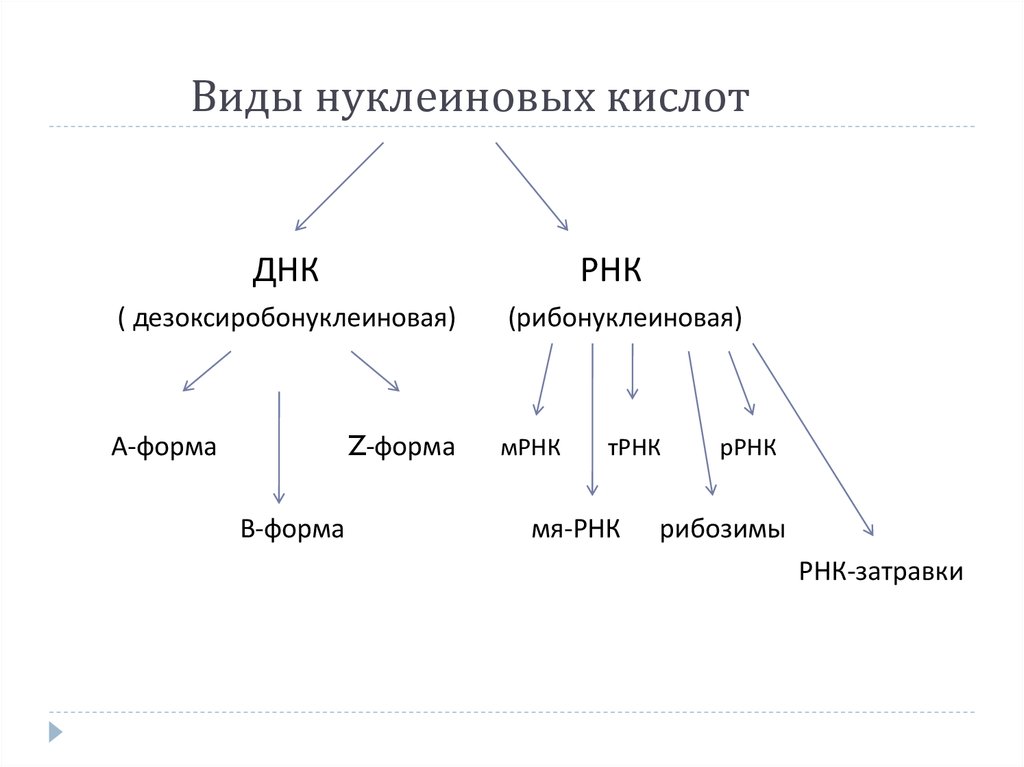
32. Виды нуклеиновых кислот
ДНКРНК
( дезоксиробонуклеиновая)
Z-форма
А-форма
В-форма
(рибонуклеиновая)
мРНК
тРНК
мя-РНК
рРНК
рибозимы
РНК-затравки
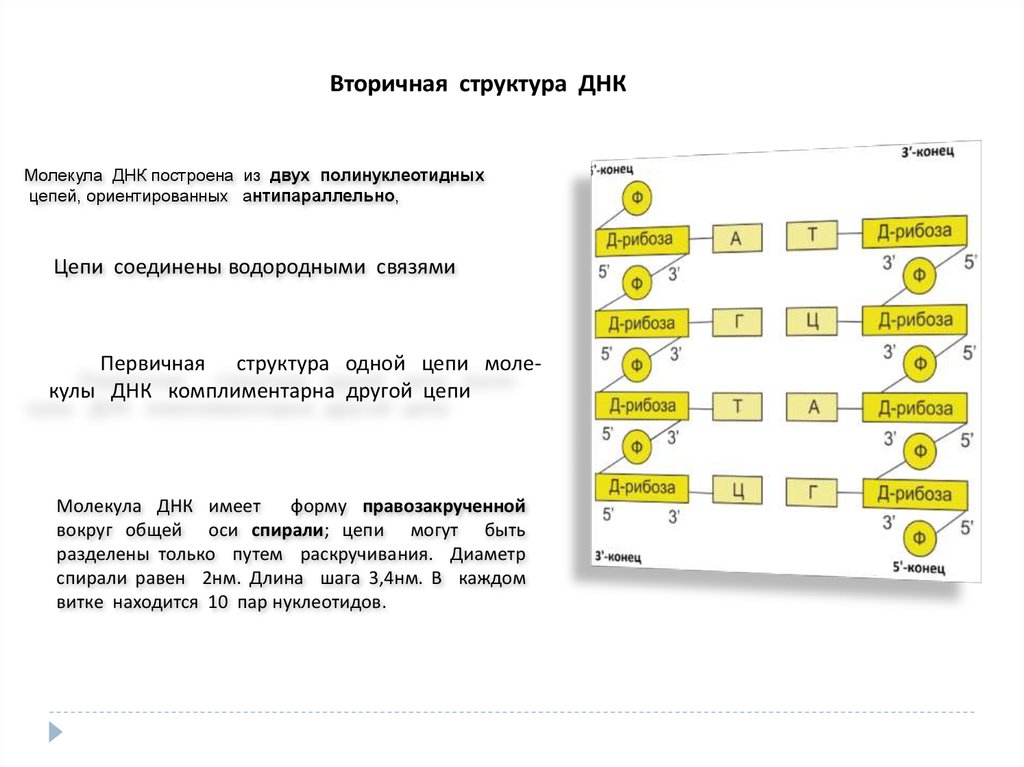
33.
Вторичная структура ДНКМолекула ДНК построена из двух полинуклеотидных
цепей, ориентированных антипараллельно,
Цепи соединены водородными связями
Первичная структура одной цепи молекулы ДНК комплиментарна другой цепи
Молекула ДНК имеет
форму правозакрученной
вокруг общей оси спирали; цепи могут быть
разделены только путем раскручивания. Диаметр
спирали равен 2нм. Длина шага 3,4нм. В каждом
витке находится 10 пар нуклеотидов.
34.
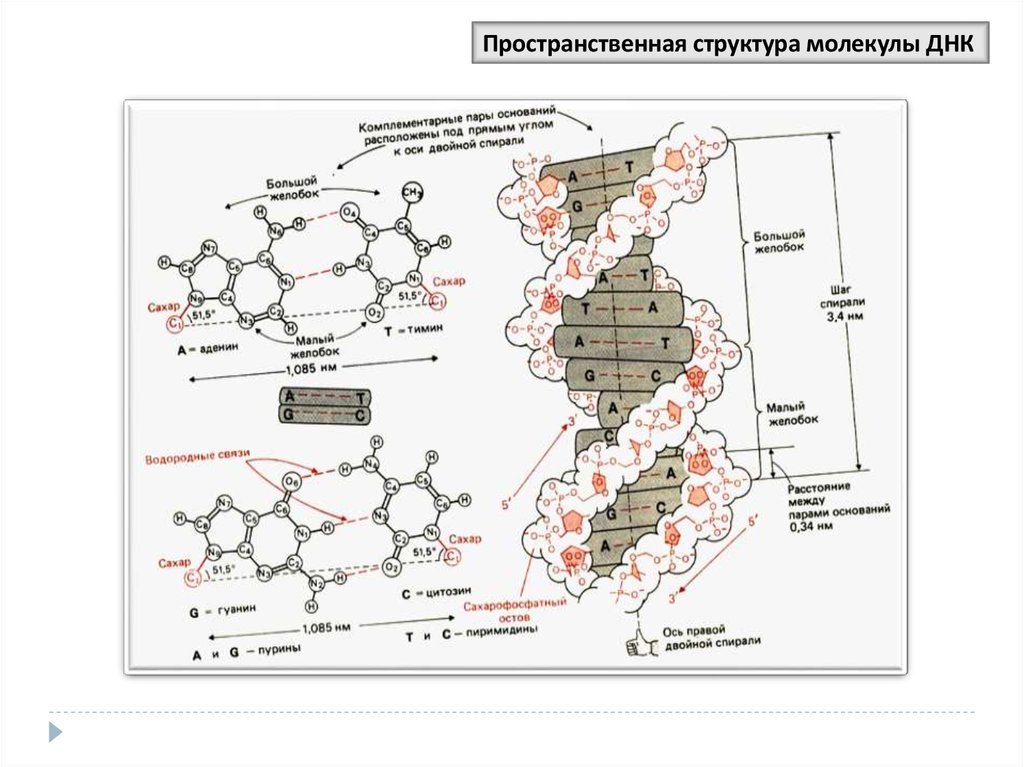
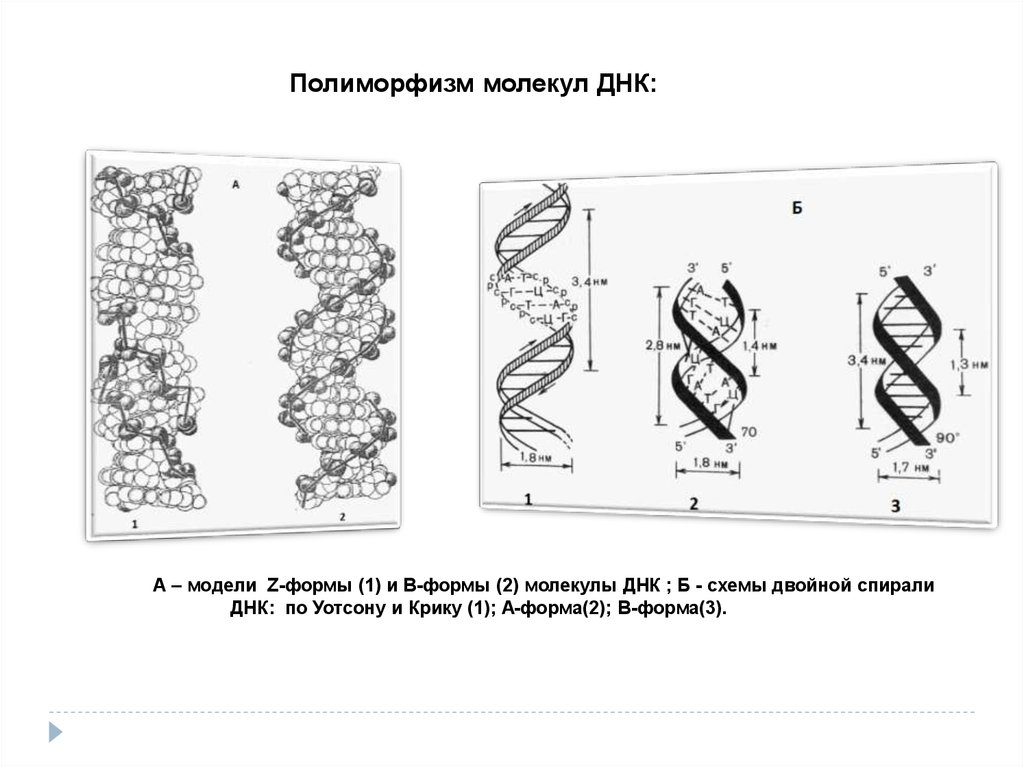
Пространственная структура молекулы ДНК35.
Полиморфизм молекул ДНК:А – модели Z-формы (1) и В-формы (2) молекулы ДНК ; Б - схемы двойной спирали
ДНК: по Уотсону и Крику (1); А-форма(2); В-форма(3).
36.
мРНК.
Схема расположения функциональных участков на
молекуле мРНК
Вторичная структура м-РНК,
Схема третичной структуры мРНК (А) и
действительно
существующей петли мРНК вируса R-17 (Б)
37.
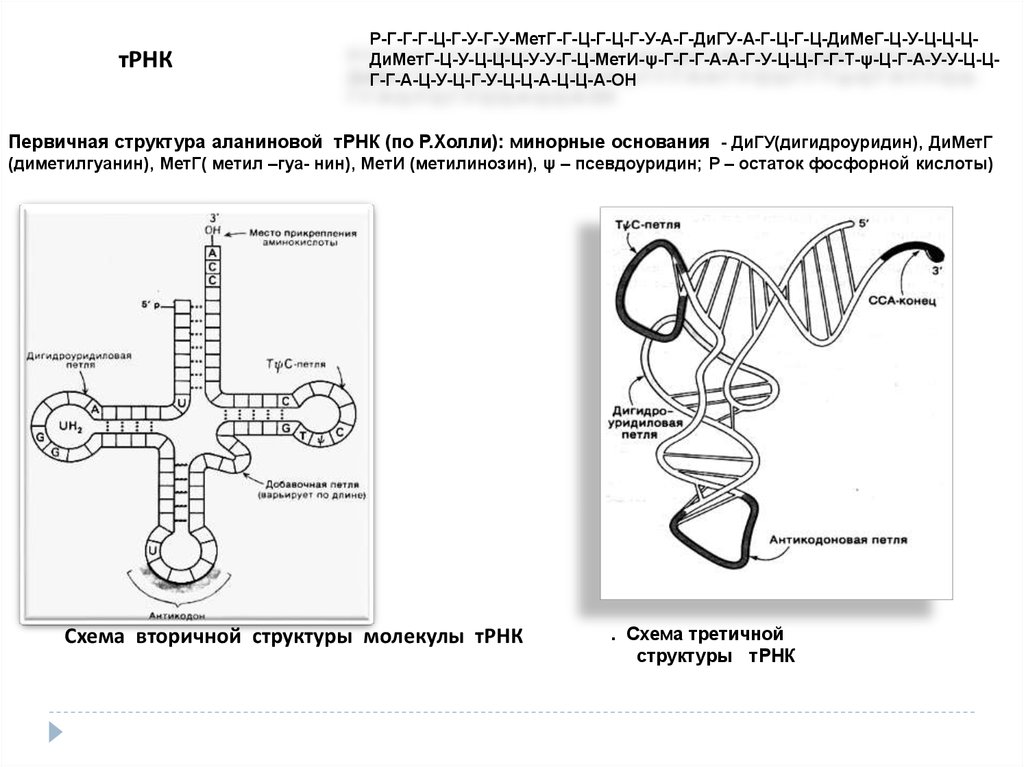
тРНКР-Г-Г-Г-Ц-Г-У-Г-У-МетГ-Г-Ц-Г-Ц-Г-У-А-Г-ДиГУ-А-Г-Ц-Г-Ц-ДиМеГ-Ц-У-Ц-Ц-ЦДиМетГ-Ц-У-Ц-Ц-Ц-У-У-Г-Ц-МетИ-ψ-Г-Г-Г-А-А-Г-У-Ц-Ц-Г-Г-Т-ψ-Ц-Г-А-У-У-Ц-ЦГ-Г-А-Ц-У-Ц-Г-У-Ц-Ц-А-Ц-Ц-А-ОН
Первичная структура аланиновой тРНК (по Р.Холли): минорные основания - ДиГУ(дигидроуридин), ДиМетГ
(диметилгуанин), МетГ( метил –гуа- нин), МетИ (метилинозин), ψ – псевдоуридин; Р – остаток фосфорной кислоты)
Схема вторичной структуры молекулы тРНК
. Схема третичной
структуры тРНК
38.
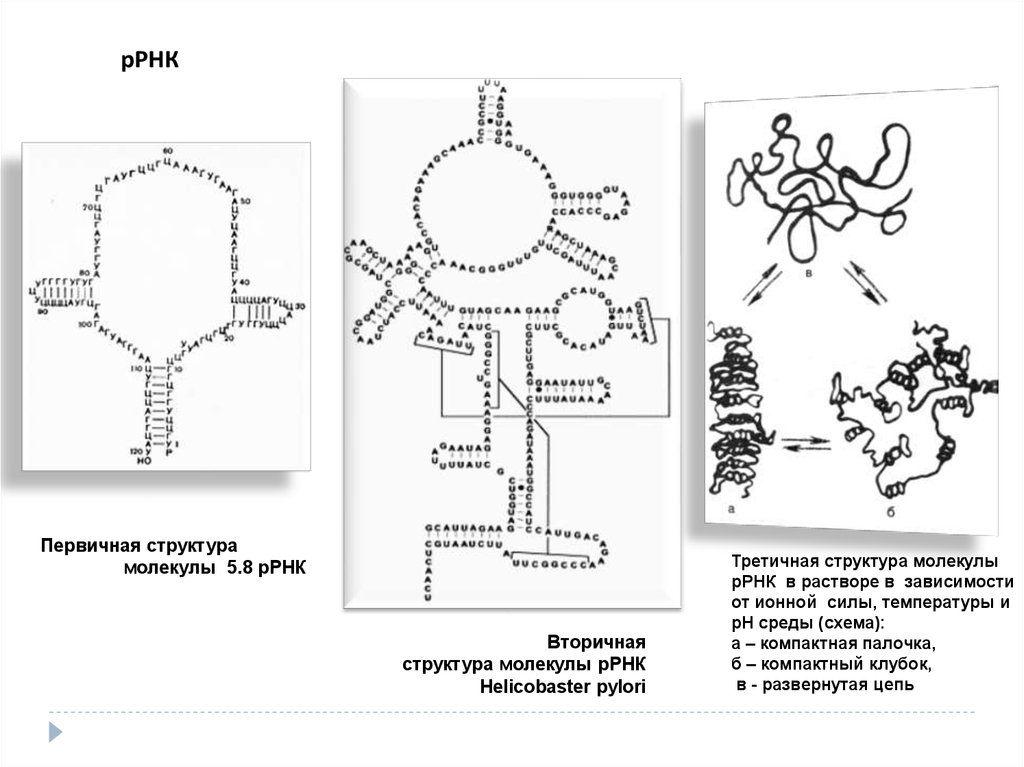
рРНКПервичная структура
молекулы 5.8 рРНК
Вторичная
структура молекулы рРНК
Helicobaster pylori
Третичная структура молекулы
рРНК в растворе в зависимости
от ионной силы, температуры и
рН среды (схема):
а – компактная палочка,
б – компактный клубок,
в - развернутая цепь
39.
Биологические функции молекулы ДНКХранение
воспроизведение (репликация) передача
генетической информации
клетки.
Функции молекулы РНК
1 - генетическая репликативная функция - выполняется при вирусных инфекциях: в
клетке, зараженный вирусом, происходит репликация РНК вируса с дальнейшей
трансляцией белков вируса;
2 - кодирующая функция – программирование белкового синтеза линейными
последовательностями нуклеотидов РНК (РНК-матрица). Триплеты нуклеотидов РНК
являются программой для расстановки 20видов аминокислот в полипептидной цепи
белка;
3 - структурная функция – молекула РНК образует трехмерные структуры рибосомы;
4 - функция узнавания – способность узнавать и пространственно взаимодействовать с другими видами РНК ( мРНК и рРНК при трансляции) и белками ( сплайсомы и
информосомы );
5 - каталитическая функция - участие в специфическом катализе химиической
реакции рибозимами.
















 Биология
Биология








