Похожие презентации:
Химическая связь
1. Химическая связь
2.
Химическая связь–электростатич.взаимодействие связывающее
атомы в ионы, молекулы,
кристаллы
Основное условие - понижение
полной энергии многоатомной
системы по сравнению с
энергией изолированных
атомов
Пример:
А + В = АВ,
ЕАВ EA + EB
3. Характеристики связи
4.
Длина химической связи(l св) - расстояние между
ядрами атомов в соед-ях
В однотипных соед-ях
длина связи закономерно
изменяется:
HF – HCl – HBr – HI
длина связи возрастает
5.
Энергия связи (Есв) – этоэнергия, выделяющаяся при
образовании хим. связи или
расходуемая на её разрыв
Взаимосвязь Есв и lсв:
Молекула HF
HCl
HBr
lсв, нм
Есв
кДж/моль
HI
0,092 0,128 0,142 0,162
566
432
366
298
6.
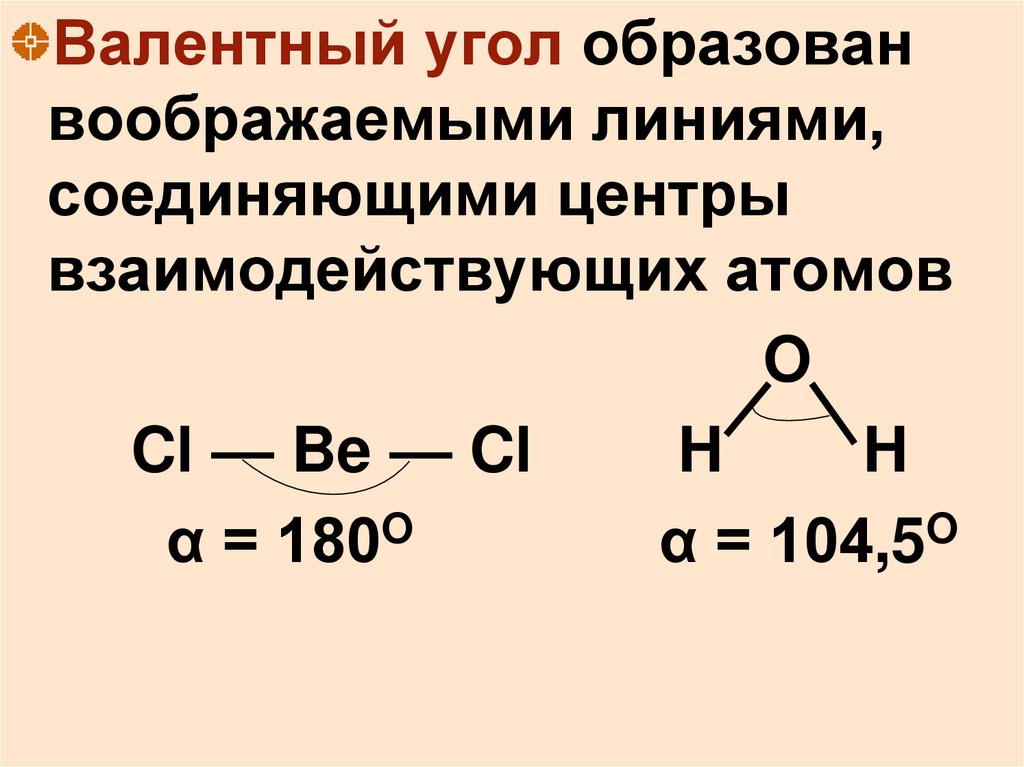
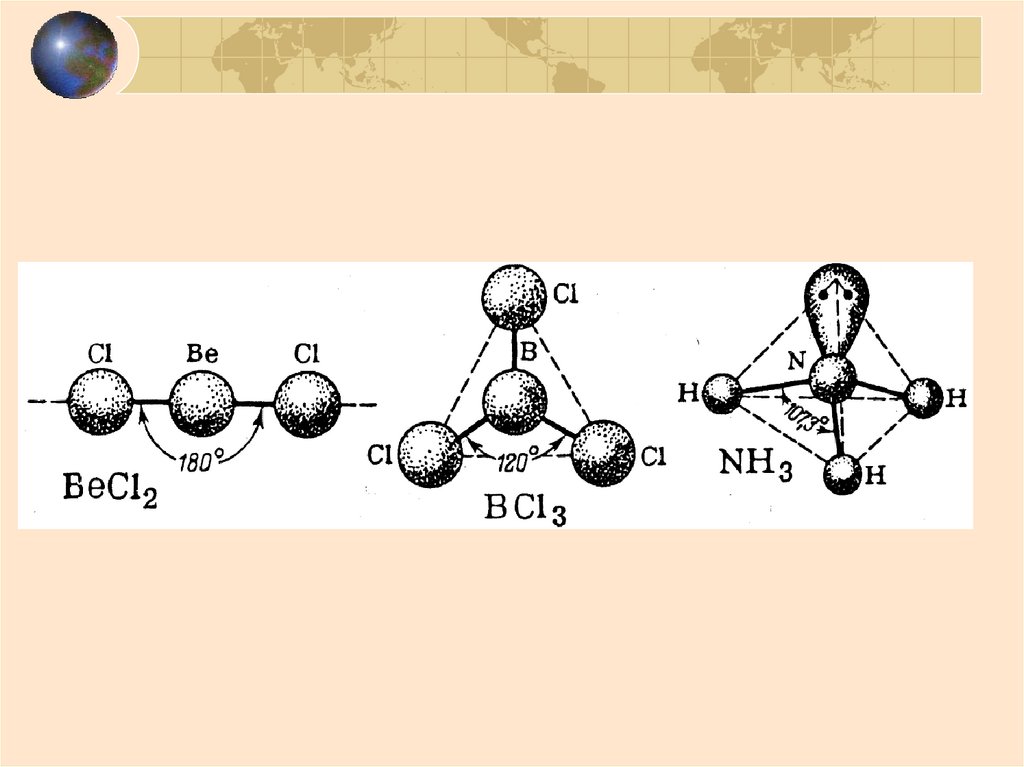
Валентный угол образованвоображаемыми линиями,
соединяющими центры
взаимодействующих атомов
O
Cl — Be — Cl
H
H
α = 180O
α = 104,5O
7.
8.
Дипольный момент – колич-наяхарактеристика полярности связи
μ = ∑ qэфф lдип [Кл•М]
qэфф– эффект. заряд, lдип – длина диполя
Дебай (D): 1D = 3,33 . 10-30 Кл м
Дипольный момент – векторная величина
Различают дип. моменты хим. связи и
молекул
μмол. = μсв
9.
О С О=0
О
Н Н
0
10. Типы химических связей
Распределение электроннойплотности между взаимод-ми
атомами определяет тип
химической связи:
ковалентная
ионная
металлическая
11. Типы химических связей
Ковалентная неполярная – это связьобразующаяся между атомами с
одинаковой электроотрицательностью.
Н–Н
О=О
Ковалентная полярная – это связь
образующаяся между атомами с разной
электроотрицательностью.
Н–F
C=O
12. Полярная и неполярная ковалентная связь
Полярная ковалентная связьНеполярная ковалентная связь
13. Ковалентная связь
Для объяснения механизмаобразования ковалентной хим.
связи разработано несколько
методов
Наиболее применимые:
- метод валентных связей (ВС)
- метод молекулярных орбиталей
(МО)
14. Метод валентных связей (ВС)
Связанные между собой атомы вмолекуле удерживаются вместе
при помощи одной или нескольких
общих эл-ных пар
Химическая связь между двумя
атомами локализована в месте
перекрывания атомных орбиталей
(локализованная двухцентровая
связь)
15. Основные положения метода ВС
Ков. связь образуют два электрона спротивоположными спинами,
принадлежащие двум атомам
При образовании связи происходит
перекрывание АО и увеличение
электронной плотности между ними,
что приводит к уменьшению энергии
Связь реализуется в направлении
наибольшего перекрывания АО
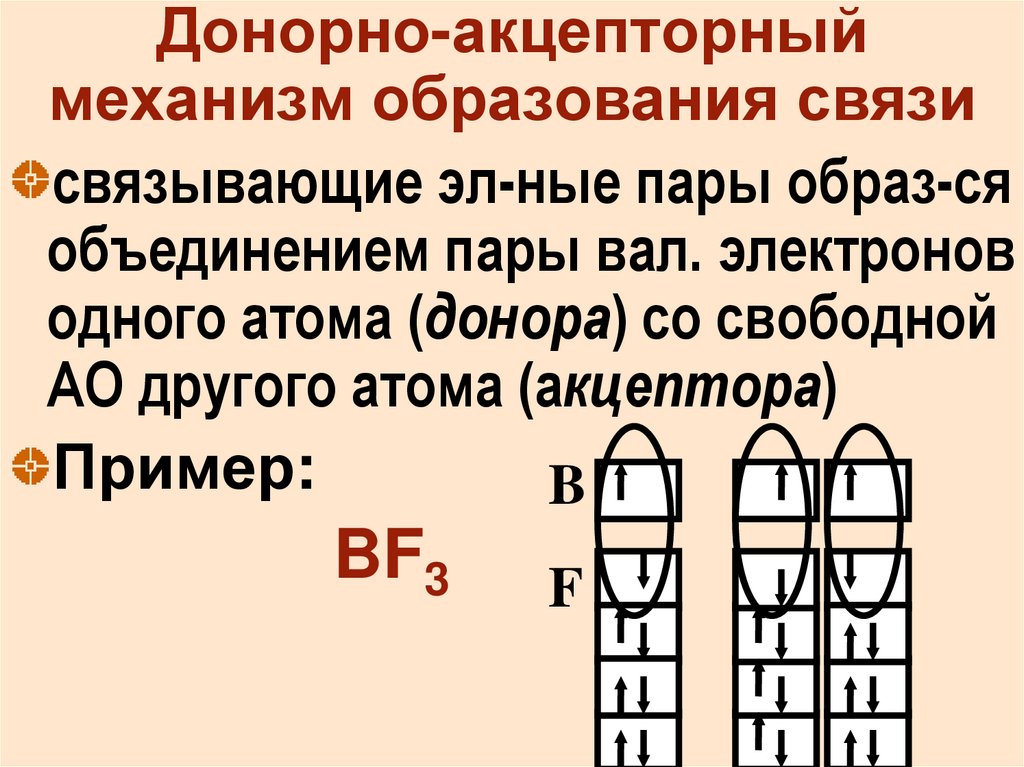
16. Донорно-акцепторный механизм образования связи
связывающие эл-ные пары образ-сяобъединением пары вал. электронов
одного атома (донора) со свободной
АО другого атома (акцептора)
Пример:
B
BF3
F
17. Свойства ковалентной связи
18.
Направленность хим. связиобусловлена перекрыванием
электронных облаков
- соединение атомов между
собой при образовании
общих электронных пар в
определённых
направлениях.
19.
Насыщаемость – макс. возможноечисло связей, определяемое общим
числом задействованных орбиталей
1-й период - макс. валентность = 1
2-й период - макс. валентность = 4,
т.к. валентные 4 АО ( 2s- и три 2р)
3-й период - валентные 9 АО (3s, три
3р и пять 3d), но макс. валентность
практически не реализуется
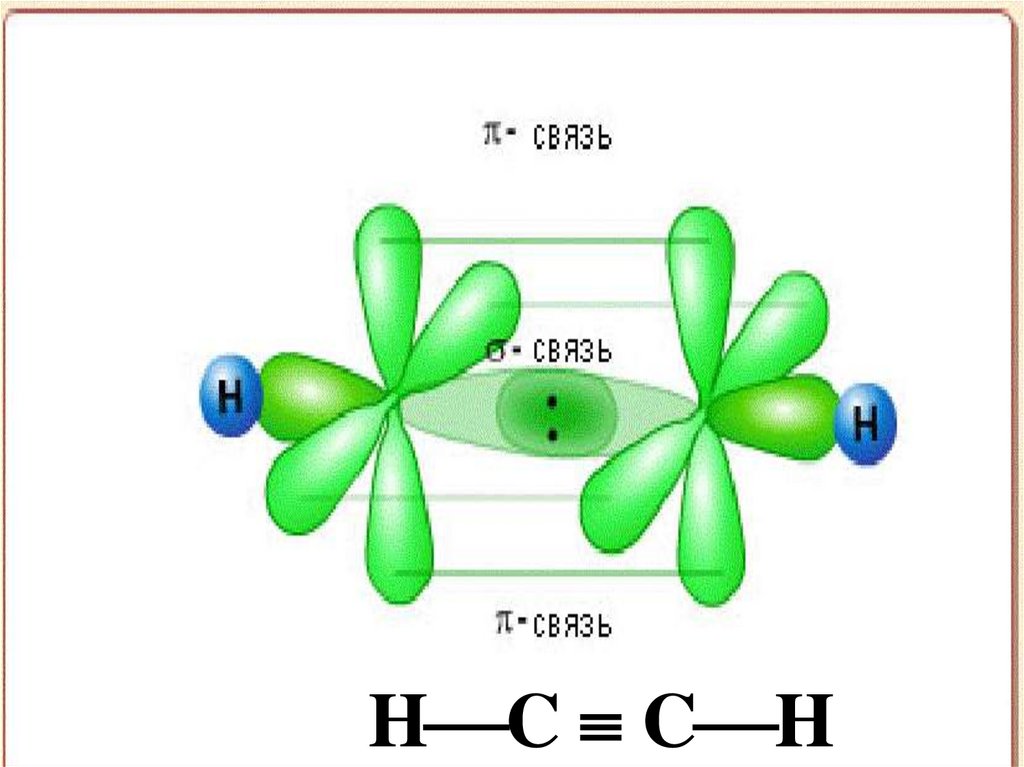
20. Типы перекрывания атомных АО
-взаимодействие возникаетпри перекрывании орбиталей
s – s, s – p, p – p, d – d вытянутых
вдоль одной оси
- возникает при перекрывании
электронных облаков по обе
стороны от линии соединения
атомов.
21.
22.
H C C H23.
- (дельта) взаимодействие, прикоторой перекрываются dорбитали четырьмя лепестками
По прочности химического
взаимодействия располагаются в
следующей ряд:
σ>π>δ
π и δ – взаимод-вия возникают
как дополнительные к взаимод-вию
24.
Кратность хим. связи - число общихэлектронных пар, реализующих
связь между двумя атомами
Чем выше кратность связи, тем она
прочнее (кратности > 3 не бывает)
Кратность обусловлена характером
перекрывания АО
Молекула
F2
O2
N2
Кратность связи 1
2
3
Е св, кДж/моль
159
494
945
25. Гибридизация АО
Это мат-ий прием отысканияновых волновых функций,
удовлетворяющих условию
равнопрочности образуемых
связей и уменьшению энергии
26. Основные положения гибридизации
Гибридизуются толькоорбитали центрального атома
Гибридизуются АО с близкой
энергией
Число гибридных орбиталей
равно суммарному числу
исходных орбиталей
27.
Гибридные орбитали болеевытянуты в пространстве и
обеспечивают более полное
перекрывание с соседними
атомами
Гибридные орбитали участвуют
только в образовании -связей
Теория гибридизации объясняет
направленность ковалентной
связи и геометрическое строение
молекул и кристаллов
28.
Всего 11 типов гибридизацииЧаще встречается 4 типа:
sp,
2
sp ,
3
sp ,
3
2
sp d
29.
При образовании молекулы BeCl2происходит гибридизация АО Be
Be (2s2)
Cl(3s23p5)
SP – гибридизация
180
30.
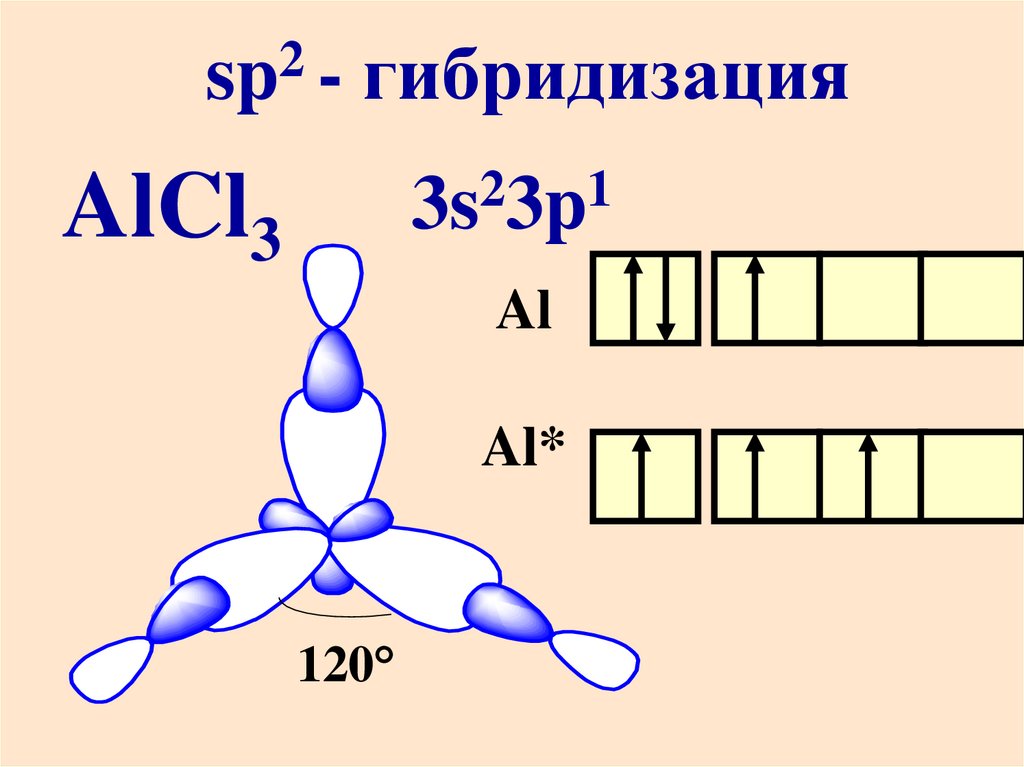
2sp -
гибридизация
2
1
3s 3p
AlCl3
Al
Al*
120
31. sp3 - гибридизация АО атома углерода в СН4
3sp - гибридизация
АО
атома углерода в СН4
32. Скелетная и пространственная модели молекулы метана
33.
NH33
sp
H2 O
- гибридизация
34.
32
sp d
SF6
– гибридизация
S
F
2
4
3s 3p
2
5
2s 2p
35. В гибридизации могут участвовать:
Одноэлектронные орбиталиОрбитали со спаренными
электронами
Орбитали без электронов
Геометрия молекул и валентные
углы зависят от типа орбиталей
36. Ионная связь
Это предельный случайполярной ковалентной связи,
когда степень ионности > 50%
или ЭО > 1,9
Пример: ЭОMg=1,2; ЭОО=3,5
ЭО = 2,3
37. Ионная связь
Энергия связи определяетсясилами электростатического
взаимодействия
противоположно заряженных
ионов
Ионные соединения состоят из
огромного числа ионов,
связанных в одно целое силами
электростатического притяжения
38. Свойства ионной связи
39.
Ненаправленность и ненасыщаемостьНенаправленность – способность иона
данного знака (+,-) притягивать к себе
ионы другого знака (-,+) по любым
направлениям.
Ненасыщаемость– проявляется в том,
что присоединив к себе ионы другого
знака, данный ион продолжает
сохранять способность притягивать к
себе ионы другого знака и по другим
направлениям.
40.
МолекулыИонная
хлороводорода кристаллическая решётка
41.
Ионные соединения приобычных условиях –
твердые и прочные, но
хрупкие вещества
При плавлении и
растворении в воде они
распадаются на ионы
(электролитическая
диссоциация) и проводят
электрический ток, т.е.
являются электролитами
42. Поляризация
Это влияние друг на другаионов, которое приводит к
деформации электронных
оболочек
Причина - действие электр-го
поля, создаваемого соседними
противоположно заряженными
ионами
В результате электронная
оболочка смещается в сторону
соседнего иона и деформируется
43.
Поляризуемость деформация электронногооблака в электрическом
поле
Поляризующая способность
- деформирующее влияние
на другие ионы
44. Поляризуемость иона
возрастает с ув-м размеров иона+
Li
–
–
–
–
F-– Cl-– Br-– I-
+
Na
+
K
+
Rb
+
Cs
радиус увеличивается
поляризуемость возрастает
rкат < rан
поэтому поляризуемость
анионов выше
поляризуемости катионов
45. Поляризующая способность ионов
зависит от заряда, размера итипа иона
Чем > заряд иона, тем > его
поляризующее действие
При одном и том же заряде
напряженность
электрического поля вблизи
иона тем >, чем < его размеры
46. Влияние поляризации на свойства соединений:
растворимостьтермич. устойчивость
окраску
47.
ПримерAgCl хуже растворим в воде,
чем NaCl и KСl
Причина
более сильное поляризующее
действие Ag+ на Cl– и связи
становятся более ковалентны
в AgCl, что ухудшает его
растворимость в воде
48. Металлическая связь
образуется в металлах и их сплавахОсуществляется между ионами, атомами
металлов и делокализованными
электронами в кристаллич. решетке
Причина: невысокие Еиониз. металлов
обусловливают легкость отрыва
валентных электронов от атомов и
перемещение по всему объему кристалла
Результат: высокая тепло- и
электропроводность
49.
Природа металлической связиоснована на обобществлении
валентных электронов, т.к.
валентных электронов меньше,
чем вакантных орбиталей,
валентные электроны могут
переходить с одной орбитали на
другую
50. Теория электронного газа
Все валентные электроны свободныи принадлежат всей крист. решетке.
Совокупность электронов наз-ся
электронным газом
+
+
+
+
+
+
+
+
+
+
+
Металлическая связь
ненасыщенна и
ненаправлена
51. Межмолекулярные взаимодействия с энергией 0,8 — 8,16 кДж/моль
называют силами Ван дер ВаальсаОбеспечивает переход из одного
агрегатного состояния в другое,
определяет многие физ св-ва: Тпл,
Ткип, электро- и теплопроводность,
твердость, плотность и др.
Ван-дер-ваальсовы силы заметно уступают химическому
связыванию. Н-р, силы, удерживающие атомы хлора в
молекуле хлора почти в десять раз больше, чем силы,
связывающие молекулы Cl2 между собой. Но без этого
слабого межмолекулярного притяжения нельзя получить
жидкий и твердый хлор.
52.
Водородная связь бываетвнутримолекулярная (чаще в орг.
молекулах) и межмолекулярная (HF,
NH3, H2O, H2O2, H2SO4, H3PO4)
Возникает мостиковая связь между
положительно поляризованным
атомом водорода одной молекулы и
отрицательно поляризованным
атомом (N, O, или F) другой
молекулы
53. Cхема образования водородной связи между молекулами H2O
НО
Н
Н
О
Н
Н О
Н
Н
:О
Н
54.
Свойства водородной связи направленность и насыщаемостьЭнергия водородной связи
примерно на порядок ниже
энергии хим.связи и в несколько
раз выше энергии
межмолекулярного
взаимодействия

















































 Химия
Химия








