Похожие презентации:
Химическая связь
1.
ХимическаяХимическаясвязь
связь
Лектор – Воронкова Наталья
Артемовна, профессор к. «Химия»
2. План лекции
ПЛАН ЛЕКЦИИ1.
Параметры химической связи
2. Ковалентная связь
3. Ионная связь
4. Металлическая связь
5. Межмолекулярные связи
3. Химическая связь
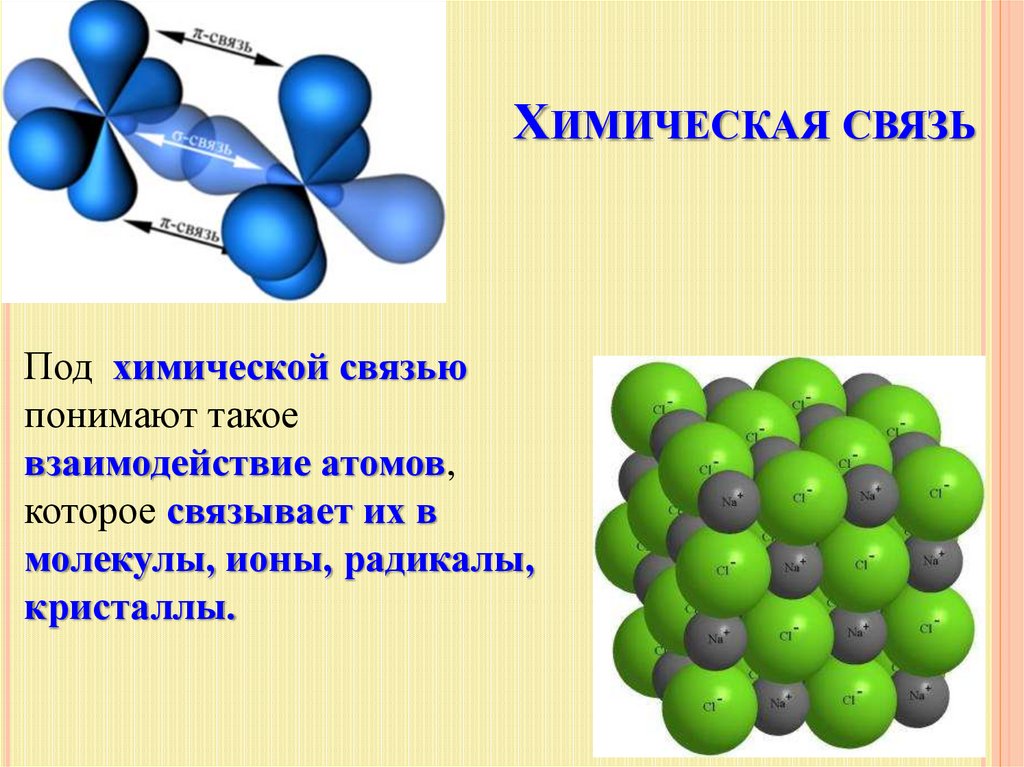
ХИМИЧЕСКАЯ СВЯЗЬПод химической связью
понимают такое
взаимодействие атомов,
которое связывает их в
молекулы, ионы, радикалы,
кристаллы.
4. Параметры химической связи:
ПАРАМЕТРЫ ХИМИЧЕСКОЙ СВЯЗИ:Энергия
Длина
Валентный угол
Кратность
Полярность
5. Энергия связи:
ЭНЕРГИЯ СВЯЗИ:Энергией химической связи
называется энергия, которая
выделяется при образовании
связи или которая
затрачивается на ее разрыв.
Н2 = 2Н , Е(н-н) = 432 кДж.
6. Зависимость энергии связи от длины:
Длина связи – это расстояние междусвязанными атомами или между их
ядрами.
ЗАВИСИМОСТЬ ЭНЕРГИИ СВЯЗИ ОТ ДЛИНЫ:
вещество
Lсв , А0
Есв
кДж/моль
HF HCl HBr
HI
0,92 1,27 1,41 1,61
566 432 366 298
1А0 = 10-10м
ангстрем
7. Валентный угол
ВАЛЕНТНЫЙ УГОЛВалентный угол – это угол
между воображаемыми
линиями соединяющими
центры атомов.
Н2
H 2O
(H-H) = 1800
(H-O-H) = 104,50
104,50
8. Примеры:
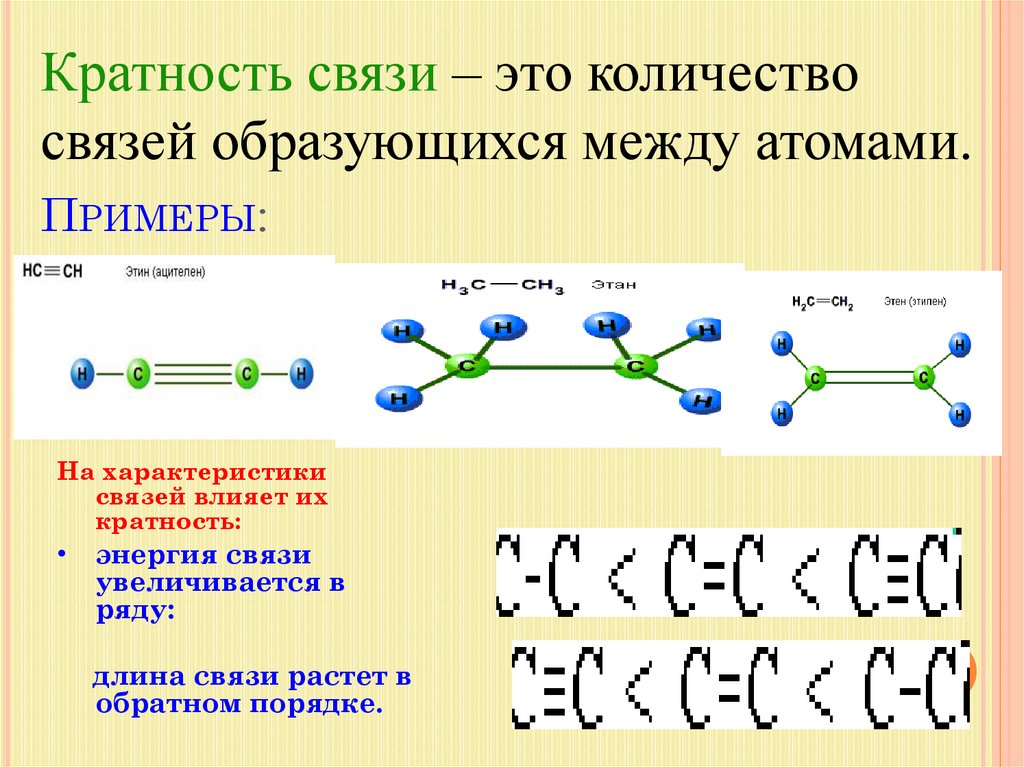
Кратность связи – это количествосвязей образующихся между атомами.
ПРИМЕРЫ:
На характеристики
связей влияет их
кратность:
• энергия связи
увеличивается в
ряду:
длина связи растет в
обратном порядке.
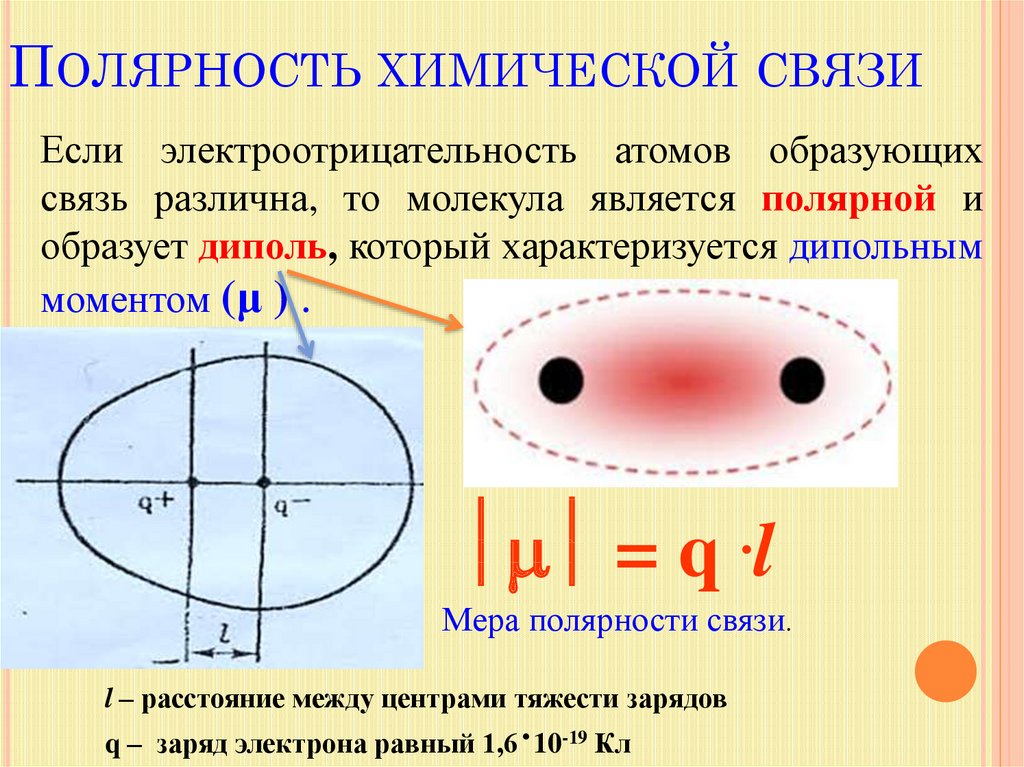
9. Полярность химической связи
ПОЛЯРНОСТЬ ХИМИЧЕСКОЙ СВЯЗИЕсли электроотрицательность атомов образующих
связь различна, то молекула является полярной и
образует диполь, который характеризуется дипольным
моментом (μ ) .
= q
.l
Мера полярности связи.
l – расстояние между центрами тяжести зарядов
q – заряд электрона равный 1,6·10-19 Кл
10.
измеряется в дебаях D иликулон-метрах: 1D = 3,4·10-30 Кл·м
[ ]
μ = 0 если
молекулы, имеют неполярную
ковалентную связь – электронное облако симметрично по
отношению к ядрам обоих атомов.
Например: Н2 ;
О2; F2; Cl2 и др.
Дипольный момент – это векторная величина.
Вектор дипольного момента направлен от
положительного заряда к отрицательному.
Сложение дипольных моментов определяется
сложением векторов по правилу параллелограмма.
Поляризуемость – способность атомов, ионов и
молекул приобретать дипольный момент (μ ) в
электрическом поле.
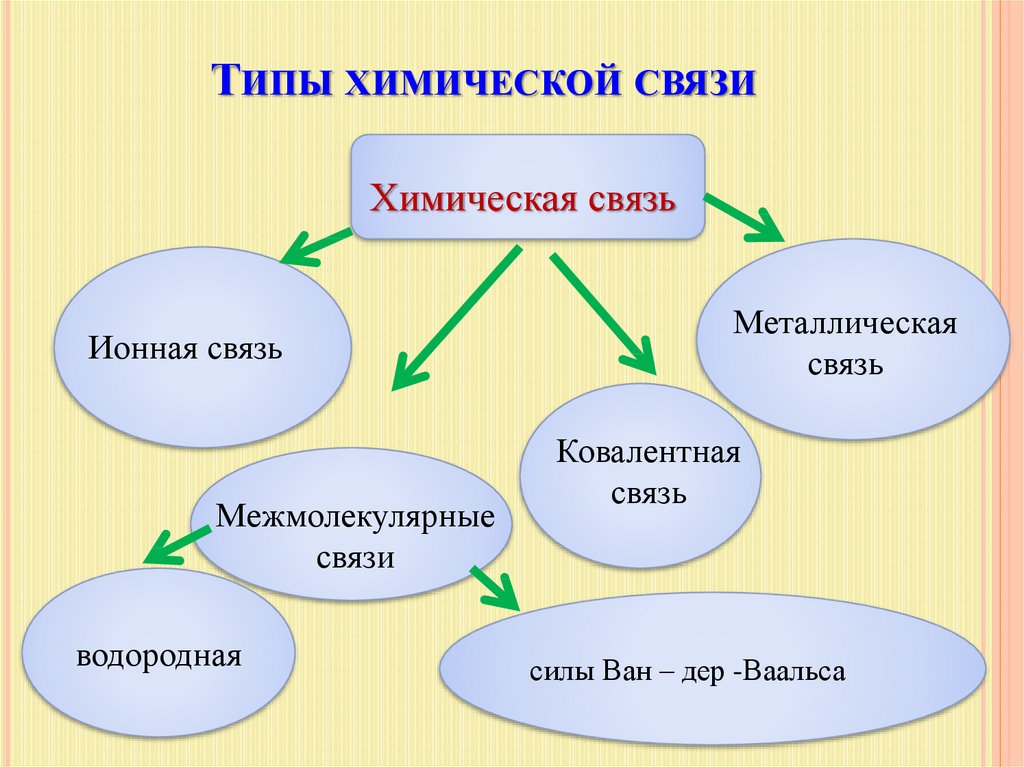
11. Типы химической связи
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИХимическая связь
Ионная связь
Межмолекулярные
связи
водородная
Металлическая
связь
Ковалентная
связь
силы Ван – дер -Ваальса
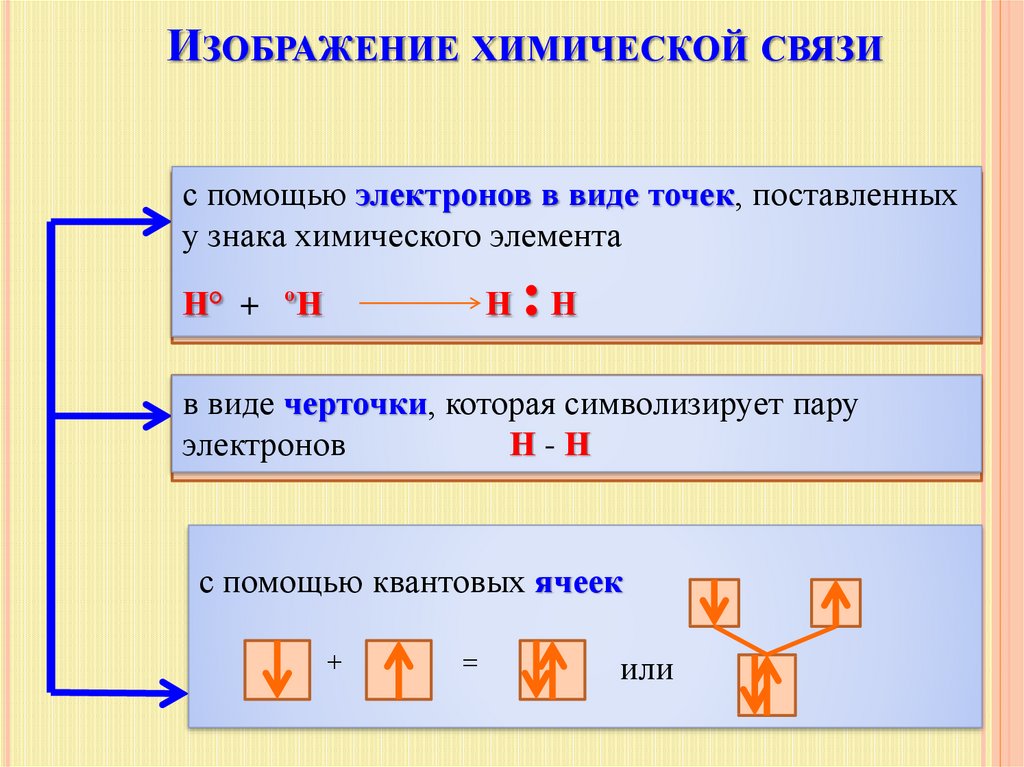
12. Изображение химической связи
ИЗОБРАЖЕНИЕ ХИМИЧЕСКОЙ СВЯЗИс помощью электронов в виде точек, поставленных
у знака химического элемента
Н° + ºН
Н
:Н
в виде черточки, которая символизирует пару
электронов
Н-Н
с помощью квантовых ячеек
+
=
или
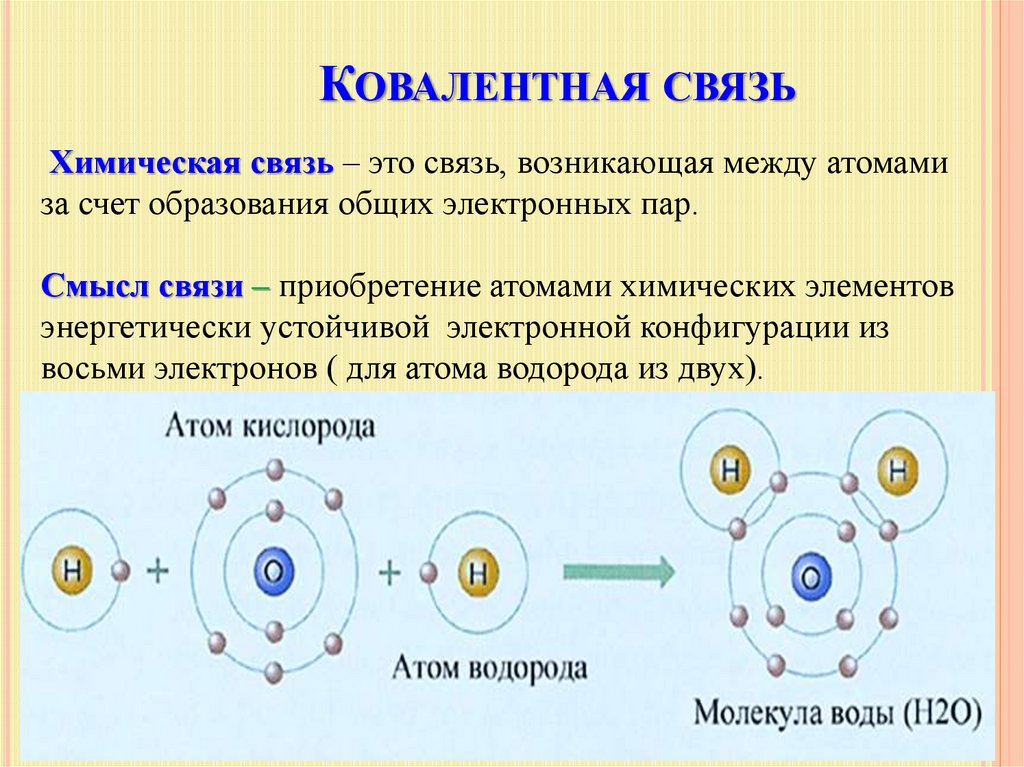
13. Ковалентная связь
КОВАЛЕНТНАЯ СВЯЗЬХимическая связь – это связь, возникающая между атомами
за счет образования общих электронных пар.
Смысл связи – приобретение атомами химических элементов
энергетически устойчивой электронной конфигурации из
восьми электронов ( для атома водорода из двух).
14. Механизмы ковалентной связи
МЕХАНИЗМЫ КОВАЛЕНТНОЙ СВЯЗИКовалентная связь
Донорноакцепторный
Донорно-акцепторный
механизм:
за счет двухэлектронного
облака донора и
свободной орбитали
акцептора.
Обменный механизм:
за счет перекрывания
электронных облаков.
Обменный
Полярная связь
Неполярная
связь
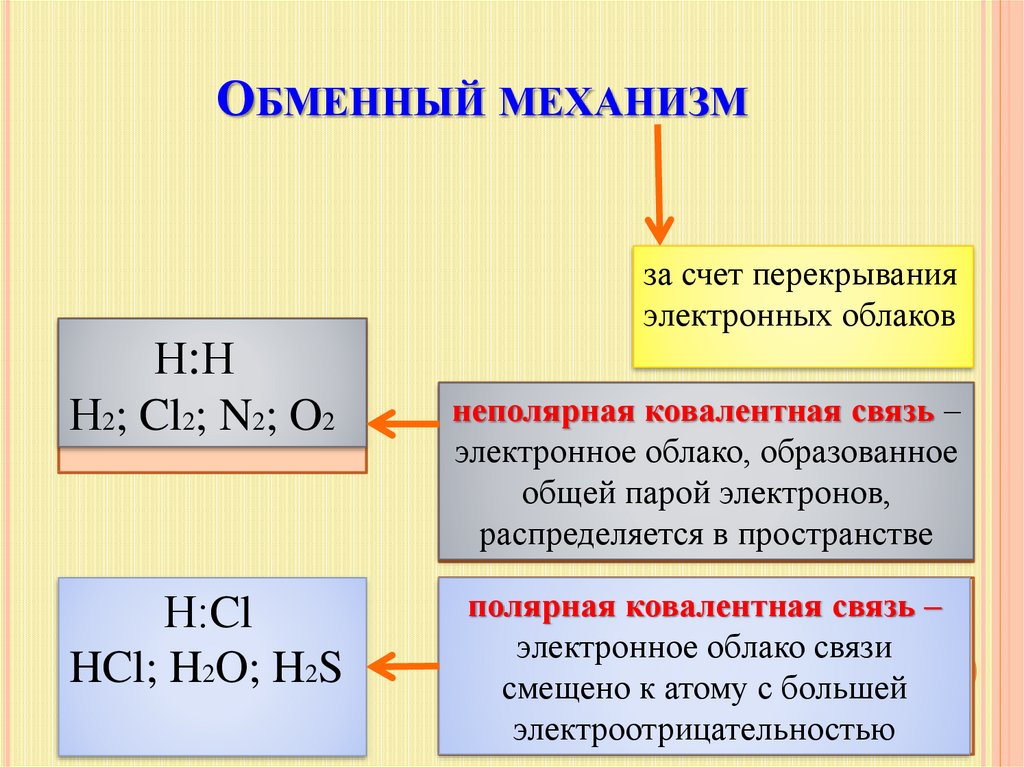
15. Обменный механизм
ОБМЕННЫЙ МЕХАНИЗМза счет перекрывания
электронных облаков
Н:Н
Н2; Cl2; N2; O2
Н:Cl
HCl; H2O; H2S
неполярная ковалентная связь –
электронное облако, образованное
общей парой электронов,
распределяется в пространстве
полярная ковалентная связь –
электронное облако связи
смещено к атому с большей
электроотрицательностью
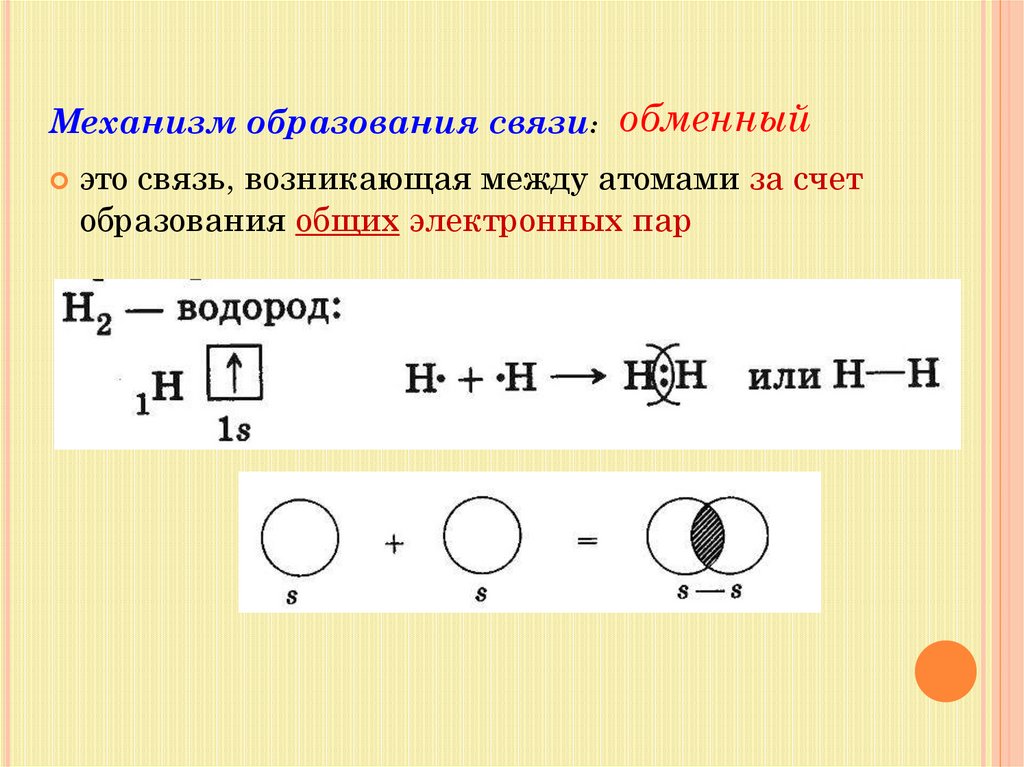
16.
Механизм образования связи: обменныйэто связь, возникающая между атомами за счет
образования общих электронных пар
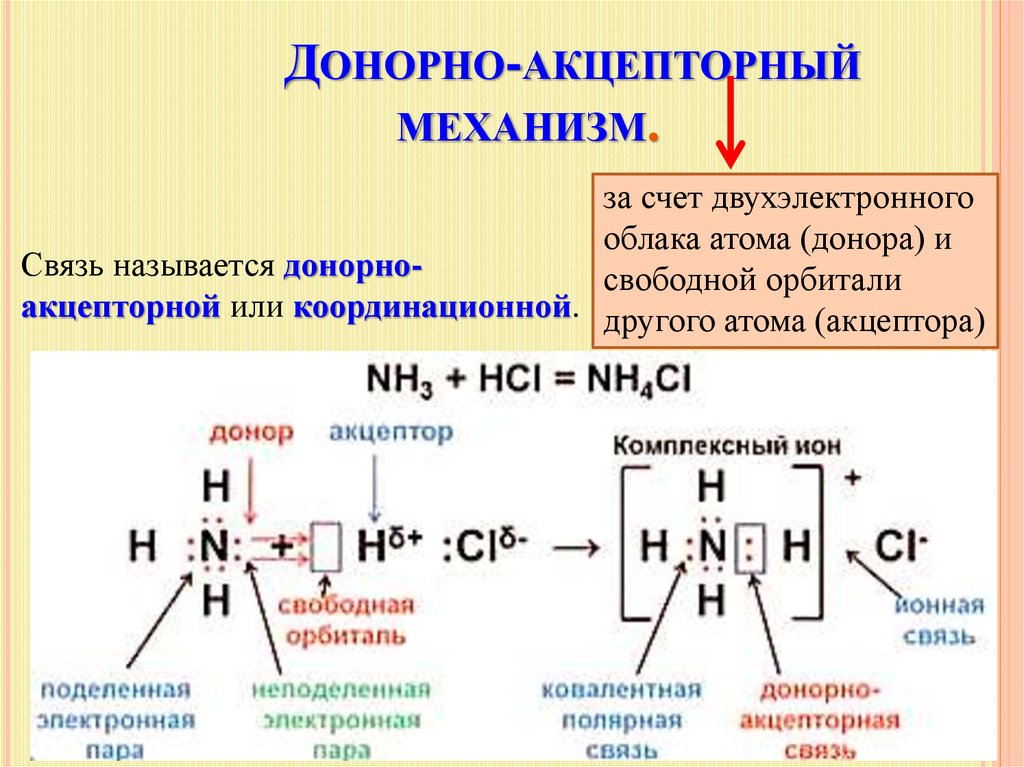
17. Донорно-акцепторный механизм.
ДОНОРНО-АКЦЕПТОРНЫЙМЕХАНИЗМ.
за счет двухэлектронного
облака атома (донора) и
Связь называется донорносвободной орбитали
акцепторной или координационной. другого атома (акцептора)
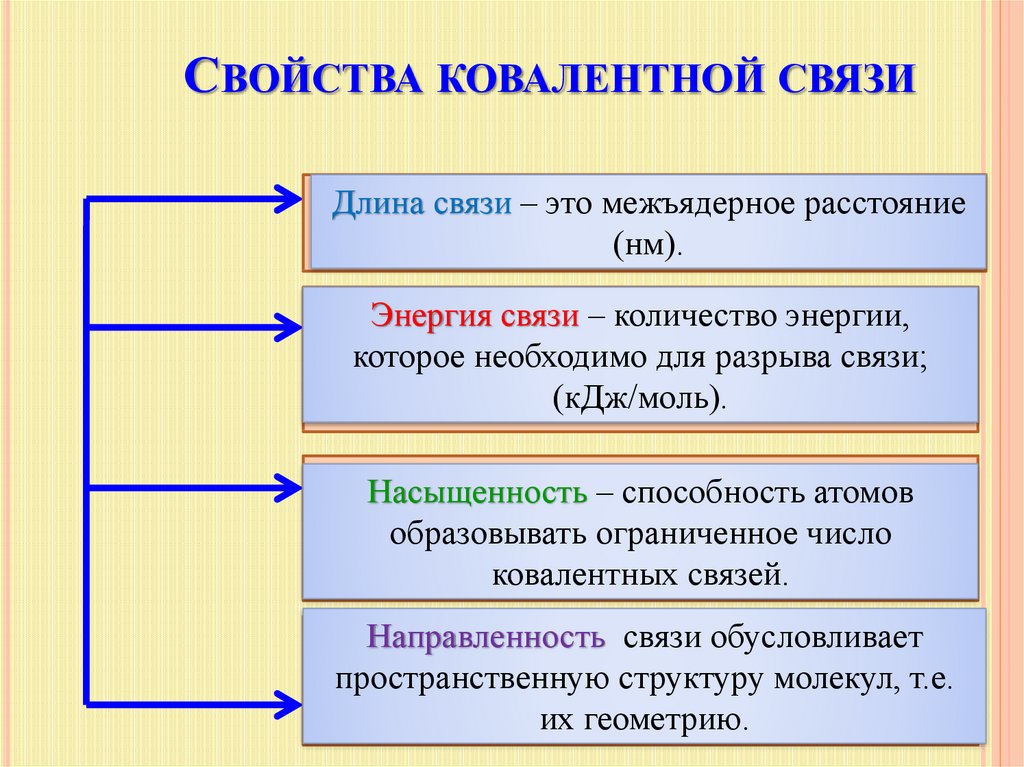
18. Свойства ковалентной связи
СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИДлина связи – это межъядерное расстояние
(нм).
Энергия связи – количество энергии,
которое необходимо для разрыва связи;
(кДж/моль).
Насыщенность – способность атомов
образовывать ограниченное число
ковалентных связей.
Направленность связи обусловливает
пространственную структуру молекул, т.е.
их геометрию.
19.
Направленность ковалентной связиНаправленность
ковалентной связи обусловлена
определенным пространственным расположением
электронных орбиталей взаимодействующих атомов.
-
Так, угол между связями, образованными p-орбиталями
атома, должен быть равен примерно 90°. Примером
может служить молекула сероводорода H2S (валентный
угол - 92°).
Однако, в большинстве молекул аналогичного состава
AB2 (CO2, H2O, BeCl2) валентные углы значительно
отличаются от прямого и составляют величину от
104,5° в молекулах H2O до 180° в молекулах CO2 и
BeCl2.
Для предсказания величин валентных углов и,
следовательно, геометрического строения молекул
целесообразно использовать теорию гибридизации
атомных орбиталей, разработанную американским
ученым Лайнусом Полингом.
20.
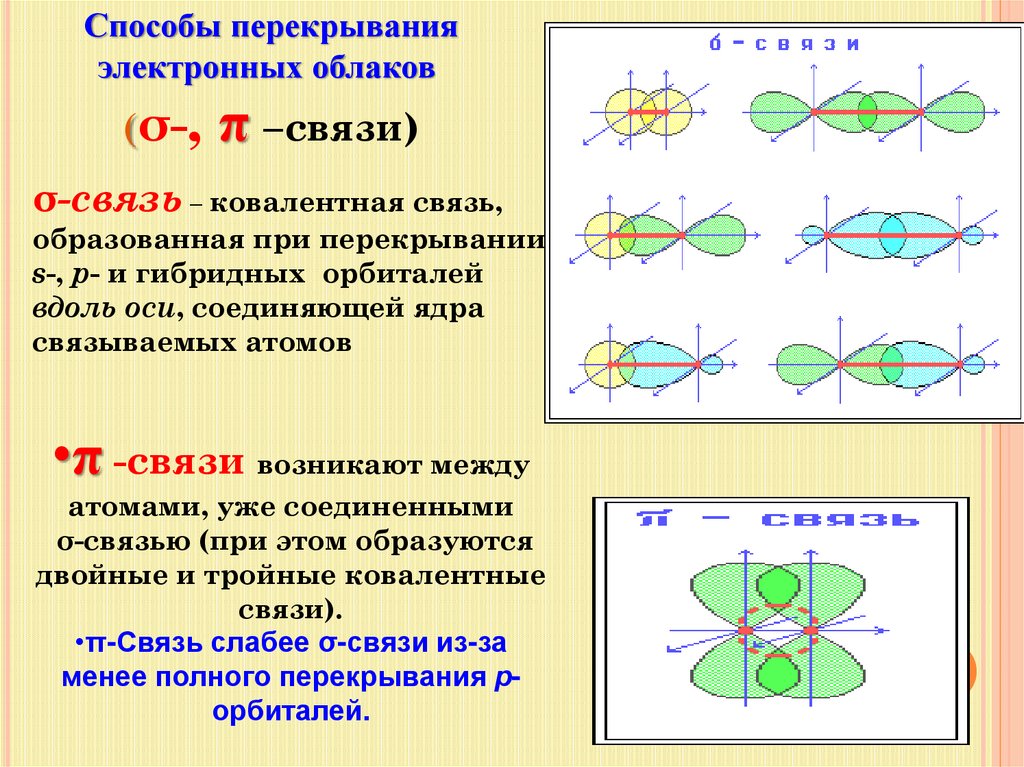
Способы перекрыванияэлектронных облаков
(σ-,
π –связи)
σ-связь – ковалентная связь,
образованная при перекрывании
s-, p- и гибридных орбиталей
вдоль оси, соединяющей ядра
связываемых атомов
•π -связи возникают между
атомами, уже соединенными
σ-связью (при этом образуются
двойные и тройные ковалентные
связи).
•π-Связь слабее σ-связи из-за
менее полного перекрывания рорбиталей.
21. Гибридизация электронных облаков
ГИБРИДИЗАЦИЯ ЭЛЕКТРОННЫХОБЛАКОВ
Гибридизация – выравнивание взаимодействующих
орбиталей разных подуровней по форме и энергии.
при этом расчетные формы орбиталей отличаются от
исходных.
180°
s + p орбитали
две sp- орбитали
sp - гибридизация
sp²- гибридизация
120°
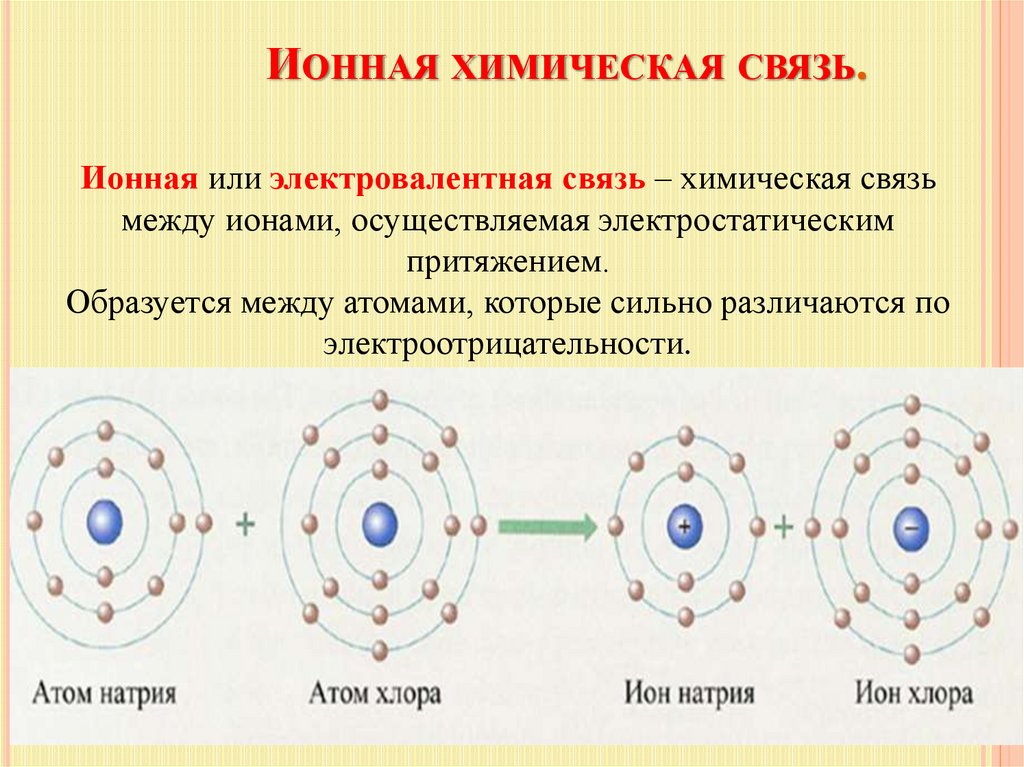
22. Ионная химическая связь.
ИОННАЯ ХИМИЧЕСКАЯ СВЯЗЬ.Ионная или электровалентная связь – химическая связь
между ионами, осуществляемая электростатическим
притяжением.
Образуется между атомами, которые сильно различаются по
электроотрицательности.
23. Образование хлорида натрия.
ОБРАЗОВАНИЕ ХЛОРИДА НАТРИЯ.24. Свойства ионной химической связи
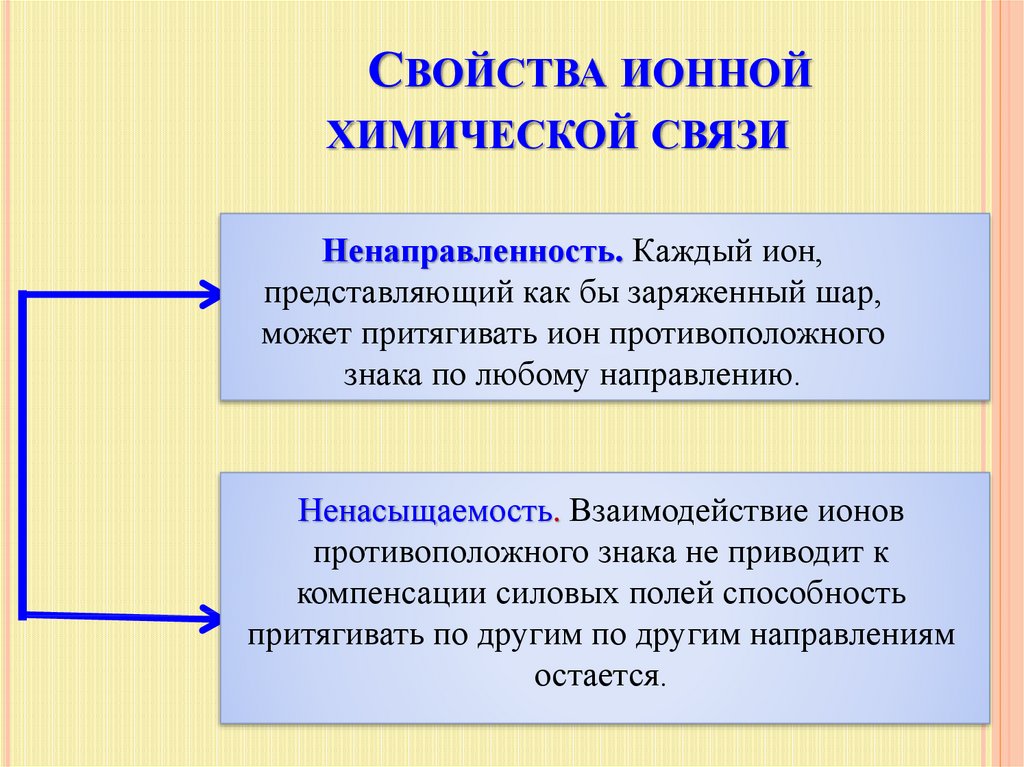
СВОЙСТВА ИОННОЙХИМИЧЕСКОЙ СВЯЗИ
Ненаправленность. Каждый ион,
представляющий как бы заряженный шар,
может притягивать ион противоположного
знака по любому направлению.
Ненасыщаемость. Взаимодействие ионов
противоположного знака не приводит к
компенсации силовых полей способность
притягивать по другим по другим направлениям
остается.
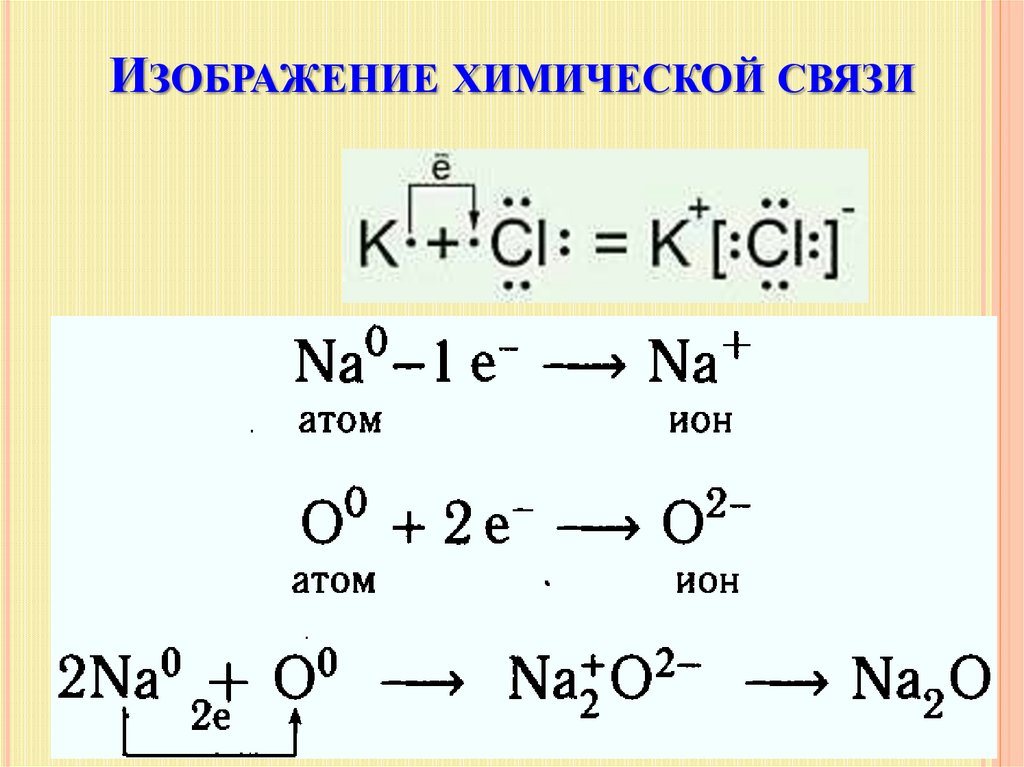
25. Изображение химической связи
ИЗОБРАЖЕНИЕ ХИМИЧЕСКОЙ СВЯЗИ26.
Металлическаясвязь
• Атомы металлов отличаются
от атомов других элементов
тем, что сравнительно слабо
удерживают свои внешние
электроны.
• Поэтому в кристаллической
решетке металла эти
электроны покидают свои
атомы, превращая их в
положительно заряженные
ионы.
• "Обобществленные"
электроны передвигаются в
пространстве между
катионами и удерживают их
вместе.
27.
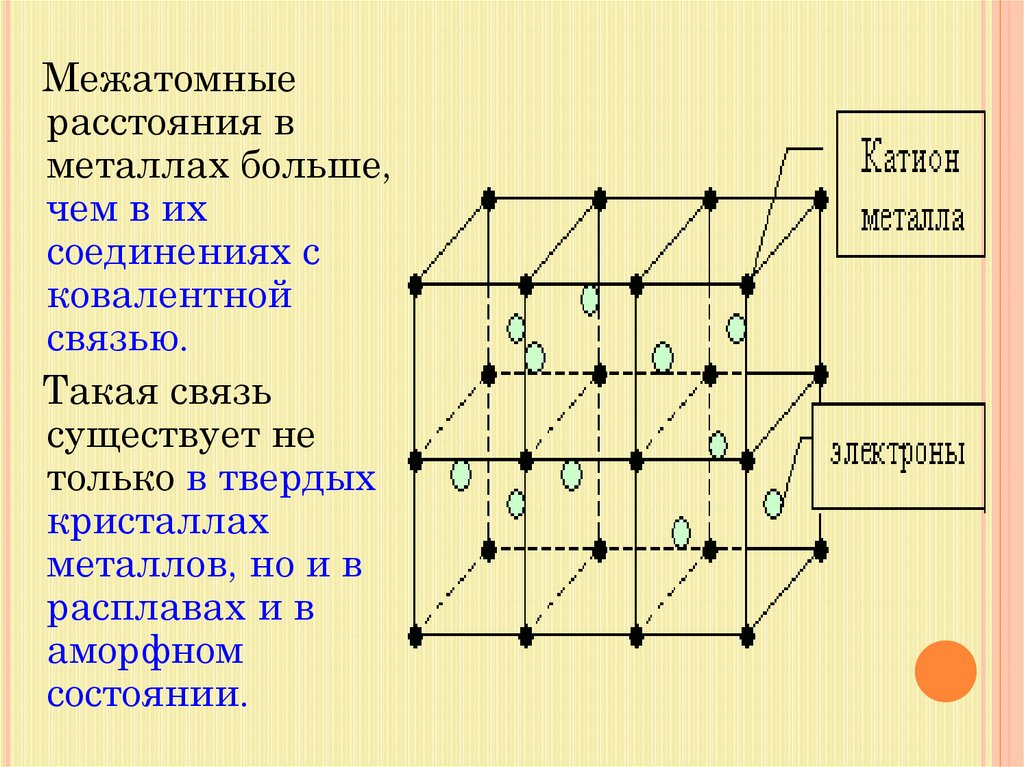
Межатомныерасстояния в
металлах больше,
чем в их
соединениях с
ковалентной
связью.
Такая связь
существует не
только в твердых
кристаллах
металлов, но и в
расплавах и в
аморфном
состоянии.
28. Особенности металлической связи
ОСОБЕННОСТИМЕТАЛЛИЧЕСКОЙ СВЯЗИ
Металлическую связь образуют элементы,
атомы которых на внешнем уровне имеют мало
валентных электронов по сравнению с общим
числом внешних энергетически близких орбиталей.
1.
2.
3.
Валентные электроны из-за небольшой энергии ионизации
слабо удерживаются в атоме.
Электроны, осуществляющие связь, обобществлены
(«электронный газ») и перемещаются по всему куску
металла, в целом электронейтрального.
Металлическая связь характерна для металлов в твердом и
жидком состоянии.
29.
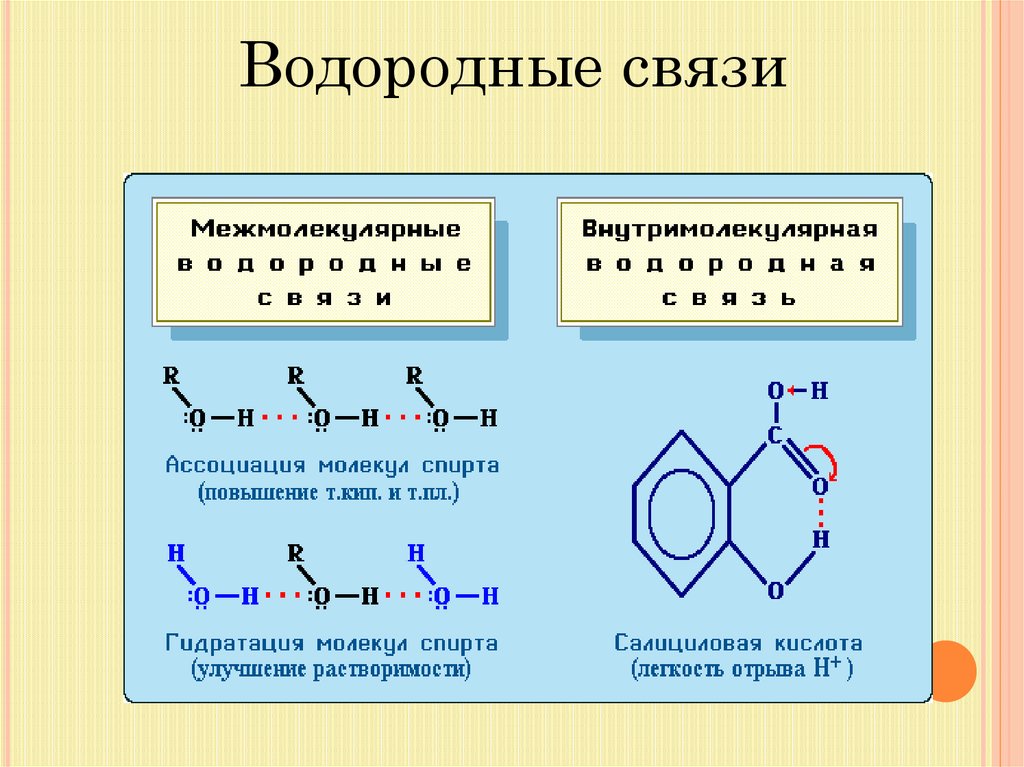
Водородные связи30.
Водородные связи (Н-связи)• Атом водорода, связанный с сильно электроотрицательным
элементом (азотом, кислородом, фтором и др.), испытывает
недостаток электронов и поэтому способен взаимодействовать с
неподеленной парой электронов другого электроотрицательного
атома этой же или другой молекулы. В результате возникает
водородная связь, которая графически обозначается тремя
точками:
• Эта связь значительно слабее других химических связей (энергия
ее образования 10-40 кДж/моль) и в основном определяется
электростатическим и донорно-акцепторным
взаимодействиями.
31.
Влияние водородных связейна свойства веществ
• Водородные связи влияют на физические (т.кип. и т.пл.,
летучесть, вязкость, спектральные характеристики) и
химические (кислотно-основные) свойства соединений.
• Межмолекулярные водородные связи обусловливают
ассоциацию молекул, что приводит к повышению температур
кипения и плавления вещества.
Например, этиловый спирт C2H5OH, способный к ассоциации,
кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не
образующий водородных связей, лишь при -24°С
(молекулярная формула обоих веществ С2Н6О).
• Образование Н-связей с молекулами растворителя
способствует улучшению растворимости. Так, метиловый и
этиловый спирты (CH3OH, С2Н5ОН), образуя Н-связи с
молекулами воды, неограниченно в ней растворяются.
32. Особенности водородной химической связи.
ОСОБЕННОСТИ ВОДОРОДНОЙХИМИЧЕСКОЙ СВЯЗИ.
1. Связь относится к межмолекулярной; возможно
образование внутримолекулярной водородной связи.
2. Водородная связь более слабая.
3. Водородная связь оказывает влияние на свойства
вещества, т.к. нужна дополнительная энергия для
разрыва водородной связи.
Силы Ван-дер-Вальса – это слабые только межмолекулярные
связи, проявляющиеся на расстоянии, превосходящем частицы.
По своим свойствам ненасыщенные и ненаправленные.
Они действуют в веществах, находящихся в жидком и газообразном
состоянии, а также между молекулами в молекулярных кристаллах.
33.
Кристаллическая решётка вещества – этоструктура с геометрически упорядоченным расположением частиц (атомы,
молекулы либо ионы) в определённых точках пространства.
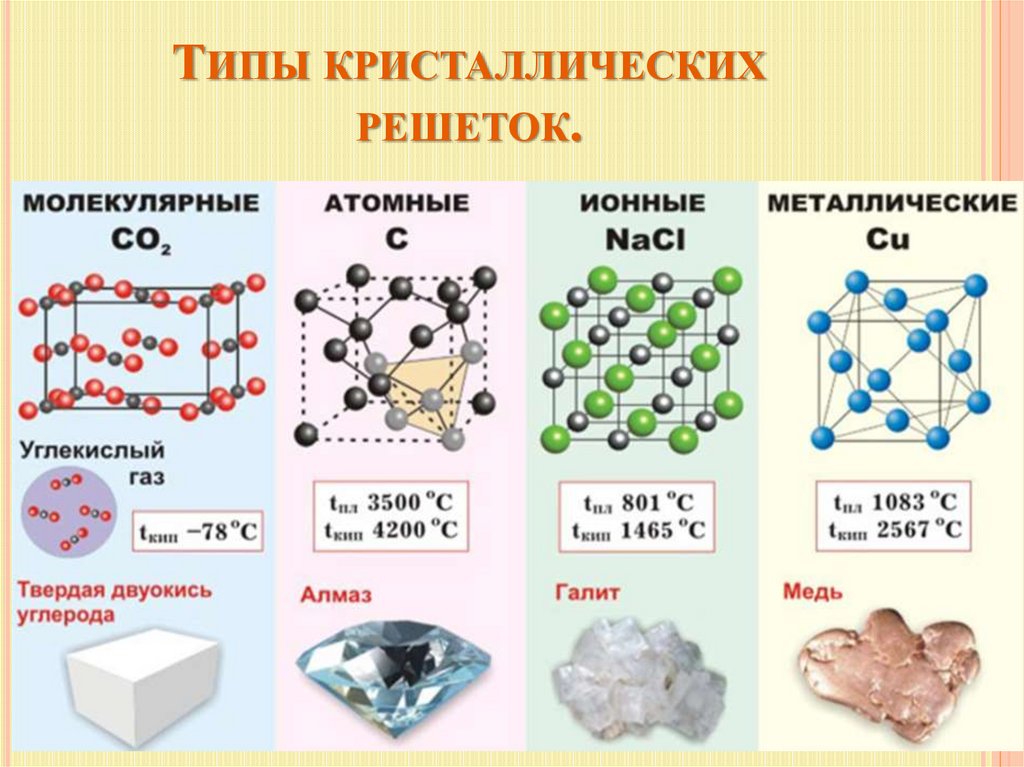
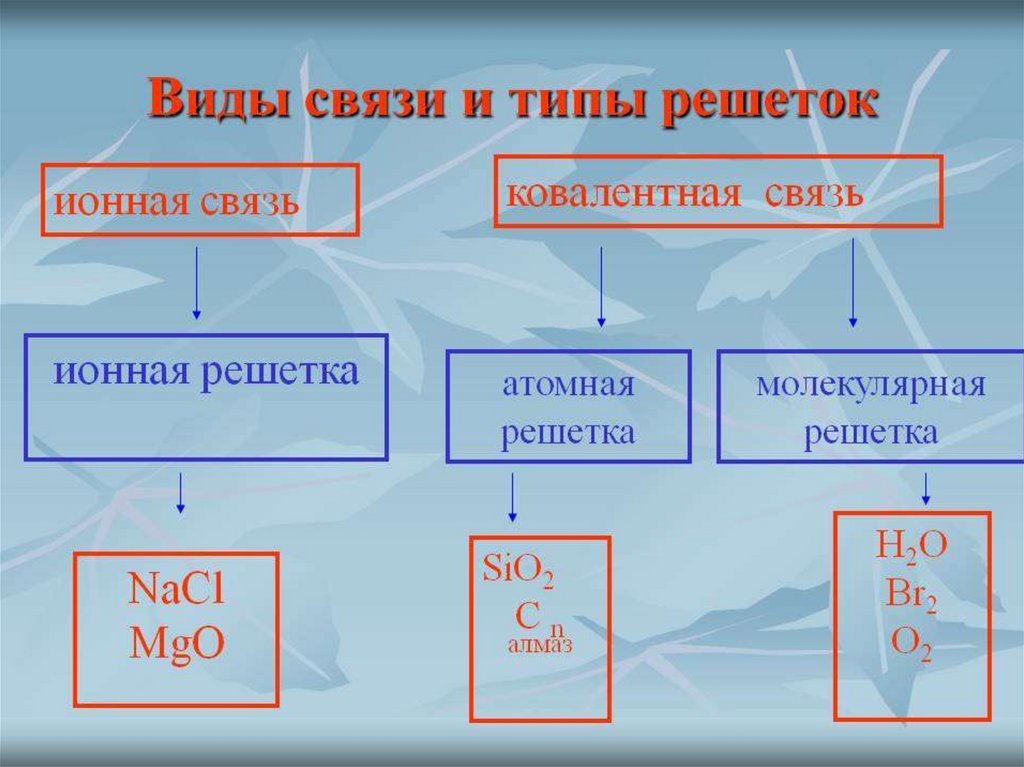
Кристаллическая решётка бывает четырех типов:
металлическая, молекулярная, атомная, ионная.
Типы решеток определяются в соответствии с видом частиц,
расположенных в их узлах, а также характером связей между ними.
Кристаллическая решётка называется молекулярной в том
случае, если в ее узлах располагаются молекулы. Они
связаны между собой межмолекулярными сравнительно
слабыми силами, называемые ван-дер-ваальсовыми,
однако сами атомы внутри молекулы соединяются
существенно более сильной ковалентной связью
(полярной либо неполярной). Молекулярная
кристаллическая решетка свойственна хлору, твердому
водороду, двуокиси углерода и другим веществам,
являющимся газообразными при обычной температуре.
34.
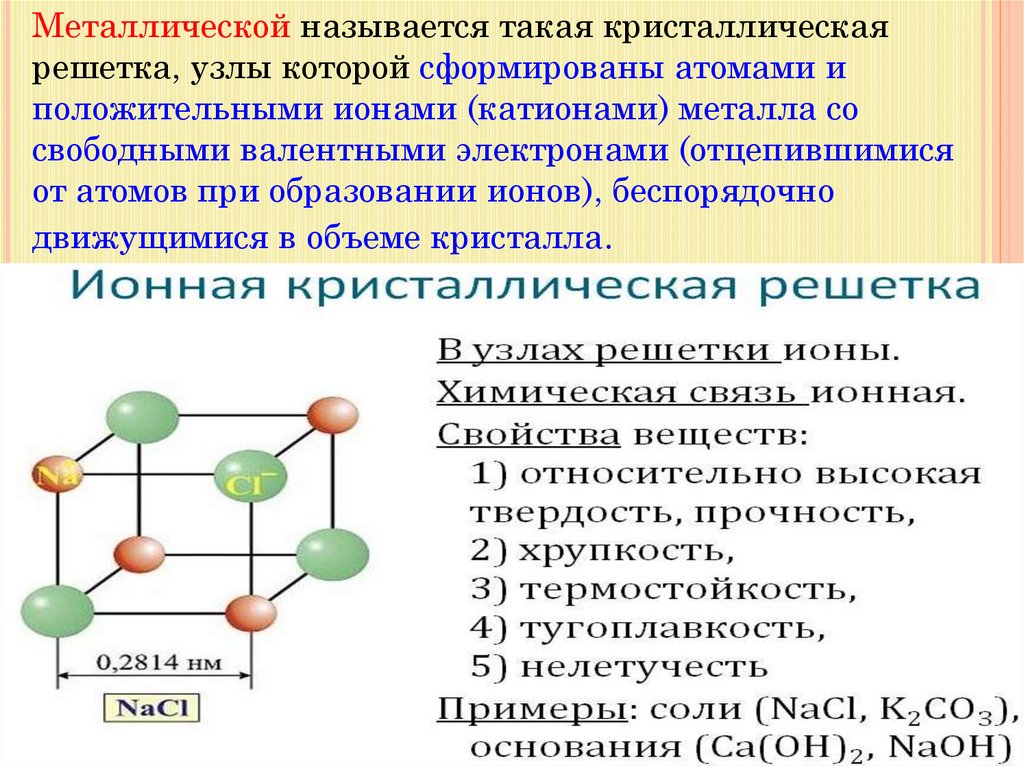
Металлической называется такая кристаллическаярешетка, узлы которой сформированы атомами и
положительными ионами (катионами) металла со
свободными валентными электронами (отцепившимися
от атомов при образовании ионов), беспорядочно
движущимися в объеме кристалла.
35. Типы кристаллических решеток.
ТИПЫ КРИСТАЛЛИЧЕСКИХРЕШЕТОК.
36.
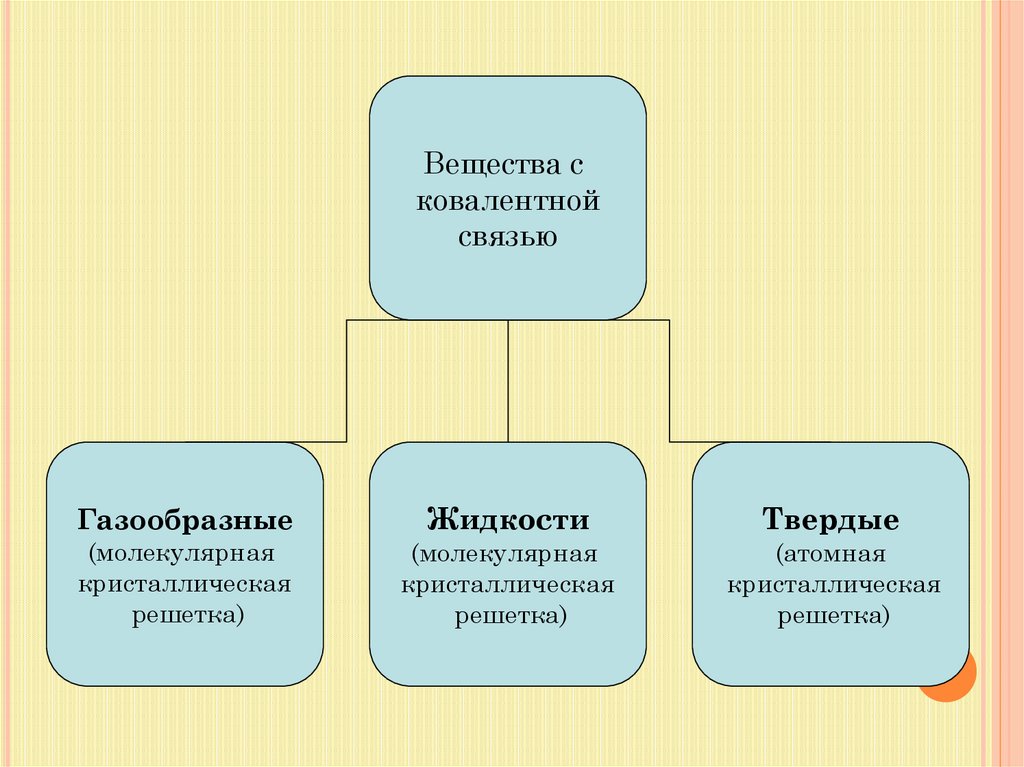
Вещества сковалентной
связью
Газообразные
(молекулярная
кристаллическая
решетка)
Жидкости
Твердые
(молекулярная
кристаллическая
решетка)
(атомная
кристаллическая
решетка)


















 Химия
Химия








