Похожие презентации:
Радиохимия аспиранты
1. РАДИОХИМИЯ
Северский технологический институт НИЯУ МИФИРАДИОХИМИЯ
Макасеев Ю.Н.
доцент, к.х.н.
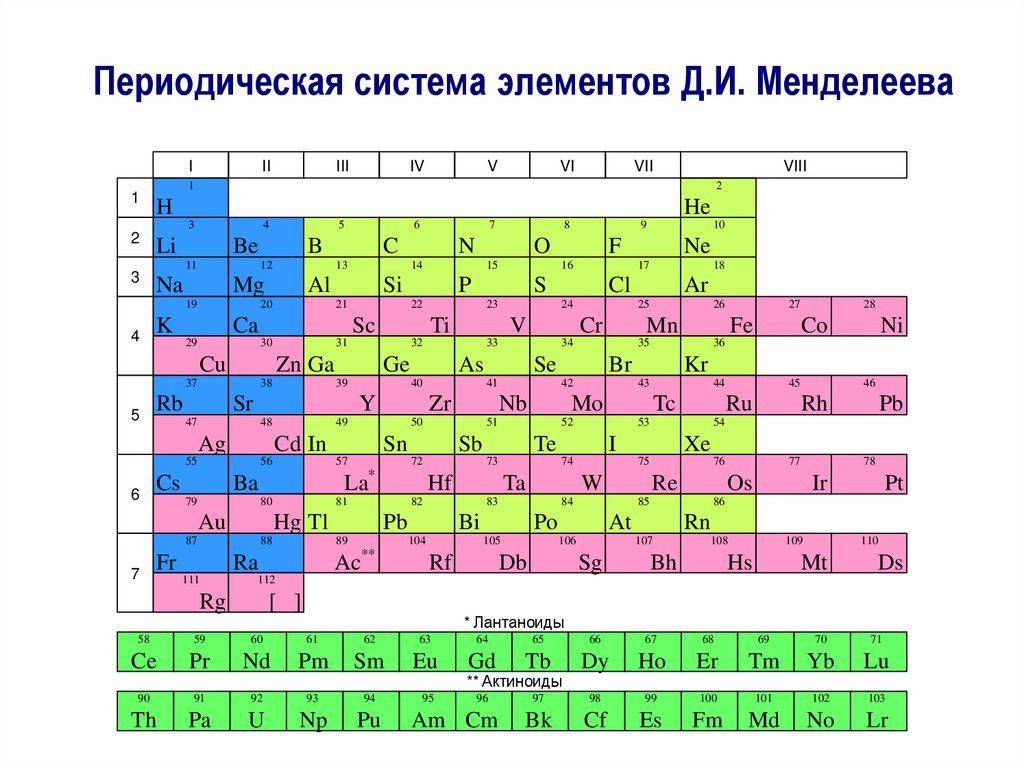
2. Периодическая система элементов Д.И. Менделеева
III
III
IV
V
VI
VII
VIII
1
1
2
H
He
3
2
4
Li
Be
11
3
Na
30
31
Cu
Zn Ga
37
5
Rb
39
48
49
Sr
Ag
Cs
*
Ba
79
La
80
Au
Hg Tl
87
7
88
Fr
Bi
104
**
Ra
111
Pb
89
Ac
Rf
Db
77
78
Os
Ir
Pt
Rn
107
Sg
Pb
86
At
106
Rh
76
85
Po
105
46
Xe
Re
84
45
Ru
75
W
83
Ni
54
I
74
Ta
82
Tc
53
Te
Hf
81
44
Mo
73
Co
Kr
43
52
Sb
72
Fe
28
36
Br
Nb
27
Mn
42
51
Sn
57
26
35
Se
Zr
50
Cd In
56
Cr
41
Ar
25
34
As
40
Y
47
55
6
Ge
38
V
33
18
Cl
24
Ti
32
Ne
17
S
23
10
F
16
P
22
Sc
9
O
15
Si
21
8
N
14
Al
20
Ca
29
7
C
13
Mg
K
6
B
12
19
4
5
108
Bh
109
Hs
110
Mt
Ds
112
Rg
[ ]
* Лантаноиды
58
59
60
61
62
63
Ce
Pr
Nd
Pm
Sm
Eu
90
91
92
93
94
95
Th
Pa
U
Np
Pu
64
65
66
67
68
69
70
71
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
96
97
98
99
100
101
102
103
Bk
Cf
Es
Fm
Md
No
Lr
** Актиноиды
Am Cm
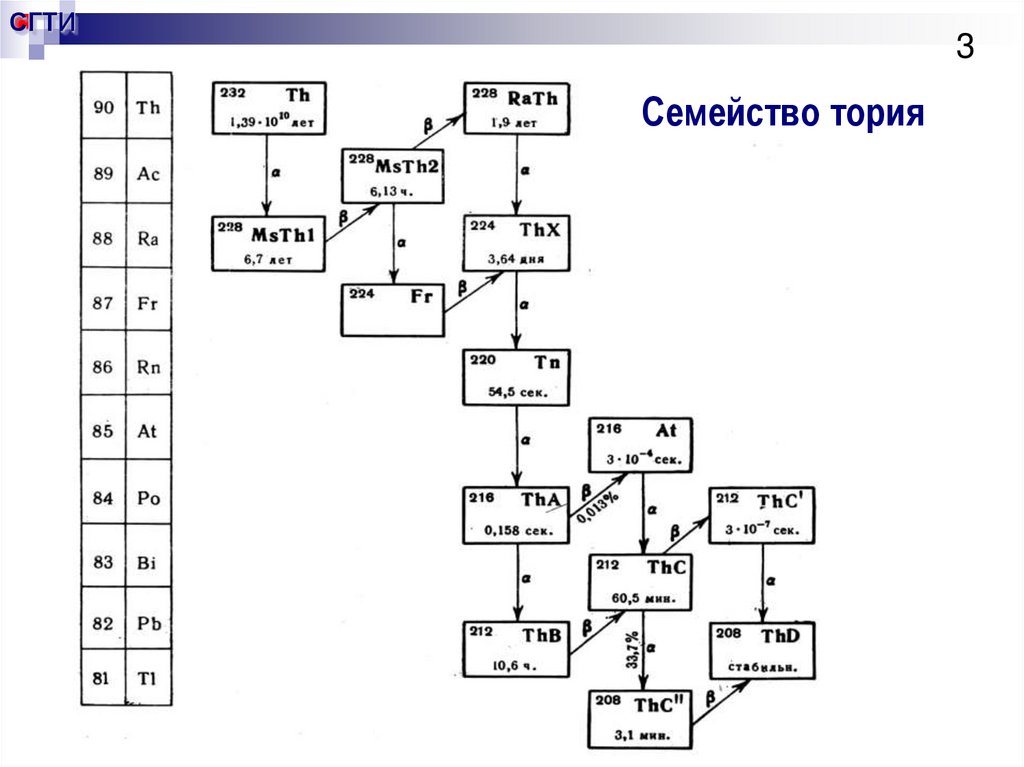
3. Семейство тория
СГТИ3
Семейство тория
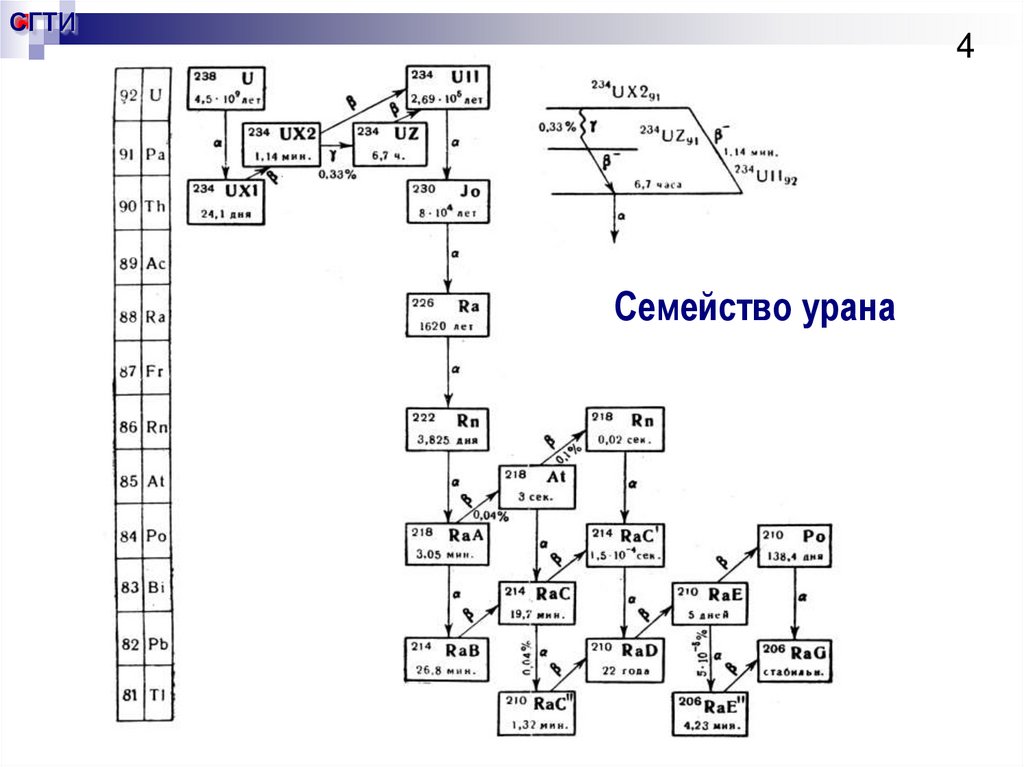
4. Семейство урана
СГТИ4
Семейство урана
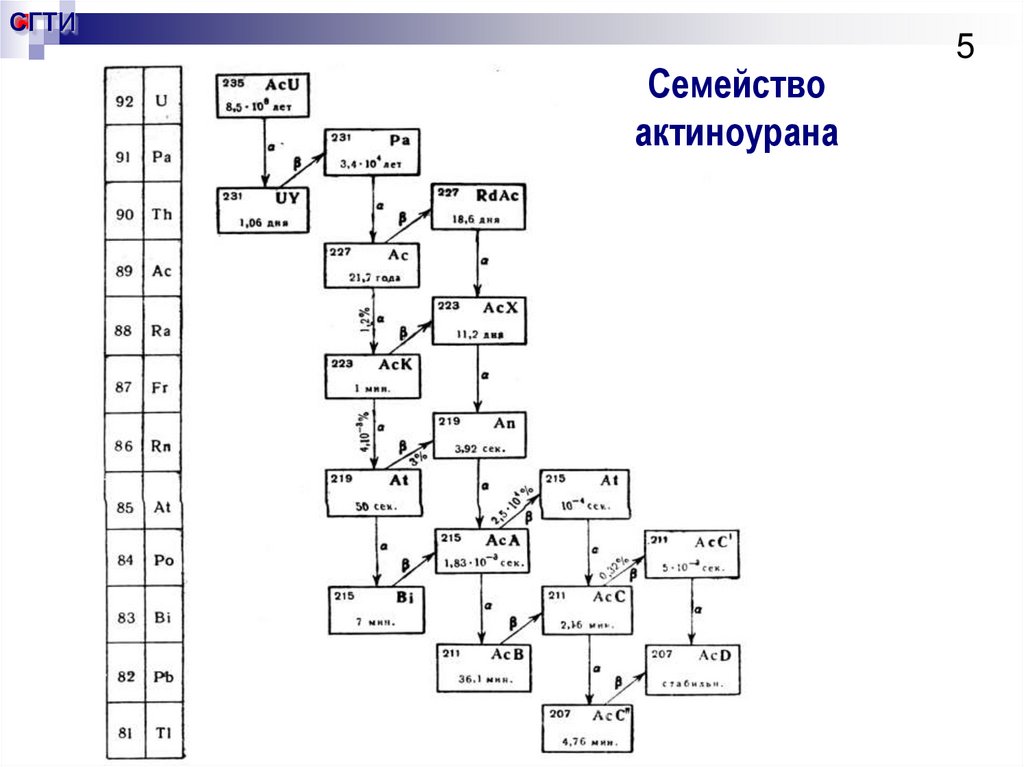
5. Семейство актиноурана
СГТИСемейство
актиноурана
5
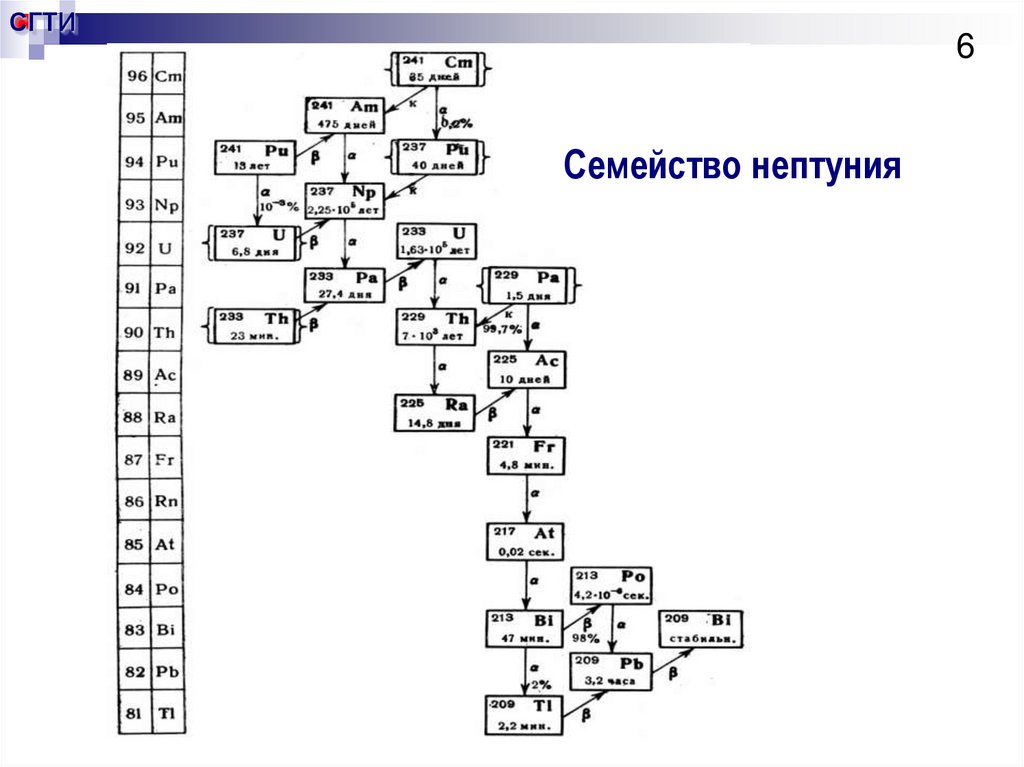
6. Семейство нептуния
СГТИ6
Семейство нептуния
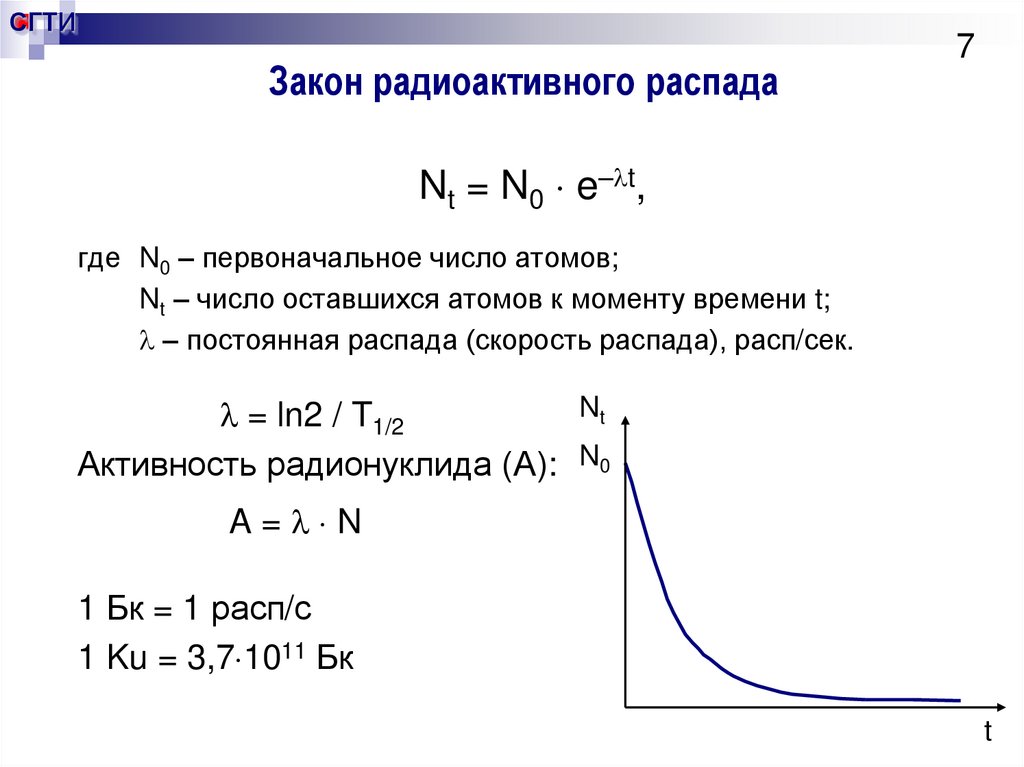
7. Закон радиоактивного распада
СГТИЗакон радиоактивного распада
7
Nt = N0 e– t,
где N0 – первоначальное число атомов;
Nt – число оставшихся атомов к моменту времени t;
– постоянная распада (скорость распада), расп/сек.
Nt
= ln2 / T1/2
Активность радионуклида (А): N0
A= N
1 Бк = 1 расп/с
1 Ku = 3,7 1011 Бк
t
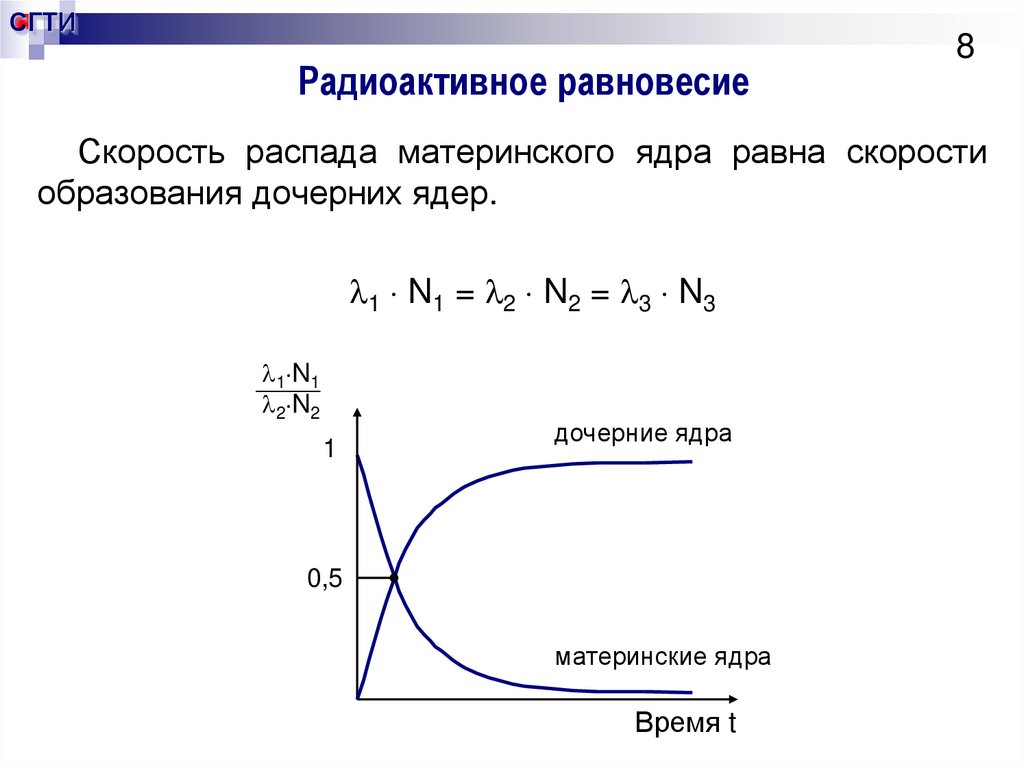
8. Радиоактивное равновесие
СГТИРадиоактивное равновесие
8
Скорость распада материнского ядра равна скорости
образования дочерних ядер.
1 N1 = 2 N2 = 3 N3
1 N1
2 N2
1
дочерние ядра
0,5
материнские ядра
Время t
9. Пример
СГТИПример
9
Вычислить активность 1 г. U-238, свободного от
продуктов распада и сравнить с активностью такого же
количества Pu-239.
Решение:
Аu=λu·Nu;
λu=Ln2/T1/2=0,693/4,5·109·365·24·3600=4,88·10-18 расп/с;
Nu=m·NA/M=1·6,023·1023/238=2,53·1021 ядер;
Au=λu·Nu=4,88·10-18·2,53·1021=1,23·104 расп/с;
10. Пример
СГТИПример
A Pu Pu NPu ;
Pu
ln 2
0,693
9 10 13 расп с ;
T1 / 2 24400 365 24 3600
m
1
6,023 10 23
6,023 10 23 2,52 10 21;
M
239
Pu NPu 2,27 10 9 расп с 2,27 10 9 Бк.
NPu
A Pu
Ответ:
A 239 Pu A 238 U
10
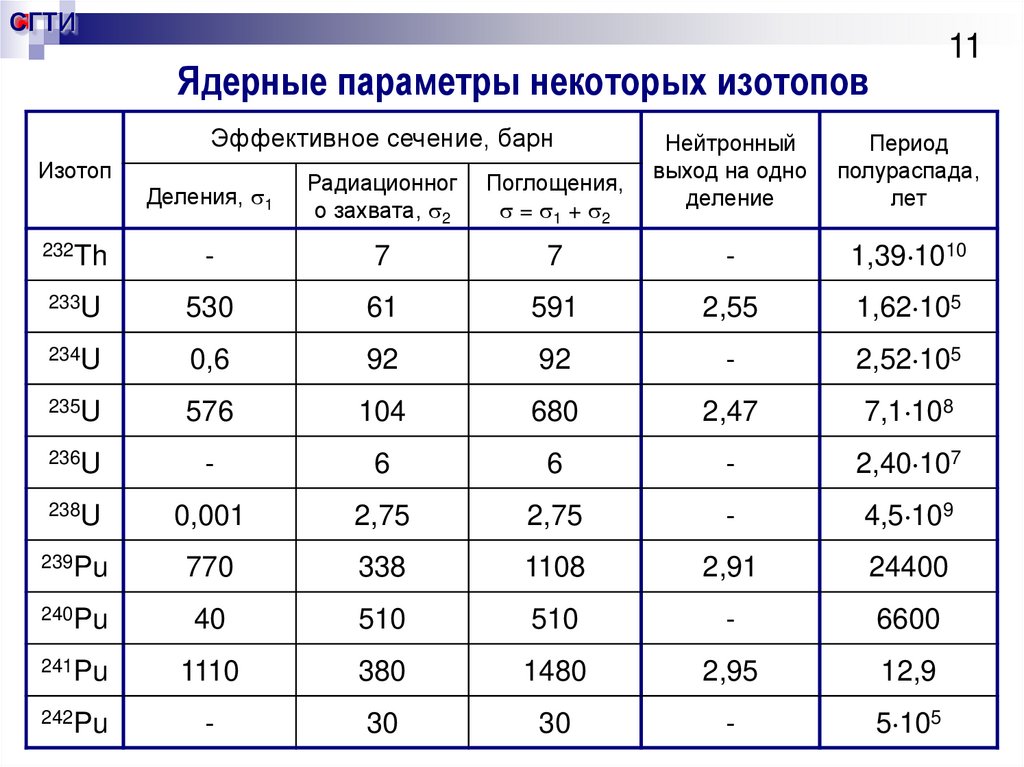
11. Ядерные параметры некоторых изотопов
СГТИ11
Ядерные параметры некоторых изотопов
Эффективное сечение, барн
Изотоп
Нейтронный
выход на одно
деление
Период
полураспада,
лет
Деления, 1
Радиационног
о захвата, 2
Поглощения,
= 1 + 2
232Th
-
7
7
-
1,39 1010
233U
530
61
591
2,55
1,62 105
234U
0,6
92
92
-
2,52 105
235U
576
104
680
2,47
7,1 108
236U
-
6
6
-
2,40 107
238U
0,001
2,75
2,75
-
4,5 109
239Pu
770
338
1108
2,91
24400
240Pu
40
510
510
-
6600
241Pu
1110
380
1480
2,95
12,9
242Pu
-
30
30
-
5 105
12. Эффективное сечение захвата
СГТИЭффективное сечение захвата
12
Эффективное сечение захвата может меняться от 10–20
до 10–32 см2/атом.
Истинная площадь сечения ядра лежит в интервале от
3 10–24 до 3 10–25 см2.
Поэтому за единицу эффективного сечения захвата
принимают 1 барн, равный 10–24 см2/атом.
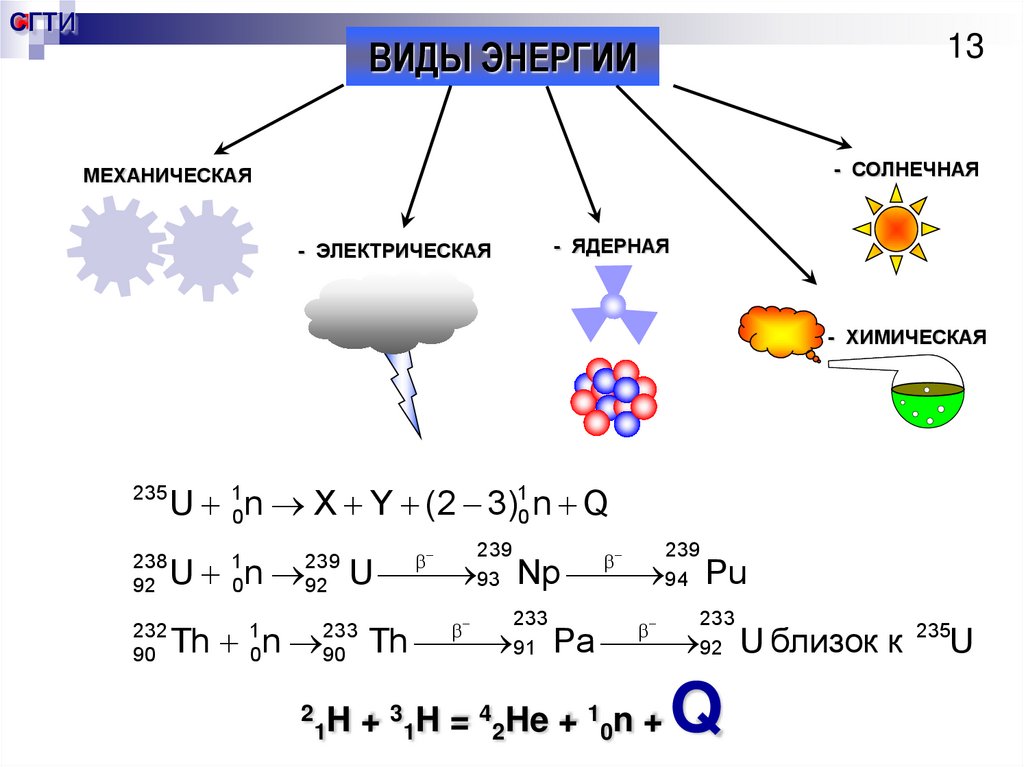
13.
СГТИ13
ВИДЫ ЭНЕРГИИ
- СОЛНЕЧНАЯ
МЕХАНИЧЕСКАЯ
- ЯДЕРНАЯ
- ЭЛЕКТРИЧЕСКАЯ
- ХИМИЧЕСКАЯ
235
U 10n X Y (2 3)10 n Q
238
92
U n
232
90
Th n
1
0
239
92
1
0
2
U
233
90
1H
239
93
Th
Np
233
91
239
94
Pa
+ 31H = 42He + 10n +
Pu
233
92
Q
U близок к
235
Uи
23
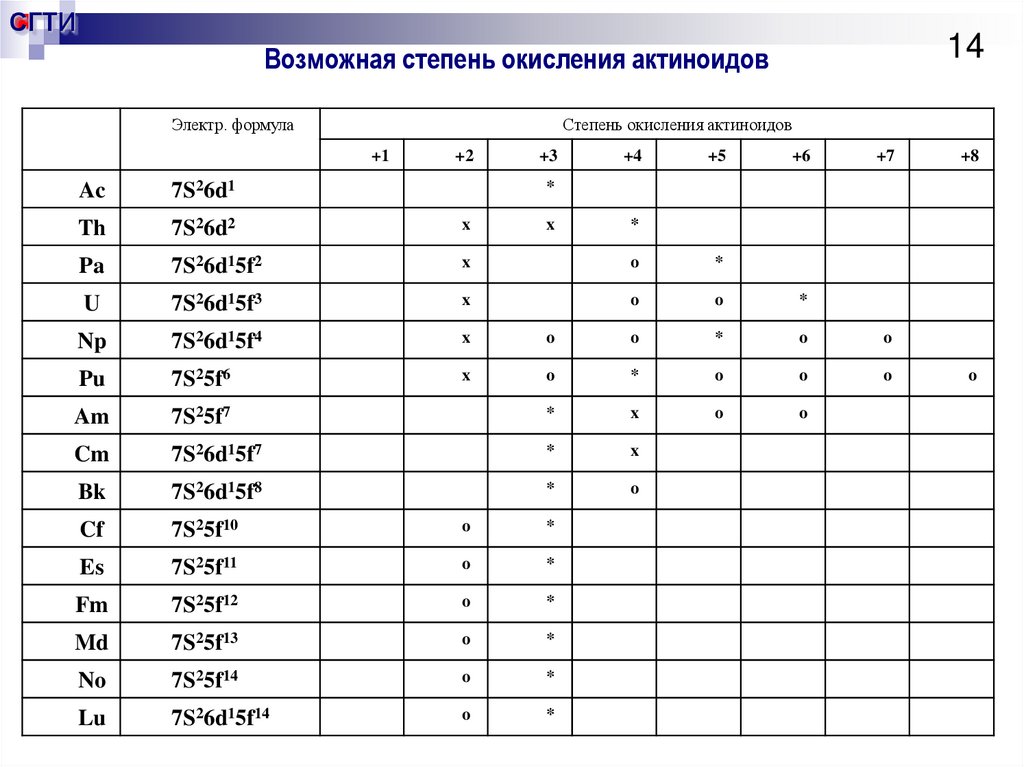
14. Возможная степень окисления актиноидов
СГТИ14
Возможная степень окисления актиноидов
Электр. формула
Степень окисления актиноидов
+1
+2
+3
+4
+5
+6
+7
Ac
7S26d1
Th
7S26d2
x
Pa
7S26d15f2
x
o
*
U
7S26d15f3
x
o
o
*
Np
7S26d15f4
x
o
o
*
o
o
Pu
7S25f6
x
o
*
o
o
o
Am
7S25f7
*
x
o
o
Cm
7S26d15f7
*
x
Bk
7S26d15f8
*
o
Cf
7S25f10
o
*
Es
7S25f11
o
*
Fm
7S25f12
o
*
Md
7S25f13
o
*
No
7S25f14
o
*
Lu
7S26d15f14
o
*
+8
*
x
*
o
15. Общая характеристика актиноидных элементов
СГТИОбщая характеристика актиноидных элементов
15
1 Наиболее устойчивая степень окисления растет от Ac до U, а затем падает до Am, т.к. уровни 5f и 6d близки
друг к другу по энергии. Поэтому переход электронов с 5f на 6d уровень происходит легко и в образовании хим. связи
принимают участие и 5f электроны наряду с 6d и 7s электронами.
Начиная с Am характерна степень окисления +3 и является наиболее устойчивой. Это связано с тем, что с
увеличением атомного номера участие 5f электронов становится все более затруднительным из-за возрастания
энергии перехода электрона с 5f на 6d подуровень.
2 Ионные радиусы актиноидов уменьшаются с увеличением порядкового номера элемента. Причем наибольшее
уменьшение у первых f-элементов, а затем замедляется, что приводит к уменьшению различия в химических
свойствах у более тяжелых f-элементов и затрудняет их разделение. Актиноидное сжатие происходит вследствие
роста числа электронов на одном f-подуровне, приводящее к росту силы притяжения их к ядру атома.
3 С уменьшением ионного радиуса степень гидролиза и способность к комплексообразованию растет, т.к. для
ионов с одинаковым зарядом уменьшение ионного радиуса приводит к росту удельного заряда.
4 Порядок вымывания катионов из хроматографической колонки следующий: сначала тяжелые, затем легкие.
Это обусловлено тем, что тяжелые ионы гидрмтированы в большей степени, чем ионы легких актиноидов и доступ
ионов с большим гидратированным радиусом в поры зерна ионита затруднен и связь с ионитом становится менее
прочная, чем у ионов легких актиноидов.
5 Экстракционная способность с нейтральными экстрагентами изменяется неоднозначно для актиноидов в
различном валентном состоянии. Например:
Для 3-х валентных актиноидов коэффициенты распределения D возрастают с ростом Z.
Для 4-х валентных актиноидов D возрастают с ростом Z.
Для 6-х валентных актиноидов D уменьшаются с ростом Z. (Разделение урана и плутония).
6 Для одного и того же элемента способность к комплексообразованию падает в ряду ионов U(+4) > UO2(+2) >
U(+3) > UO2(+).
7 Для актиноидов способность к комплексообразованию с лигандами имеет следующие закономерности:
Однозарядные
F- >NO3- >Cl->ClO4-;
[UO2F]- > [UO2NO3]- > [UO2Cl]- > [UO2ClO4]-;
Двухзарядные (CO3)2- > (C2O4)2-> (SO4)2-.
8 Характерны реакции окисления – восстановления, диспропорционирования и самовосстановления.
16. Химические и физико-химические свойства урана и его соединений
СГТИХимические и физико-химические свойства
урана и его соединений
Уран открыт Клапротом в 1789 году.
Известно 14 изотопов урана с массовыми числами от
227 до 240.
Изотопный состав природного урана:
U238 - 99,28%
U235 - 0,71%
α - радиоактивны
U234 - 0,006%
U234 – дочерний продукт распада изотопа U238
16
17. Уран металлический
СГТИУран металлический
t пл. = 1132 0С
t кип. = 3818 0С
d = 19,05 г/см3
Аллотропные модификации
α β 668 0С γ 774 0С
17
18. Химические свойства урана
СГТИХимические свойства урана
6s26p66d1 5 f3 7s2
U Г UГ n (Г Cl2 , F2 , Br2 , I)
700
UN, U2N3 , UN2
U N2
1800
UC, U2C3 , UC2
U C
500
US, U2S3 , US 2
U S
1000
UP
U P
18
19. Соединения урана
СГТИСоединения урана
Оксиды: UO, UO2, U3O8, UO3, UO4 · 2H2O
19
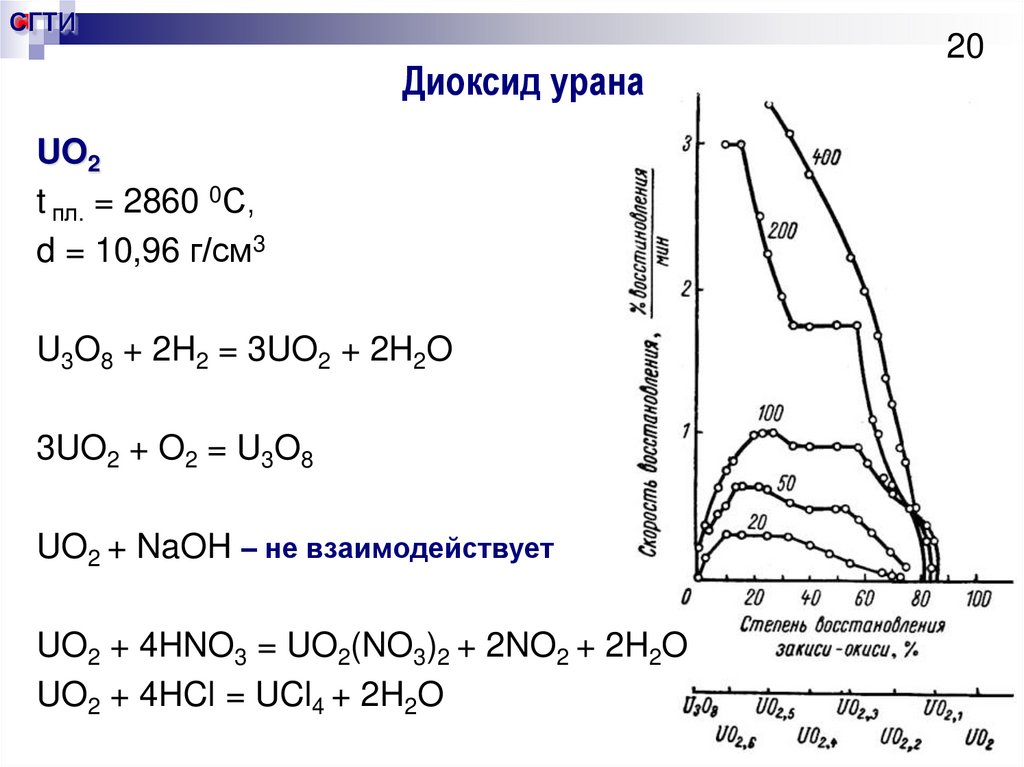
20. Диоксид урана
СГТИДиоксид урана
UO2
t пл. = 2860 0С,
d = 10,96 г/см3
U3O8 + 2H2 = 3UO2 + 2H2O
3UO2 + O2 = U3O8
UO2 + NaOH – не взаимодействует
UO2 + 4HNO3 = UO2(NO3)2 + 2NO2 + 2H2O
UO2 + 4HCl = UCl4 + 2H2O
20
21. Октаоксид триурана
СГТИОктаоксид триурана
U3O8 или UO2 · 2UO3 , или UO3 · U2O5
700
U3O8 14NH3 15H2O 2N2
9(NH4 )2 U2O7
Имеет 4 модификации α, β, γ, δ
U3O8 + O2 UO3
U3O8 + H2 UO2 + H2O
2U3O8+14HNO3 6UO2(NO3)2+7H2O+NO+NO2
U3O8+ 8HCl 2UO2Cl2 + UCl4 + 4H2O
21
22. Триоксид урана
СГТИТриоксид урана
UO3 имеет 6 кристаллических модификаций
550
UO 2 (NO3 )2 UO3 NO NO 2
550
2(UO 4 · 2H2O) 2UO 3 O 2 4H2O
600
6UO 3 2U3O8 O 2
550
2UO 3 2H2 2UO 2 2H2O
22
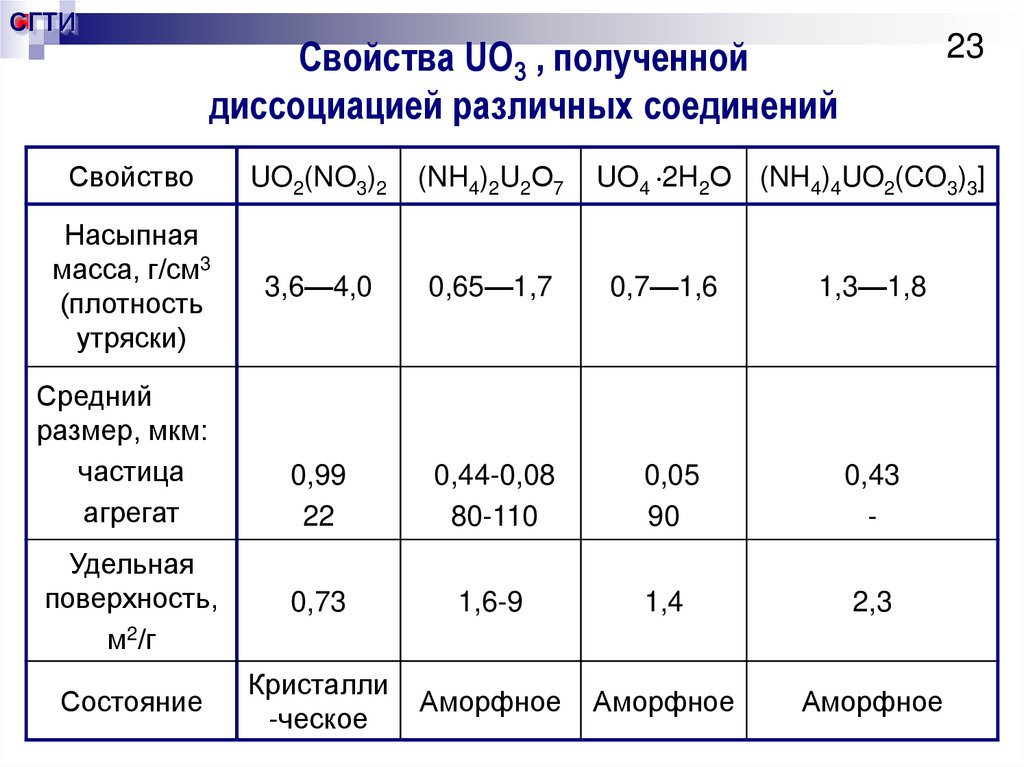
23. Свойства UO3 , полученной диссоциацией различных соединений
СГТИ23
Свойства UO3 , полученной
диссоциацией различных соединений
UO4 2H2О (NH4)4UO2(CO3)3]
Свойство
UO2(NO3)2
(NH4)2U2О7
Насыпная
масса, г/см3
(плотность
утряски)
3,6—4,0
0,65—1,7
0,7—1,6
1,3—1,8
0,99
22
0,44-0,08
80-110
0,05
90
0,43
-
Удельная
поверхность,
м2/г
0,73
1,6-9
1,4
2,3
Состояние
Кристалли
-ческое
Аморфное
Аморфное
Аморфное
Средний
размер, мкм:
частица
агрегат
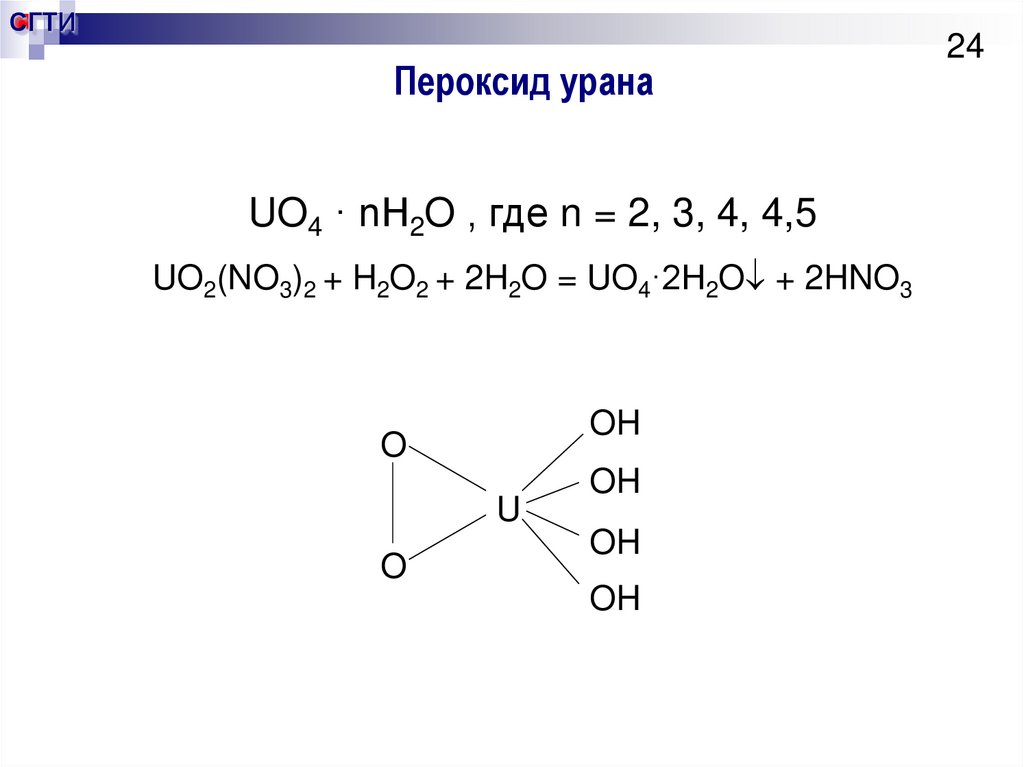
24. Пероксид урана
СГТИПероксид урана
UO4 · nH2O , где n = 2, 3, 4, 4,5
UO2(NO3)2 + H2O2 + 2H2O = UO4·2H2O + 2HNO3
OH
O
U
O
OH
OH
OH
24
25. Фториды урана
СГТИФториды урана
UF4 , UF6 (UF3 , U4F17 , U2F9 , UF5 )
0
960
C
пл
U(SO 4 )2 4HF 2,5H2O UF4 ·2,5H2O 2H2SO 4
UF4
t
HF
UF4 ·2,5H2O
UF4 2,5H2O
UO2 2HF UF4 2H2O
UF4 2Ca U 2CaF2
25
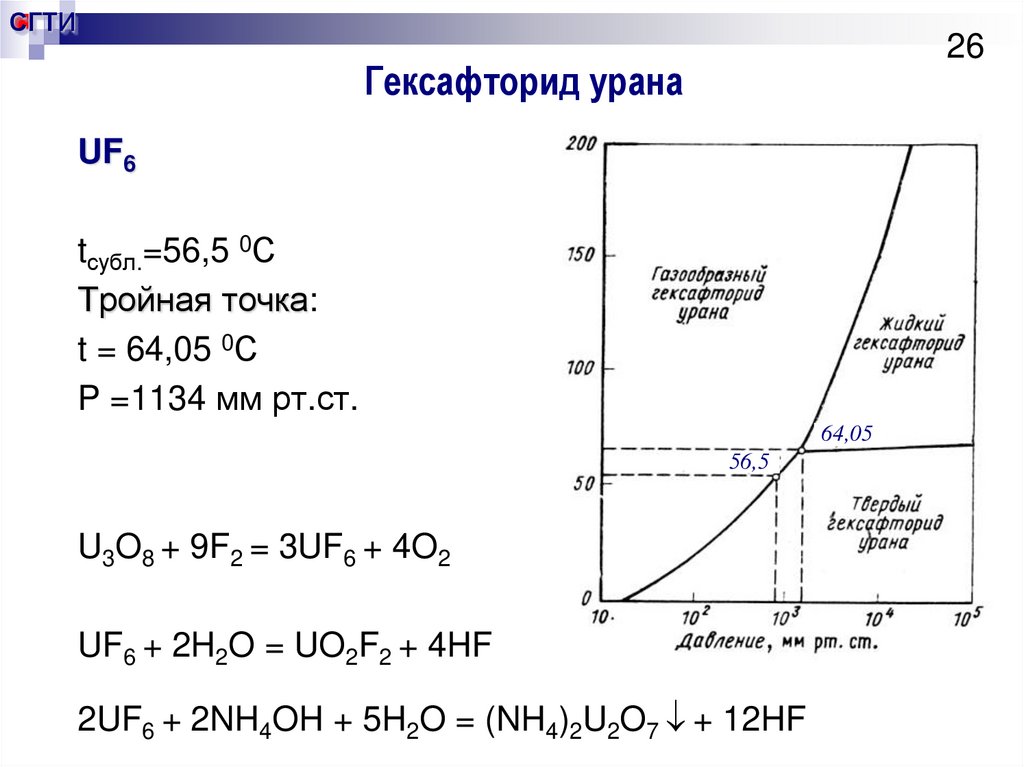
26. Гексафторид урана
СГТИ26
Гексафторид урана
UF6
tсубл.=56,5 0С
Тройная точка:
t = 64,05 0С
P =1134 мм рт.ст.
64,05
56,5
U3O8 + 9F2 = 3UF6 + 4O2
UF6 + 2H2O = UO2F2 + 4HF
2UF6 + 2NH4OH + 5H2O = (NH4)2U2O7 + 12HF
27. Водные растворы урана
СГТИВодные растворы урана
27
0,631B
-0,58 B
-0,063 B
U3
U4
UO2
UO22
В щелочной среде:
2,17 В
2,14 В
0,62 В
U
U(OH)3
U(OH)4
UO2 (OH)2
Получение уранатов:
2UO2(NO3)2 + 6NH4OH = (NH4)2U2O7 + 4NH4NO3 + 3H2O
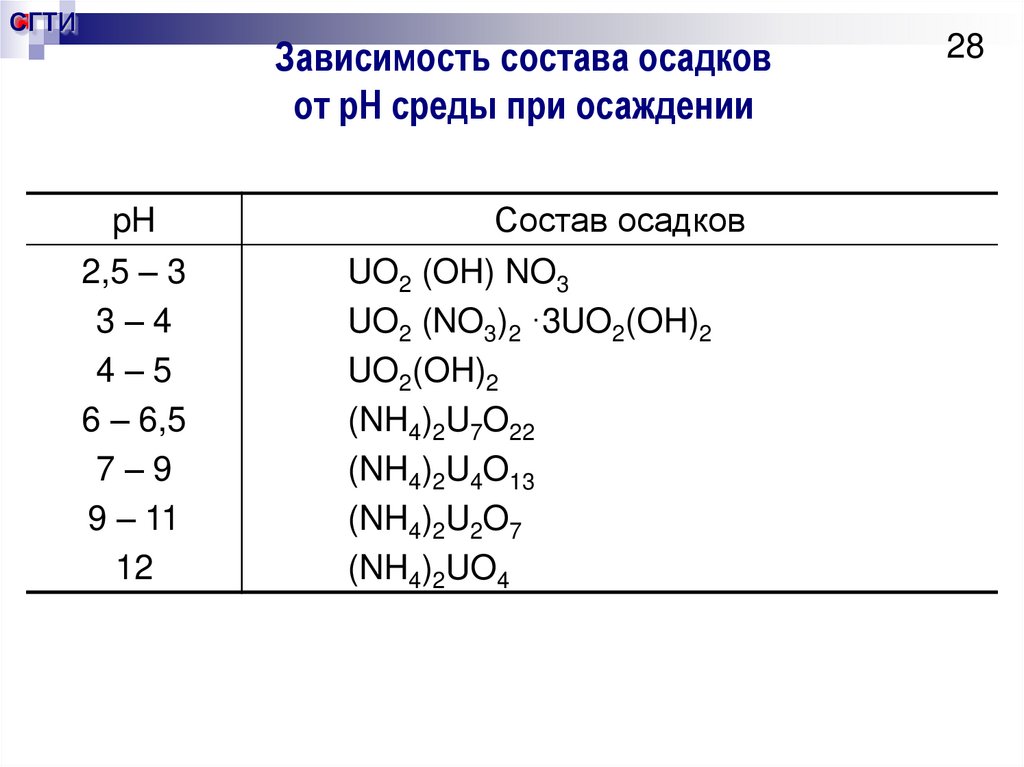
28. Зависимость состава осадков от pH среды при осаждении
СГТИЗависимость состава осадков
от pH среды при осаждении
pH
2,5 – 3
3–4
4–5
6 – 6,5
7–9
9 – 11
12
Состав осадков
UO2 (OH) NO3
UO2 (NO3)2 ·3UO2(OH)2
UO2(OH)2
(NH4)2U7O22
(NH4)2U4O13
(NH4)2U2O7
(NH4)2UO4
28
29. Соли уранила
СГТИСоли уранила
29
UO2(NO3)2·6H2O
UO2CO3 - труднорастворим
UO2C2O4·3H2O – растворимость (0,47%)
UO2 (CH3 COO)2 – растворимость (7,7 г в 100 г воды)
U3O8 + 3H2SO4 + 1,5O2 = 3UO2SO4 + 3H2O
UO2(NO3)2 + (NH4)2CO3 = UO2CO3 + 2NH4NO3
UO2(NO3)2 + 3(NH4)2CO3 = (NH4)4UO2(CO3)3 + 2NH4NO3
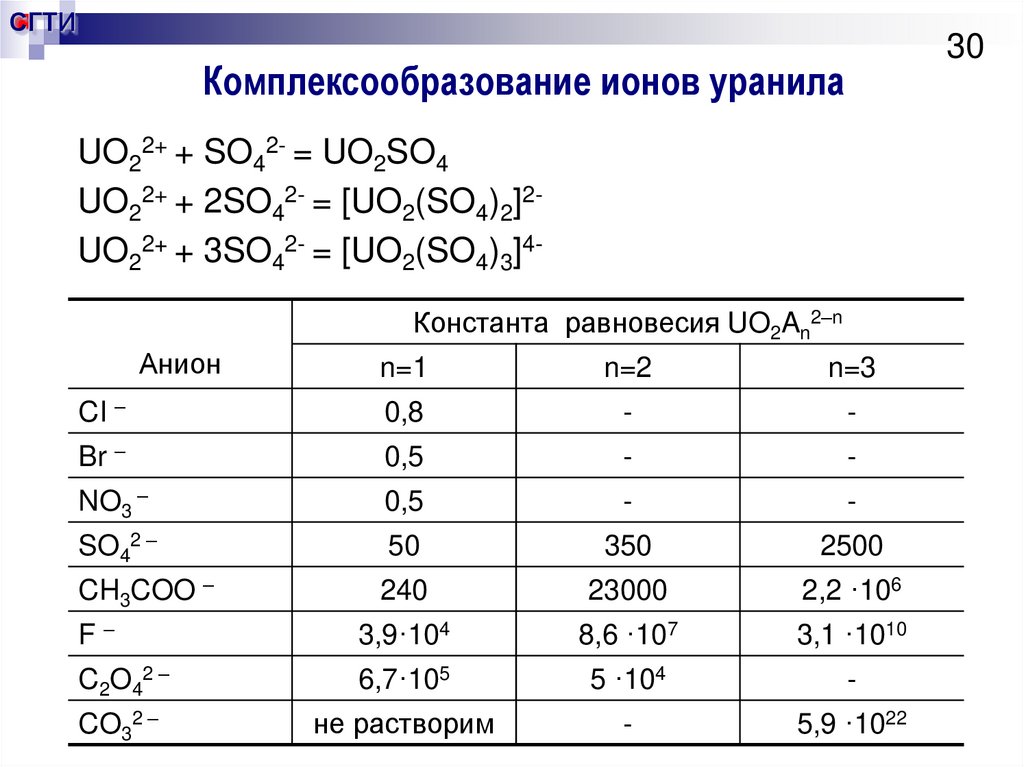
30. Комплексообразование ионов уранила
СГТИ30
Комплексообразование ионов уранила
UO22+ + SO42- = UO2SO4
UO22+ + 2SO42- = [UO2(SO4)2]2UO22+ + 3SO42- = [UO2(SO4)3]4Константа равновесия UO2An2–n
Анион
n=1
n=2
n=3
CI –
0,8
-
-
Br –
0,5
-
-
NO3 –
0,5
-
-
SO42 –
50
350
2500
CH3COO –
240
23000
2,2 ·106
F–
3,9·104
8,6 ·107
3,1 ·1010
C 2O42 –
6,7·105
5 ·104
-
CO32 –
не растворим
-
5,9 ·1022
31. Методы выделения и разделения радионуклидов
СГТИМетоды выделения и разделения радионуклидов
1 Соосаждение
2 Ионообменный
3 Хроматографический
4 Экстракционный
5 Электрохимический
31
32. Соосаждение
СГТИСоосаждение
32
Это процесс, в котором микрокомпонент увлекается из раствора
макрокомпонентом – носителем.
Применяется в том случае, когда микрокомпонент не может
образовать самостоятельную твердую фазу (осадок), т.к. его
концентрация
меньше
произведения
растворимости
трудно
растворимого соединения.
Носители – изотопные (207PbSO4 – 212PbSO4);
- неизотопные, сходные по хим. свойствам
(изоморфные) или несходные по хим. свойствам, но образуют осадки
с развитой поверхностью (Fe(OH)3) Пример).
По механизму соосаждение может происходить путем:
- сокристаллизации, при котором микрокомпонент распределяется
по всему объему твердой фазы, участвуя в построении
кристаллической решетки макрокомпонента;
- адсорбции микрокомпонента на поверхности твердой фазы
макрокомпонента, включая внутреннюю поверхность.
33. Изоморфизм
СГТИИзоморфизм
33
Изоморфными являются одинаковые по химическому составу вещества,
сходных по свойствам химических элементов, которые кристаллизуются в
одинаковых или близких формах.
1 Смешанные кристаллы I рода (изоморфизм замещения), например, KCLRbCL.
Необходимые условия:
- близость размеров атомов;
- одинаковая симметрия элементов;
- близкие поляризующие свойства ионов.
2 Смешанные кристаллы II рода (изоморфизм внедрения). Атомы второго
компонента занимают пустоты в решетке первого. Пример, атомы углерода в
решетке железа.
3 Смешанные кристаллы, образующиеся заполнением пространства
(имеет место изоморфизм I и II рода).
Пример: YF3+CaF2.
У СаF2 атомы фтора находятся в пустотах между атомами Ca. Y замещает
атомы Сa, а третий атом фтора занимает октаэдрические пустоты.
34.
СГТИ34
4 Гриммовские смешанные кристаллы - изоморфизм по ГриммуГольдшмидту (Г-Г). Возникновение участков кристаллов одного
компонента в другом.
Пример: Ba(Sr,Pb)SO4 – K (NH4,Na)MnO4.
5 Аномально смешанные кристаллы, которые не отвечают правилу
(Г-Г). Имеет место неограниченная смешиваемость за счет
образования
комплексных
соединений
компонентов
с
кристаллической решеткой, сходной с решеткой макрокомпонента.
Пример: NH4CL-FeCL3; RaF2-LaF3.
35. ЗАКОН ХЛОПИНА
СГТИЗАКОН ХЛОПИНА
35
Если два вещества являются изоморфными или
изодиморфными и концентрация одного из них мала, то
распределение микрокомпонента между кристаллической
фазой и раствором при постоянной температуре и
давлении есть величина постоянная и не зависит от
количественного соотношения фаз.
К=Скрист./Сраст.
где Скрист.- конц-я микрокомпонента в кристалле;
Сраст.- конц-я микрокомпонента в растворе.
36. Уравнение Гендерсона и Кречека
СГТИУравнение Гендерсона и Кречека
36
Более удобное для практических целей выражение:
х/у=Д(Х-х)/(У-у);
где:
Х и х - кол-во микрокомпонента в системе и в кристалле;
У и у - кол-во макрокомпонента в системе и в кристалле;
Д – коэффициент кристаллизации, который зависит от:
температуры; состава жидкой фазы; состава твердой фазы;
присутствия второго микрокомпонента.
Пример: выделить актиний из продуктов распада тория-232
методом сокристаллизации.
2 Изменение состава ж.ф. не влияет на Д, если соотношение
макро- и микрокомпонентов остается постоянным. Если же
соотношение падает, то Д растет.
3 Плавное изменение состава тв.ф. путем плавного введения в
раствор второго макрокомп-та, изоморфно кристаллизующегося с
первым, приводит к плавному изменению Д. При резком изменении
состава тв. Ф. Д меняется скачкообразно. Пример: сокристаллизация
Ra с Sr(NO3)2
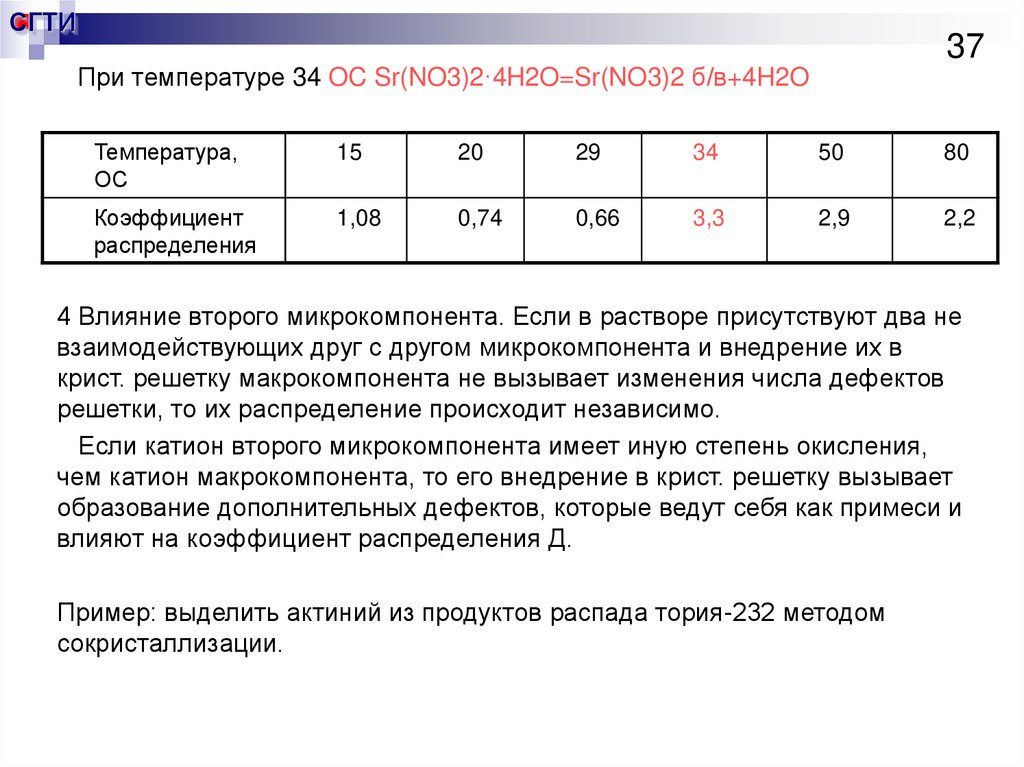
37.
СГТИ37
При температуре 34 OC Sr(NO3)2·4H2O=Sr(NO3)2 б/в+4H2O
Температура,
ОС
15
20
29
34
50
80
Коэффициент
распределения
1,08
0,74
0,66
3,3
2,9
2,2
4 Влияние второго микрокомпонента. Если в растворе присутствуют два не
взаимодействующих друг с другом микрокомпонента и внедрение их в
крист. решетку макрокомпонента не вызывает изменения числа дефектов
решетки, то их распределение происходит независимо.
Если катион второго микрокомпонента имеет иную степень окисления,
чем катион макрокомпонента, то его внедрение в крист. решетку вызывает
образование дополнительных дефектов, которые ведут себя как примеси и
влияют на коэффициент распределения Д.
Пример: выделить актиний из продуктов распада тория-232 методом
сокристаллизации.
38. АДСОРБЦИЯ
СГТИ38
АДСОРБЦИЯ
Виды адсорбции: молекулярная и ионная.
Молекулярная адсорбция происходит за счет сил Ван-дер-Ваальса
и подчиняется законам газовой адсорбции:
C
Ленгмюра:
x x
C A
x -равновесная концентрация вещества в сорбенте;
Х- концентрация вещества в сорбенте в состоянии насыщения;
С- концентрация сорбируемого вещества в растворе;
А- константа для данного сорбента при данной температуре.
x A y
Фрейндлиха:
х и у - равновесные концентрации сорбируемого
сорбенте и в растворе;
А и n- опытные коэффициенты.
n
вещества в
39. АДСОРБЦИЯ
СГТИАДСОРБЦИЯ
39
Ионная адсорбция происходит на: мелкокристаллических осадках,
активированном угле, ионообменных материалах, частицах суспензий
и коллоидов, силикагелях и гидроксидах многовалентных металлов
(Fe(ОН)3, AL(ОН)3). Причем последние адсорбируют катионы путем
первичной обменной адсорбции за счет ионов Fe(3+) и Al(3+).
Адсорбция ионов на полярных кристаллах
Механизм обмена на полярных кристаллах связан с образованием
двойного электрического слоя (ДЭС). Например, рассмотрим
адсорбцию изотопа 212Pb на осадках AgI в присутствии избытка или
в растворе.
Первичная адсорбция происходит путем обмена между ионами
кристалла и раствора или путем потенциалобразования на
поверхности свободного заряда. Вторичная адсорбция – это
ионообменное или электростатическое взаимодействие во внешнем
слое. Иногда происходит Ван-дер-Ваальсовое взаимодействие,
например, обмен молекул воды с ионами обоих знаков зарядов.
40.
СГТИКристалл
Раствор
Поверхность
раздела
40
Избыток AgNO3
Ag+
I-
I-
Ag+
Ag+
I-
I-
Ag+
Избыток KI
NO3-
NO3Ag+
NO3NO3-
Ag+
Ag+
I-
I-
Ag+
Ag+
I-
I-
Ag+
I-
I
II
K+
I-
K+
K+
K+
кристалл
I
II
III
IV
III
IV
I – кристалл ; II – внутренняя часть двойного слоя (потенциал
определяющая адсорбция); III – внутренняя часть двойного слоя (вторичная
адсорбция ионов); IV – внешний диффузионный слой, который также
характеризует вторичную адсорбцию
Рисунок 1 – Образование ДЭС на кристалле AgI в условиях избытка
одноименного иона в растворе.
Подобным образом осуществляется разделение урана и тория на
адсорбционном носителе .
41. Пример разделения на адсорбционном носителе
СГТИПример разделения на адсорбционном носителе
Пример: Отделить Th-234 от U-238 и продуктов его распада
методом адсорбционного соосаждения на гидроксиде железа.
UO2(NO3)2 + 3(NH4)2CO3 = (NH4)4UO2(CO3)3 + 2NH4NO3
3(NH4)2CO3 +3H2O=3(HCO3)-+ 6NH4 + 3OHFeCl3 + 3OH- = Fe(OH)3+3ClTh4+ + OH- = ?
41
42. Экстракционный метод разделения
СГТИЭкстракционный метод разделения
42
Метод основан на различии в устойчивости констант
комплексообразования разделяемых радионуклидов с
экстрагентом.
Классификация экстрагентов:
Нейтральные алкилфосфаты (спирты, кетоны, эфиры,
альдегиды);
Кислые алкилфосфаты (катионообменники);
Амины (анионообменники).
Кислые и нейтральные алкилфосфаты являются
производными фосфорной кислоты.
Экстракционная способность производных фосфорной
кислоты усиливается в ряду сверху - вниз в каждом
столбце
таблицы,
что
связано
с
удалением
электроотрицательных атомов кислорода из левой части
молекулы экстрагента.
43. Фосфорорганические экстрагенты
СГТИ43
Фосфорорганические экстрагенты
Фосфорная
кислота
HO HO - P = O
HO -
Фосфористая
кислота
HO HO - P = O
H -
Фосфорноватист
ая кислота
H H-P=O
HO -
Фосфиноксин
H H-P=O
H -
Моноалкилфос
фат
R1 O HO - P = O
HO -
Алкилфосфонат
R1 HO - P = O
HO -
Алкилфосфинат
R1 H-P=O
HO -
Алкилфосфинок
сид
R1 H-P=O
H -
Диалкилфосфат
R1 O R2 O - P = O
HO -
Моноалкилфосфонат
R1 R2 O - P = O
HO -
Диалкилфосфин
ат
R1 R2 - P = O
HO -
Диалкилфосфин
оксид
R1 R2 - P = O
H -
Триалкилфосфат
R1 O R2 O - P = O
R3 O -
Диалкилалкилфосфонат
R1 R2 O - P = O
R3 O -
Моноалкилдиал
килфосфинат
R1 R2 - P = O
R3 O -
Триалкилфосфи
ноксид
R1 R2 - P = O
R3 -
44. Механизмы экстракции различными классами экстрагентов
СГТИ44
Механизмы экстракции различными классами экстрагентов
1) экстракция нейтральными экстрагентами
UO 22 2NO3 2ТБФ UO 2 ( NO3 ) 2 2ТБФ
ТБФ
С4H9O C4H9O - P = O
C4H9O R1O
R1O
R1O
P
O
UO2(NO3)2
O
P
R1O
R1O
R1O
Для нейтральных ФОС характерно
наличие высокого дипольного момента
молекул. Значительная
электроотрицательность
фосфорильного
.
атома кислорода объясняет большую
склонность таких соединений
координироваться с катионами металлов
с образованием экстрагирующихся
соединений. Координация происходит
благодаря донорно-акцепторному
взаимодействию с участием свободной
пары электронов фосфорильного атома
кислорода;
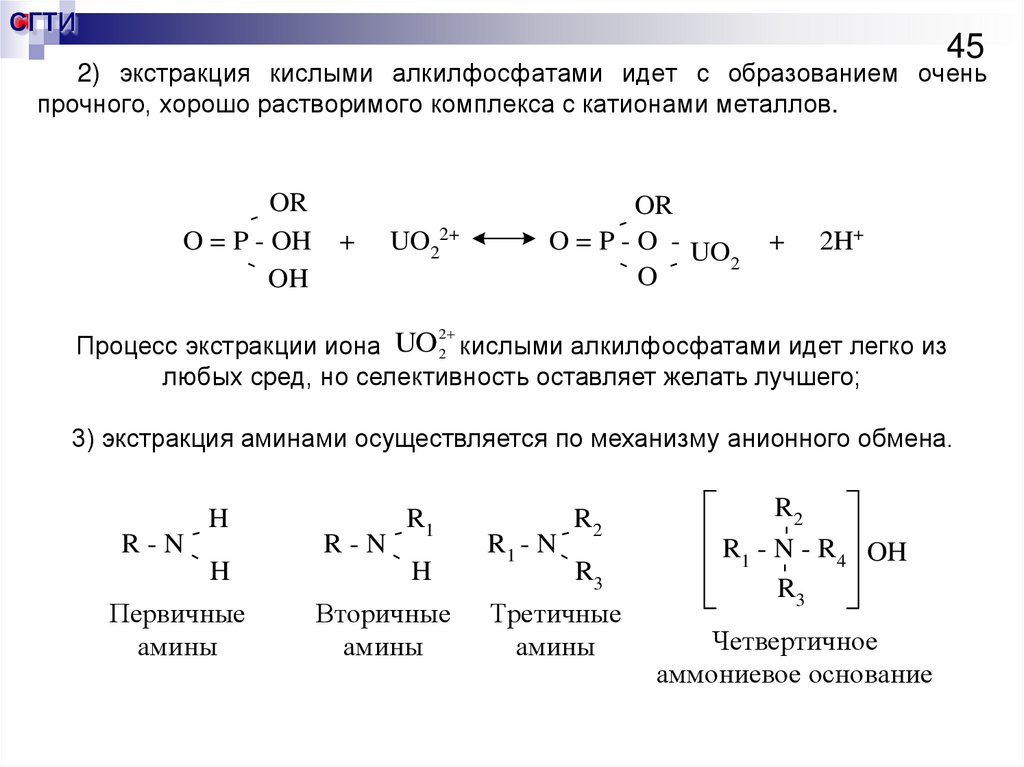
45.
СГТИ45
2) экстракция кислыми алкилфосфатами идет с образованием очень
прочного, хорошо растворимого комплекса с катионами металлов.
OR
O = P - OH
OH
+
UO22+
OR
O = P - O - UO
2
O -
+
2H+
2
Процесс экстракции иона UO 2 кислыми алкилфосфатами идет легко из
любых сред, но селективность оставляет желать лучшего;
3) экстракция аминами осуществляется по механизму анионного обмена.
H
Первичные
амины
H
Вторичные
амины
R1 - N--
R2
R3
Третичные
амины
R2
-
R - N --
R1
R1 - N - R4 OH
R3
-
R - N --
H
Четвертичное
аммониевое основание
46. Экстракция аминами
СГТИЭкстракция аминами
46
NH 3 HCl NH 4 Cl
NH 3 HCl NH 4 Cl
R 3 N H 2SO 4 (R 3 NH ) 2 SO 4
(R 3 NH) 2 SO4 [UO 2 (SO4 ) 2 ]2 (R 3 NH) 2 UO 2 (SO4 ) 2 SO24
(R 3 NH ) 2 SO 4 UO 2SO 4 (R 3 NH ) 2 UO 2 (SO 4 ) 2
(R 3 NH ) 2 SO 4 UO 2SO 4 (R 3 NH ) 2 UO 2 (SO 4 ) 2
Экстракция аминами протекает в течение нескольких секунд и
только тогда, когда водная фаза содержит ионы Н+. Важную роль при
экстракции играет вода. Происходит ее вытеснение из внутренней
координационной сферы экстрагента по мере его насыщения.
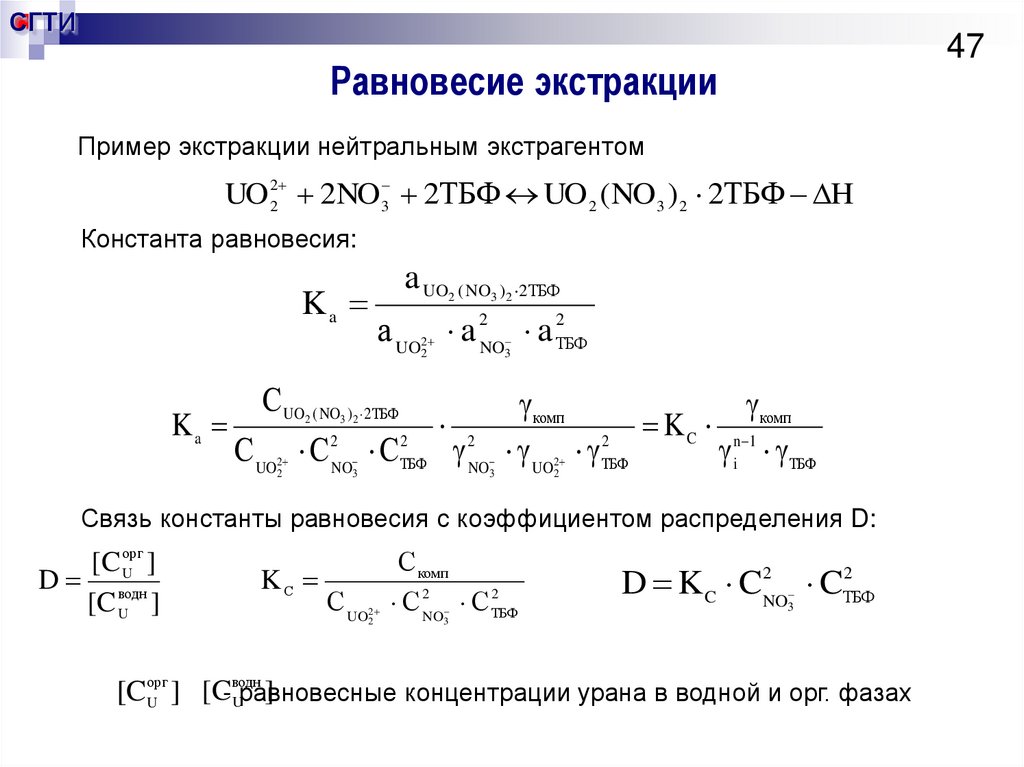
47. Равновесие экстракции
СГТИ47
Равновесие экстракции
Пример экстракции нейтральным экстрагентом
UO 22 2NO3 2ТБФ UO 2 ( NO3 ) 2 2ТБФ H
Константа равновесия:
Ka
a UO ( NO ) 2 ТБФ
2
3 2
2
а UO a 2NO a ТБФ
2
2
Ka
С UO ( NO ) 2ТБФ
2
3 2
С UO С NO С
2
2
2
3
2
ТБФ
3
2NO
3
комп
комп
K C n 1
2
UO ТБФ
i ТБФ
2
2
Связь константы равновесия с коэффициентом распределения D:
[C орг
]
U
D водн
[C U ]
KС
С UO
2
2
С комп
2
С 2NO С ТБФ
3
2
D K C C2NO CТБФ
3
водн
[
C
]
[Cорг
]
Uравновесные концентрации урана в водной и орг. фазах
U
48. Факторы, влияющие на коэффициент распределения урана
СГТИ48
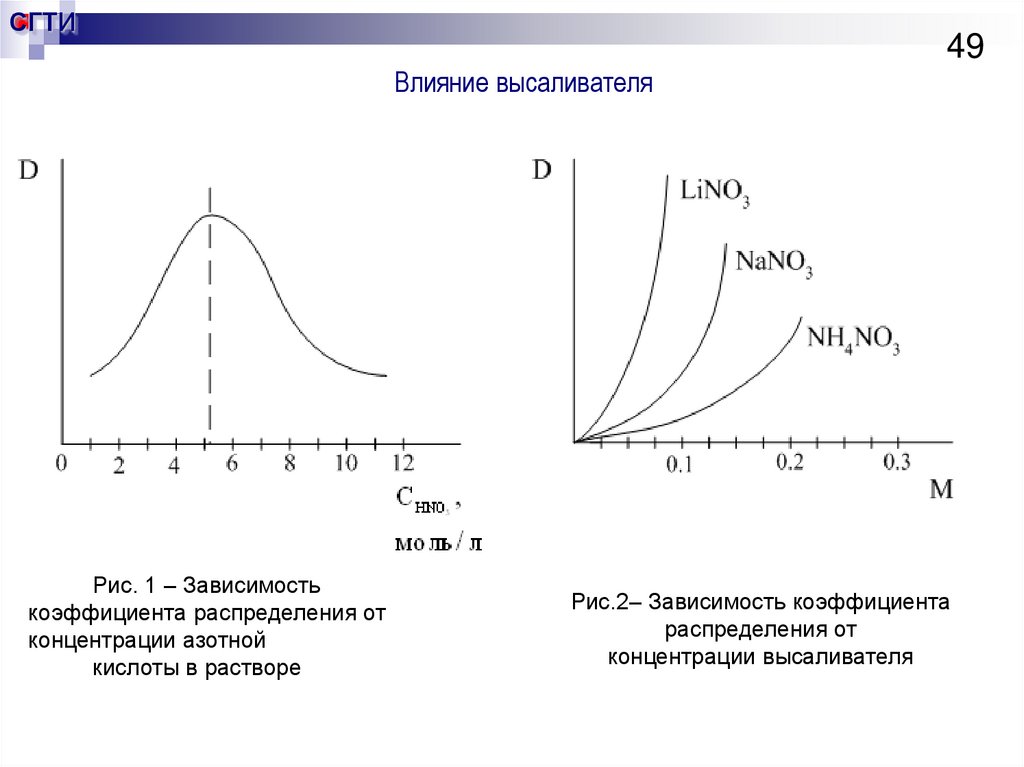
Факторы, влияющие на коэффициент распределения урана
Так как процесс экзотермический, то повышение температуры будет
смещать равновесие в сторону исходных веществ и ухудшать экстракцию что
касается давления, то оно не влияет на систему не содержащую
газообразных продуктов. При увеличении концентрации одноименных ионов
коэффициент распределения D увеличивается в квадратичной зависимости.
Также коэффициент распределения увеличивается с увеличением
концентрации экстрагента в органическом растворе. Несмотря на то, что
коэффициент распределения возрастает с увеличением концентрации ТБФ,
на практике работают с растворами 30-40% ТБФ с целью увеличения
разности плотностей водной и органической фаз, уменьшения вязкости и
таким образом ускорения самой медленной стадии – расслаиванию.
49. Влияние высаливателя
СГТИ49
Влияние высаливателя
Рис. 1 – Зависимость
коэффициента распределения от
концентрации азотной
кислоты в растворе
Рис.2– Зависимость коэффициента
распределения от
концентрации высаливателя
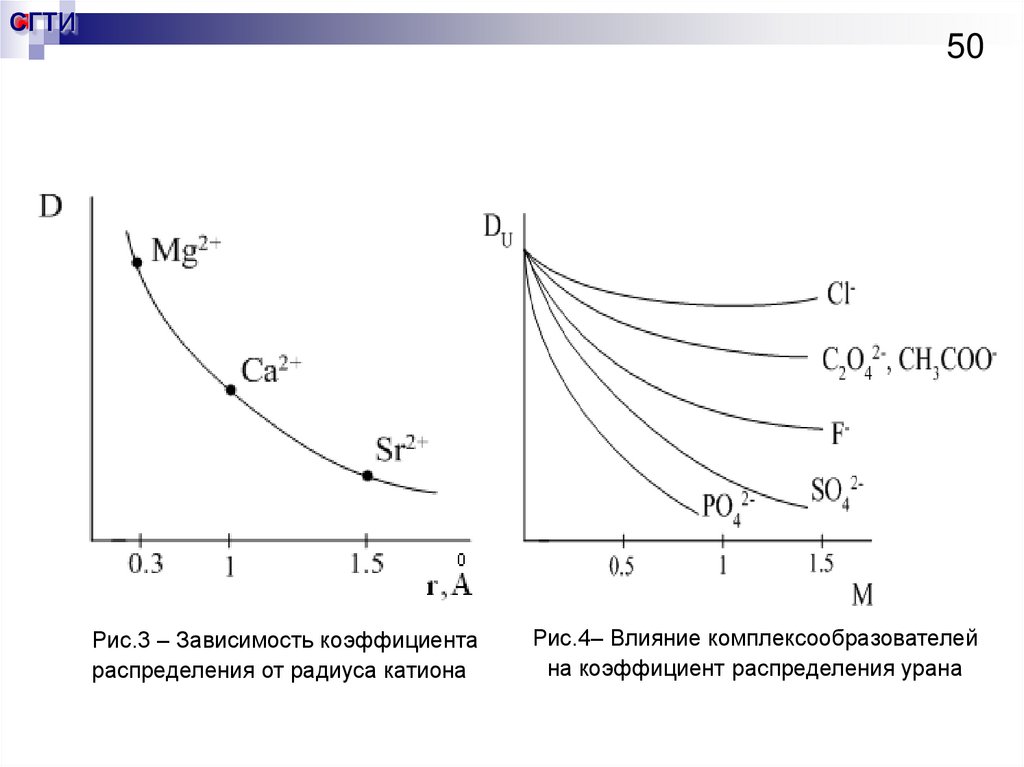
50.
СГТИ50
Рис.3 – Зависимость коэффициента
распределения от радиуса катиона
Рис.4– Влияние комплексообразователей
на коэффициент распределения урана
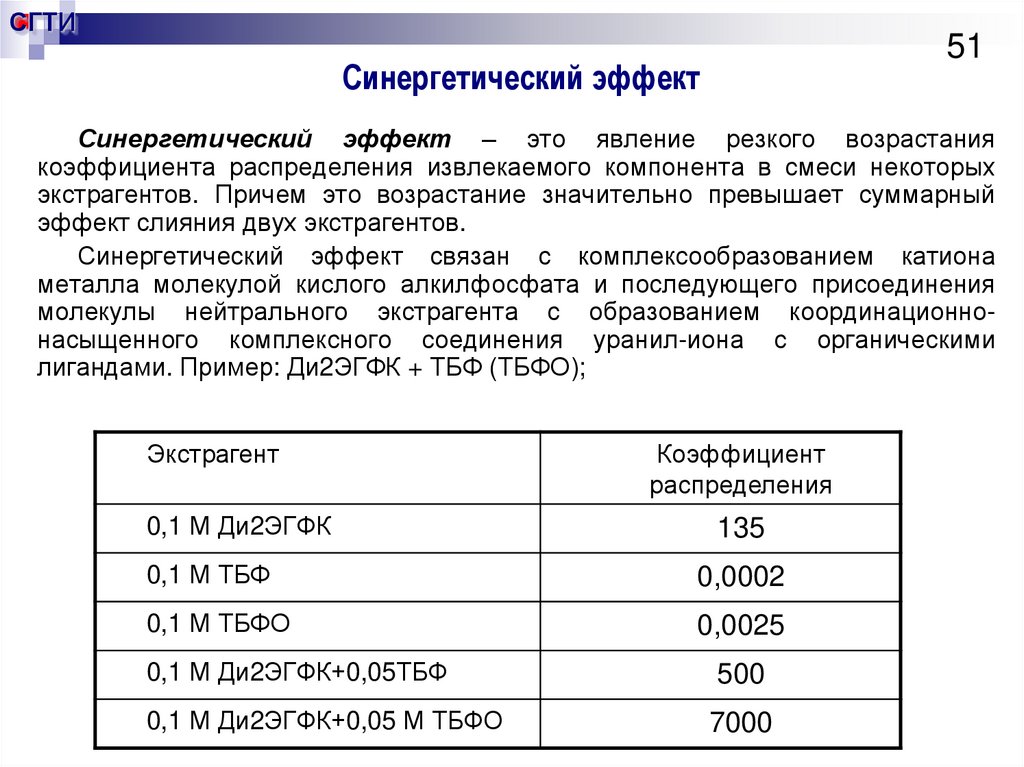
51. Синергетический эффект
СГТИ51
Синергетический эффект
Синергетический эффект – это явление резкого возрастания
коэффициента распределения извлекаемого компонента в смеси некоторых
экстрагентов. Причем это возрастание значительно превышает суммарный
эффект слияния двух экстрагентов.
Синергетический эффект связан с комплексообразованием катиона
металла молекулой кислого алкилфосфата и последующего присоединения
молекулы нейтрального экстрагента с образованием координационнонасыщенного комплексного соединения уранил-иона с органическими
лигандами. Пример: Ди2ЭГФК + ТБФ (ТБФО);
Экстрагент
0,1 М Ди2ЭГФК
Коэффициент
распределения
135
0,1 М ТБФ
0,0002
0,1 М ТБФО
0,0025
0,1 М Ди2ЭГФК+0,05ТБФ
0,1 М Ди2ЭГФК+0,05 М ТБФО
500
7000
52. Кинетика экстракции
СГТИ52
Кинетика экстракции
Схема массопереноса из водной фазы в органическую
В общем случае скорость
процесса зависит от:
- градиента концентраций;
- температуры;
- вязкости водной и
органической фаз;
- площади массопередачи;
- толщины диффузионного слоя.
Равенство потоков вещества в водной и органической фазах:
K 1 ( x x i ) K 2 ( y i y)
Кинетические коэффициенты экстракции:
диффузии;
D1 ,-Dкоэффициенты
2
1 , 2
K1
D1
1
- толщина диффузионного слоя в водной и орг. фазах.
K2
D2
2
53. Ионообменный метод разделения
СГТИИонообменный метод разделения
53
Метод разделения основан на различии в устойчивости связей
сорбируемого иона с ионитом.
Ионит
состоит
из
матрицы
(стиролдивинилбензольной
или
фенолформальдегидной) и функциональной группы:
катиониты
PO3 H 2
- сильнокислые SO 3 H
COOH
- слабокислые
Аниониты
- сильноосновные NOH (четвертичное аммониевое основание);
- Слабоосновные NH 2
(первичные, вторичные и
NH
N
третичные амины).
- Например, сульфокатионит КУ-2 имеет сульфогруппу SO 3 H , состоящую
из фиксированного иона SO3 и противоиона H
54. Классификация ионитов по Никольскому
СГТИКлассификация ионитов по Никольскому
54
По степени диссоциации различают:
Обменная
1 класс - Проявляют свойства сильных
1
емкость
кислот или оснований; обменная емкость
мг/г
максимальна и постоянна в широком интервале
рН (кривая 1).
4
2 класс - Проявляют свойства слабых
кислот или оснований; обменная емкость
3
максимальна только при определенном значении
рН высоком для катионитов и низком для
2
анионитов (кривая 2).
3 класс - Иониты смешанного типа, которые
проявляют свойства смеси сильной или слабой
рН
кислот или оснований; имеют два предельных
раствора
значения обменной емкости (кривая 3).
Рис. 1 – Зависимость
4 класс - Ведут себя подобно смеси многих
обменной емкости от рН раствора
кислот или оснований различной силы; обменная
емкость постепенно изменяется в широком
интервале рН.
55. Равновесие ионного обмена
СГТИРавновесие ионного обмена
Катионный обмен
RSO3 H Na RSO3 Na H
Анионный обмен
7 M
UO 2 Cl2 Cl
[UO 2 Cl3 ]
Переведем анионит в Сl-форму:
R4 NOH HCl R4 NCl H 2O
R4 NCl [UO2 Cl3 ] R4 NUO2 Cl3 Cl
2 R4 NCl [UO2 Cl3 ] [ R4 N ]2 [UO2 Cl4 ] Cl .
55
56. Селективность ионного обмена
СГТИСелективность ионного обмена
56
Селективность ионного обмена определяется двумя факторами:
1) валентностью и радиусом обменивающихся ионов в гидратированном
состоянии;
2) структурой ионита, степенью набухания, гидратацией ионогенных групп
и степенью диссоциации.
С ростом удельного заряда степень его гидратации возрастает, и
селективность по отношению к сорбенту падает. Это характерно для
сильнокислых катионитов.
Для сульфокатионита ряд селективности имеет следующий вид:
Li Na K Rb Cs
Для слабокислого (карбоксильного) катионита ряд селективности выглядит
следующим образом:
Li Na K Rb Cs
Обращение рядов селективности объясняет теория электро-статического
взаимодействия Айзенмана.
Так, сульфогруппы принадлежат к числу групп со слабым силовым полем,
имеют большой размер и слабо притягивают сильногидратированные ионы Li+
57.
СГТИ57
с высоким удельным зарядом.
Карбоксильные группы слабокислого катионита из-за малых размеров
имеют сильное поле и удерживают ионы малого размера Na+ прочнее чем
ионы К+, поэтому ряд сродства обращается на противоположный.
Селективность ионита к ионам также уменьшается с увеличением склонности
иона к гидратации. Менее гидратированные ионы, большего размера или
меньшего заряда будут преимущественно переходить в фазу ионита, поэтому
сродство меняется в ряду
F Cl Br NO3 I ClO 4
Для многоатомных анионитов степень гидратации зависит не только от
размера, но и от структуры, то есть от наличия гидрофильных групп
определяющих взаимодействие
с молекулами
воды.
Вещества
гидрофобные не смачиваются водой. В одной группе периодической
системы
селективность
многоатомных
анионов
уменьшается
с
возрастанием основности анионов, а она возрастает с увеличением
атомного номера:
MnO 4 TcO 4 Re O 4
ClO 3 BrO3 IO3
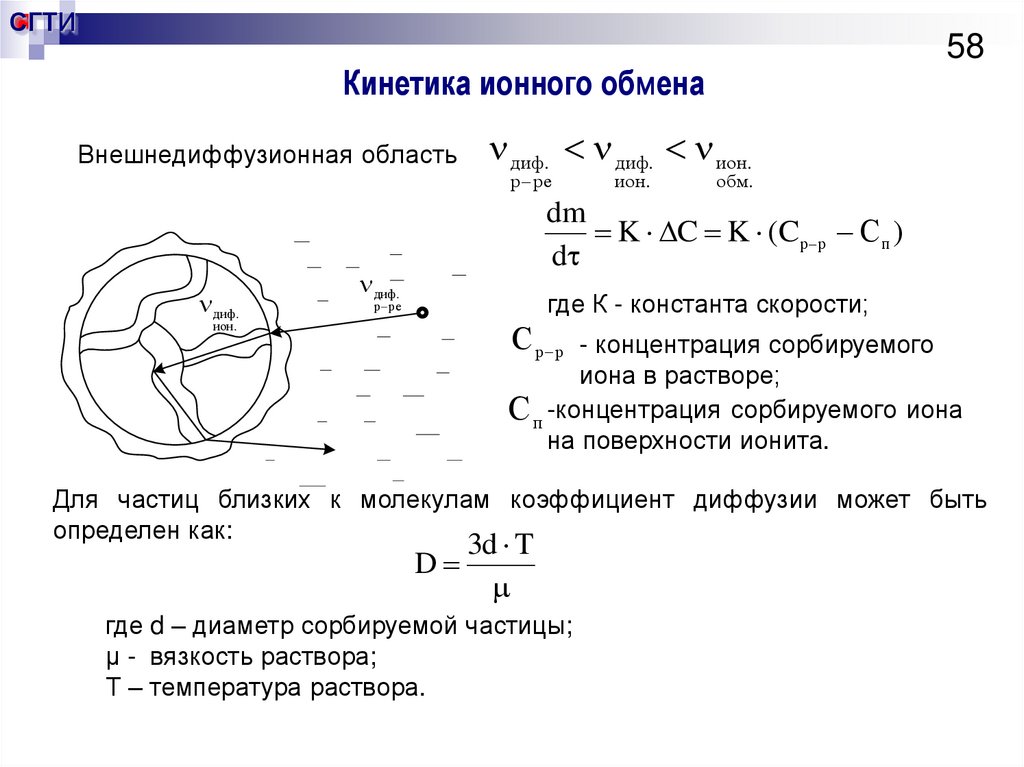
58. Кинетика ионного обмена
СГТИ58
Кинетика ионного обмена
Внешнедиффузионная область
диф. диф. ион.
р ре
диф.
ион.
обм.
dm
K C K (C р р С п )
d
диф.
где К - константа скорости;
р ре
ион .
С р р
- концентрация сорбируемого
иона в растворе;
С п -концентрация сорбируемого иона
на поверхности ионита.
Для частиц близких к молекулам коэффициент диффузии может быть
определен как:
D
3d T
где d – диаметр сорбируемой частицы;
μ - вязкость раствора;
Т – температура раствора.
59.
СГТИ59
Так как практически для всех реакций ионного обмена скорость
химической реакции высока, а зерно ионита имеет макропористую
структуру (дивинилбензола 8%) и малый диаметр (1-2мм), что
обеспечивает высокую скорость диффузии внутри зерна ионита, то
скорость ионного обмена будет определяться внешней диффузией.
Пример: разделение урана и тория-234 ионообменным
способом
60. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ВЫДЕЛЕНИЯ
СГТИЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ВЫДЕЛЕНИЯ
60
ЦЕМЕНТАЦИЯ;
ЭЛЕКТРОЛИЗ;
ЭЛЕКТРОМИГРАЦИЯ.
Метод цементации включает протекание двух реакций:
окисления
металла
электрода
и
восстановления
радионуклида на поверхности электрода.
Процесс самопроизволен при условии:
G= - n∙F(φок.– φвосст.)<0; где:
N- число электронов, принимающих участие в реакциях;
F- число Фарадея;
φок. и φвосст. – потенциалы окисления металлического
электрода (Pt, Au, Ag) и восстановления выделяемого
радионуклида.
61. Метод электролиза
СГТИМетод электролиза
61
Возможность выделения радионуклида на электроде
определяется соотношением его критического потенциала
осаждения и потенциала водородного электрода.
Элементы, у которых критический потенциал осаждения
более положителен, чем потенциал водородного
электрода, могут быть выделены на 100%.
На процесс разделения влияют:
плотность
тока,
материал
электрода,
состав
электролита, температура раствора.
Электроотрицательные элементы не могут быть
выделены электролизом из водного раствора, так как в
первую очередь на электроде будет выделяться водород.
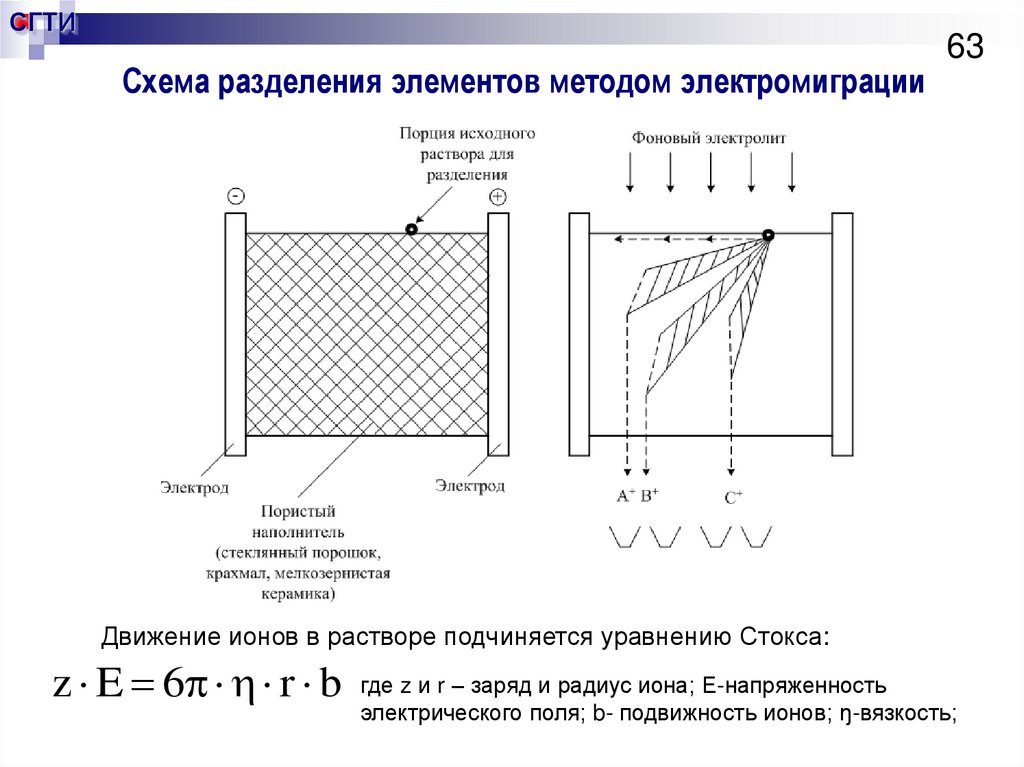
62. Метод электромиграции
СГТИМетод электромиграции
62
Основан на различии в скоростях движения ионов в
электрическом поле.
В свою очередь подвижность иона пропорциональна
отношению заряда к его радиусу.
Пример: возможно быстрое разделение РЗЭ и
актиноидов.
63. Схема разделения элементов методом электромиграции
СГТИСхема разделения элементов методом электромиграции
63
Движение ионов в растворе подчиняется уравнению Стокса:
z E 6 r b
где z и r – заряд и радиус иона; Е-напряженность
электрического поля; b- подвижность ионов; ŋ-вязкость;
64. Хроматографический метод разделения
СГТИХроматографический метод разделения
64
Это физико-химический метод разделения веществ в
динамических условиях между двумя фазами, одна из
которых неподвижна с большой поверхностью, вторая
подвижная (жидкость или газ).
Способы проведения:
Фронтальный;
Элюэнтный;
Вытеснительный.
Примеры:








































 Химия
Химия








