Похожие презентации:
Комплексные соединения
1. Комплексные соединения
2.
Некоторыеэлементы
Cu2+,Ag+,Au3+,Cr3+,Fe+2,Zn+2
и
др.
способны образовывать комплексные
соединения.
Например:
K4[Fe2+(CN)6];
[Ag+(NH3)2]Cl
3.
Соединениями первого порядка или валентно-насыщеннымисоединениями,
называются соединения типа BF3, CH4, NH3,
CO2 и др., в которых элемент
проявляет свою обычную
максимальную валентность. Соединениями высшего порядка,
валентно-ненасыщенными, называются
соединения, которые
получаются при взаимодействии соединений первого
друг с другом. Например:
порядка
4. Координационная теория А. Вернера
• В 1893 г. швейцарским химикомнеоргаником Альфредом Вернером (1866–1919) была сформулирована теория,
позволившая понять строение и некоторые
свойства комплексных соединений и
названная
координационной
теорией.
Поэтому
комплексные
соединения
также
называют
координационными соединениями.
• Соединения, в состав которых входят
сложные ионы, существующие как в
кристалле, так и в растворе, называются
комплексными, или координационными.
5.
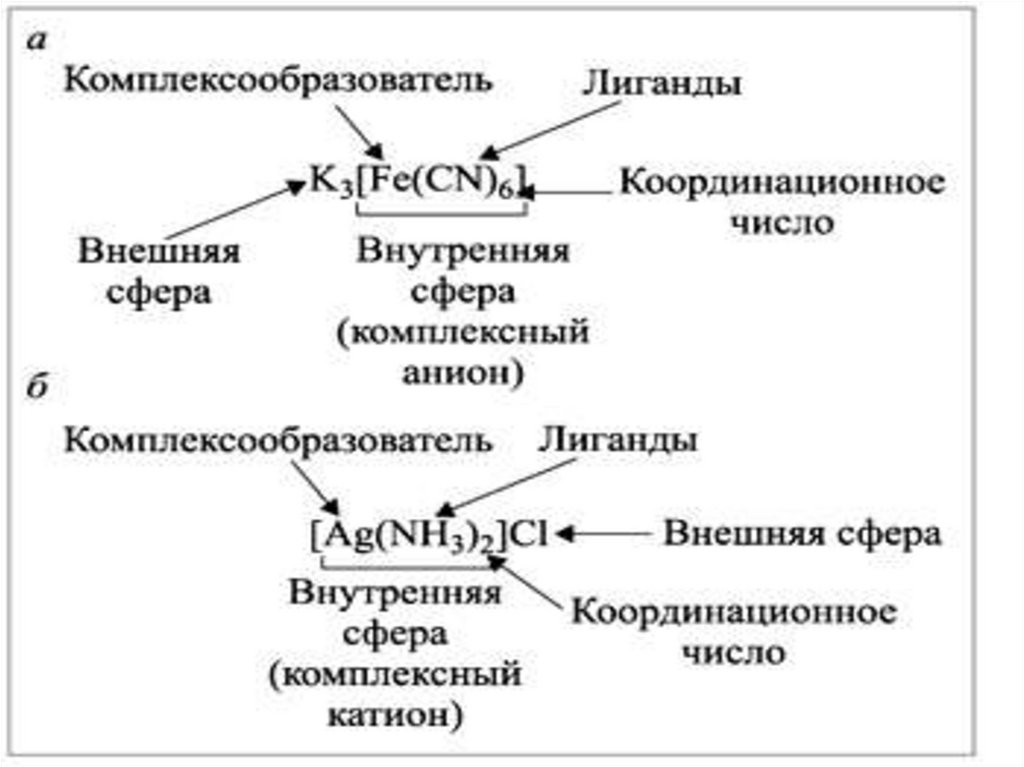
1. Состав комплексных соединенийВ составе комплексных соединений выделяют
внутреннюю и внешнюю сферу:
В состав внутренней сферы, обозначаемой [ ], входит
центральный атом, или комплексообразователь
(Al3+,Fe3+) и окружающие его атомы, ионы или молекулы,
называемые лигандами (в примерах F-,CN-)
6.
Комплексообразователь – частица (чащеположительно заряженный ион металла),
координирующая (располагающая) вокруг
себя другие ионы или молекулы.
Центральный
атом
или
ион
внутренней
сферы
называют
комплексообразователем.
Обычно,
в
качестве
комплексообразователей выступают атомы или ионы металлов с достаточным
количеством свободных орбиталей – это p-, d-, f- элементы: Cu2+, Pt2+, Pt4+,
Ag+, Zn2+, Al3+и др. Но это могут быть и атомы неметаллы. Заряд
комплексообразователя обычно положительный, но также может быть
отрицательным или равным нулю и равен сумме зарядов всех остальных
ионов. В приведенных выше примерах комплексообразователями являются
ионы Al3+и Fe3+.
7.
Комплексообразователь окружен и связан сигма-связями сионами противоположного знака или нейтральными молекулами
(лигандами).
Лиганды – частицы (нейтральные молекулы и ионы
противоположного
знака),
координируемые
комплексообразователем и имеющие с ним
непосредственно химические связи (например,
ионы: Cl–, I–, NO3–, OH–; нейтральные молекулы: NH3,
H2O, CO).
В состав внутренней сферы могут входить различные
лиганды [Cо3+(NH3)4Cl2]Cl
8.
Число лигандов, расположенных вокругкомплексообразователя,
определяет
координационное число центрального атома:
[Cu(NH3)4](OH)2
координационное число меди = 4
[Co(NH3)4Cl2]Cl
координационное число кобальта = 6
9.
Заряд комплексаЗаряд комплексного иона численно равен суммарному заряду
внешней
сферы, но противоположен ему по знаку, и определяется
как алгебраическая сумма зарядов комплексообразователя и лигандов.
Например,
[Co3+(NH3)6]Cl3--;
K3[Fe(CN)6];
+3 6 0 3 (-1);
+3 3+ 6 (-1);
10.
11.
Химическая связь между комплексообразователеми лигандом ковалентная, образованная по
донорно-акцепторному механизму.
12.
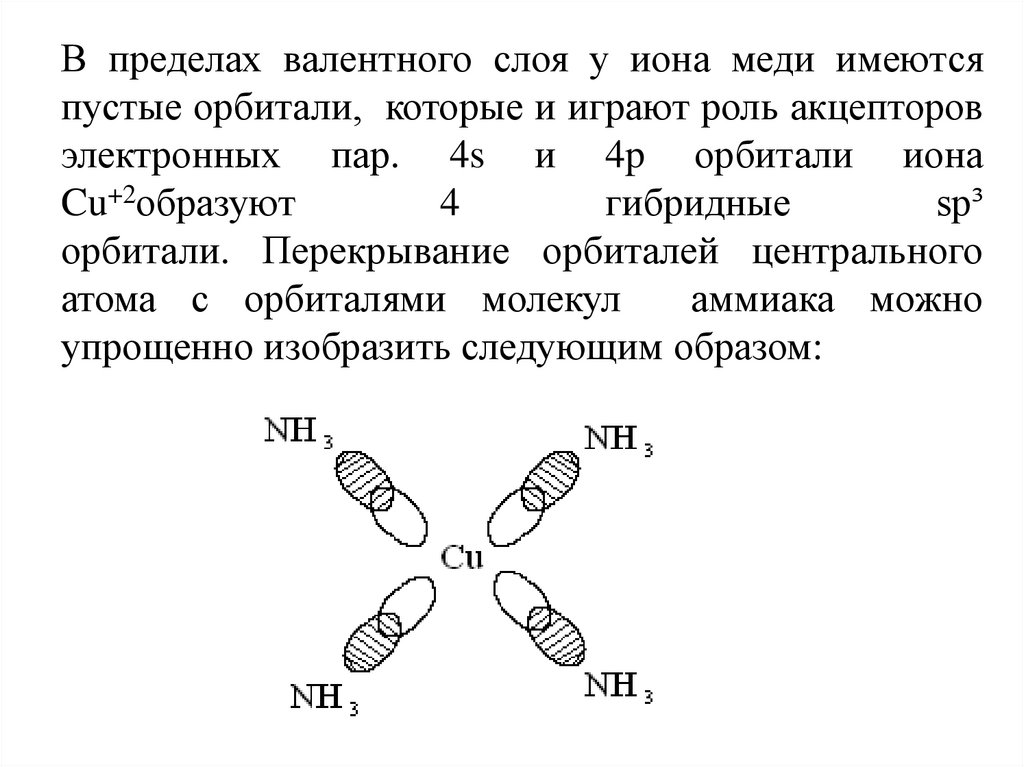
Рассмотрим строение комплексного иона [Cu(NH3)4]2+Электронная формулы атома меди:
Графическая электронная формула атома и иона
меди
13.
В пределах валентного слоя у иона меди имеютсяпустые орбитали, которые и играют роль акцепторов
электронных пар. 4s и 4p орбитали иона
Cu+2образуют
4
гибридные
sp³
орбитали. Перекрывание орбиталей центрального
атома с орбиталями молекул
аммиака можно
упрощенно изобразить следующим образом:
14.
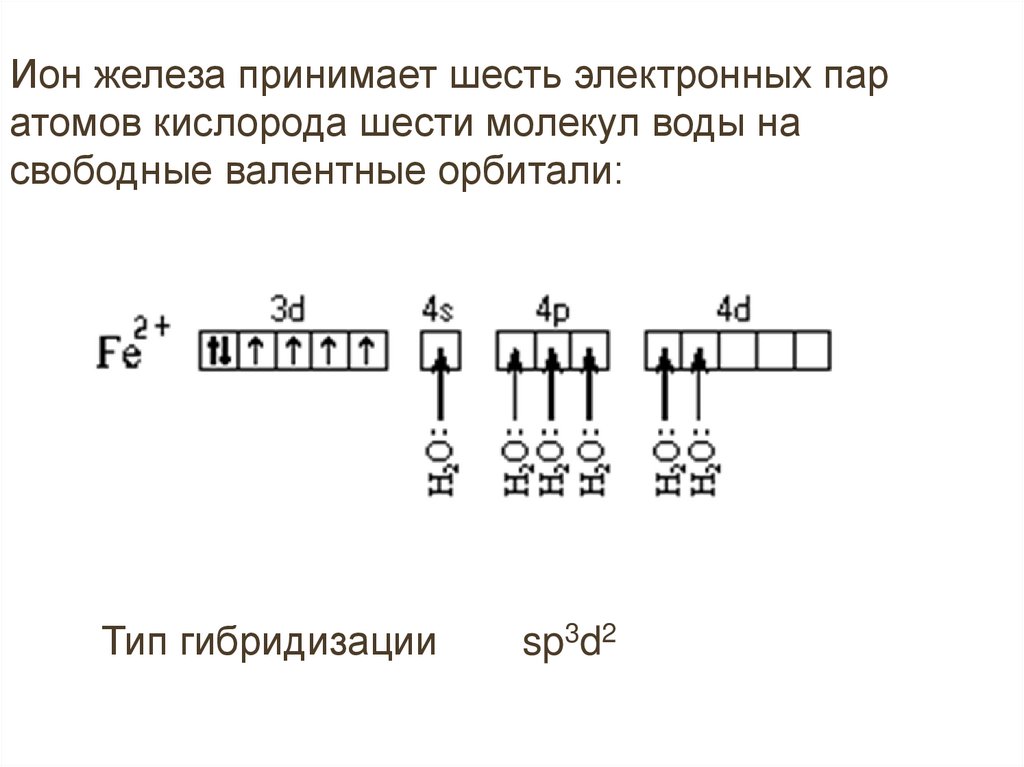
[Fe(H2O)6]2+
Электронная формула атома железа –
1s22s22p63s23p64s23d6.
При образовании двухзарядного иона атом железа
теряет два 4s-электрона:
15.
Ион железа принимает шесть электронных паратомов кислорода шести молекул воды на
свободные валентные орбитали:
Тип гибридизации
sp3d2
16.
Образуется комплексный катион, химическое строение которого можновыразить одной из следующих формул:
17.
2. Классификация комплексных соединений•1) По составу:
Нейтральные комплексы (неэлектролиты) - не имеют
внешней сферы.
[Fe(CO)5]; [Ni(CO)4]
18.
•2) По типу координируемых лигандов.:•а) Аквакомплексы – это комплексные
катионы, в которых лигандами являются
молекулы H2O.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
19.
б)Гидроксокомплексы – это комплексныеанионы, в которых лигандами являются
гидроксид-ионы OH–.
Комплексообразователями являются
металлы, склонные к проявлению
амфотерных свойств – Be, Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в
которых лигандами являются молекулы NH3.
Комплексообразователями являются dэлементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
20.
г) Ацидокомплексы – это комплексныеанионы, в которых лигандами являются
анионы неорганических и органических
кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4],
K4[Fe(CN)6].
21.
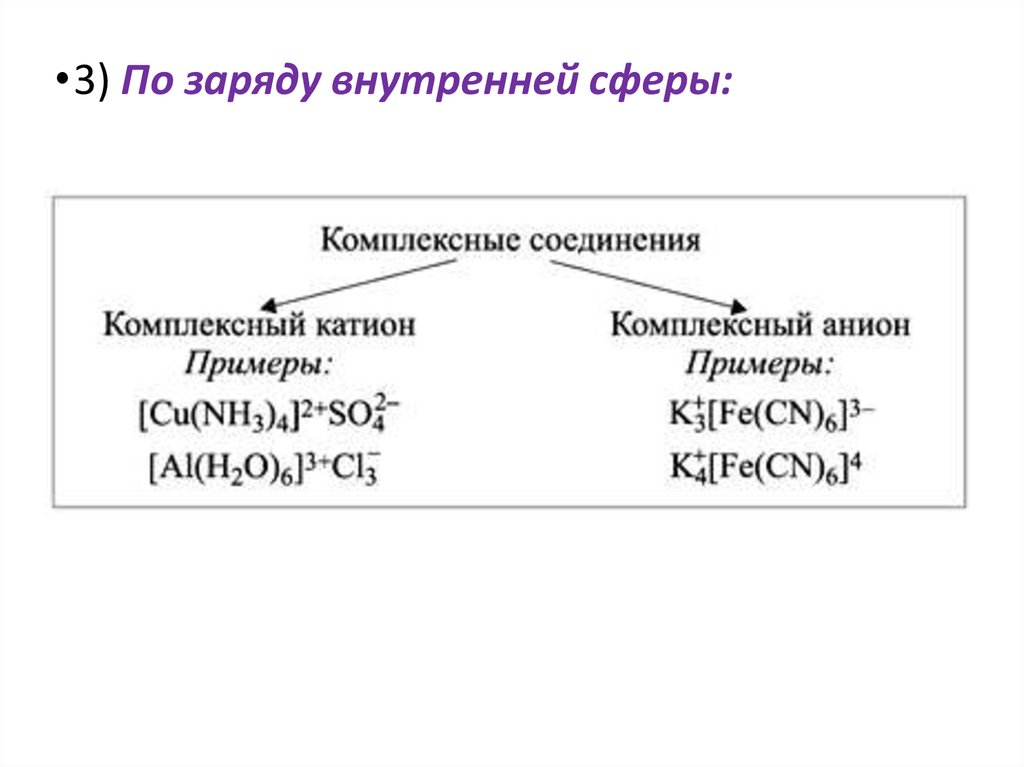
•3) По заряду внутренней сферы:22.
3. Номенклатура комплексныхсоединений
1. Названия комплексных соединений составляют
аналогично названиям обычных солей (NaCl –
хлорид натрия). Первым называется анион, затем
катион, при этом в названии аниона употребляется
корень
латинского
наименования
комплексообразователя, а в названии катиона – его
русское название в родительном падеже:
K2[CuCl3] – трихлорокупрат (I) калия
[Ag(NH3)2]Cl – хлорид диамминсеребра (I)
23.
Названия лигандов и комплексообразователей:24.
K2[CuCl3] – трихлорокупрат (I) калия[Ag(NH3)2]Cl – хлорид диамминсеребра (I)
2. К лигандам-анионам добавляют суффикс О. Нейтральные
молекулы-лиганды без суффикса О.
3. В названии комплекса сначала указывают лиганды, а после –
комплексообразователь.
4. Если количество лигандов больше единицы, то их число
указывают греческими приставками:
2-ди-, 3-три-, 4-тетра-, 5-пента-, 6-гекса-, 7-гепта-, 8-окта-, 9нона-, 10-дека-.
5. В скобках указывают степень окисления комплексообразователя
римсой цифрой.
6. Названия комплексных анионов оканчиваются суффиксом – ат
25.
Например (сложные анионы):K2[PtCl6] – гескахлороплатинат (IV) калия:
K2[Zn(OH)4] – тетрагидроксоцинкат (II) калия
K3[Co(NO2)6] – гексанитрокобальтат (III) калия
K3[Fe(CN)6] – гексацианоферрат (III) калия
K[Ag(CN)2] – дицианоаргентат (I) калия
26.
Например (сложные катионы):[Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II)
[Al(H2O)6]Cl3 – хлорид гексаакваалюминия
[Cr(H2O)6]Cl3 – хлорид гескааквахрома (III)
[Zn(NH3)4]Cl2 — хлорид тетраамминцинка(II)
В
названии
нейтральных
комплексных
частиц
комплексообразователь указывается в именительном падеже, а
степень его не указывается, так как она однозначно определяется,
исходя
из
электронейтральности
комплекса.
Например [Pt(NH3)2Cl4] – тетрахлордиамминплатина
7.
27.
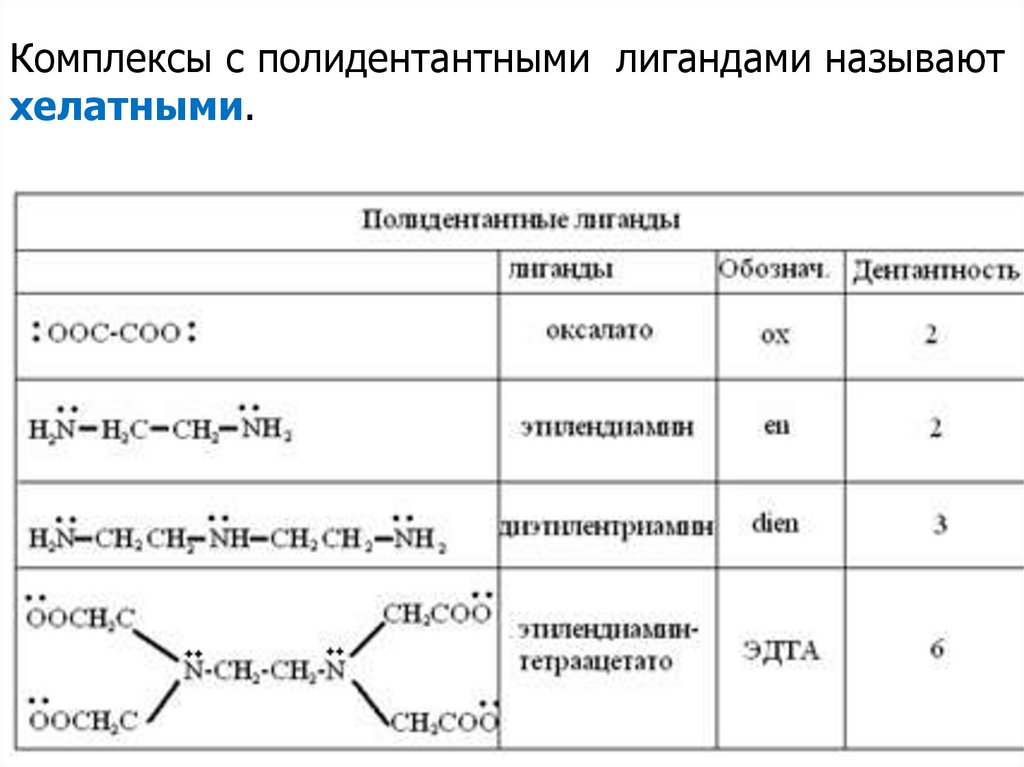
4. Понятие дентантности.Хелатные комплексы
Дентантность
(координационная
емкость)
лиганда - это число координационных мест,
которое
может
занимать
данный
лиганд.
Дентантность определяется числом донорных
атомов, входящих в его состав.
По этому признаку различают монодентантные,
бидентантные, полидентантные лиганды.
Число
монодентантных
лигандов
в
координационной сфере равно координационному
числу комплексообразователя.
28.
Комплексы с полидентантными лигандами называютхелатными.
29.
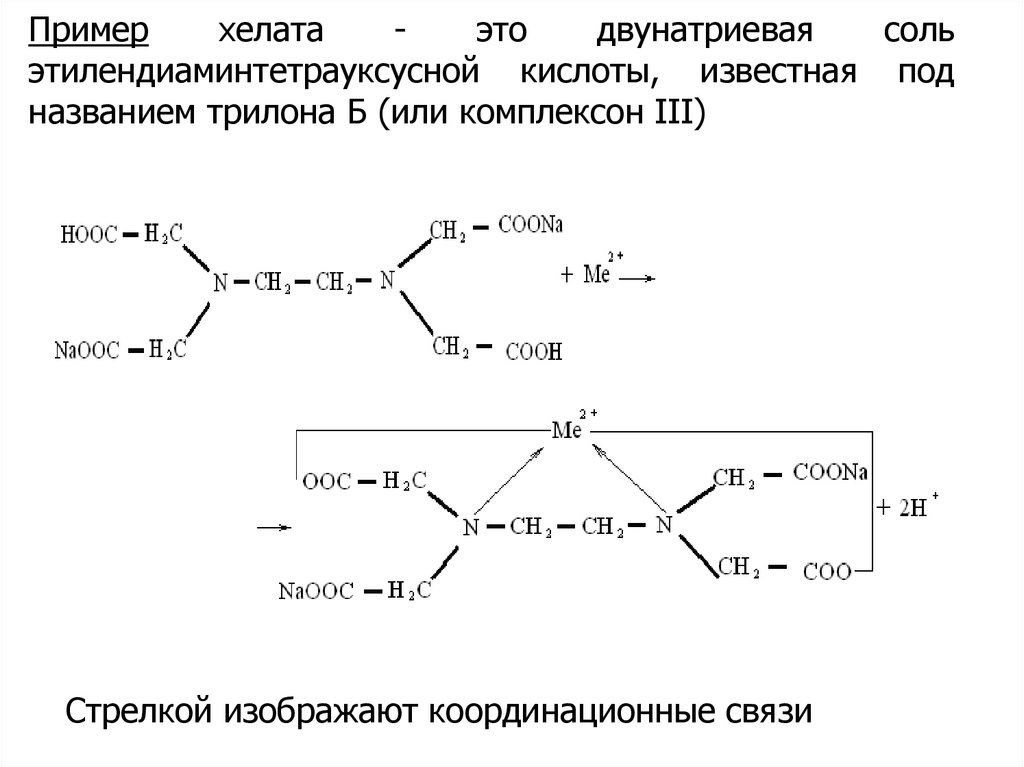
Примерхелата
это
двунатриевая
соль
этилендиаминтетрауксусной кислоты, известная под
названием трилона Б (или комплексон III)
Стрелкой изображают координационные связи
30.
Роль хелатов в биологических системах. К хелатнымсоединениям относятся такие важные для жизни вещества,
как хлорофилл и гемоглобин.
Структурные формулы этих веществ очень сложные, но
схематично хлорофилл изображают так:
31.
Наиболее известные металлоферменты32.
5. Диссоциация комплексных соединений.Константой неустойчивости
Комплексные
соединения
в
водных
растворах – сильные электролиты –
практически полностью диссоциируют на
ионы.
В меньшей степени распадается комплексный
ион
33.
Как равновесный процесс распад комплексногоиона характеризуется константой равновесия,
называемой константой неустойчивости
(нестойкости) комплекса (Кн).
где Кн – величина постоянная, характеризует
устойчивость комплексов.
Чем выше Кн, тем менее прочным является
комплекс. Чем меньше Кн, тем устойчивее
комплексный ион.
34.
Вместо константы нестойкости иногда пользуютсявеличиной обратной, называемой константой
устойчивости
или константой образования
комплекса:
Куст = 1/кн
35. 6. Химические свойства комплексных соединений
•1. В растворе комплексные соединения ведутсебя как сильные электролиты, т.е. полностью
диссоциируют на катионы и анионы.
[Pt(NH3)4]Cl2 = Pt(NH3)4]2+ + 2Cl–,
K2[PtCl4] = 2K+ + [PtCl4]2–
36.
•2. При действии сильных кислотпроисходит разрушение
гидроксокомплексов
а) при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 +
3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 +
6H2O.
37.
•3.Нагревание
(термолиз)
всех
аммиакатов приводит к их разложению,
например:
[Cu(NH3)4]SO4 = CuSO4 + 4NH3 .
38.
4. Комплексные кислоты, основания и соли вступают вобычные реакции обмена, например:
[Cu(NH3)4]SO4 + BaCl2 = BaSO4 + [Cu(NH3)4]Cl2
FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 3KCl
39. 7. Значение комплексных соединений
• Координационные соединения имеют исключительнобольшое значение в природе. Достаточно сказать, что
почти все ферменты, многие гормоны, лекарства,
биологически активные вещества представляют собой
комплексные соединения. Например, гемоглобин
крови, благодаря которому осуществляется перенос
кислорода от легких к клеткам ткани, является
комплексным соединением, содержащим железо, а
хлорофилл, ответственный за фотосинтез в растениях, –
комплексным соединением магния.
40.
• Значительную часть природных минералов,также
составляют
координационные
соединения. Например: Na3[AlF6] – криолит,
KNa3[AlSiO4]4
–
нефелин
(минералы,
комплексные
соединения,
содержащие
алюминий).
криолит
нефелин
41.
• Современнаяхимическая
отрасль
промышленности
широко
использует
координационные соединения как катализаторы
при синтезе высокомолекулярных соединений,
при
химической
переработке
нефти,
в
производстве кислот.



































 Химия
Химия








