Похожие презентации:
Комплексные соединения
1. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
2.
Комплексные соединения(координационные соединения) –
сложные химические вещества, в составе
которых имеются комплексные ионы,
образованные центральным атомом и
связанными с ним лигандами.
3. Двойная соль или комплексное соединение?
KCr(SO4)2∙ 12H2O – хромокалиевые квасцыKCr(SO4)2∙ 12H2O =
= K+ + Cr3+ + 2SO42- + 12H2O
Fe(CN)3.3KCN = 3K+ + Fe3+ + 6CNКрасная кровяная соль
не определяются в растворе
4.
Теорию комплексных соединений –(координационную теорию),
разработал в 1893 г. швейцарский химик
Альфред Вернер, который в 1913 стал
лауреатом Нобелевской премии.
Его научная деятельность проходила в
Цюрихском университете. Ученый
синтезировал много новых комплексных
соединений, систематизировал ранее
известные и вновь полученные
комплексные соединения и разработал
экспериментальные методы
доказательства их строения.
5.
Положения координационной теории Вернерав центре комплексного соединения находится
центральный ион – комплексообразователь.
Ионами –коплексообразователями
являются катионы металлов, а также
некоторые неметаллы, например В, Р, Si.
Наибольшую склонность к комплексообразованию проявляют ионы d-элементов.
6.
Вокруг центрального атома (ионакомплексообразователя) находятсяпротивоположно заряженные ионы или
нейтральные молекулы, которые называются
лигандами (от латинского "ligare" – связывать).
Ион-комплексообразователь и лиганды
cоставляют внутреннюю сферу комплекса,
которую обозначают квадратными скобками.
Число сигма - связей, которые образует
центральный атом с лигандами, называется
координационным числом (к.ч.).
7.
Природа химической связив комплексных соединениях
• Во внутренней сфере между комплексообразователем и
лигандами существуют ковалентные связи, образованные по
донорно-акцепторному механизму.
•Роль донора (поставщика электронов) играет лиганд, а
акцептором, принимающим электроны, является
комплексообразователь.
•Донорно-акцепторная связь возникает как результат
перекрывания свободных валентных орбиталей
комплексообразователя с заполненными орбиталями донора.
•Между внешней и внутренней сферой существует ионная
связь.
8.
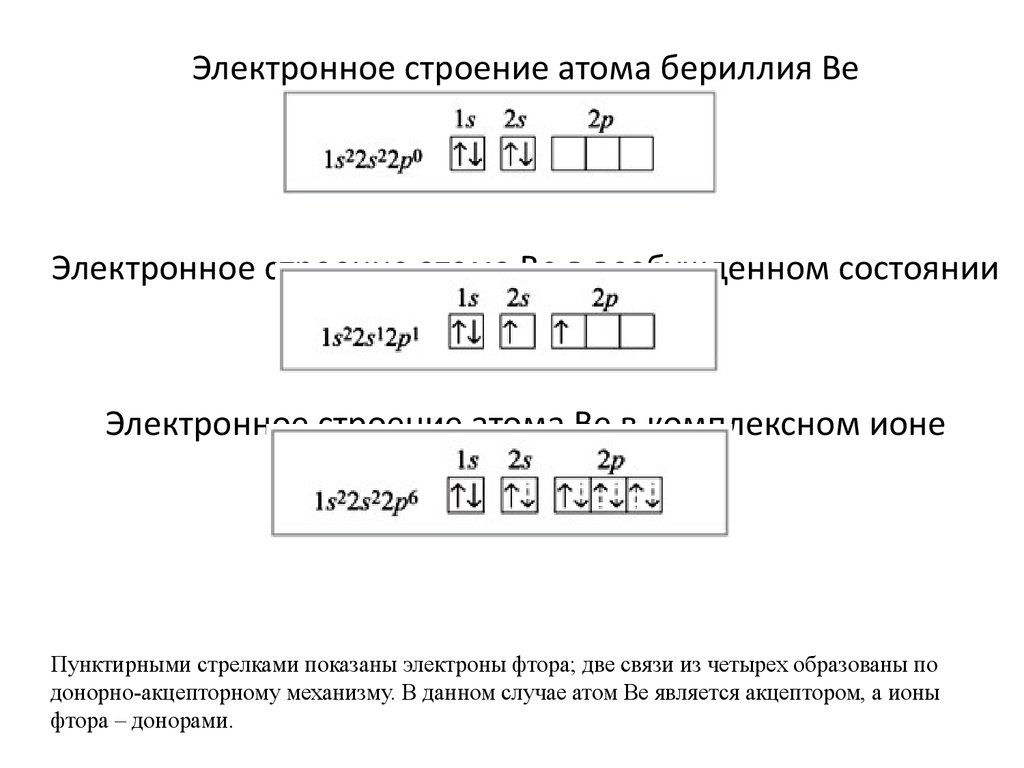
Электронное строение атома бериллия BeЭлектронное строение атома Be в возбужденном состоянии
Электронное строение атома Be в комплексном ионе
[BeF4]2–:
Пунктирными стрелками показаны электроны фтора; две связи из четырех образованы по
донорно-акцепторному механизму. В данном случае атом Be является акцептором, а ионы
фтора – донорами.
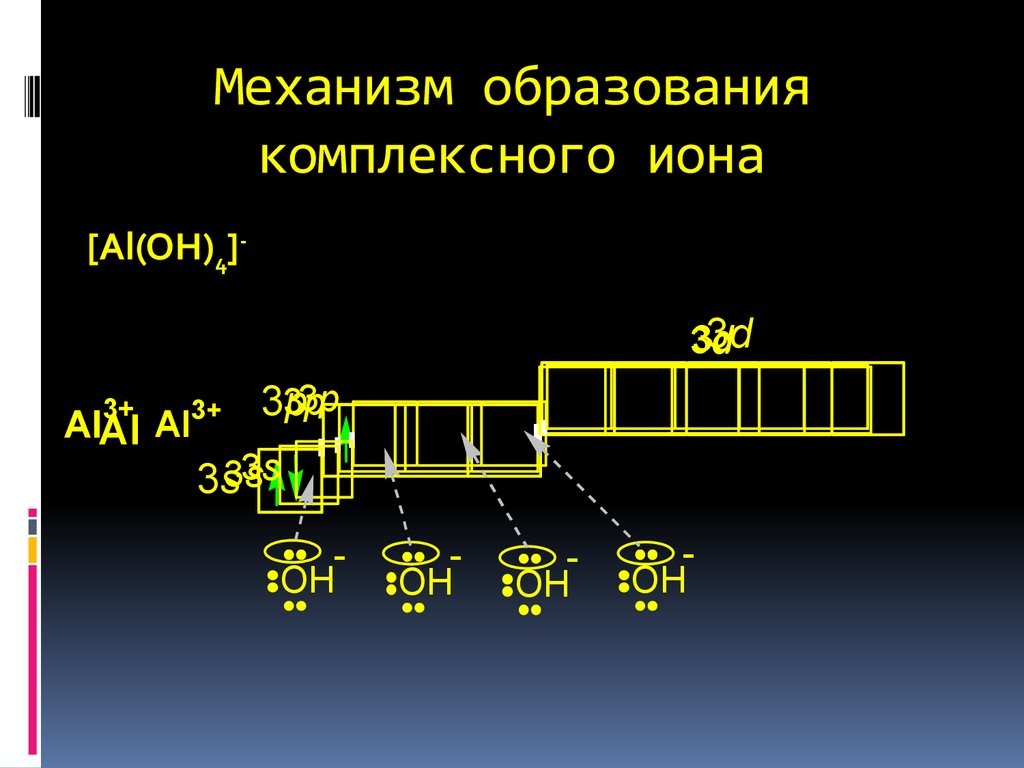
9. Механизм образования комплексного иона
[Al(OH)4]-3d
3d
3+
AlAl Al
3+
3p
3p
3p
3s
3s3s
OH
OH
OH
OH
10.
• Донорно-акцепторный механизм:лиганд предоставляет электронную пару
(основание Льюиса), а центральный атом
вакантную орбиталь (кислота Льюиса).
• Координационные (комплексные) соединения
характерны прежде всего для d- элементов (а
также f – элементов) – есть вакантные орбитали
металла и они способны принимать электронную
пару от лиганда.
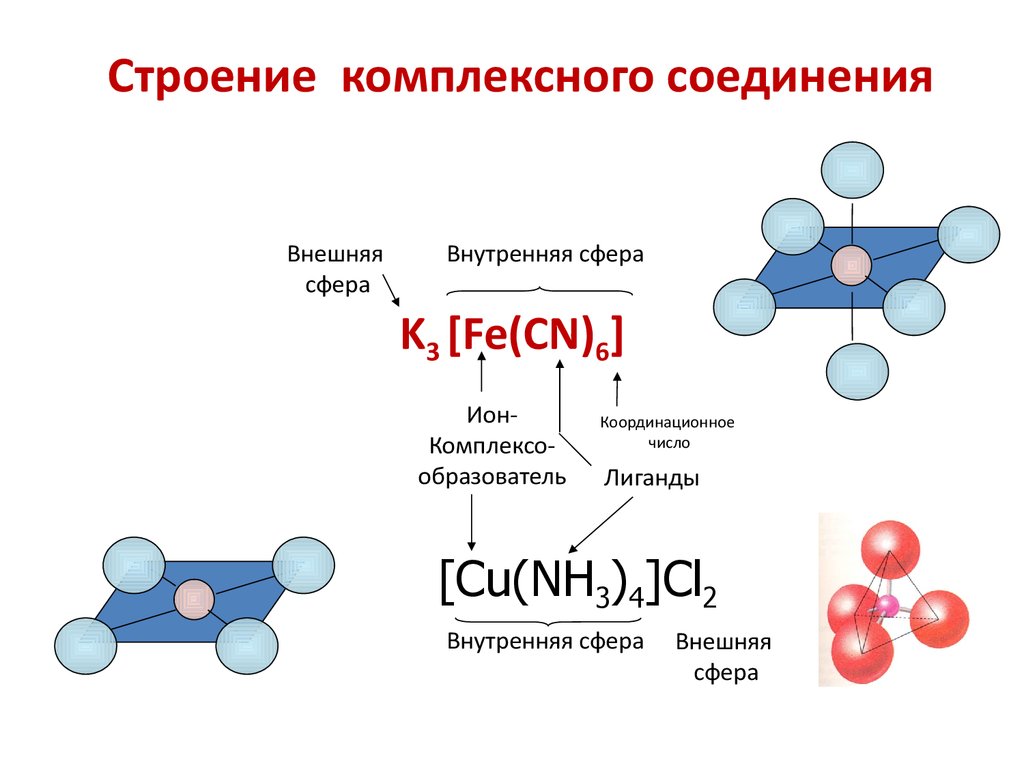
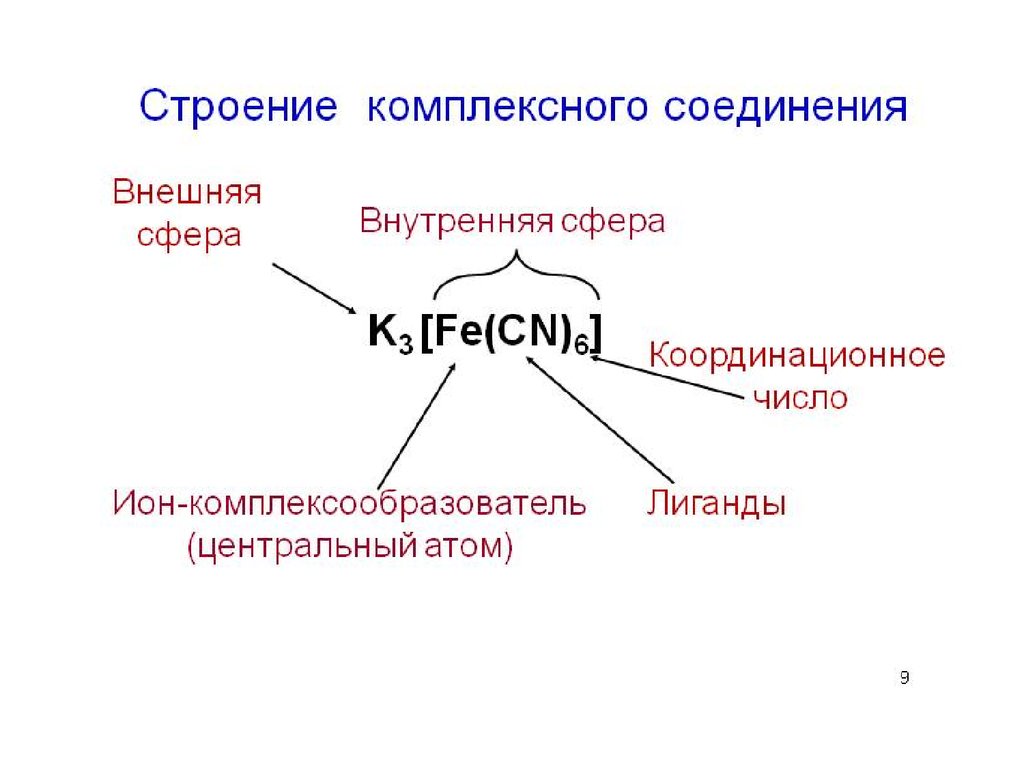
11. Строение комплексного соединения
Внешняясфера
Внутренняя сфера
K3 [Fe(CN)6]
ИонКомплексообразователь
Координационное
число
Лиганды
[Cu(NH3)4]Cl2
Внутренняя сфера
Внешняя
сфера
12.
13.
Заряд комплексного иона равен алгебраическойсумме зарядов иона-комплексообразователя и
лигандов.
2+
0
2+
2-
[Cu(NH3)4] SO4
комплексный ион
14.
ЦЕНТРАЛЬНЫЙ АТОМ (ц. а.)(ион-комплексообразователь)
Чаще всего центральными атомами являются
ионы металлов d-элементов: Cu, Ag, Pt, Cr, Fe,
Zn и др.
В состав некоторых комплексных соединений
могут входить и ионы щелочных и щелочноземельных металлов (Na, Ca, Mg).
15.
Координационное число (к. ч.)Координационное число (к. ч.) не
является неизменной величиной.
Даже для одних и тех же
комплексообразователей и лигандов
координационное число зависит от:
•заряда ц. а.
•размера ц.а.
•агрегатного состояния вещества, от
концентрации, температуры.
16.
Заряд центрального иона являетсяосновным фактором, влияющим на
координационное число
Заряд ц.а.
КЧ
(подчеркнуто
характерное)
Примеры
+1
2, 3
[Ag(NH3)2]Cl
+2
3, 4, 6
[Cu(NH3)4]Cl2
+3
4, 5, 6
Na3[Co(NO2)6]
+4
6, 8
H2[SnCl6]
17.
Эмпирическое правило:чаще всего кч
устойчивого комплекса в
два раза больше степени
окисления ц.а.
КЧ = 2Z
18. Na[BF4] Na3[AlF6]
FF
F-
F
F
FF
F
F
B
3+
F-
F
-
Al3+
F
F
F-
rB3+ = 0,02 нм
F
F-
-
F
F-
F
F-
rAl3+ = 0,057 нм
19. Na3[AlF6] Na [AlCl4]
lF
F
-
F
Cl
F
-
l
Cl-
-
l
F
F
-
Al3+
F
Fl
F
F
-
F
F-
rF_ = 0,133 нм
Cl-
Al3+
Cl-
rCl- = 0,181 нм
20.
ЛИГАНДЫЛигандами могут быть:
- нейтральные молекулы H2O, NH3, CO,
карбамида (NH2)2CO,
этилендиамина NH2CH2CH2NH2,
α-аминоуксусной кислоты NH2CH2COOH,
этилендиаминтетрауксусной кислоты (ЭДТА).
- ионы (CN-, F-, Cl-, Br-, I-, NO2-, OH-, C2O42-, CO32- )
21.
Дентатность лиганда определяется числомкоординационных мест, занимаемых
лигандом в координационной сфере
комплексообразователя.
Различают монодентатные лиганды,
занимающие во внутренней сфере одно
место, бидентатные лиганды, занимающие
два места, и полидентатные лиганды,
занимающие несколько мест.
22.
К числу монодентатных лигандов относятсявсе галогенид-ионы,
цианид-ион, аммиак, вода и другие.
23. -монодентатные лиганды, содержат 1 донорный атом (H2 O, NH3, OH-, Cl-, Br-)
Лат. dentalus – имеющий зубы-монодентатные лиганды,
содержат 1 донорный атом
(H2 O, NH3, OH-, Cl-, Br-)
24.
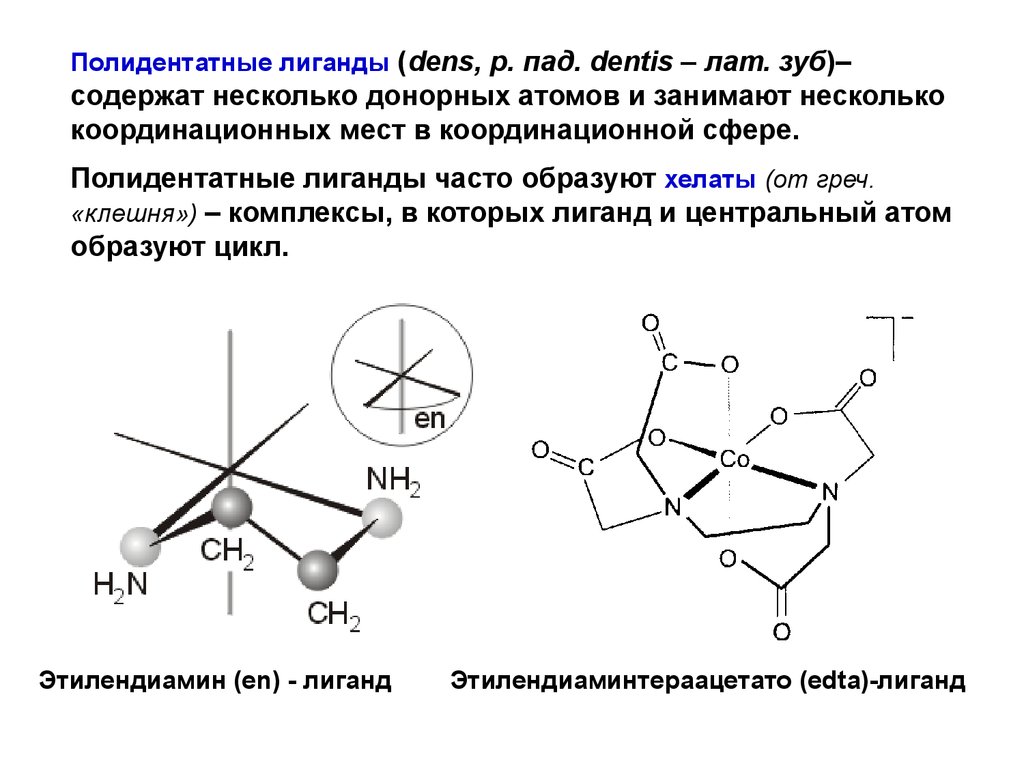
Полидентатные лиганды (dens, р. пад. dentis – лат. зуб)–содержат несколько донорных атомов и занимают несколько
координационных мест в координационной сфере.
Полидентатные лиганды часто образуют хелаты (от греч.
«клешня») – комплексы, в которых лиганд и центральный атом
образуют цикл.
Этилендиамин (en) - лиганд
Этилендиаминтераацетато (edta)-лиганд
25.
-бидентатные лиганды, содержат2 донорных атома и занимают два
координационных места:
О=С–ОО=С–О–
O
С2О42-
OS
O
O-
SО42-
26.
Существует целый ряд лигандов, которые в комплексахявляются практически всегда бидентатными.
Это этилендиамин, карбонат-ион, оксалат-ион и др.
Каждая молекула или ион бидентатного лиганда
образует с комплексообразователем две химические
связи в соответствии с особенностями своего строения:
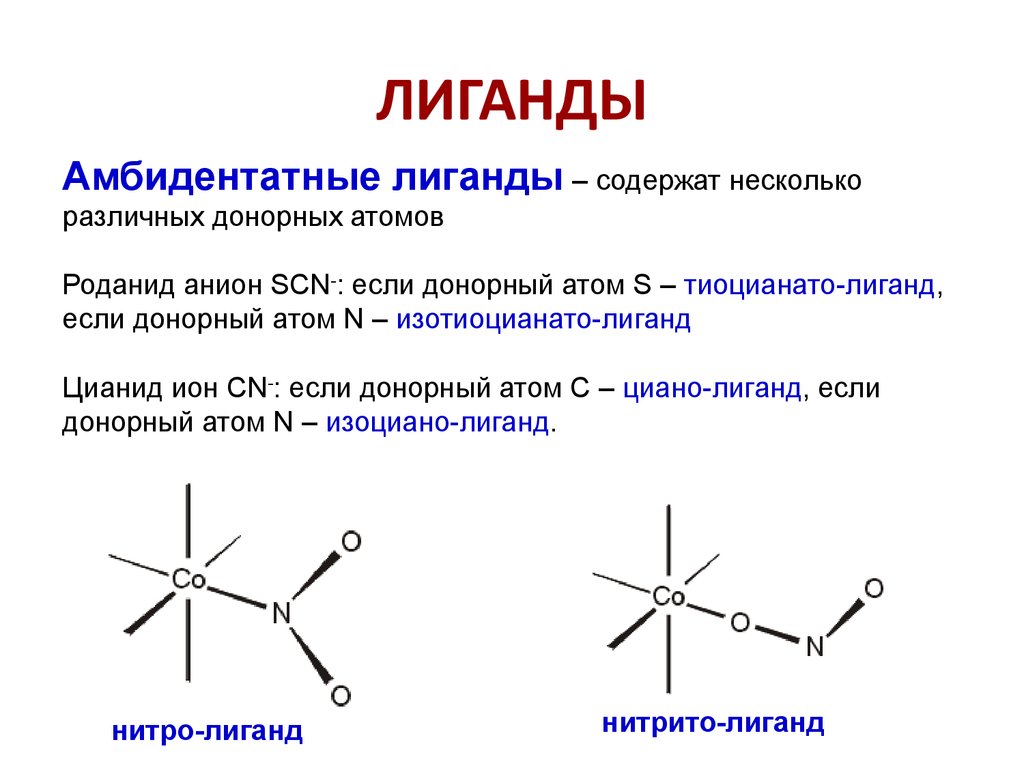
27. ЛИГАНДЫ
Амбидентатные лиганды – содержат несколькоразличных донорных атомов
Роданид анион SCN-: если донорный атом S – тиоцианато-лиганд,
если донорный атом N – изотиоцианато-лиганд
Цианид ион CN-: если донорный атом C – циано-лиганд, если
донорный атом N – изоциано-лиганд.
нитро-лиганд
нитрито-лиганд
28.
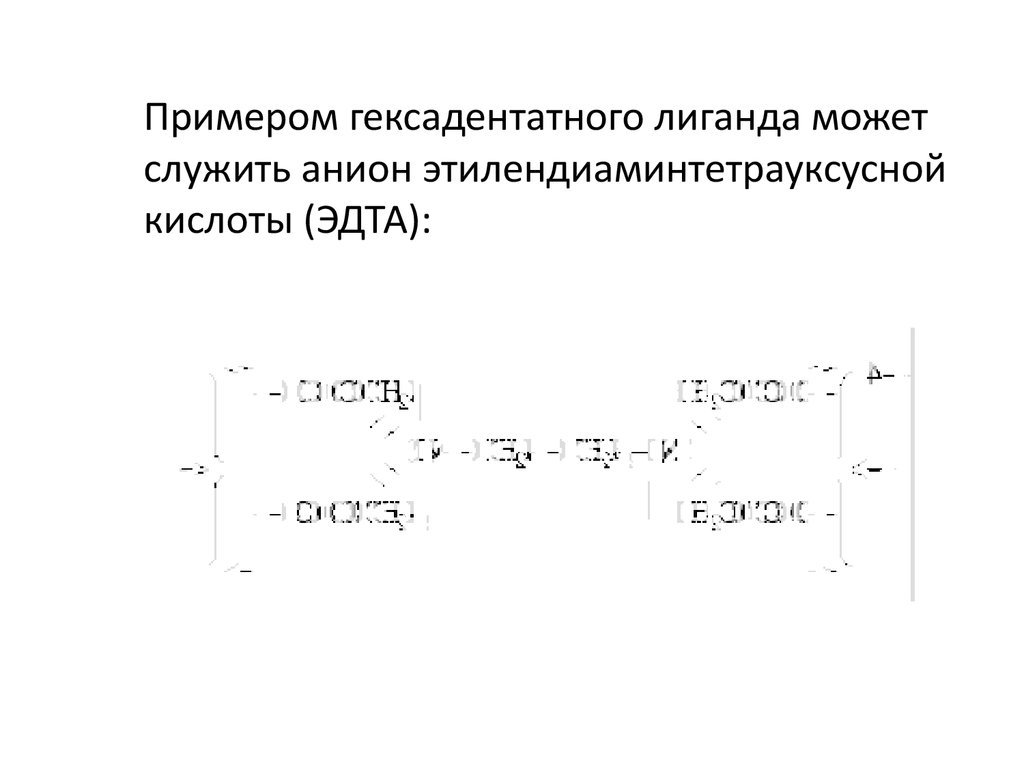
Примером гексадентатного лиганда можетслужить анион этилендиаминтетрауксусной
кислоты (ЭДТА):
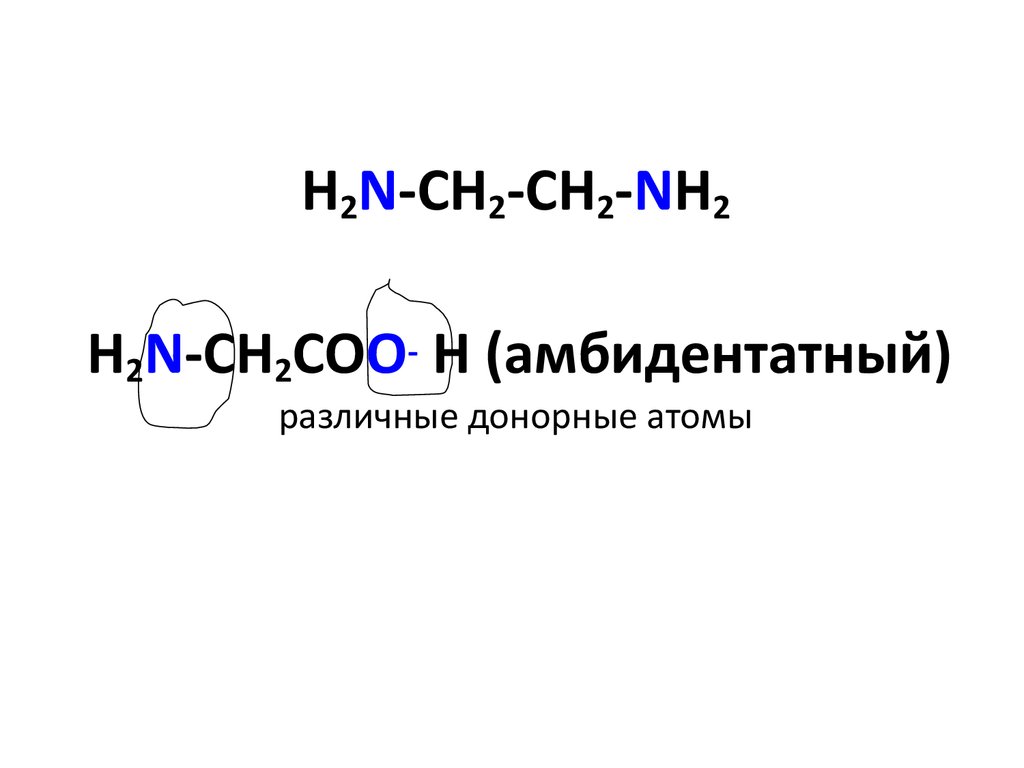
29. H2N-CH2-CH2-NH2 H2N-CH2COO- H (амбидентатный) различные донорные атомы
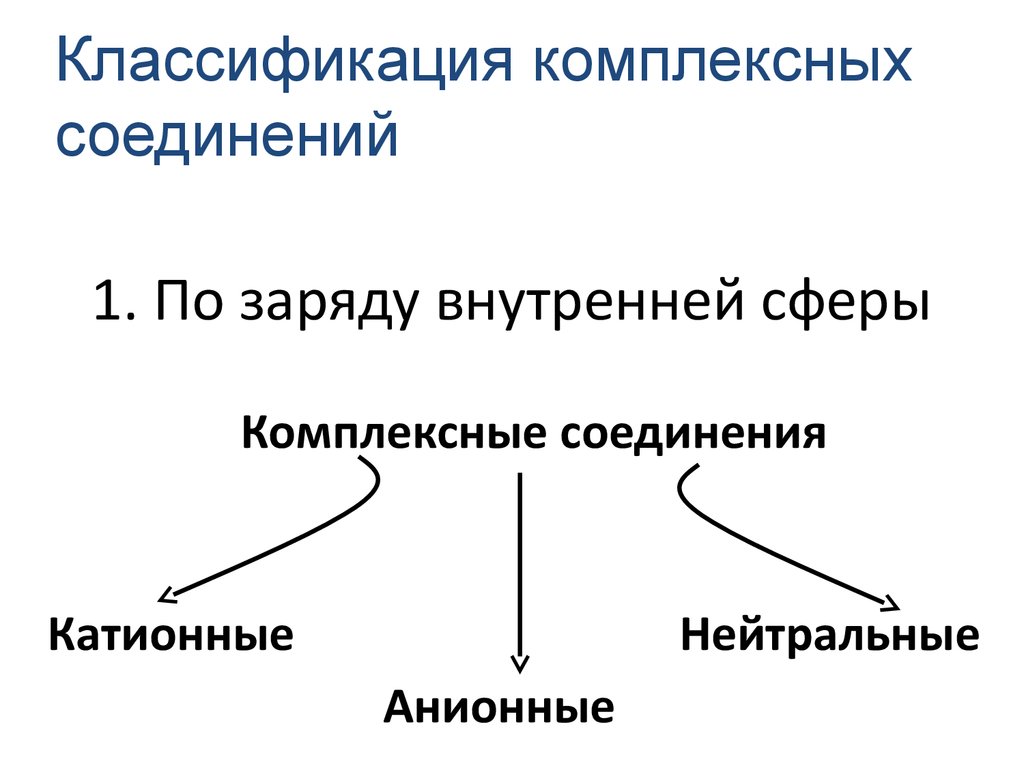
30. 1. По заряду внутренней сферы
Классификация комплексныхсоединений
1. По заряду внутренней сферы
Комплексные соединения
Катионные
Нейтральные
Анионные
31. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6]
2+[Cu(NH3)4]SO4 Na3[Co(NO2)6]
+
[Co(NH3)4Cl2]Cl
0
[Pt(NH3)2Cl2]
0
[Fe(CO)5]
3-
3-
K3 [Fe(CN) 6]
32.
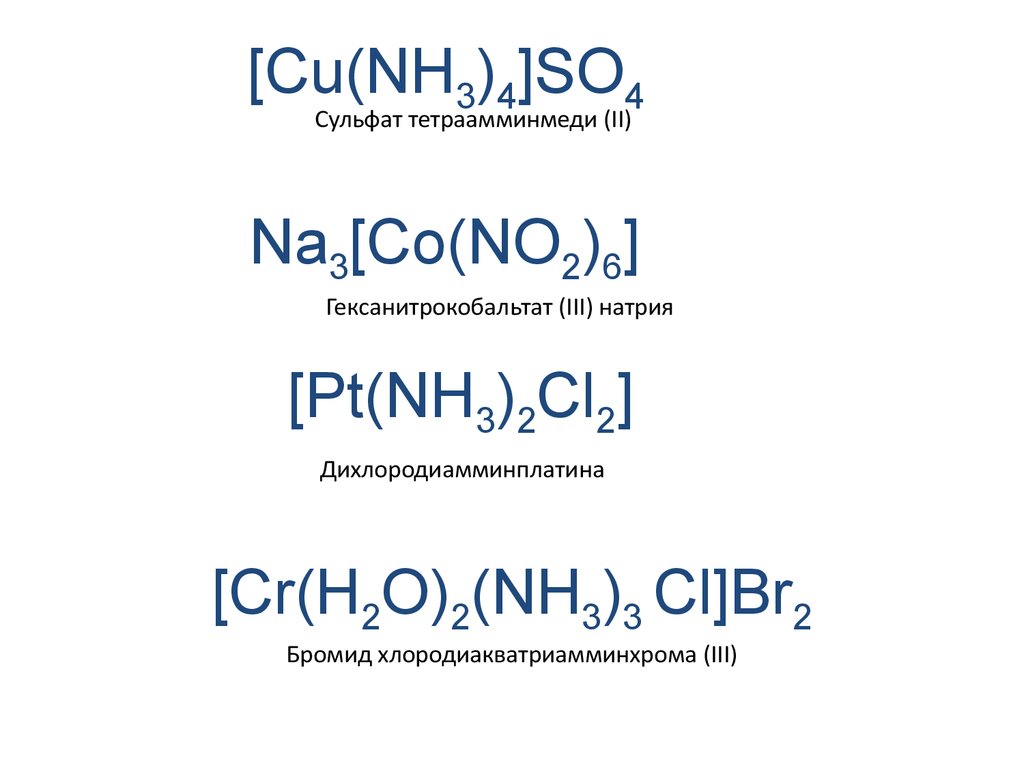
[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)
Na3[Co(NO2)6]
Гексанитрокобальтат (III) натрия
[Pt(NH3)2Cl2]
Дихлородиамминплатина
[Cr(H2O)2(NH3)3 Cl]Br2
Бромид хлородиакватриамминхрома (III)
33.
По природе лиганда1) Аммиакаты — комплексы, в которых лигандами
служат молекулы аммиака, например:
[Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — комплексы, в которых
лигандом выступает вода:
[Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в
которых лигандами являются молекулы
оксида углерода(II):
[Fe(CO)5], [Ni(CO)4].
34.
4) Ацидокомплексы — комплексы, в которыхлигандами являются кислотные остатки.
K2[PtCl4], H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексы, в которых в
качестве лигандов выступают гидроксид-ионы:
Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
6) Смешанные комплексы включают в себя
различные лиганды. Например:
[Pt(NH3)2Cl2], (NH4)2[Co2(C2O4)2(OH)2]
35.
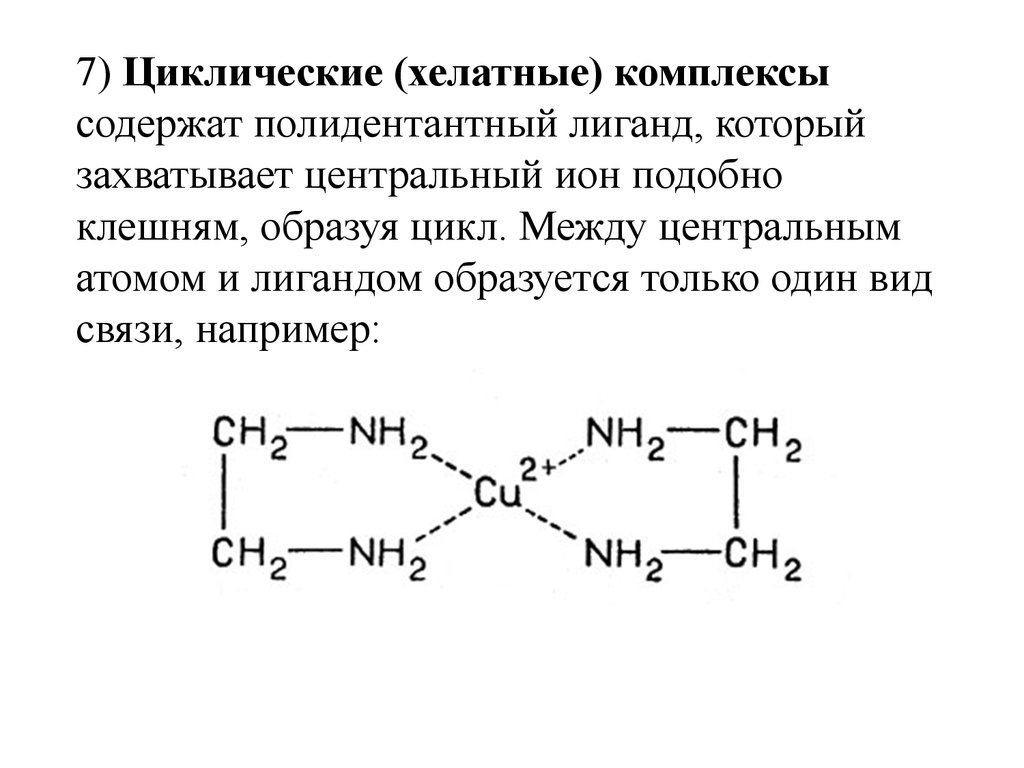
7) Циклические (хелатные) комплексысодержат полидентантный лиганд, который
захватывает центральный ион подобно
клешням, образуя цикл. Между центральным
атомом и лигандом образуется только один вид
связи, например:
36.
8) Внутрикомплексные соединения – комплексы, вкоторых полидентантный лиганд образует с
центральным атомом циклическое соединение за счет
разных типов связи: донорно-акцепторной и ионной.
Лиганд
NH2CH2COO- (глицинат-ион)
относят
к
категории бидентатных лигандов, образующих две химические
связи с комплексообразователем – через атом кислорода
карбоксильной группы и через атом азота аминогруппы.
37.
НоменклатураОсновы современной номенклатуры комплексных
соединений были заложены Альфредом Вернером. До его
работ в этой области химии не существовало никакой
системы. Комплексные соединения называли, руководствуясь
их внешним видом или происхождением, например:
красная кровяная соль
K3[Fe(CN)6]
желтая кровяная соль
K 4[Fe(CN)6]
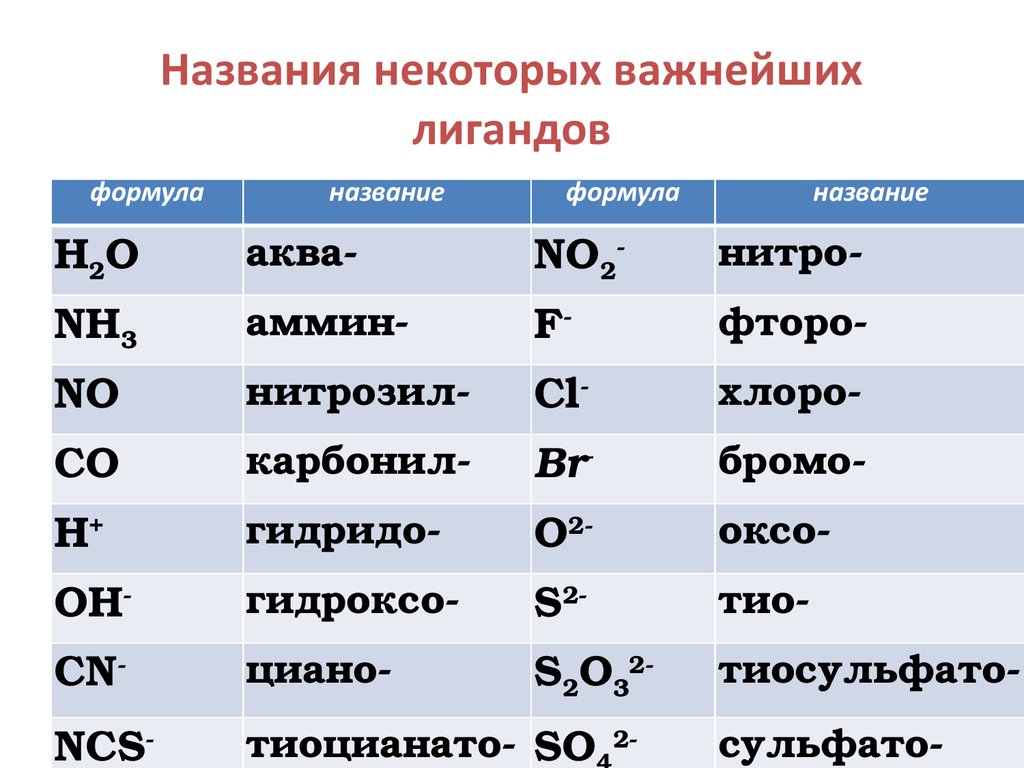
38. Названия некоторых важнейших лигандов
формуланазвание
формула
название
H2O
аква-
NO2-
нитро-
NH3
аммин-
F-
фторо-
NO
нитрозил-
Cl-
хлоро-
CO
карбонил-
Br-
бромо-
H+
гидридо-
O2-
оксо-
OH-
гидроксо-
S2-
тио-
CN-
циано-
S2O32-
тиосульфато-
NCS-
тиоцианато- SO
2-
сульфато-
39. Номенклатура комплексных соединений
+3K3 [Fe(CN)6]
• Гексацианоферрат(III) калия
+2
[Cu(NH3)4]Cl2
• Хлорид тетраамминмеди(II)
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
H2O – аква
NH3 – аммин
Cl- – хлороNO2- - нитро
CN- - цианоSCN- - родано-
Порядок перечисления лигандов:
1. Анионные: H-, O2-, OH-, простые анионы, многоатомные анионы,
органические в алфавитном порядке
2. Нейтральные: NH3, H2O и т.д.
3. Катионные: N2H5+ и т.д.
40.
Соль содержит комплексный катион[Cо(NH3)4Cl2]Cl
хлорид дихлоротетраамминкобальта (III)
-называют анион соли (хлорид);
-называют входящие во внутреннюю сферу лиганды-анионы
с окончанием на «о» (хлоро), указывая их количество (2-ди):
дихлоро;
-называют лиганды, представляющие собой нейтральные
молекулы (аммин), указывая их количество (4-тетра);
-называют центральный ион в русской транскрипции в
родительном падеже (кобальта)
- указывают в скобках заряд иона-комплексообразователя
римскими цифрами (III)
41.
Соль содержит комплексный анионK4[Fe(CN)6]
гексацианоферрат (II) калия
-называют лиганды-анионы с окончанием на «о» с
указанием их количества (гексациано);
-называют
комплексообразователь,
используя
латинское название элемента с прибавлением
суффикса «ат» (феррат);
-указывают
в
скобках
заряд
ионакомплексообразователя римскими цифрами (II);
-называют катион внешней сферы в родительном
падеже (калия)
42.
Нейтральный комплекс[Co2(CO)8]
октакарбонилдикобальт
[Сo(NH3)3 (NO2)2Cl]
хлородинитритотриамминкобальт
-названия комплексов без внешней сферы состоят из
одного слова;
-указывается число и названия лигандов (для лигандов
каждого вида отдельно);
-называют центральный атом в именительном падеже (в
случае многоядерных комплексов – с указанием числа
центральных атомов).
43. Упражнение 1
Первое основание Рейзе [Pt(NH3)4](OH)2
Соль Чугаева [Pt(NH3)5Cl]Cl3
Соль Цейзе K[PtCl3C2H4]
Пурпуреосоль [Co(NH3)5Cl]Cl2
Кроцеосоль [Co(NH3)4(NO2)2]Cl
44. Упражнение 2
• Гексанитрокобальтат(III) натрияNa3[Co(NO2)6]
• Гидроксид диаммминсеребра(I)
[Ag(NH3)2]OH реактив Толленса
• Тетраиодомеркурат(II) калия
K2[HgI4]
реактив Несслера
• Тетрароданомеркурат(II) аммония
(NH4)2[Hg(SCN)4]
45. Комплексные соединения в растворах
46.
Химические свойстваКомплексные соединения можно условно
разделить на две большие группы: электролиты и
неэлектролиты.
К неэлектролитам относят нейтральные комплексы.
1. Отщепление ионов внешней сферы
Комплексы, имеющие ионную внешнюю сферу, в
растворе подвергаются
диссоциации на комплексный ион и ионы
внешней сферы и ведут себя в разбавленных
растворах как сильные электролиты.
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-
47. Комплексные соединения в растворах
Первичная диссоциация комплексных соединенийK3[Fe(CN)6] = 3K+ + [Fe(CN)6]3[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42[Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl-
48.
Если во внешней сфере комплексного соединения находятсягидроксид-ионы, то это соединение – сильное
основание (диссоциация идет нацело, рН > 7).
Пример соединения этого типа – гидроксид
тетраамминцинка (II):
[Zn(NH3)4](OH)2 = [Zn(NH3)4]2+ + 2OH-
Комплексные соединения с внешнесферными катионами
водорода, например, тетрафторобората водорода в водном
растворе нацело подвергаются протолизу. Они
являются сильными кислотами:
H[BF4] + H2O = [BF4]- + H3O+
49.
2. Обратимая диссоциация комплексов.Комплексные ионы подвергаются обратимой
электролитической диссоциации как слабые
электролиты.
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl–
(первичная диссоциация)
[Ag(NH3)2]+ ↔ Ag+ + 2 NH3
(вторичная диссоциация)
Вторичная диссоциация подчиняется
закону действия масс и характеризуется
соответствующей константой равновесия, которая
называется константой нестойкости комплексного иона:
50. Вторичная диссоциация комплексов
[Ag(NH3)2]+[Ag(NH3)]+
[Ag(NH3)]+ + NH3
Ag+ + NH3
[Ag(NH3)2]+
Ag+ + 2NH3
[Ag+] [NH3]2
KH =
= 9,3.10-8
[ [Ag(NH3)2]+ ]
Диссоциация комплексов (или реакции обмена
лигандов на молекулы растворителя)
количественно характеризуется константами
нестойкости комплексов Kн .
51. K4 [Fe(CN)6]
Ковалентная(диссоциация по типу слабого электролита)
K4 [Fe(CN)6]
Ионная связь
(диссоциация по типу сильного электролита)
52. K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация
K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4первичная диссоциация53.
[Fe(CN)6 ] Fe +6(CN)вторичная диссоциация
4-
2+
Константа нестойкости (Кн):
Кн =
[Fe2+] [CN-]6
[Fe (CN)6] 4-
Kн = 1ּ10-31
(очень прочный комплекс)
-
54. [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс)
Куст.=1/ Кн55. Кн и Ку относятся только к комплексному иону!
Не забывайте !56. Вернер подтверждает Вернера
1893-4 гг. не были периодомутверждения теории.
Вернер 20 лет
не оставлял лаборатории
Для установления состава соединений
Вернер использовал:
1. Химический метод
2. Измерение электропроводности
Химический метод
При действии AgNO3
на 1 моль CrCl3. 6NH3 осаждается 3 моль Cl[Cr(NH3)6]Cl3
на 1 моль CrCl3. 5NH3 осаждается 2 моль Cl[Cr(NH3)5Cl]Cl2
на 1 моль CrCl3. 4NH3 осаждается 1 моль Cl[Cr(NH3)4Cl2]Cl
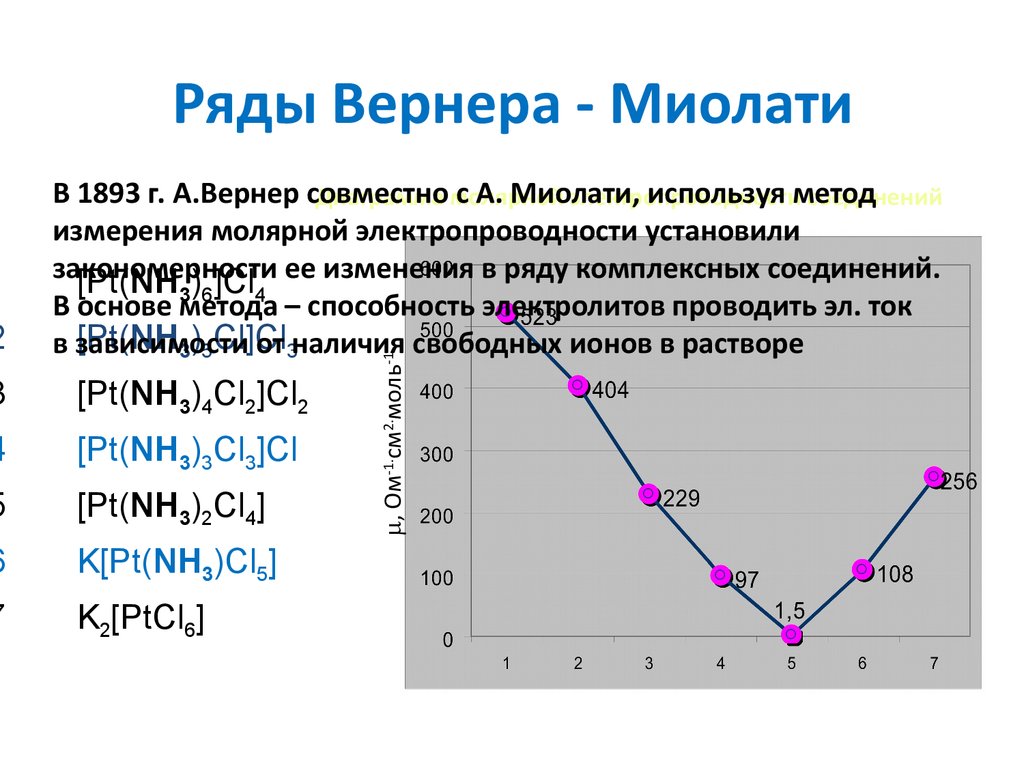
57. Ряды Вернера - Миолати
2В 1893 г. А.Вернер совместно
с А. Миолати,
используя метод
Диаграмма молярной
электропроводности
соединений
измерения молярной электропроводности установили
закономерности
[Pt(NH3)6]Cl4 ее изменения в ряду комплексных соединений.
В основе метода – способность электролитов проводить эл. ток
[Pt(NH3)5Cl]Cl
в зависимости
от 3наличия свободных ионов в растворе
3
[Pt(NH3)4Cl2]Cl2
4
[Pt(NH3)3Cl3]Cl
5
[Pt(NH3)2Cl4]
6
K[Pt(NH3)Cl5]
7
K2[PtCl6]
, Ом-1.см2.моль-1
1
Ряды Вернера - Миолати
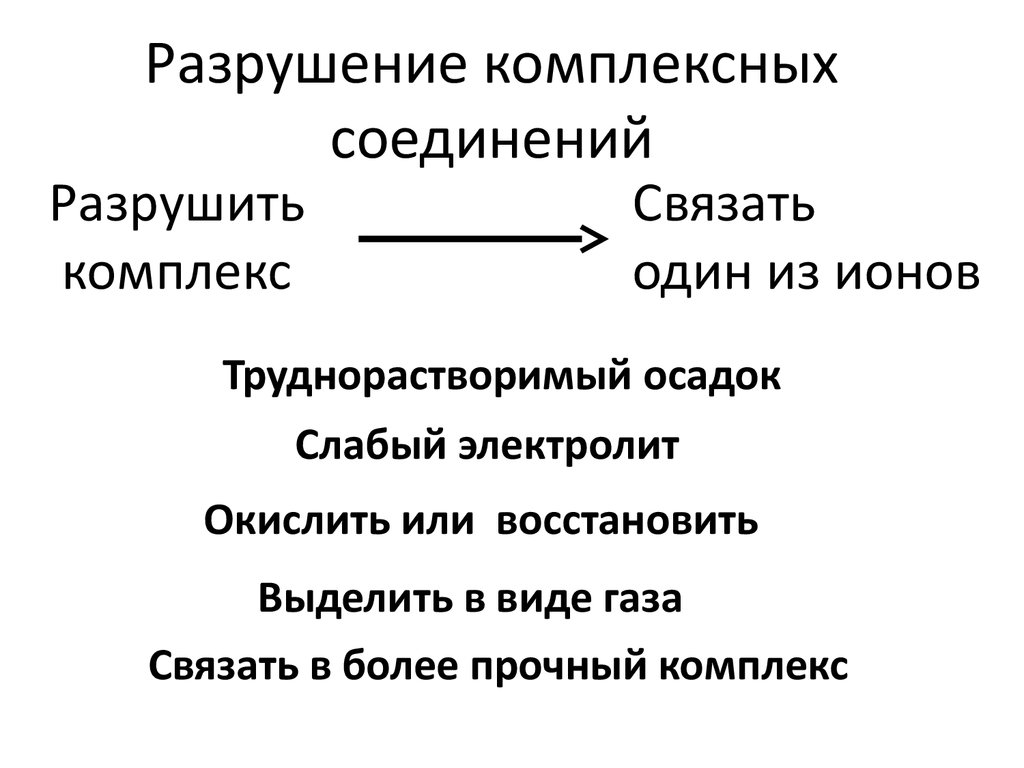
58. Разрушение комплексных соединений
Разрушитькомплекс
Связать
один из ионов
Труднорастворимый осадок
Слабый электролит
Окислить или восстановить
Выделить в виде газа
Связать в более прочный комплекс
59. [Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8
[Ag (NH3)2] Ag + 2 NH3+
+
Кн = 9,3 ·10-8
60. [Ag (NH3)2]++ KI =AgI+ NH3 +K+ ПРAgI = 1,5·10 -16
[Ag (NH3)2]++ KI =AgI + NH3 +K+ПРAgI = 1,5·10 -16
[Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3
Кн = 8·10-22
61. [Ag (NH3)2]+ Ag+ + 2 NH3
[Ag (NH3)2]+ Ag+ + 2 NH3+ KI
+ HNO3
+ KCN
Образование
NH4NO3
труднорастворимого
осадка
Образование
более прочного комплекса
62.
2. Придействии сильных кислот происходит
разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 + 3H2O
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 + 6H2O
63.
3. Нагревание (термолиз) всех аммиакатовприводит к их разложению, например:
[Cu(NH3)4]SO4 → CuSO4 + 4NH3
64.
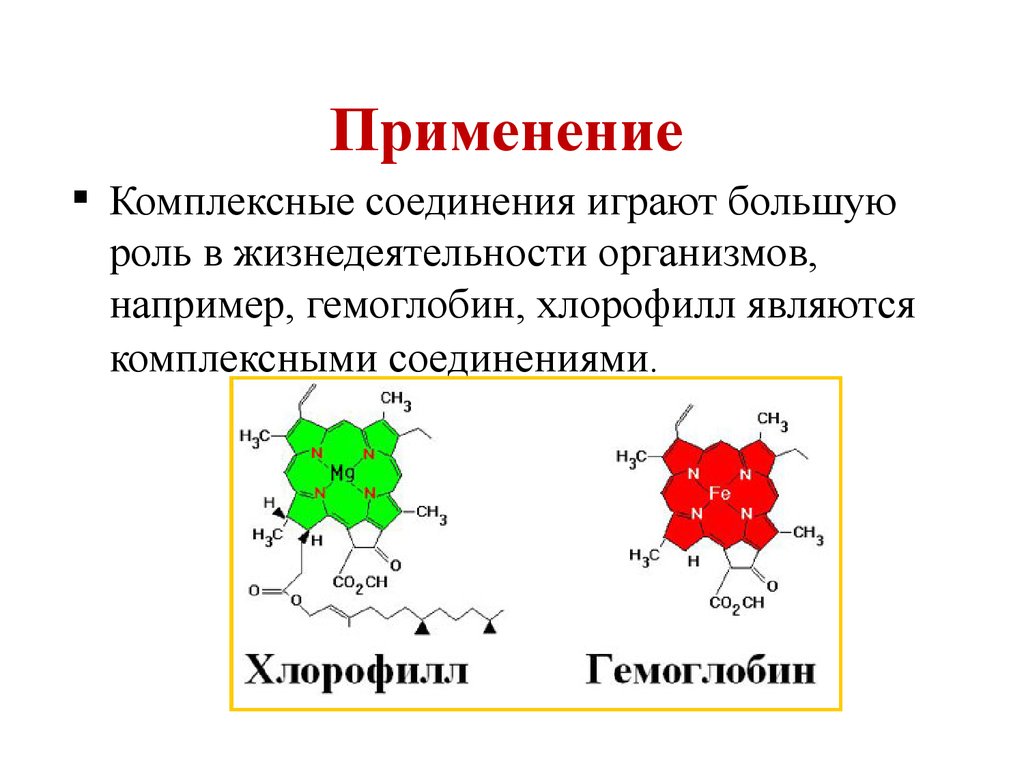
ПрименениеКомплексные соединения играют большую
роль в жизнедеятельности организмов,
например, гемоглобин, хлорофилл являются
комплексными соединениями.
65.
Комплексные соединения используются дляизвлечения металлов из руд. Например, для
отделения золота от породы руду обрабатывают
раствором цианида натрия в присутствии
кислорода:
4Au + O2 + 8NaCN + 2H2O = 4Na[Au(CN)2] + 4NaOH
Из полученного раствора золото выделяют
действием цинковых стружек:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
66.
Для получения чистых железа, никеля, кобальтаиспользуют термическое разложение карбонилов
металлов. Эти соединения - летучие жидкости,
легко разлагающиеся с выделением
соответствую-щих металлов.
[Fe(CO)5] (ж) →Fe(т) + 5CO(г)
67.
K4[Fe(CN)6] - желтая кровяная соль, содержащийион железа Fe2+, является реактивом на ионы
железа Fe3+ в растворе:
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3
берлинская лазурь
Fe4[Fe(CN)6]3 гексацианоферрат (II) железа (III)
используется как краситель.
68.
K3[Fe(CN)6] - красная кровяная соль являетсяреактивом на обнаружение ионов Fe2+ в
растворе:
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2
турнбуллева синь
Fe3[Fe(CN)6]2 гексацианоферрат (III) железа (II)
69.
Комплексные цианиды серебра K[Ag(CN)2]применяют для гальванического серебрения, так как
при электролизе растворов обычных солей серебра не
образуется плотно прилегающего слоя.
В машиностроительной технологии широко
используют K2[Ni(CN)4], из которого электролизом
хорошо осаждается никель (процесс никелирования).
Многие КС обладают каталитической активностью,
поэтому их широко используют в неорганическом и
органическом синтезах.
70.
Таким образом, с использованиемкомплексных соединений связана
возможность получения
многообразных химических
продуктов: лаков, красок, металлов,
фотоматериалов, катализаторов,
надежных средств для переработки и
консервирования пищи и т.д.
71.
[Ag(NH3)2]OH – гидроксид диамминсеребра (I)[Ag(NH3)2]OH → [Ag(NH3)2]+ + OH–
[Ag(NH3)2]+ ↔ Ag+ + 2 NH3
72.
Na[Al(OH)4] – тетрагидроксоалюминат натрияNa[Al(OH)4] →Na+ + [Al(OH)4]–
[Al(OH)4]– ↔ Al 3+ + 4 OH–
73.
ЗаданиеОпределите структуру молекул, дайте
название комплексу, запишите уравнения
первичной и вторичной диссоциации, К нест.
[Cu(NH3)4]SO4
Na2[Zn(OH)4]
[Cu(NH3)4]Cl2
[Co(NH3)3H2OCl2]NO3
Li[AlH4]
(NH4)2[PtCl4(OH)2]













![Na[BF4] Na3[AlF6] Na[BF4] Na3[AlF6]](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-17.jpg)
![Na3[AlF6] Na [AlCl4] Na3[AlF6] Na [AlCl4]](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-18.jpg)






![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6]](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-30.jpg)
















![K4 [Fe(CN)6] K4 [Fe(CN)6]](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-50.jpg)
![K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-51.jpg)

![[Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс) [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс)](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-53.jpg)


![[Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8 [Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-58.jpg)
![[Ag (NH3)2]++ KI =AgI+ NH3 +K+ ПРAgI = 1,5·10 -16 [Ag (NH3)2]++ KI =AgI+ NH3 +K+ ПРAgI = 1,5·10 -16](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-59.jpg)
![[Ag (NH3)2]+ Ag+ + 2 NH3 [Ag (NH3)2]+ Ag+ + 2 NH3](https://cf.ppt-online.org/files/slide/k/KgWiPo6f9re4SdwzUVm8q2GkBXMjn30FZuybY5/slide-60.jpg)











 Химия
Химия








