Похожие презентации:
Предельные углеводороды
1. урок № 3 - 4 в теме «ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ» 10 класс
Муниципальное бюджетное общеобразовательное учреждениесредняя многопрофильная школа № 65
г. Липецка
Презентацию
подготовила:
учитель химии высшей
категории
Малык Светлана
2. ТЕМА УРОКА: «Химические свойства алканов»
Цели урока:На основе представлений о составе и
строении молекул, природе химических
связей рассмотреть химические свойства
предельных углеводородов.
Обратить внимание на соблюдение правил
пользования бытовым газом вследствие
его взрывоопасности.
3. Теория строения органических соединений А.М. Бутлерова
2 положение: Свойства веществопределяются не только их
качественным и количественным
составом, но и порядком
соединения атомов в молекуле,
т.е. химическим строением
вещества.
=> Строение вещества
определяет его химические
свойства.
4. Тест по теме «Строение алканов»
Вставьте в текст пропущенные слова, термины, символы:1) Алканами называются углеводороды, в молекулах которых все атомы связаны ______ связями.
Их общая формула ______. Все атомы углерода в алканах находятся в состоянии ___
гибридизации. Оси гибридных орбиталей направлены к вершинам правильного _____, угол
между ними составляет ____. Относительно одинарных С-С связей ______ свободное вращение.
2) Валентное состояние атома углерода в алканах:
1. первое; 2. второе; 3. третье.
3) Оси гибридных орбиталей в метане направлены к вершинам:
1. куба; 2. тетраэдра; 3. параллелепипеда; 4. октаэдра.
4) Величина угла между осями гибридных орбиталей в алканах составляет:
1. 180о 2. 120о 3. 109о28/ 4. 90о
5) Длина связи С-С в алканах составляет:
1. 0,120нм 2. 0, 134 нм 3. 0,140нм 4. 0,154нм
6) Какая связь в алканах длинее?
1. С-Н 2. С-С 3.длины С-Н и С-С связей одинаковы
7) Тип углерод-углеродной связи в молекуле этана:
1. ионная 2. ковалентная полярная 3. водородная 4. ковалентная неполярная
8) Какова валентность углерода в алканах?
1. Один 2. два 3. три 4. четыре
9) Число первичных, вторичных, третичных и четвертичных атомов углерода в углеводороде,
имеющем формулу:
равно соответственно:
СН3
1. 5,1,1,1
2. 2,1,1,1
3. 4,1,2,1
4. 2,3,1,1
|
CH3- C- CH2- CH-CH3
|
|
CH3
CH3
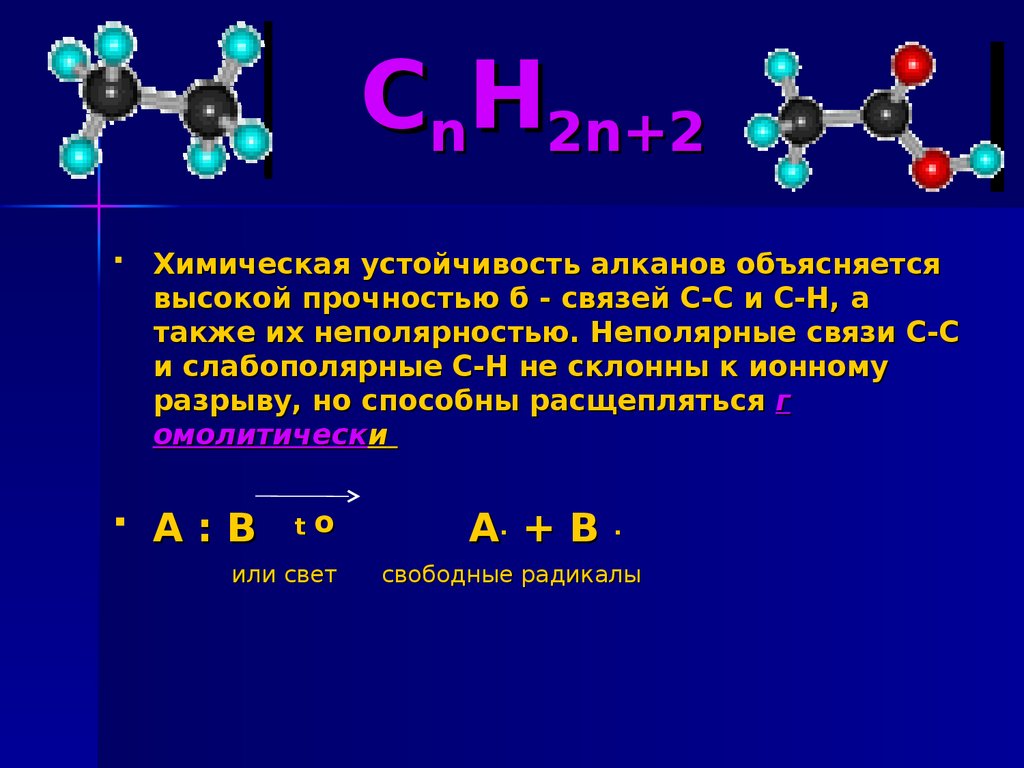
5. CnH2n+2
Химическая устойчивость алканов объясняетсявысокой прочностью б - связей С-С и С-Н, а
также их неполярностью. Неполярные связи С-С
и слабополярные С-Н не склонны к ионному
разрыву, но способны расщепляться г
омолитически
А:В
t
o
или свет
А. + В
.
свободные радикалы
6. Строение метана и этана
7. Характеристики связей в алканах
СВЯЗЬC-C
C-Н
Энергия
связи,
кДж/моль
Длина
связи, нм
Дипольный
момент, D
348
0, 154
0
414
0, 110
0, 40
8. I. Наиболее характерны для алканов реакции замещения Протекают по механизму радикального замещения, обозначаемого Sr (англ.
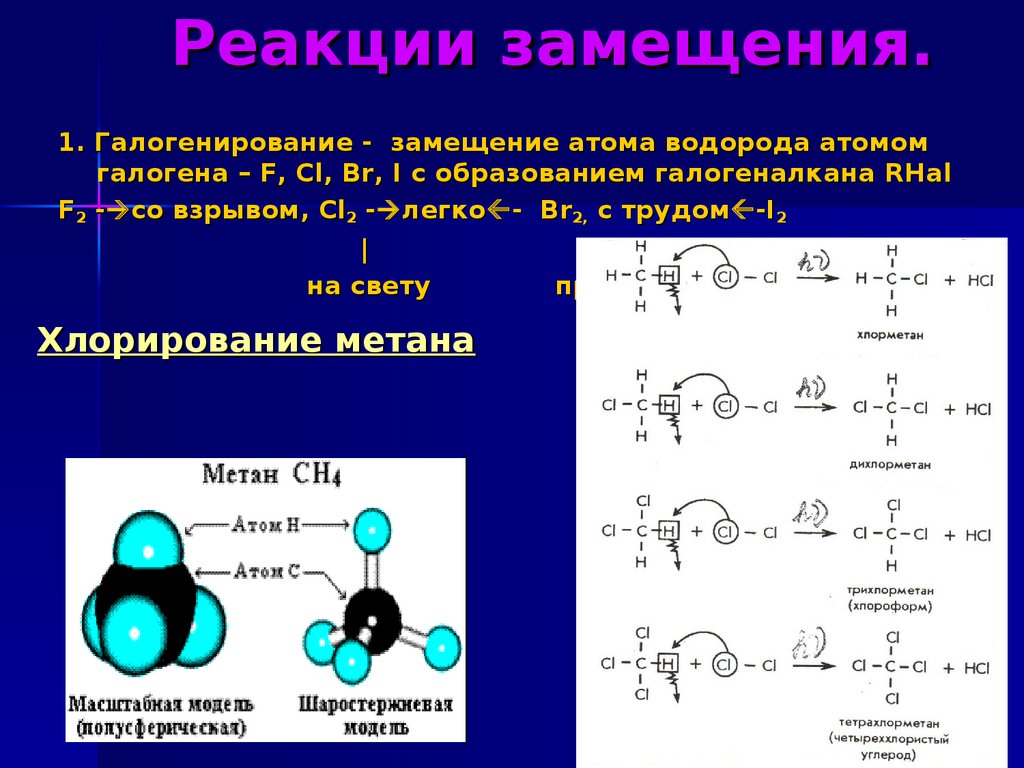
substitution radicalic).9. Реакции замещения.
1. Галогенирование - замещение атома водорода атомомгалогена – F, Cl, Br, I с образованием галогеналкана RHal
F2 - со взрывом, Cl2 - легко - Br2, с трудом -I2
|
|
на свету
при to
Хлорирование метана
10. Механизм реакции замещения
Состоит из 3 стадий:-зарождение
цепи
-развитие
цепи
-обрыв цепи
Cl2
свет
2Cl·
CH + Cl·
·CH3 + HCl
4
·CH3 + Cl2
·CH3 + Cl·
2Cl·
2·CH3
Cl2
C 2 H6
CH3Cl + Cl·
CH3Cl
11.
Перед нами типичнаяАкадемик Н.Н. Семенов
(1896-1986г.), советский
ученый, один из
основоположников
химической физики,
разработал теорию
цепных реакций, за что в
1956г. был удостоен
Нобелевской премии.
цепная реакция…
Теоретически
хлорирование метана
может идти до
бесконечности, т.е. до тех
12. Общая схема реакции Sr
* Замещение ухлорметана идет легче,
чем у метана, так как
атом хлора поляризует
связи С-Н и делает их
реакционноспособными.
(36%)
(64%)
* Замещение легче
всего идет у
третичного атома
углерода, сложнее – у
вторичного,
первичного атомов.
13. 2. Нитрование алканов -
2. Нитрованиеалканов замещение атома водорода нитрогруппой –
NO2 с образованием нитроалканов R-NO2
Нитрующий реагент: азотная кислота HNO3 (HO-NO2)
нитрогруппа
Условия: HNO3 - разбавл., t = 140 , P – повышенное или
o
o
нормальное
Именная реакция: реакция М.И. Коновалова
140 C°,
C°,P
Схема реакции: R-H + HO-NO
2
R-NO2 + H2O
Разб.
CH4 + HO-NO2
Разб.
140 C°,
C°,P
CH3-NO2 + H2O
нитрометан
14. 3. Сульфирование алканов -
3. Сульфирование алканов замещение атома водорода сульфогруппой – SO3H собразованием алкансульфокислот RSO3H
Сульфирующий реагент: серная кислота H2SO4 (HO-SO3H)
сульфогруппа
Условия: H2SO4 - концентрированная, to
Схема реакции:
R-H + HO-SO3H
t°
R-SO3H+ H2O
Конц.
CH4 + HO-SO3H
Конц.
t°
CH3-SO3H+ H2O
сульфометан
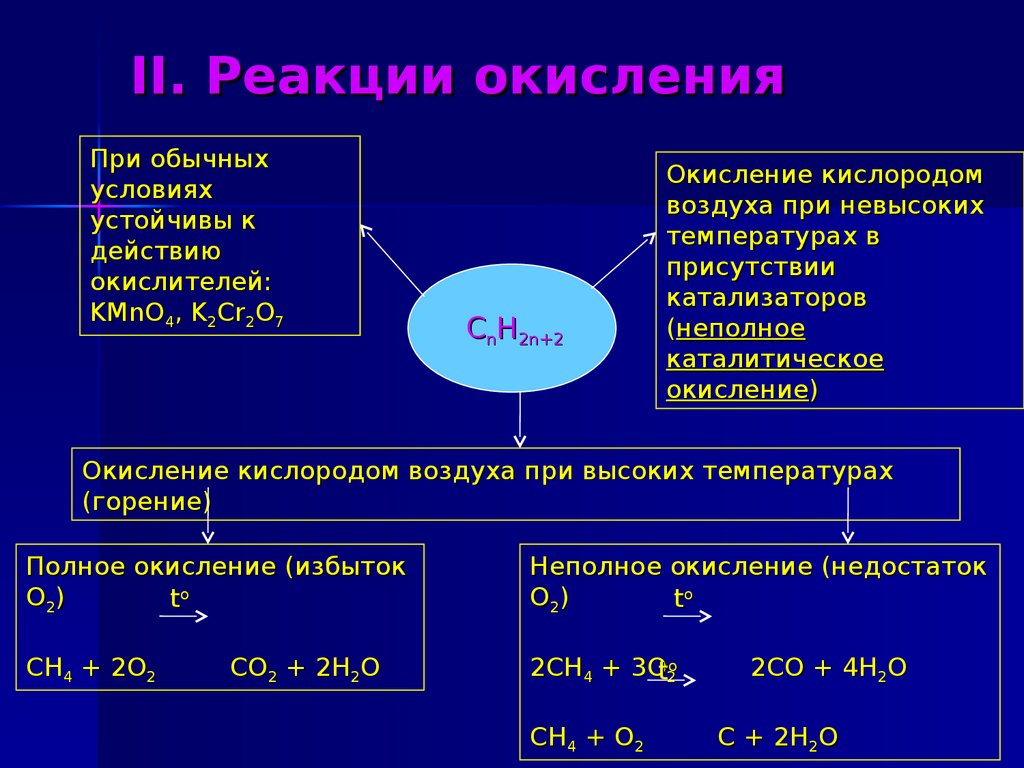
15. II. Реакции окисления
При обычныхусловиях
устойчивы к
действию
окислителей:
KMnO4, K2Cr2O7
CnH2n+2
Окисление кислородом
воздуха при невысоких
температурах в
присутствии
катализаторов
(неполное
каталитическое
окисление)
Окисление кислородом воздуха при высоких температурах
(горение)
Полное окисление (избыток
О2)
to
Неполное окисление (недостаток
О2)
to
CH4 + 2O2
2CH4 + 3Ot2o
CO2 + 2H2O
CH4 + O2
2CO + 4H2O
C + 2H2O
16. Опыт «Горение метана»
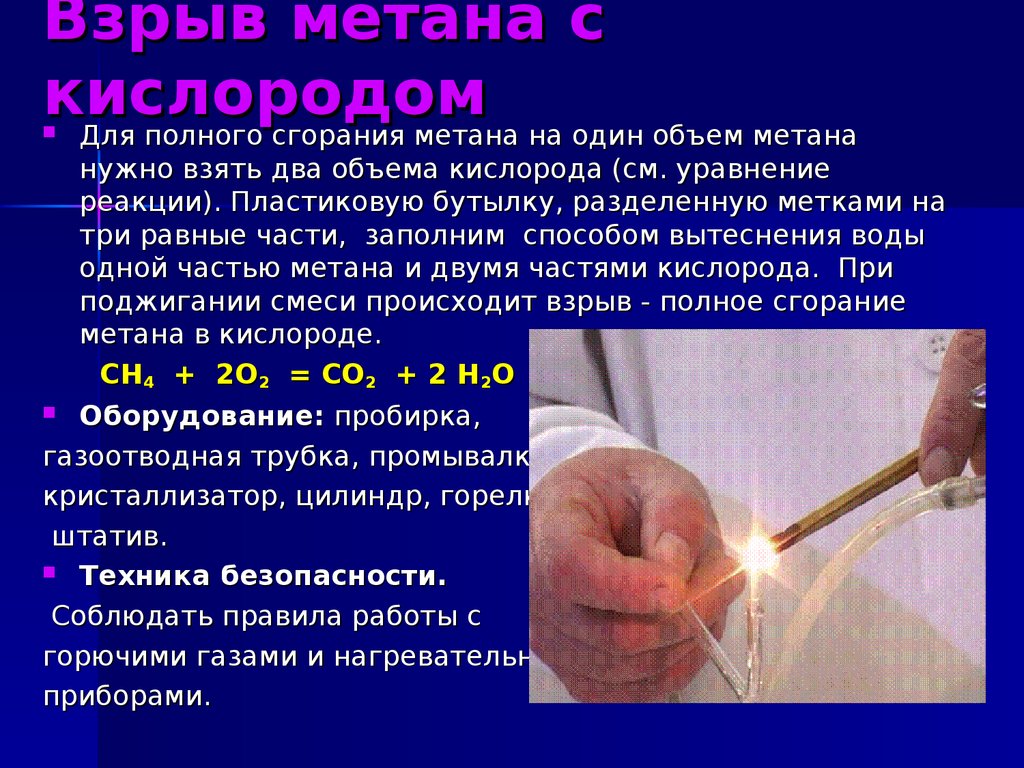
17. Взрыв метана с кислородом
Для полного сгорания метана на один объем метананужно взять два объема кислорода (см. уравнение
реакции). Пластиковую бутылку, разделенную метками на
три равные части, заполним способом вытеснения воды
одной частью метана и двумя частями кислорода. При
поджигании смеси происходит взрыв - полное сгорание
метана в кислороде.
CH4 + 2О2 = СО2 + 2 Н2О
Оборудование: пробирка,
газоотводная трубка, промывалка,
кристаллизатор, цилиндр, горелка,
штатив.
Техника безопасности.
Соблюдать правила работы с
горючими газами и нагревательными
приборами.
18. Неполное каталитическое окисление
R-OHt
кат.1
o
1
спирт
t
кат.2
o
2
CnH2n+2 + O2
to3
кат.3
to4
кат.4
а) CH4 +
б) CH4 +
H
R-C-R+ H2O
||
О
Кетон
число «С» ≥ 3
R-C=O + H2O
|
OH
в) 2CH4
метанол
|
альдегид
Карбоновые кислоты
to
O2кат. 2CH3OH
метанол
to
O2кат. H-C=O
R-C=O + H2O
|
H
+ H2O
to
+ кат.
O2
2H-C=O + H2O
|
OH
метановая кислота
19. CnH2n+2
В обычных условиях алканы химическиинертны. Они устойчивы к действию
многих реагентов: не взаимодействуют с
концентрированными серной и азотной
кислотами, с концентрированными и
расплавленными щелочами, не
окисляются сильными окислителями –
перманганатом калия KMnO4 и т. п.



















 Химия
Химия








