Похожие презентации:
Углеводороды
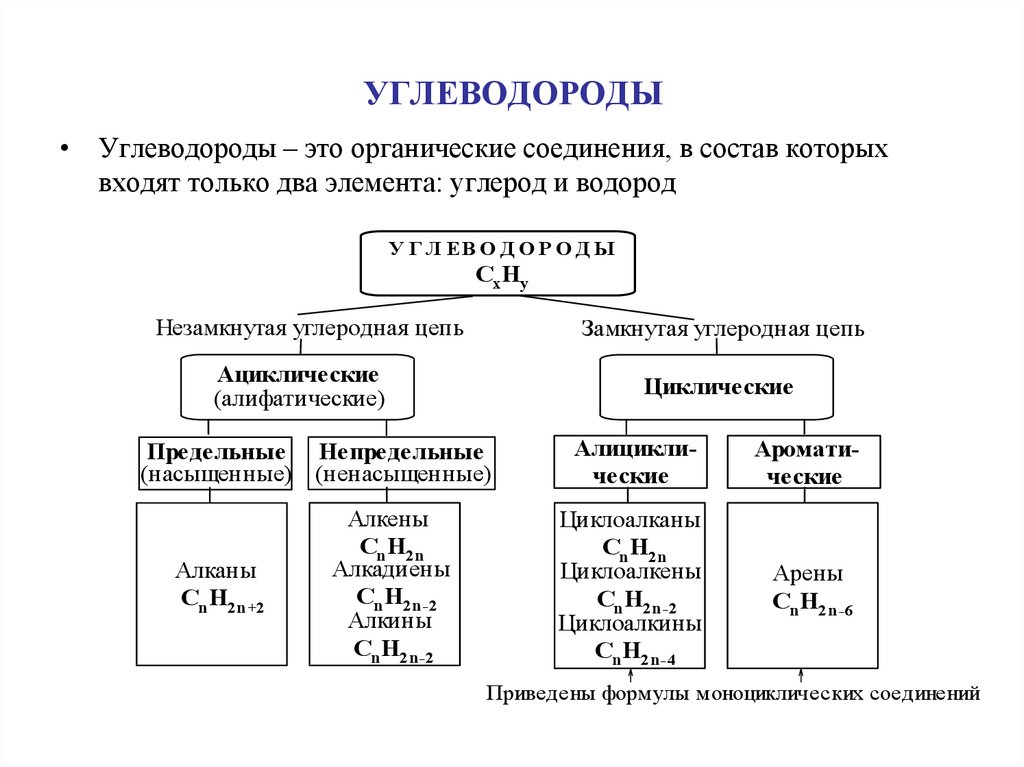
1. УГЛЕВОДОРОДЫ
• Углеводороды – это органические соединения, в состав которыхвходят только два элемента: углерод и водород
У Г Л ЕВ О Д О Р О Д Ы
Cx Hy
Незамкнутая углеродная цепь
Замкнутая углеродная цепь
Ациклические
(алифатические)
Циклические
Предельные Непредельные
(насыщенные) (ненасыщенные)
Алканы
Cn H2n+2
Алкены
Cn H2n
Алкадиены
Cn H2n-2
Алкины
Cn H2n-2
Алициклические
Ароматические
Циклоалканы
Cn H2n
Циклоалкены
Cn H2n-2
Циклоалкины
Cn H2n-4
Арены
Cn H2n-6
Приведены формулы моноциклических соединений
2. АЛКАНЫ
• Алканы – ациклические насыщенные (предельные) углеводородыобщей формулы СnH2n+2
Гомологический ряд - ряд родственных соединений с
однотипной структурой, в котором каждый последующий
член ряда отличается от предыдущего на постоянную
группу атомов - гомологическую разность –CH2–
CH4 – метан
C11H24 – ундекан
C2H6 – этан
C3H8 – пропан
C4H10 – бутан
C5H12 – пентан
C6H14 – гексан
C7H16 – гептан
C8H18– октан
C9H20 – нонан
C10H22 – декан
C12H26 – додекан
C13H28 – тридекан
C14H30 – тетрадекан
…
C20H42 – эйкозан
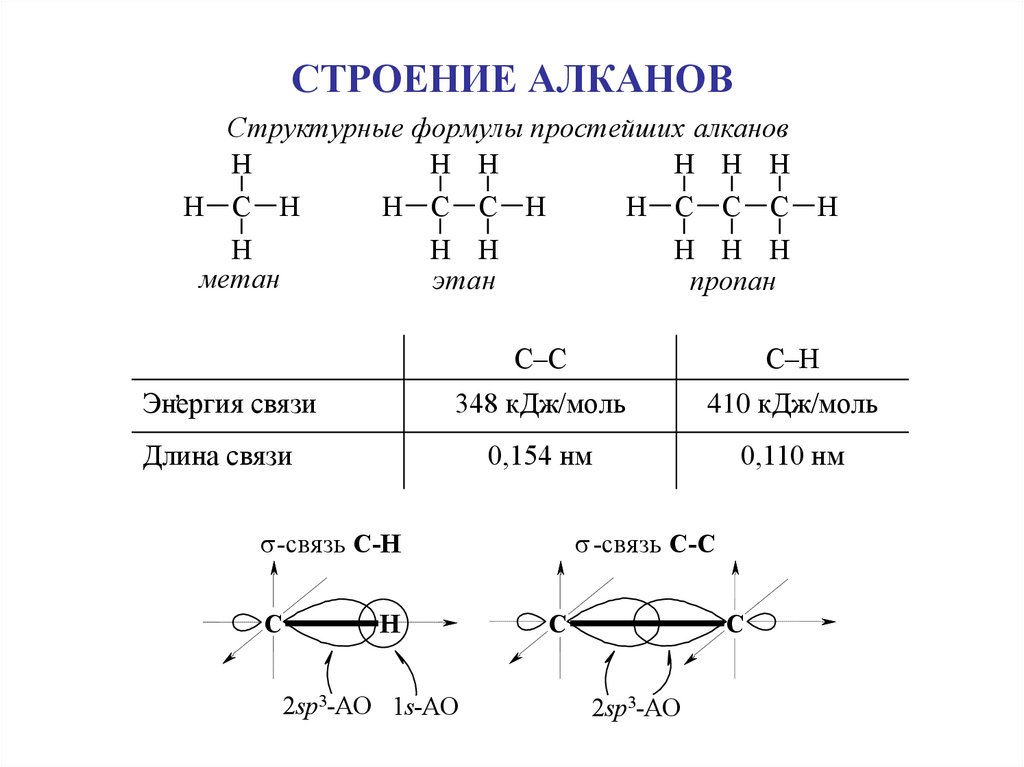
3. СТРОЕНИЕ АЛКАНОВ
Структурные формулы простейших алкановH
H H
H H H
H C H
H C C H
H C C C H
H
H H
H H H
метан
этан
пропан
,
Энергия связи
С–С
С–Н
348 кДж/моль
410 кДж/моль
0,154 нм
0,110 нм
Длина связи
-cвязь С-C
-cвязь С-Н
C
H
2sp3-AO 1s-AO
C
C
2sp3-AO
4.
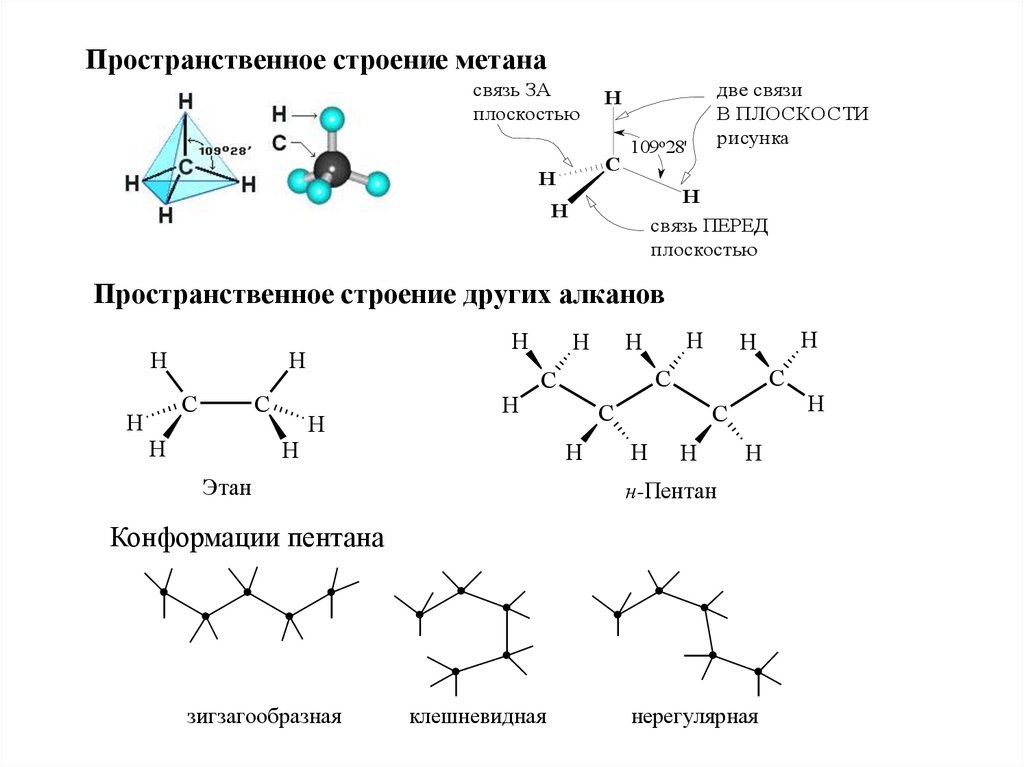
Пространственное строение метанасвязь ЗА
плоскостью
H
C
H
109о28'
две связи
В ПЛОСКОСТИ
рисунка
H
связь ПЕРЕД
плоскостью
H
Пространственное строение других алканов
C
H
H
H
H
C
H
H
H
H
Этан
C
C
H
C
H
H
H
н-Пентан
Конформации пентана
зигзагообразная
клешневидная
H
H
C
C
H
H
H
нерегулярная
H
5.
НОМЕНКЛАТУРА АЛКАНОВ• Правилами ИЮПАК для простейших алканов приняты
исторически сложившиеся (тривиальные) названия:
СН4 – метан, СН3СH3 – этан, СН3СH2CH3 – пропан,
СН3СH2CH2CH3 – бутан, СH(CH3)3 – изобутан
• Начиная с пятого гомолога, названия нормальных
(неpазветвленных) алканов строят в соответствии с числом
атомов углерода, используя греческие числительные и
суффикс -ан: пентан (С5), гексан (С6), гептан (С7)
• Названия одновалентных углеводородных радикалов,
произведенных от алканов, строят по названию
соответствующего алкана, заменяя суффикс -ан на -ил.
Общее название таких радикалов алкилы (обозн. Alk), общая
формула: -СnН2n+1
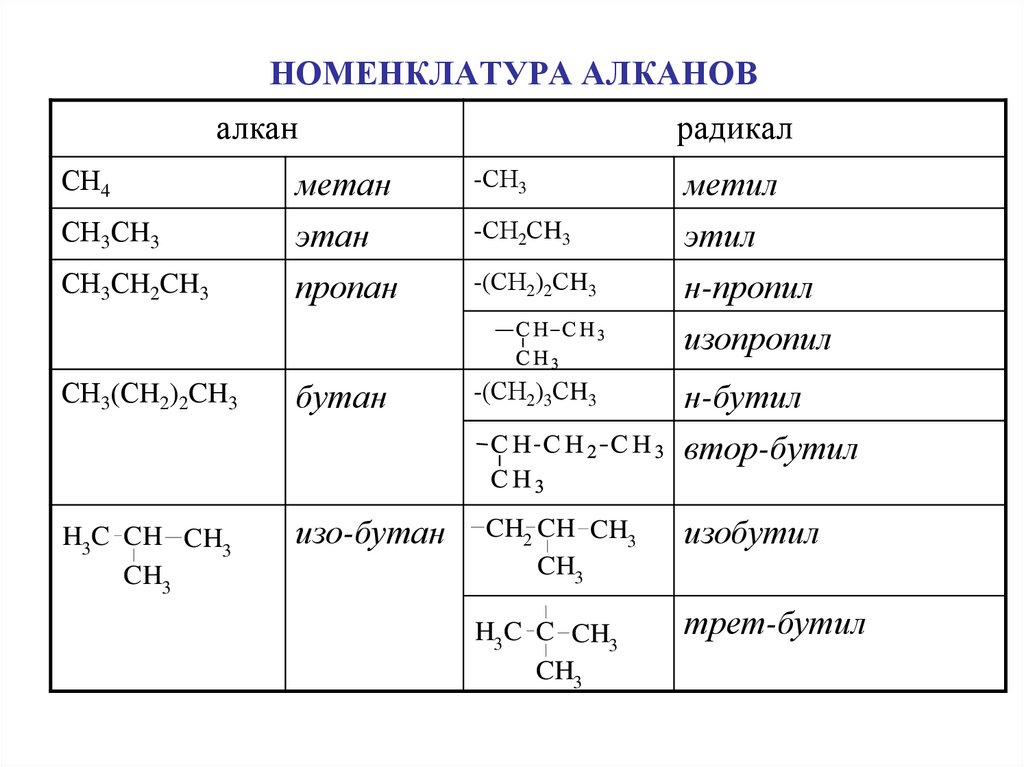
6. НОМЕНКЛАТУРА АЛКАНОВ
алканСН4
радикал
-СН3
СН3СH3
метан
этан
-СН2СH3
метил
этил
СН3СH2CH3
пропан
-(СН2)2СH3
н-пропил
изопропил
СН3(СH2)2CH3
бутан
H3 C CH CH3
CH3
изо-бутан
-(СН2)3СH3
CH2 CH CH3
CH3
H3 C C CH3
CH3
н-бутил
втор-бутил
изобутил
трет-бутил
7.
Порядок построения названия разветвленного алкана:1. Выбирают главную углеродную цепь, которая должна быть самой длинной и
наиболее разветвленной. Называют ее как соответствующий нормальный
алкан.
2. Нумеруют атомы углерода в цепи, начиная от конца, ближайшего к первому
ответвлению.
3. Называют все радикалы (заместители), указав впереди цифры, обозначающие
их местоположение в главной цепи. Эти цифры принято называть локантами.
Если есть несколько одинаковых заместителей, то для каждого из них через
запятую записывают локант, а их количество указывают умножающими
приставками: ди-, три-, тетра- и т.д. Локанты ставят перед приставкой
(префиксом) через дефис (например, 2,3-диметил).
4. Названия всех заместителей располагают в алфавитном порядке, не включая в
этот порядок умножающие приставки. Локанты и названия одного
заместителя отделяют от другого дефисом. Например, 2-метил-4,4-диэтил.
5. Объединяют все части названия по схеме: префиксы (локанты и названия
углеводородных радикалов) и корень – название главной цепи как
нормального алкана (греч. числительное + суффикс "ан").
CH3
метил
1
CH3
2
C
CH3
CH2
3
C
CH3 CH2
CH3
этил
метил
CH3
4
CH
5
CH2
6
CH3
этил
2,2,4-триметил-3,3-диэтилгексан
главная
цепь
гексан
8. ИЗОМЕРИЯ АЛКАНОВ
• Структурная изомерия – изомерия углеродного скелетаH3 C CH2 CH2 CH3 н-бутан
т.кип. -0,5 оС
H3C CH CH3
CH3
т.кип. -11,4 о С
C5H12 3 изомера,
C8H18 18 изомеров,
C10H22 75 изомеров
C20H42 более 300 тыс. изомеров
Пространственная изомерия (стереоизомерия):
– оптическая изомерия (энантиомерия)
– конформационная изомерия
метилпропан
(изобутан)
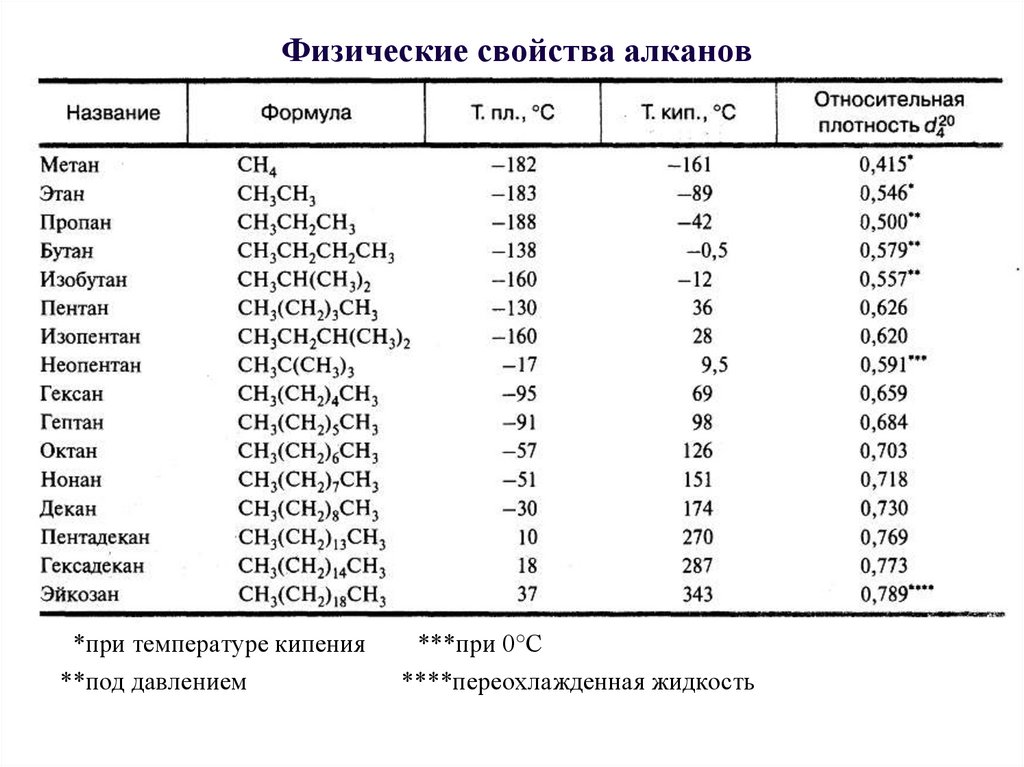
9. Физические свойства алканов
*при температуре кипения**под давлением
***при 0°С
****переохлажденная жидкость
10. ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Реакции алканов подразделяются на следующие типы:• реакции разложения (крекинг алканов) и реакции изомеризации
углеродного скелета с разрывом связей С–С;
• реакции замещения атома водорода или его отщепления
(дегидрирование алканов) - по связям С–Н, а также некоторые стадии
крекинга и изомеризации алканов;
• реакции окисления алканов с участием связей С–С и С–Н.
Крекинг (расщепление алканов)
1
CH3(CH2)4CH3
1
2
3
расщепление
CH4 + CH2
2
3
CH3 + CH2 CH2 CH2 CH2 CH3
CH3 CH2 + CH2 CH2 CH2 CH3
CH3 CH2 CH2 + CH2 CH2 CH3
1
2
3
CH CH2 CH2 CH3
CH3 CH3 + CH2 CH CH2 CH3 или CH2
CH3 CH2 CH3 + CH2 CH CH3
CH2 + CH3 CH2 CH2 CH3
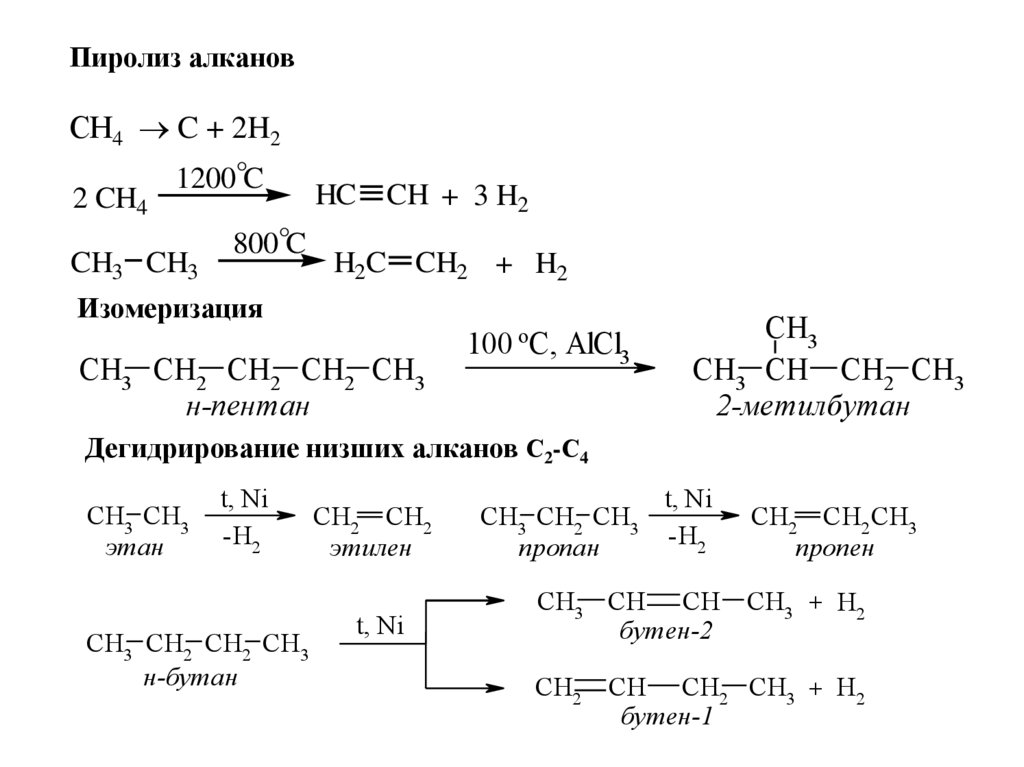
11.
Пиролиз алкановСН4 C + 2H2
1200°C
HC CH + 3 H2
2 CH4
800°C
CH3 CH3
H2C CH2 + H2
Изомеризация
CH3 CH2 CH2 CH2 CH3
н-пентан
100 oC, AlCl3
CH3
CH3 CH CH2 CH3
2-метилбутан
Дегидрирование низших алканов С2-С4
CH3 CH3
этан
t, Ni
-H2
CH3 CH2 CH2 CH3
н-бутан
CH2 CH2
этилен
t, Ni
CH3 CH2 CH3
пропан
t, Ni
-H2
CH2 CH2 CH3
пропен
CH3 CH CH CH3 + H2
бутен-2
CH2
CH CH2 CH3 + H2
бутен-1
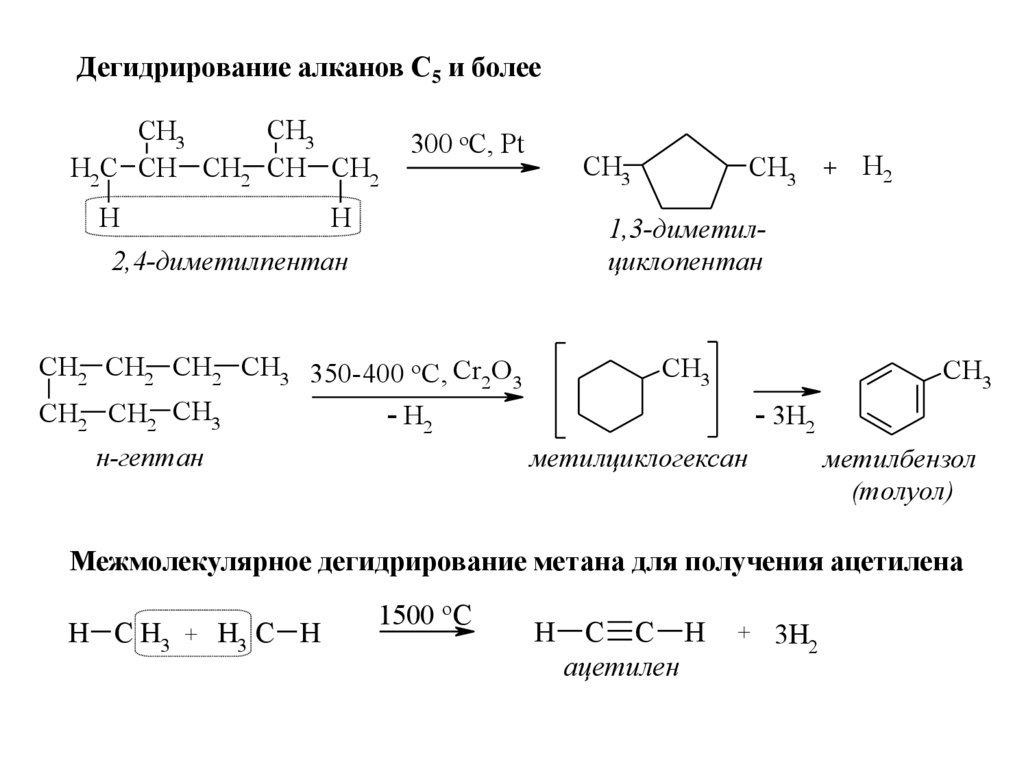
12.
Дегидрирование алканов С5 и болееCH3
CH3
H2C CH CH2 CH CH2
H
300 oC, Pt
CH3
H
CH3
+
H2
1,3-диметилциклопентан
2,4-диметилпентан
CH2 CH2 CH2 CH3 350-400 o C, Cr2 O 3
CH2 CH2 CH3
- H2
н-гептан
CH3
CH3
- 3H2
метилциклогексан
метилбензол
(толуол)
Межмолекулярное дегидрирование метана для получения ацетилена
H C H3 + H3 C H
1500 o C
H
C C H
ацетилен
+ 3H
2
13.
ОкислениеУравнение реакции горения алканов в общем виде:
CnH2n+2 + (3n + 1)/2 O2 n CO2 + (n + 1) H2O + Q
Неполное окисление
СН3 СН2–СН2 СН3 + 3О2 2СН3СООН + 2H2O
н-бутан
уксусная кислота
СН4 +
Н2О
800 оС , Ni
3Н2 + СО
синтез- газ
14. РЕАКЦИИ ЗАМЕЩЕНИЯ
Галогенирование алкановАктивность галогенов в этой реакции уменьшается в ряду: F > Cl > Br > I
h
CH4 + Cl2
CH3Cl + HCl
хлорметан
CH4
Cl2
Cl2
Cl2
Cl2
CCl4
CH2 Cl2
CHCl3
CH3 Cl
-HCl
-HCl
-HCl
-HCl
трихлорметан
дихлорметан
тетрахлорхлорметан
(хлороформ)
метан
Механизм радикального замещения SR
•Реакция замещения – такая химическая реакция, в которой атом
или атомная группировка в молекуле замещается на другой атом или
атомную группировку
•Механизм химической реакции – совокупность элементарных
стадий процесса превращения исходных веществ в продукты реакции
•Элементарная стадия (элементарная реакция) – единичный акт
образования или разрыва химической связи при непосредственном
взаимодействии молекул, ионов или радикалов
15.
Механизм радикального замещения SRСтадия I: зарождение (инициирование) цепи
h
.
Cl2
2Cl
Стадия II: развитие (рост) цепи
+ .CH3
CH3 Cl + Cl.
. + CH
Cl
.CH + Cl
HCl
4
2
3
Стадия III: обрыв цепи
.CH3
.CH3
.
+ CH3 быстро
H3 C CH3
+ Cl
CH3 Cl
.
быстро
Устойчивость свободных радикалов возрастает в ряду:
CH3 < CH2R < CHR2 < CR3
Реакция бромирования алканов региоселективна, т.е. явно
преобладает один из возможных продуктов:
CH3 CH2 CH3 + Br2
пропан
h 125 o C
CH3 CHBr CH3 + HBr
2-бромпропан
16.
Нитрование алкановРеакция Коновалова
R H + HO
алкан
NO 2
140-150 o C, p
R NO 2 + H2 O
нитроалкан
Парофазное нитрование алканов (Хесс)
CH3 CH2 CH2 CH3 + HONO2
CH3 NO2 + H3C CH2 NO2 +
нитрометан нитроэтан
бутан
+ CH3 CH2 CH2 NO2 +
1-нитропропан
H3C CH CH3 + CH3 CH2 CH2 CH2 NO2 + H3C CH CH2 CH3
NO2
2-нитропропан
1-нитробутан
NO2
2-нитробутан
Реакции сульфохлорирования (I) и сульфоокисления (II) алканов С12-С18
R-H + SO 2 + Cl2
R-H + 2SO 2 + O 2 + H2 O
h
h
R-SO 2 -Cl + HCl
алкансульфонилхлорид
(I)
R-SO 2 -OH + H2 SO 4 (II)
алкансульфониловая кислота
17. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ
1. Крекинг нефтиCn H2n+2
t
Cm H2m+2 +
алканы
Cn-mH2(n-m)
алкены
2. Метод Бергиуса (гидрогенизация бурых углей)
n C + (n + 1) H2
H2, Fe
450 - 500 C, 200 - 300 атм
CnH2n+2
газ
бензин, смазочные масла,
тяж. погон
3. Метод Фишера-Тропша
n CO + (n + 1) H2
Ni , Co
400 C
Синтин – смесь углеводородов.
CnH2n+2 + n H2O
синтин
4. Получение метана газификацией твердого топлива
(гидрогенизацией углей)
t°C, p, Ni
С + 2Н2 СН4
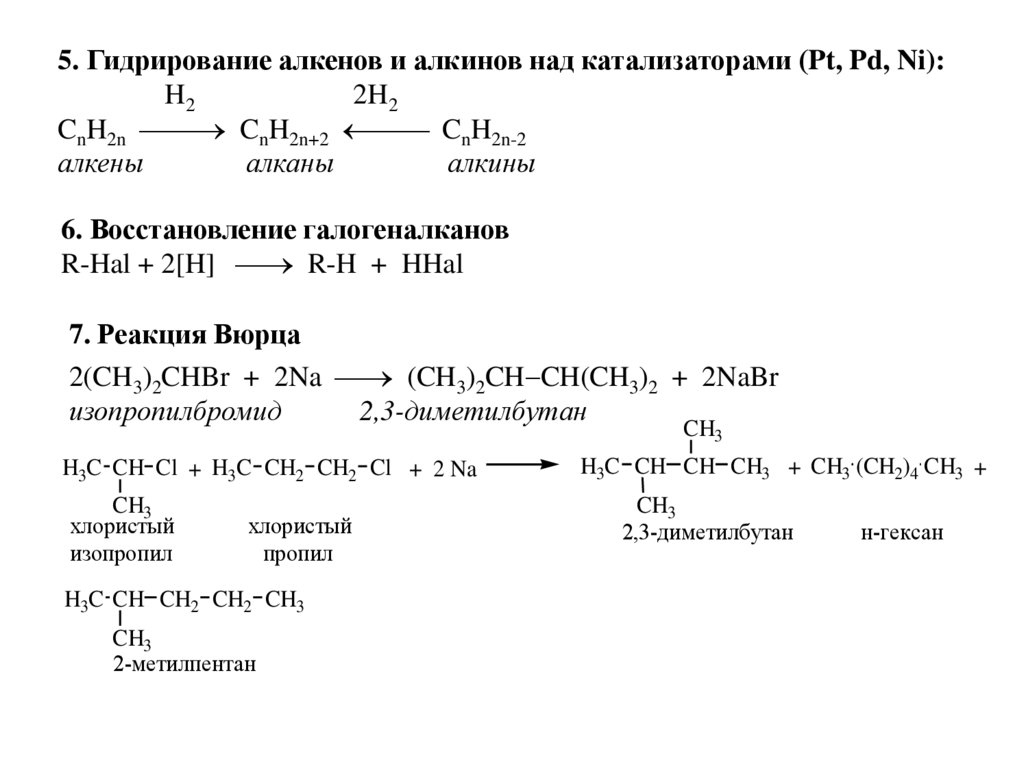
18.
5. Гидрирование алкенов и алкинов над катализаторами (Pt, Pd, Ni):H2
2H2
CnH2n CnH2n+2 CnH2n-2
алкены
алканы
алкины
6. Восстановление галогеналканов
R-Hal + 2[H] R-H + HHal
7. Реакция Вюрца
2(CH3)2CHBr + 2Na (CH3)2CH CH(CH3)2 + 2NaBr
изопропилбромид
2,3-диметилбутан
CH3
H3C CH Cl + H3C CH2 CH2 Cl + 2 Na
CH3
хлористый
изопропил
хлористый
пропил
H3C CH CH2 CH2 CH3
CH3
2-метилпентан
H3C CH CH CH3 + CH3 (CH2)4 CH3 +
CH3
2,3-диметилбутан
н-гексан
19.
8. Получение алканов из солей карбоновых кислот:а) сплавление со щелочью (реакция Дюма)
_
t
+
CH4 + Na2CO3
CH3COO Na + NaOH
ацетат натрия
б) анодный синтез (реакция Кольбе)
электролиз
+
2RCOO Na + 2H2 O
R R + 2CO2
на аноде
+ H2
+ 2NaOH
на катоде
9. Метан получают при разложении карбидов металлов (метанидов)
водой:
Al4C3 + 12H2O 4Al(OH)3 + 3CH4











 Химия
Химия








