Похожие презентации:
Требования к помещениям и оборудованию в рамках системы обеспечения качества при изготовлении лекарственных препаратов
1. Требования к помещениям и оборудованию в рамках системы обеспечения качества при изготовлении лекарственных препаратов.
Подготовила Воронович АлинаГруппа ФО-3301
2.
Основной документ:Руководство PIC/S по надлежащей практике изготовления
лекарственных препаратов в в медицинских учреждениях,
версия PE 010-4 от 1 марта 2014г.
3. Помещения и оборудование: Принципы
Помещения иоборудование должны
быть пригодны для
планируемой
деятельности и не
должны представлять
какой-либо опасности
для качества
препарата.
4. Помещения и оборудование: Общие требования
• 1. Помещения и оборудование должны быть надлежащим образом• спроектированы
4. Деятельность
по мытьюа итакже
очистке
сама по себеобслуживаться
не должна
и построены,
эксплуатироваться,
ибыть
модернизироваться
таким образом, чтобы обеспечить их пригодность
источником загрязнения.
планируемой
деятельности
и свестии к контроля
минимуму качества
риск ошибок.
• для
5.
Зоны
производства,
хранения
Должны быть достаточные возможности для обеспечения
должны быть доступны только для уполномоченного
логического рабочего процесса и надлежащего разделения
персонала.
деятельности.
Окружающие
условия
(температура,
влажность,
•• 2.6.Для
снижения риска
загрязнения,
например в результате
освещение) загрязнения
во время или
производства,
контроля
качества
перекрестного
накопления пыли
и грязи,
следует и
хранения (включая
хранение
холодильниках)помещения
должны и
использовать
надлежащим
образомв спроектированные
определятьсяа итакже
контролироваться
и при необходимости
оборудование,
тщательно продуманные
и подходящие
регулироваться.
Результаты
должны возможность
методы
работы. Проектом
должнаконтроля
быть предусмотрена
документироваться,
оцениваться
и сохраняться.
Когда при
условия
тщательной
очистки. Особую
осторожность
следует проявлять
выходят
за установленные
пределы, должны
приниматься
отборе
проб
или очистке оборудования,
а также —
в
соответствующие
корректирующие
меры.
соответствующих
случаях
— его дезинфекции
после ремонта или
обслуживания.
• технического
7. Все помещения
должны быть чистыми, опрятными и
• 3.хорошо
Должныосвещенными.
приниматься адекватные меры против проникновения
насекомых и других животных (борьба с вредителями).
5. Помещения и оборудование: Производственные зоны
• 1. В производственных зонах должно обеспечиваться надлежащееразделение от других видов деятельности.
• 2. Следует рассмотреть вопрос о разделении зон для конкретных
лекарственных форм (например, сухие и влажные производственные
объекты). Если разделение зон для конкретных лекарственных форм не
представляется возможным, необходимо провести документальную оценку
риска и принять соответствующие меры, прежде чем работать с разными
лекарственными формами одновременно.
• 3. Необходимо предусмотреть специализированные комнаты для опасных
препаратов, например цитостатиков, пенициллинов, биопрепаратов,
радиофармацевтических препаратов, препаратов крови. В исключительных
случаях принцип работы в рамках производственных кампаний может быть
приемлемым при условии принятия конкретных мер предосторожности и
проведения всех необходимых оценок риска.
• 4. Материалы и продукты следует хранить и обрабатывать таким
образом, чтобы риск перепутывания разных продуктов или их
ингредиентов был минимальным, чтобы избежать перекрестного
загрязнения и уменьшить риск пропуска или некорректного выполнения
стадии обработки.
• 5. Зоны взвешивания и отбора проб должны быть в достаточной степени
отделены от других зон изготовления, чтобы избежать перекрестного
загрязнения.
6. Помещения и оборудование: Зоны хранения
• 1. Зоны хранения должны иметь достаточную вместимость для обеспеченияорганизованного хранения различных категорий материалов и препаратов. Примерами
таких категорий являются: исходные и упаковочные материалы, промежуточные и
готовые продукты, продукты в карантине, выпущенные, отклоненные, возвращенные
или отозванные продукты.
• 2. Исходные и упаковочные материалы обычно хранятся вне зон изготовления, если
только они не сегрегированы надлежащим образом.
• 3. Материалы и препараты, находящиеся в карантине, отклоненные,
возвращенные или отозванные, должны храниться в изолированных зонах и должны
быть четко помечены в качестве таковых.
• 4. Условия хранения (например, температура, относительная влажность), необходимые
для того, чтобы не оказывать отрицательного воздействия на материал или
качество препарата, должны быть определены и контролироваться. Контроль
должен быть адекватным для поддержания всех частей соответствующей зоны
хранения в соответствии с предписанными условиями. Зоны хранения должны быть
оборудованы регистраторами или другими контрольными устройствами, которые
показывали бы, когда установленные условия не поддерживались, чтобы можно было
оценить ситуации, не удовлетворяющие техническим условиям, и принять
соответствующие меры.
7. Помещения и оборудование: Зоны контроля качества
• Как правило, мероприятия по контролю качества должны проводиться вспециализированной зоне. Если это не достижимо, необходимо принять меры для
исключения ошибок и загрязнения.
Помещения и оборудование:
Дополнительные зоны
• 1. Комнаты для отдыха и приема пищи должны быть отделены от других помещений.
• 2. Туалеты, помещения для переодевания и умывания должны быть легко
доступны и соответствовать числу пользователей. Туалеты не должны иметь
непосредственного доступа из производственных или складских помещений
8. Помещения и оборудование: оборудование
• 1. Оборудование для изготовления должно быть спроектировано,размещено и обслуживаться в соответствии с его целевым
назначением.
• 2. Оборудование должно быть сконструировано таким образом, чтобы
его можно было легко и тщательно очистить. Оно должно содержаться
в чистом и сухом состоянии.
• 3. Измерительное, взвешивающее и контрольное оборудование
должно иметь требуемую прецизионность: оно должно
калиброваться, а также проверяться на корректность работы и
повторно калиброваться через соответствующие промежутки времени.
• 4. Неисправное оборудование подлежит выведению из зон
производства и контроля качества или хотя бы иметь четкую
маркировку «неисправно».
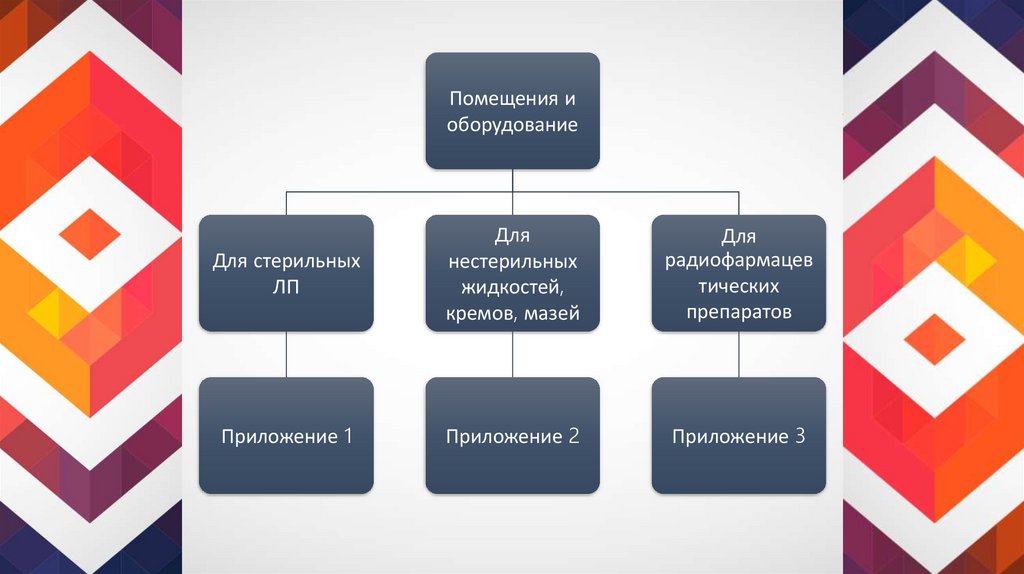
9.
Помещения иоборудование
Для стерильных
ЛП
Для
нестерильных
жидкостей,
кремов, мазей
Для
радиофармацев
тических
препаратов
Приложение 1
Приложение 2
Приложение 3
10. Стерильное изготовление ЛП
• 13. Помещения должны располагаться в окружении, которое в совокупности с мерами по защите препарата,представляет минимальные риски загрязнения материалов или препаратов. В случае изготовления цитостатиков и
радиофармацевтических препаратов следует также принимать меры по защите оператора от обрабатываемых материалов.
Чистые помещения для изготовления стерильных препаратов относятся к четырем классам (А, В, С и D) в соответствии с
требуемыми характеристиками окружающей среды (см. раздел 6). Уровень классификации комнат должен определяться в
соответствии с выполняемой деятельностью и изготовляемыми продуктами. Соответственно, для каждых чистых комнаты или
комплекса чистых комнат должны быть указаны состояния «в работе» (установка функционирует в определенном рабочем
режиме с заданным количеством работающего персонала) и «в покое» (полная установка с производственным
оборудованием, но без персонала, т. е. без операторов). Для достижения указанных состояний должна быть определена
подходящая фильтрация воздуха (терминальные HEPA-фильтры для классов А, В и С) и достаточная кратность
воздухообмена (см. раздел 6). Чтобы соответствовать состоянию «в работе», эти зоны должны быть спроектированы
таким образом, чтобы состояние «в покое» достигалось после короткого периода «очистки» в течение 15–20 минут
(справочное значение) после завершения операций.
• 14. Стерильные изготовления должны осуществляться в чистых специализированных зонах, имеющих воздушные шлюзы
для доступа персонала, материалов и оборудования. Раздевалки должны быть выполнены в виде воздушных шлюзов.
• 15. Расположение и использование моек следует тщательно продумать с учетом их потенциальной способности вызывать
микробиологическое загрязнение. Раковины или мойки рук не должны быть доступны в рабочих комнатах или вблизи выхода
из раздевалок. Если раздевалка находится в прилежащих зонах, то ее следует регулярно контролировать и дезинфицировать.
• 16. Для всего оборудования, используемого для обработки, должны быть составлены и внедрены стандартные
операционные процедуры.
• 17. Если оправданно, оборудование следует регулярно калибровать и проверять правильность приборов измерения объема.
11. Особые требования к изготовлению терминально стерилизуемых продуктов:
• 18. Изготовление компонентов и большинства продуктов должно производиться в окружениикласса не ниже D, чтобы снизить риск микробного загрязнения и загрязнения
механическими включениями. При наличии необычного микробиологического риска для
препарата, например в силу того что препарат активно поддерживает рост
микроорганизмов или хранится в течение длительного периода перед стерилизацией либо не
обрабатывается в закрытых сосудах, изготовление следует проводить в среде класса С.
• Наполнение продуктов для терминальной стерилизации должно производиться в окружении
класса не ниже С. В тех случаях, когда продукт подвергается необычному риску загрязнения из
окружающей среды, например из-за низкой скорости проведения операции наполнения или изза того, что контейнеры имеют широкое горлышко или обязательно выдерживаются в
течение нескольких секунд перед укупориванием, наполнение должно производиться в зоне
класса А с прилегающей зоной класса не ниже С.
• Изготовление и наполнение мазей, кремов, суспензий и эмульсий обычно следует
проводить в окружении класса С перед терминальной стерилизацией.
Класс
Примеры операций для терминально стерилизуемых продуктов
A
Наполнение продуктов, если они подвержены необычному риску
С
Изготовление растворов, если они подвержены необычному риску.
Наполнение продуктов
D
Изготовление растворов и компонентов для последующего наполнения
12. Особые требования к деятельности по стерильному изготовлению
• 19. После промывки компоненты следует обрабатывать в окружении класса не ниже D. Работасо стерильными исходными материалами и компонентами, если только позднее в ходе
процесса они не подвергаются стерилизации или фильтрации через фильтр,
задерживающий микроорганизмы, должна осуществляться в окружении класса А.
• Изготовление растворов, подвергаемых стерильной фильтрации во время процесса, следует
производить в окружении класса С; если они не фильтруются, то изготовление материалов
и продуктов следует производить в окружении класса А.
• Обработка и наполнение асептически изготовляемых продуктов (открытые и закрытые
процедуры) должны выполняться в окружении класса А в шкафу с ламинарным потоком воздуха
(LFC) или фармацевтическом изоляторе положительного давления. Комната должна иметь
положительное давление (в идеале 10-15 Паскалей) и поток воздуха относительно
окружающих зон более низкого класса, чтобы защитить продукт от загрязнения.
• Примеры операций для асептически изготовляемых препаратов, которые должны выполняться в
помещениях различного класса:
A
Асептическое изготовление и наполнение
С
Изготовление растворов, подлежащих фильтрации
D
Обращение с компонентами после промывки
13. Особые требования к деятельности по стерильному изготовлению
• 20. Процесс изготовления под отрицательным давлением, защищающим оператора иокружающую среду от загрязнения, следует использовать только для изготовления опасных лекарств
(например, цитотоксических лекарств, радиофармацевтических препаратов и радиоактивно
меченных препаратов крови) вместе с соответствующими мерами предосторожности для
защиты от загрязнения лекарственного препарата (например, соответствующее качество воздуха в
прилежащей комнате, системы воздушных шлюзов с положительным давлением). Шкафы с
ламинарным потоком воздуха (LFC) не подходят для изготовления опасных лекарств. Вместо
этого следует использовать шкафы биологической безопасности (BSC) с вертикальным нисходящим
потоком воздуха, выходящим вертикально из шкафа, а не по направлению к оператору.
• 21. Поскольку терминальная стерилизация асептически изготовляемых продуктов не проводится,
микробиологическое окружение, в котором их изготавливают, имеет первостепенное значение.
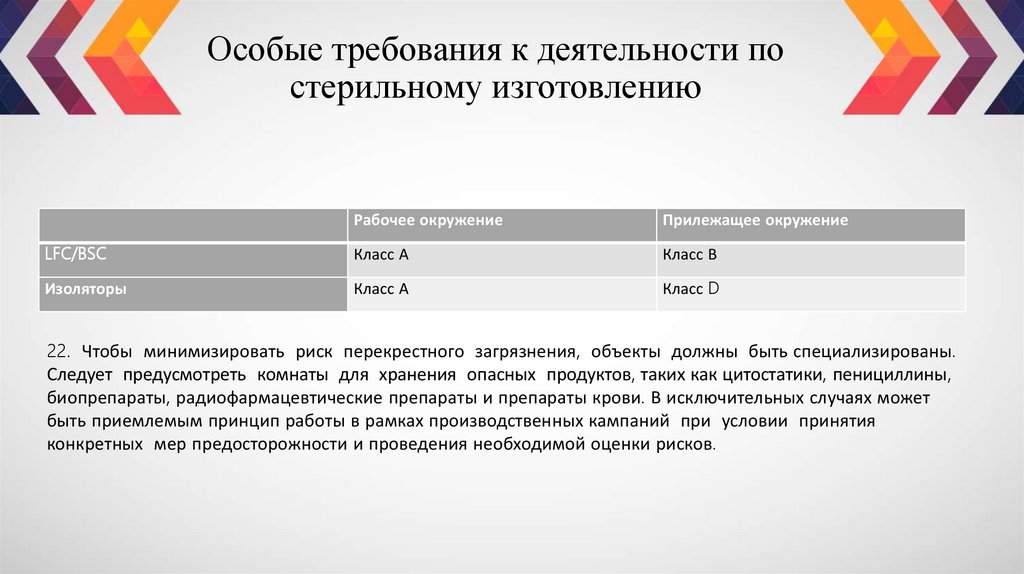
В связи с этим необходимо контролировать окружающие условия и допускать в них только
уполномоченных лиц. Если нет надлежащего обоснования, прилежащее окружение для LFC и BSC
должно соответствовать требованиям к помещениям класса В, а для фармацевтических изоляторов
— класса D.
• Любое обоснование для прилежащего окружения более низкого класса должно основываться
на документально подтвержденной оценке риска, которую следует проводить с большой
тщательностью. Возможные факторы, которые могут быть учтены при такой оценке риска, включают:
• Время между изготовлением и применением
• Использование закрытой системы
• Природа и состав продукта
14. Особые требования к деятельности по стерильному изготовлению
Рабочее окружениеПрилежащее окружение
LFC/BSC
Класс А
Класс В
Изоляторы
Класс А
Класс D
22. Чтобы минимизировать риск перекрестного загрязнения, объекты должны быть специализированы.
Следует предусмотреть комнаты для хранения опасных продуктов, таких как цитостатики, пенициллины,
биопрепараты, радиофармацевтические препараты и препараты крови. В исключительных случаях может
быть приемлемым принцип работы в рамках производственных кампаний при условии принятия
конкретных мер предосторожности и проведения необходимой оценки рисков.
15. Изготовление нестерильных жидкостей, кремов, мазей
• 3. Для защиты продукта от загрязнения рекомендуется использовать закрытые системыобработки и транспортировки. Производственные помещения, в которых продукт или
открытые чистые контейнеры подвержены экспозиции, как правило, должны эффективно
вентилироваться фильтрованным воздухом.
• 4. Производственные помещения не должны использоваться для других видов деятельности.
• 5. Должны приниматься меры по снижению риска загрязнения, которые включают:
a) Использование спецодежды и шапочек для покрытия волос.
b) Если используются открытые процедуры, рекомендуются местная фильтрация воздуха и
ношение перчаток.
c) Оперативная чистка используемого оборудования.
d) Ополаскивание оборудования, которое контактирует с препаратом водой
соответствующего класса после промывки (могут быть пригодны очищенная вода или
бутилированная вода для инъекций либо орошение, если они используются в течение 24 часов
после вскрытия).
e) Убедитесь, что удалены остатки чистящих и дезинфицирующих средств (например,
гипохлориты).
f) Перед хранением убедитесь, что оборудование чистое и сухое. g) Бережное хранение
очищенного оборудования.
h) Все материалы, поступающие в производственную зону, должны быть чистыми.
i) Дезинфекция спиртом критических поверхностей перед использованием.
16. Изготовление нестерильных жидкостей, кремов, мазей
j) Перед использованием проверьте контейнеры и крышки, чтобы убедиться, что они чистые и сухие.k) Контейнеры с конечным продуктом не подлежат повторному использованию.
l) Швабры и тряпки не должны оставлять волокна, их следует дезинфицировать каждый день, если
они используются повторно, и не следует использовать для очистки других помещений.
m) Если в производственной зоне одновременно осуществляется более одного вида деятельности, то
должно быть обеспечено надлежащее разделение для предотвращения перекрестного загрязнения и
перепутывания. Должна проводиться оценка риска.
n) Рекомендуется использовать специализированное оборудование в случае сильнодействующих
веществ, пенициллинов, цефалоспоринов, сенсибилизаторов, цитотоксических средств,
эктопаразитицидов и других веществ, которые очень опасны или трудно поддаются очистке. Эти
материалы должны быть идентифицированы, и должна быть проведена оценка риска.
• 6. Резервуары, контейнеры, трубопроводы и насосы должны быть спроектированы и установлены таким
образом, чтобы их можно было легко чистить и при необходимости дезинфицировать. В частности,
конструкция оборудования должна включать минимум тупиковых или застойных участков, где могут
скапливаться остатки, способствуя размножению микробов.
• 7. По возможности следует избегать использования стеклянных приборов. Высококачественная
нержавеющая сталь часто является материалом выбора для деталей, вступающих в контакт с продуктом.
Стеклянное оборудование, если оно используется, необходимо проверять на наличие повреждений до и
после использования.
17. Изготовление радиофармацевтических препаратов
• 11. Изготовление радиофармацевтических препаратов должно проходить на специализированныхобъектах.
• 12. Радиофармацевтические препараты для инъекций следует изготавливать в окружении,
защищающем продукт от микробного загрязнения. В то же время окружающая среда также должна
быть защищена от ионизирующего излучения.
• 13. Если исследовательская деятельность и изготовление выполняются в одном и том же месте,
необходимо обеспечить их физическое или организационное разделение, чтобы избежать влияния
исследовательского персонала на задачи GMP.
• 14. Должно быть предусмотрено соответствующее оборудование для обнаружения радиации и
мониторинга персонала на предмет радиационного облучения.
• 15. В связи с требованиями охраны труда и техники безопасности, чтобы обеспечить оперативное
удаление загрязнений для персонала, может потребоваться разместить подходящие средства,
например мойки и (или) душевые кабины, ближе к чистым комнатам, чем в случае обычных
асептических операций (в зависимости от национальных требований к безопасности). Следует
предусмотреть надлежащие средства контроля за проектированием и техническим обслуживанием
моек и (или) душевых кабин. Могут быть использованы и другие методы обеззараживания в
соответствии с местными требованиями.
• 16. Маркирование клеток крови необходимо производить в отдельной комнате, в которой не
проводятся операции по изготовлению. Риск использования общих раздевалок для этих двух видов
деятельности должен быть оценен и задокументирован.
18. Изготовление радиофармацевтических препаратов
• 17. Во всех возможных случаях продукты должны изготавливаться с использованием закрытогометода изготовления, например переноса из одного герметичного стерильного контейнера в другой.
По возможности следует избегать асептического прокалывания пробки флакона. 18. Операции
должны выполняться либо на рабочих местах с ламинарным потоком, в горячих камерах, либо на
закрытых рабочих местах с радиационной защитой. Если используются открытые рабочие места,
например ламинарные шкафы, то они потребуют окружающего воздуха более высокого класса в
зависимости от того, является ли продукт асептически изготовляемым или терминально
стерилизуемым.
• 19. Следует проводить осмотр перчаток для изоляторов и рукавов манипулятора горячих камер перед
использованием. Испытания на герметичность горячих камер, если возможно, и изоляторов
должны проводиться с интервалами, определенными в дополнении 1.
• 20. Ожидается, что любой открытый способ изготовления и обработки асептических продуктов будет
осуществляться в окружении класса А. В случае закрытого способа изготовления, используемого
для наполнения окончательного продукта в один контейнер для немедленного использования,
для проведения операции наполнения может подойти зона класса С на основании оценки риска.
• 21. В случае продуктов, которые могут быть подвергнуты терминальной стерилизации,
наполнение необходимо проводить в окружении класса С. В случае стадий до наполнения, например
радиохимического синтеза, следует использовать окружение класса С или обосновать выбор
окружения другого класса посредством оценки риска.
• 22. Материалы должны передаваться на рабочее место через передаточные люки, которые
блокируются в соответствующих случаях
19. Изготовление радиофармацевтических препаратов
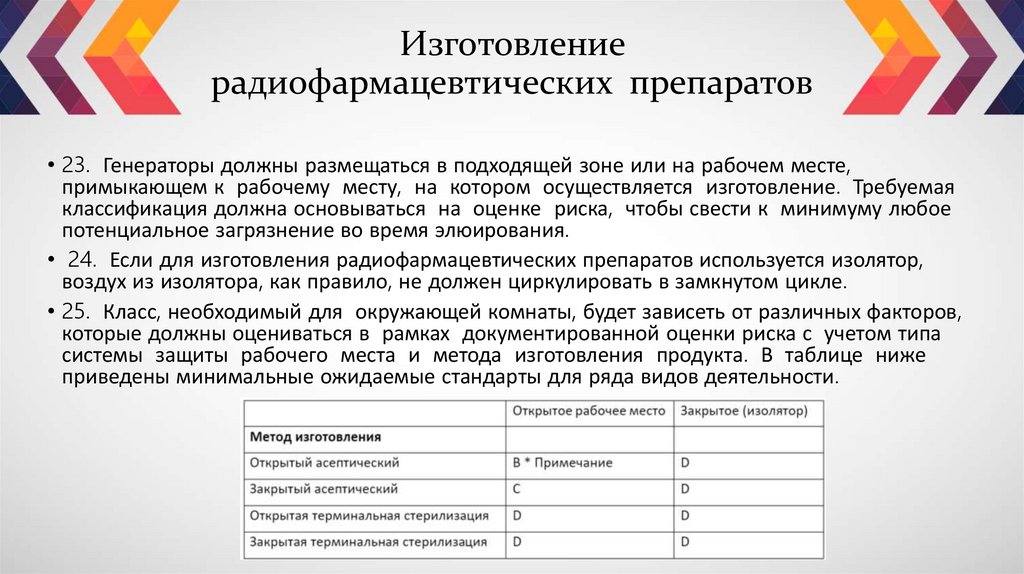
• 23. Генераторы должны размещаться в подходящей зоне или на рабочем месте,примыкающем к рабочему месту, на котором осуществляется изготовление. Требуемая
классификация должна основываться на оценке риска, чтобы свести к минимуму любое
потенциальное загрязнение во время элюирования.
• 24. Если для изготовления радиофармацевтических препаратов используется изолятор,
воздух из изолятора, как правило, не должен циркулировать в замкнутом цикле.
• 25. Класс, необходимый для окружающей комнаты, будет зависеть от различных факторов,
которые должны оцениваться в рамках документированной оценки риска с учетом типа
системы защиты рабочего места и метода изготовления продукта. В таблице ниже
приведены минимальные ожидаемые стандарты для ряда видов деятельности.
20. Изготовление радиофармацевтических препаратов
• Закрытые рабочие места определяются как изоляторы и горячие камеры, которыемогут быть проверены на герметичность. Открытые рабочие места определяются как
шкафы с ламинарным потоком воздуха, которые частично открыты спереди.
• Если асептически изготовляемый радиоактивный лекарственный препарат в
открытом флаконе при любых обстоятельствах во время производства находится
за пределами рабочего места, комната должна соответствовать классу В.
* Примечание: в случае немедленного введения допускается использовать зону
класса C при условии оценки риска.
• 26. Радиоактивные материалы должны храниться в экранированной внешней
упаковке, такой как свинцово-вольфрамовые сосуды или эквивалентные
контейнеры для радиационной защиты.
• 27. В зависимости от микробного риска для продукта изготовление капсул и
других нестерильных продуктов должно осуществляться в контролируемой среде с
соответствующей радиационной защитой.