Похожие презентации:
Валентность
1.
Валентность- способность атома образовыватьопределенное количество химических связей.
Степень окисления - условный заряд, который
имел бы атом, если бы все связи были
ионными.
Степень окисления у металлов – число всегда
положительное
Неметаллы могут иметь отрицательные и
положительные степень окисления.
Укажите ст.ок атомов в соединении:
Н2СО3,К 3РО4, SO3, CO2, Mg(NO3)2
2. Реакции
*РеакцииВзаимодействие
красного
фосфора с кислородом
Взаимодействие оксида
фосфора (V)
с водой
3. Окислительно – восстановительные реакции
*… – реакции, протекающие с
изменением степени
окисления элементов
4. Два антипода парою ходят, Первый – теряет; второй - находит, Ролью меняясь при этом порой… Кто ж из них первый и кто же второй?
* Два антипода парою ходят,Первый – теряет; второй - находит,
Ролью меняясь при этом порой…
Кто ж из них первый и кто же
второй?
*
*
восстановитель
окислитель
О2
Р
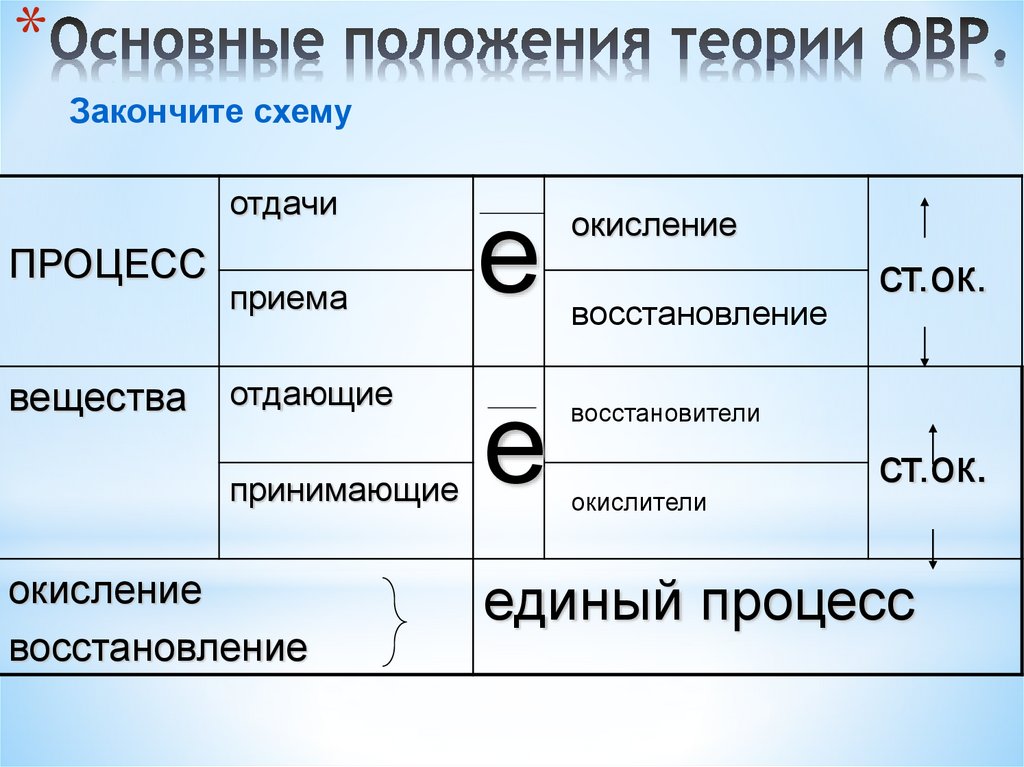
5. Основные положения теории ОВР.
*Закончите схему
отдачи
ПРОЦЕСС
вещества
приема
отдающие
принимающие
окисление
восстановление
е
е
окисление
восстановление
ст.ок.
восстановители
окислители
ст.ок.
единый процесс
6.
Вставьте пропущенные слова:процесс отдачи электронов называется
окислением_
___________________
,
степень окисления элементов при этом
_______________
.
повышается
Атом, отдающий электроны называется
восстановителем_
_____________,
Атомы металлов всегда ________электроны
и
отдают
являются _____________.
восстановителями
Процесс присоединения электронов называется
восстановлением
понижается
____________, степень окисления при этом ____
Атомы неметаллов, принимающие электроны,
окислителями
называются __________________,
восстановителями.
Отдающие электроны ________________
7. Алгоритм составления ОВР
*1. Определить степени окисления элементов
в соединениях, участвующих в реакции.
2. Выявить элемент, степень окисления
которого понизилась, повысилась,
окислитель и восстановитель.
3. Выявить число отданных и принятых
электронов.
8.
Число отданных и принятых электронов должно бытьодинаковым.
Если это не так, то составить электронный баланс:
Найти НОК числа отданных и принятых
электронов;
Делением НОК на число отданных и принятых
получить коэффициент перед восстановлением;
Делением НОК на число принятых электронов
получить коэффициент перед окислением;
Умножить полуреакции окисления и
восстановления на соответствующие
коэффициенты.
Перенести коэффициенты в общее уравнение.







 Химия
Химия








