Похожие презентации:
Окислительно-восстаовительные реакции
1.
2. Химический словарь:
оксид, гидроксид, кислота, соль,химическая реакция, химическое
уравнение, условия протекания реакций,
признаки течения химических реакций,
алгоритм составления химической
реакции, экзо- и эндотермическая
реакция, закон сохранения массы
веществ (автор), закон сохранения
энергии (автор).
3. Укажите тип реакции
Преобразуйте схемы в уравненияреакций:
А) S + F2 → SF6 ,
Б) Fe2O3 + H2 → Fe + H2O,
В) CO + O2 → CO2,
Г) Fe(OH)3 → Fe2O3 + ?,
Д) AgNO3 + KCl → AgCl + KNO3.
4. Закончите уравнения реакций:
А) соединения B +F2 → ? Sb + O2 →?Б) разложения H2O2 → H2O +?
В) замещения Al + H2SO4 → ?
5. Изучение нового материала
6. Степень окисления неметаллов – окислителей.
7. Химические реакции
• с изменением степени окисления2Н20 + О20 = 2Н2 +1О-2
• без изменения степени окисления
СаО + СО2 = СаСО3
8. Степень окисления – Условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все
соединениятолько ионные.
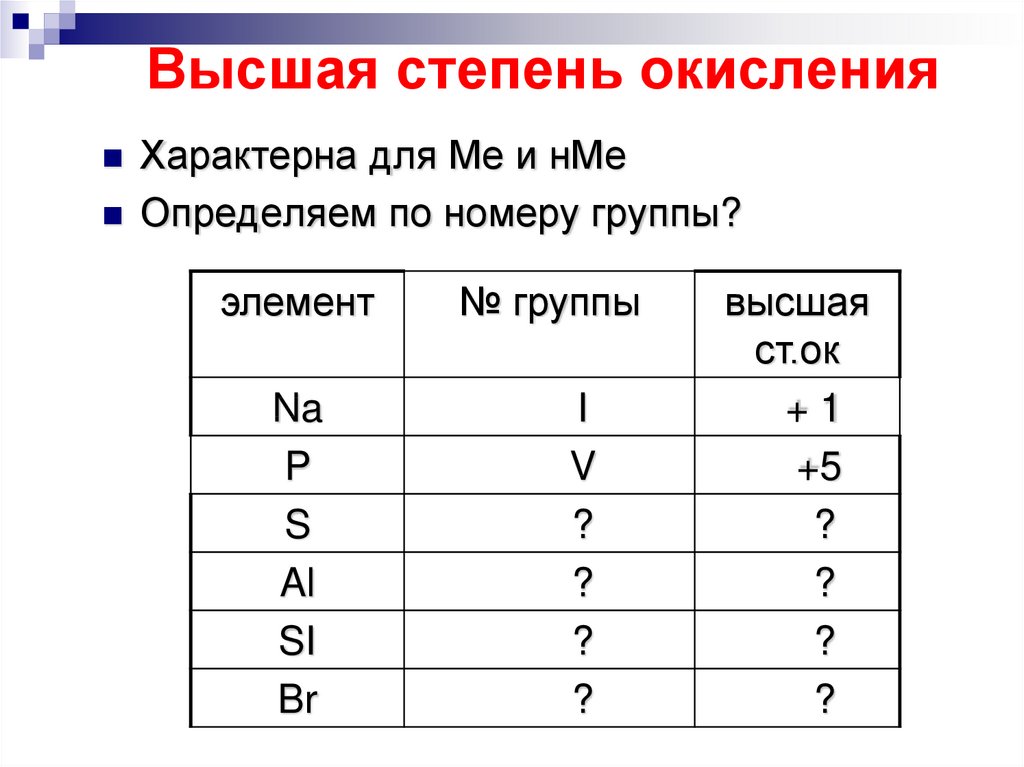
9. Высшая степень окисления
Характерна для Ме и нМеОпределяем по номеру группы?
элемент
Na
P
S
Al
SI
Br
№ группы
I
V
?
?
?
?
высшая
ст.ок
+1
+5
?
?
?
?
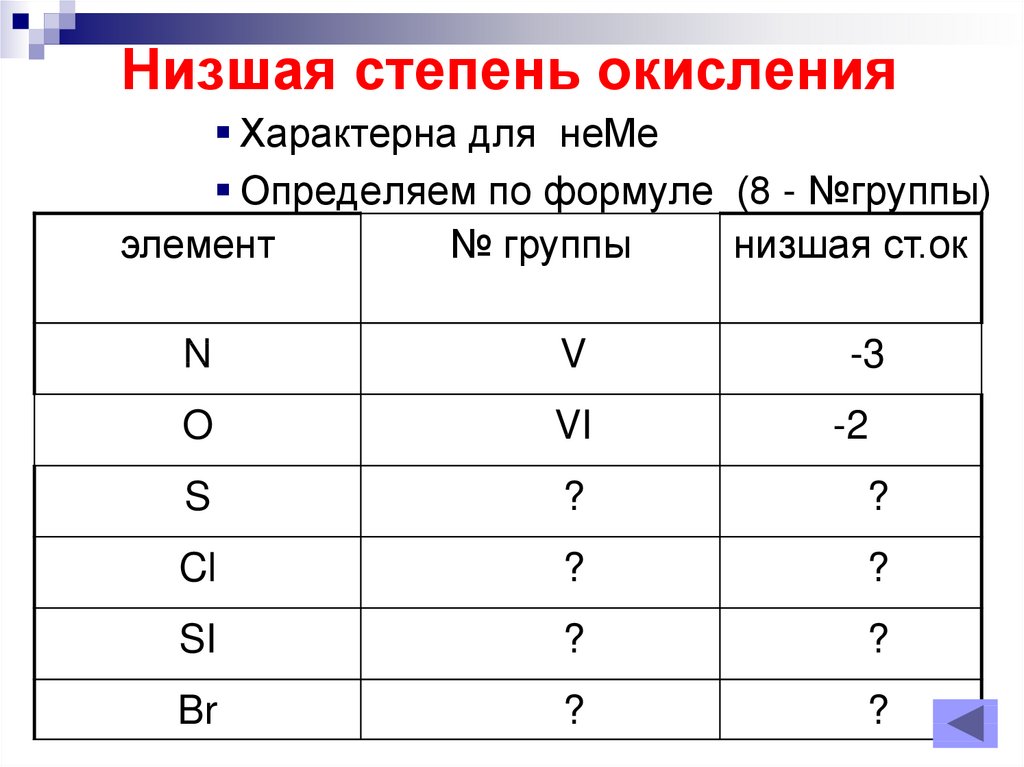
10. Низшая степень окисления
Характерна для неМеОпределяем по формуле (8 - №группы)
элемент
№ группы
низшая ст.ок
N
V
-3
O
VI
S
?
?
Cl
?
?
SI
?
?
Br
?
?
-2
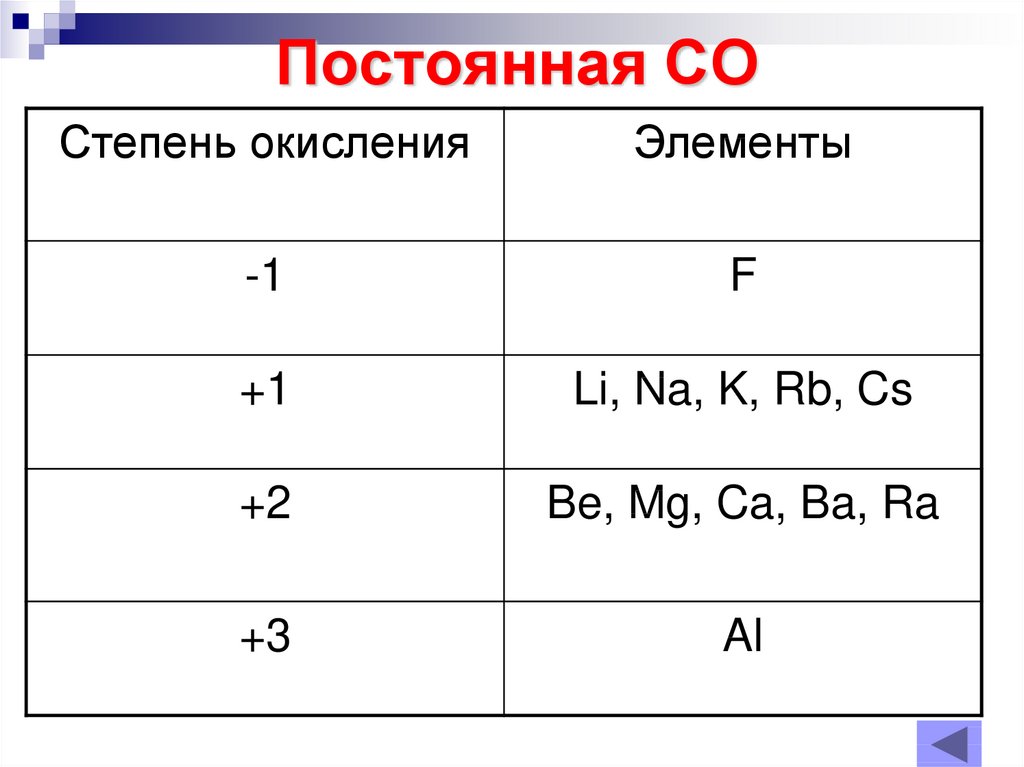
11. Постоянная СО
Степень окисленияЭлементы
-1
F
+1
Li, Na, K, Rb, Cs
+2
Be, Mg, Ca, Ba, Ra
+3
Al
12.
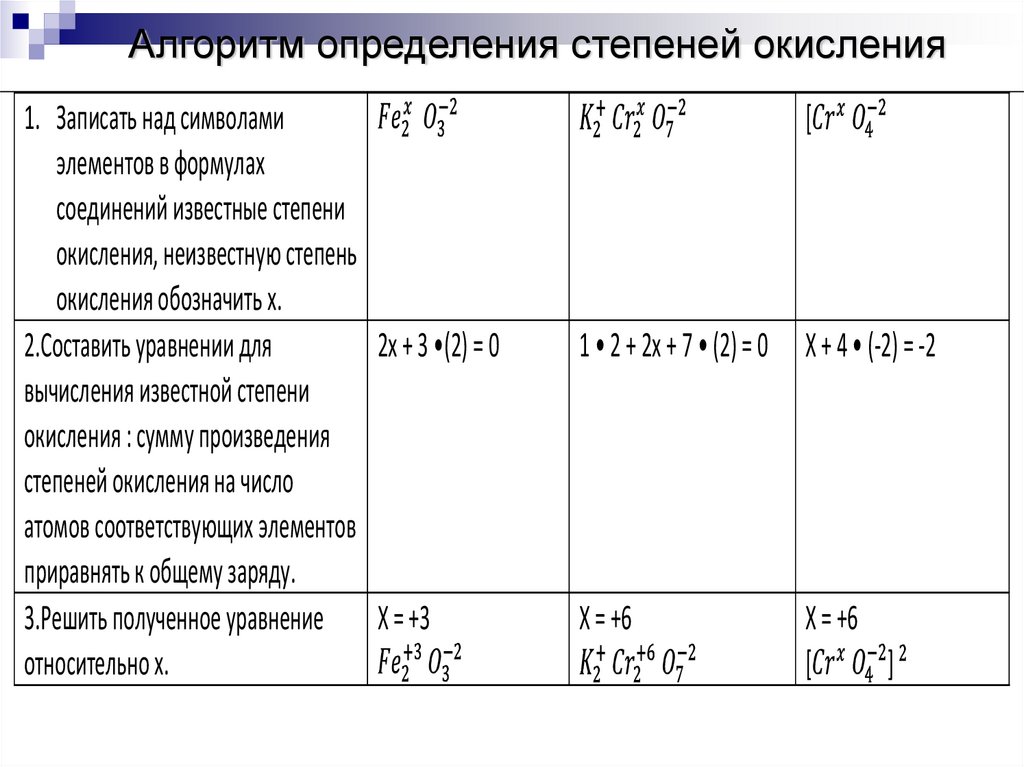
Алгоритм определения степеней окисления1. Записать над символами
элементов в формулах
соединений известные степени
окисления, неизвестную степень
окисления обозначить х.
2.Составить уравнении для
2x + 3 •(2) = 0
вычисления известной степени
окисления : сумму произведения
степеней окисления на число
атомов соответствующих элементов
приравнять к общему заряду.
3.Решить полученное уравнение X = +3
относительно х.
[
1 • 2 + 2x + 7 • (2) = 0 X + 4 • (-2) = -2
X = +6
X = +6
[
]
13.
• Вещества, содержащие атомы,которые понижают свою степень
окисления и присоединяют электроны,
называются окислителями.
• Вещества, содержащие атомы,
которые повышают степень окисления
и отдают электроны –
восстановителями.
• Еще есть такое шутливое правило:
окислитель - грабитель,
восстановитель - потерпевший.
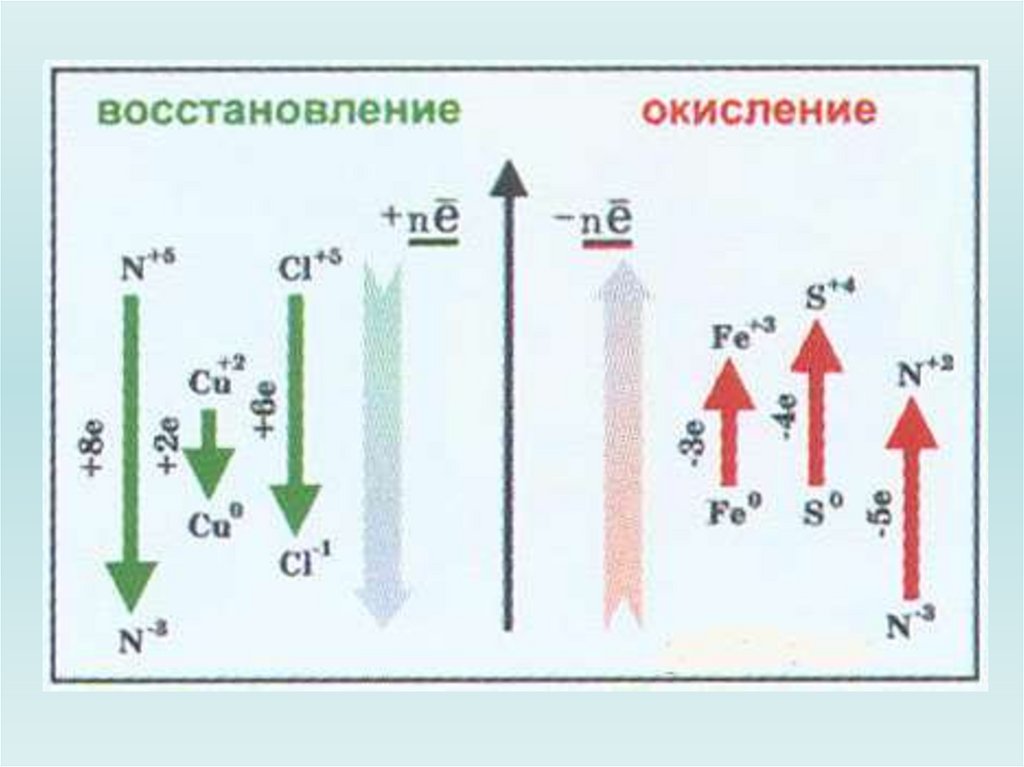
14.
15.
Характерной особенностью окислительновосстановительных реакций является изменениестепени окисления, по меньшей мере двух
атомов: окисление одного (потеря электронов) и
восстановление другого (присоединение
электронов).
Окисление и восстановление - два
полупроцесса, самостоятельное существование
каждого из которых невозможно, но их
одновременное протекание обеспечивает
прохождение окислительно-восстановительного
процесса.
16. Алгоритм составления ОВР
1. Определить степени окисления элементовв соединениях, участвующих в реакции.
2. Выявить элемент, степень окисления
которого понизилась, повысилась,
окислитель и восстановитель.
3. Выявить число отданных и принятых
электронов.
17.
Число отданных и принятых электронов должно бытьодинаковым.
Если это не так, то составить электронный баланс:
Найти НОК числа отданных и принятых
электронов;
Делением НОК на число отданных и принятых
получить коэффициенты перед окислителем и
восстановителем;
Перенести коэффициенты в общее уравнение.
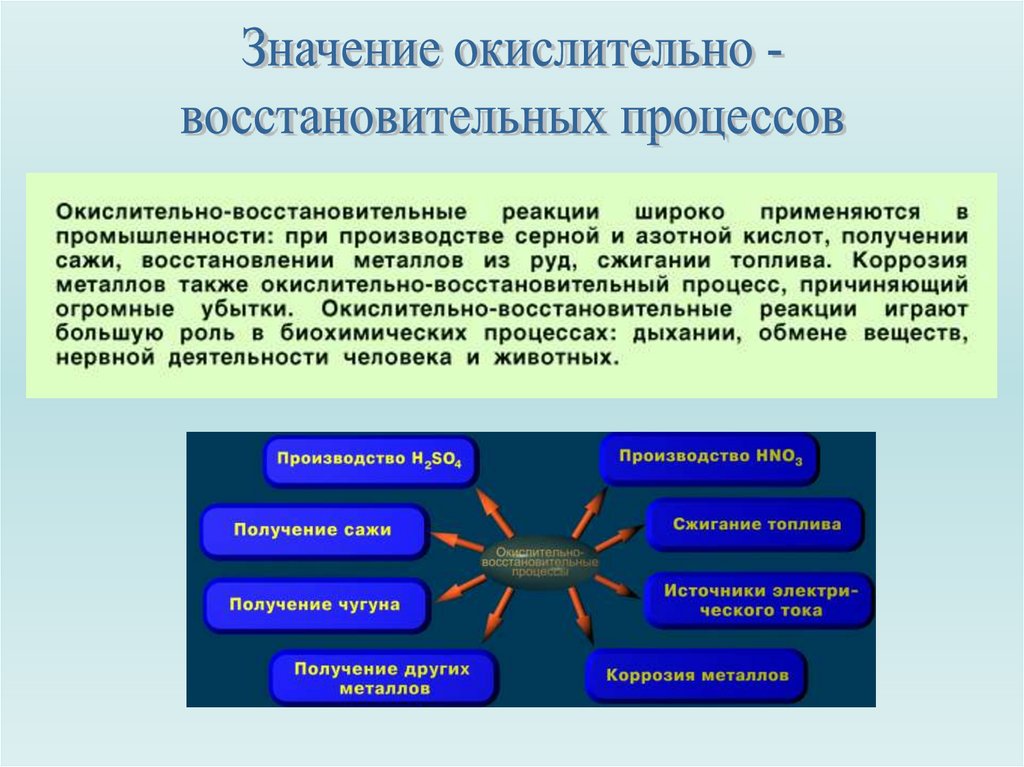
18.
19.
20.
21. Домашнее задание:
• § 49, 50• упражнение 4 (стр. 211, 214)
• № 7-38.















 Химия
Химия








