Похожие презентации:
Роль свободнорадикального окисления в пролиферации стволовых клеток
1.
Роль свободнорадикальногоокисления в пролиферации
стволовых клеток
Докладчик: Студентка 2 курса ФГБОУ ВО ПИМУ Минздрава РФ
Богомолова Мария Дмитриевна
Научный руководитель: к.б.н., ассистент кафедры биохимии
ФГБОУ ВО ПИМУ Минздрава РФ Мурач Елена Ивановна
2.
АктуальностьПриволжский исследовательский
медицинский университет
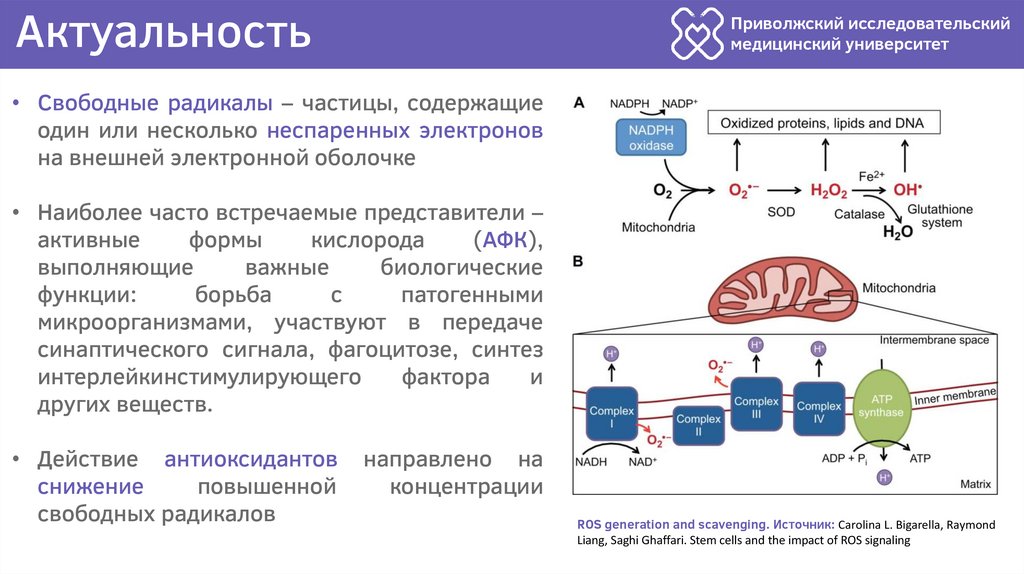
• Свободные радикалы – частицы, содержащие
один или несколько неспаренных электронов
на внешней электронной оболочке
• Наиболее часто встречаемые представители –
активные
формы
кислорода
(АФК),
выполняющие
важные
биологические
функции:
борьба
с
патогенными
микроорганизмами, участвуют в передаче
синаптического сигнала, фагоцитозе, синтез
интерлейкинстимулирующего
фактора
и
других веществ.
• Действие антиоксидантов
снижение
повышенной
свободных радикалов
направлено на
концентрации
ROS generation and scavenging. Источник: Carolina L. Bigarella, Raymond
Liang, Saghi Ghaffari. Stem cells and the impact of ROS signaling
3.
АктуальностьПриволжский исследовательский
медицинский университет
• СР способны вызывать онкологические заболевания, провоцируя
деструктивные изменения внутри клетки
• Также
причастны
к
развитию
сердечно-сосудистых
заболеваний,
нейродегенеративных
расстройств,
сахарного
диабета
и
других
патологических состояний
• При
лечении
и
устранении
последствий
данных
патологий
используют стволовые клетки
4.
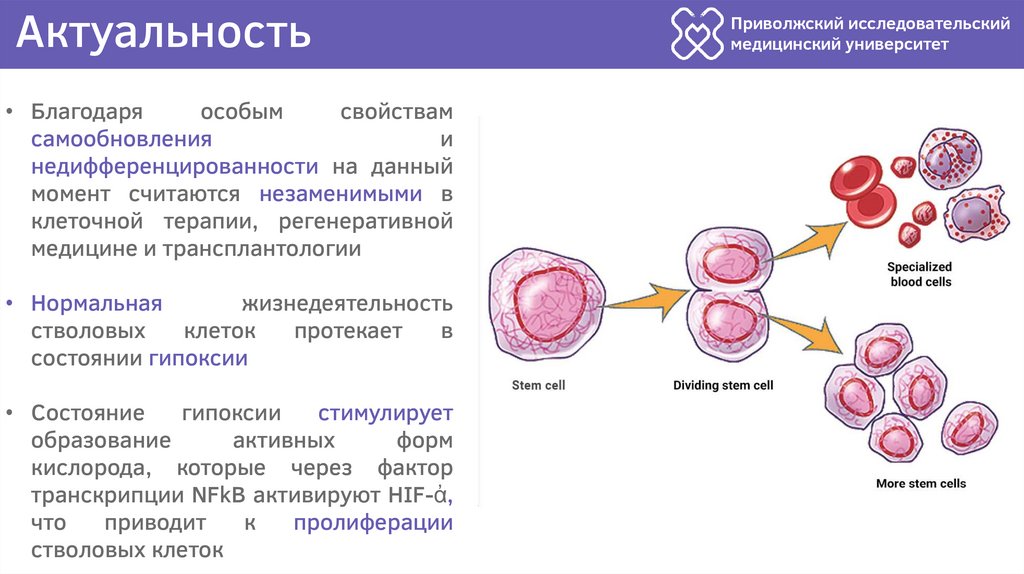
Актуальность• Благодаря
особым
свойствам
самообновления
и
недифференцированности на данный
момент считаются незаменимыми в
клеточной терапии, регенеративной
медицине и трансплантологии
• Нормальная
жизнедеятельность
стволовых
клеток
протекает
в
состоянии гипоксии
• Состояние
гипоксии
стимулирует
образование
активных
форм
кислорода, которые через фактор
транскрипции NFkB активируют HIF-ἀ,
что
приводит
к
пролиферации
стволовых клеток
Приволжский исследовательский
медицинский университет
5.
Цель работыОценить роль свободнорадикальных
процессов в индивидуальной
пролиферативной активности
стволовых клеток
6.
Задачи1. Оценить протекание
свободнорадикального окисления и
ответную активность
антиоксидантной системы в
стволовых клетках
2. Сравнить степень выраженности
этих процессов в стволовых клетках
разных пациентов
3. Объяснить полученные результаты
7.
Материалы и методыМезенхимальные стволовые клетки жирового
происхождения, увеличение x100
Источник: Wang Y. et al. Human adipose-derived mesenchymal
stem cells are resistant to HBV infection during differentiation
into hepatocytes in vitro //International journal of molecular
sciences. – 2014. – Т. 15. – №. 4. – С. 6096-6110.
Материалы были предоставлены научной
лабораторией регенеративной медицины НИИ
экспериментальной онкологии и биомедицинских
технологий. Экспериментальными образцами
послужили кондиционные среды ἀ-МЕМ, в которых
культивировали мезенхимальные стволовые клетки,
выделенные из жировой ткани двух пациентов. Оба
донора, предоставившие материал для исследования,
были женского пола, приблизительно одного возраста
(26 и 27 лет), европейцы. Каждый донор дал
информированное согласие на использование своего
материала для исследования.
Приволжский исследовательский
медицинский университет
8.
Материалы и методыСвободнорадикальную активность определяли
методом индуцированной биохемилюминесценции
(Кузьмина Е.И. с соавт., 1983)
Механизм цепного окисления в реакции Фентона
в присутствии антиоксидантов и гидроперекисей.
Источник: Пискарев И. М., Иванова И. П. Оценка окислительной и
антиоксидантной способности биологических субстратов по
хемилюминесценции, индуцированной реакцией Фентона
//Современные технологии в медицине. – 2016. – Т. 8. – №. 3..
Приволжский исследовательский
медицинский университет
№
реакции
1
2
3
4
5
6
7
8
9
10
11
12
Реакция
HOOH+Fe2+→OH• +Fe3++OH–
ROOH+Fe2+→RO• +Fe3++OH
RH+OH•→R• +H2O
RH+RO•→R• +ROH
RO• +RO• +M→ROOR+M
OH• +OH•→H2O+½O2
R• +O2+M→ROO• +M
ROO• +RH→ROOH+R
ROO• +ROO•→ROOR+1O2
OH• +InH→H2O+In
ROO• +InH→ROOH+In
ROOH+OH•→ROO• +H2O
9.
Материалы и методыПриволжский исследовательский
медицинский университет
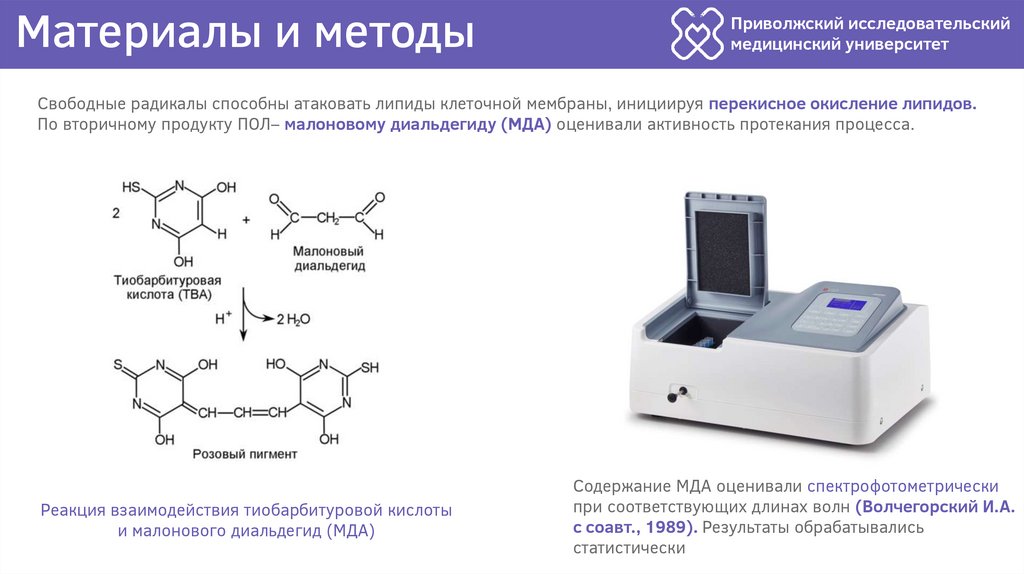
Свободные радикалы способны атаковать липиды клеточной мембраны, инициируя перекисное окисление липидов.
По вторичному продукту ПОЛ– малоновому диальдегиду (МДА) оценивали активность протекания процесса.
Реакция взаимодействия тиобарбитуровой кислоты
и малонового диальдегид (МДА)
Содержание МДА оценивали спектрофотометрически
при соответствующих длинах волн (Волчегорский И.А.
с соавт., 1989). Результаты обрабатывались
статистически
10.
РезультатыПриволжский исследовательский
медицинский университет
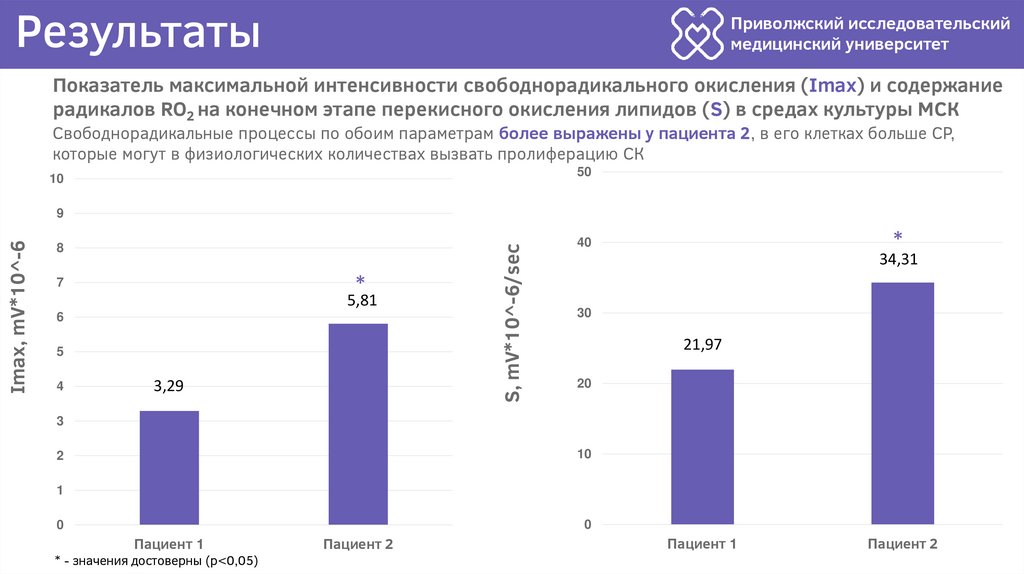
Показатель максимальной интенсивности свободнорадикального окисления (Imax) и содержание
радикалов RO2 на конечном этапе перекисного окисления липидов (S) в средах культуры МСК
Свободнорадикальные процессы по обоим параметрам более выражены у пациента 2, в его клетках больше СР,
которые могут в физиологических количествах вызвать пролиферацию СК
50
10
8
*
7
5,81
6
5
4
3,29
S, mV*10^-6/sec
Imax, mV*10^-6
9
*
40
34,31
30
21,97
20
3
10
2
1
0
0
Пациент 1
* - значения достоверны (р<0,05)
Пациент 2
Пациент 1
Пациент 2
11.
РезультатыПриволжский исследовательский
медицинский университет
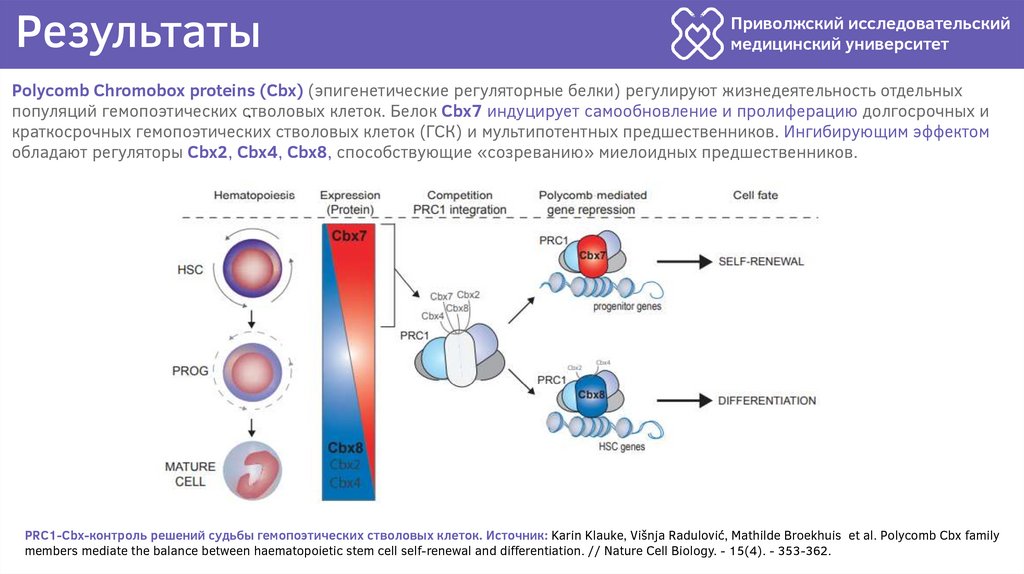
Polycomb Chromobox proteins (Cbx) (эпигенетические регуляторные белки) регулируют жизнедеятельность отдельных
популяций гемопоэтических стволовых
клеток. Белок Cbx7 индуцирует самообновление и пролиферацию долгосрочных и
.
краткосрочных гемопоэтических стволовых клеток (ГСК) и мультипотентных предшественников. Ингибирующим эффектом
обладают регуляторы Cbx2, Cbx4, Cbx8, способствующие «созреванию» миелоидных предшественников.
PRC1-Cbx-контроль решений судьбы гемопоэтических стволовых клеток. Источник: Karin Klauke, Višnja Radulović, Mathilde Broekhuis et al. Polycomb Cbx family
members mediate the balance between haematopoietic stem cell self-renewal and differentiation. // Nature Cell Biology. - 15(4). - 353-362.
12.
РезультатыПриволжский исследовательский
медицинский университет
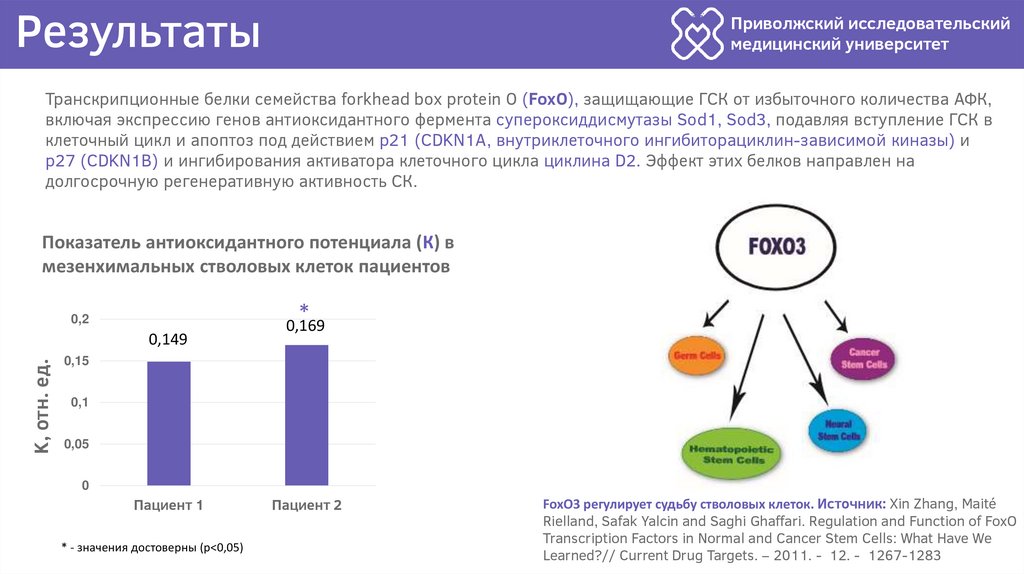
Транскрипционные белки семейства forkhead box protein O (FoxO), защищающие ГСК от избыточного количества АФК,
включая экспрессию генов антиоксидантного фермента супероксиддисмутазы Sod1, Sod3, подавляя вступление ГСК в
клеточный цикл и апоптоз под действием p21 (CDKN1A, внутриклеточного ингибиторациклин-зависимой киназы) и
p27 (CDKN1B) и ингибирования активатора клеточного цикла циклина D2. Эффект этих белков направлен на
долгосрочную регенеративную активность СК.
Показатель антиоксидантного потенциала (К) в
мезенхимальных стволовых клеток пациентов
0,2
K, отн. ед.
0,149
*
0,169
0,15
0,1
0,05
0
Пациент 1
* - значения достоверны (р<0,05)
Пациент 2
FoxO3 регулирует судьбу стволовых клеток. Источник: Xin Zhang, Maité
Rielland, Safak Yalcin and Saghi Ghaffari. Regulation and Function of FoxO
Transcription Factors in Normal and Cancer Stem Cells: What Have We
Learned?// Current Drug Targets. – 2011. - 12. - 1267-1283
13.
РезультатыПриволжский исследовательский
медицинский университет
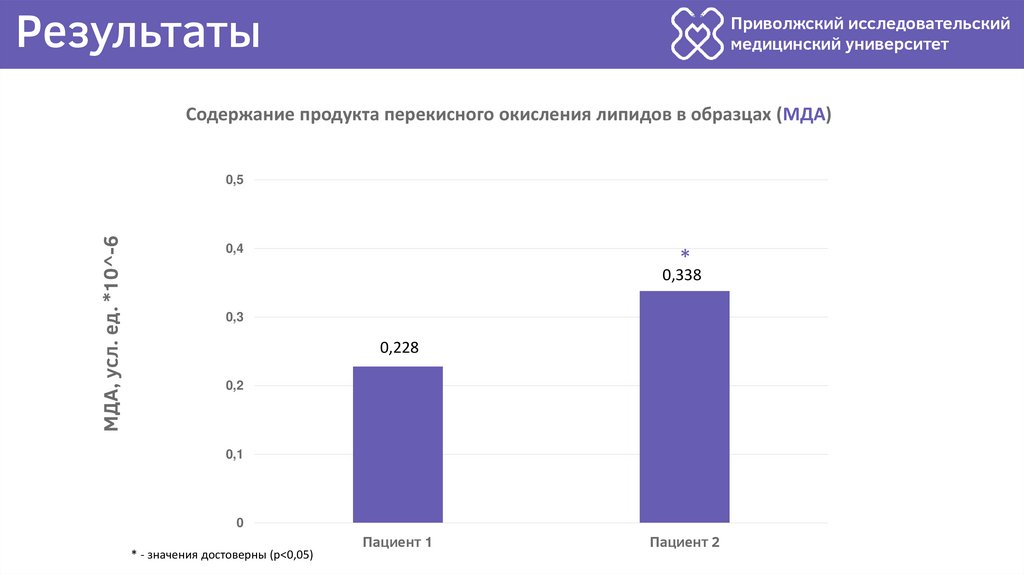
Содержание продукта перекисного окисления липидов в образцах (МДА)
МДА, усл. ед. *10^-6
0,5
0,4
*
0,338
0,3
0,228
0,2
0,1
0
* - значения достоверны (р<0,05)
Пациент 1
Пациент 2
14.
РезультатыПриволжский исследовательский
медицинский университет
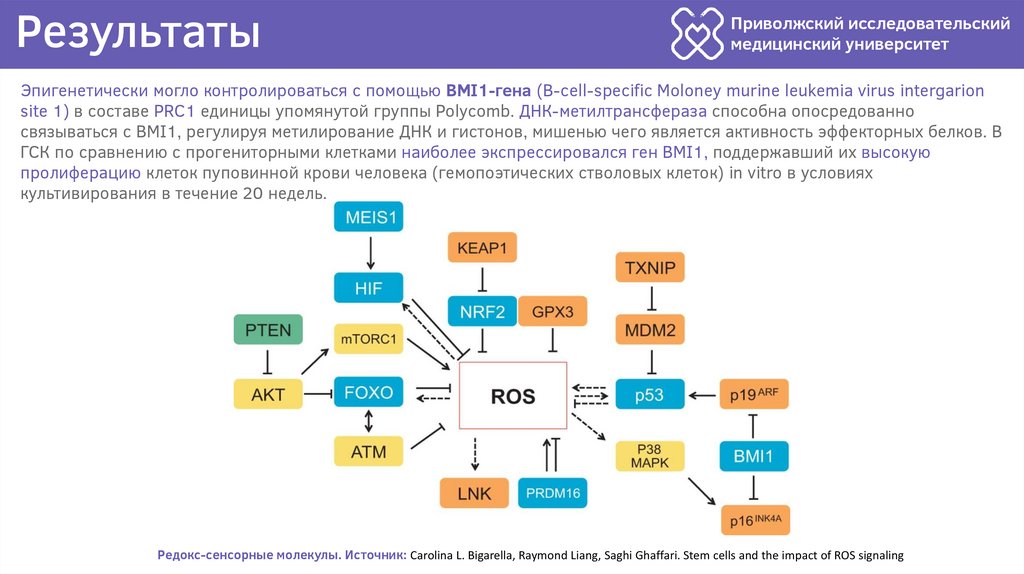
Эпигенетически могло контролироваться с помощью BMI1-гена (B-cell-specific Moloney murine leukemia virus intergarion
site 1) в составе PRC1 единицы упомянутой группы Polycomb. ДНК-метилтрансфераза способна опосредованно
связываться с BMI1, регулируя метилирование ДНК и гистонов, мишенью чего является активность эффекторных белков. В
ГСК по сравнению с прогениторными клетками наиболее экспрессировался ген BMI1, поддержавший их высокую
пролиферацию клеток пуповинной крови человека (гемопоэтических стволовых клеток) in vitro в условиях
культивирования в течение 20 недель.
Редокс-сенсорные молекулы. Источник: Carolina L. Bigarella, Raymond Liang, Saghi Ghaffari. Stem cells and the impact of ROS signaling
15.
Заключение1. Свободные радикалы способны
активировать пролиферацию
недифференцированных стволовых
клеток
2. Анализ данных
свободнорадикального окисления,
процессов перекисного окисления
липидов и антиоксидантной
активности позволяют выявить этот
процесс
16.
Источники литературы1. Bigarella C. L., Liang R., Ghaffari S. Stem cells and the impact of ROS signaling
//Development. – 2014. – Т. 141. – №. 22. – С. 4206-4218.
2. Klauke K. et al. Polycomb Cbx family members mediate the balance between haematopoietic
stem cell self-renewal and differentiation //Nature cell biology. – 2013. – Т. 15. – №. 4. –
С. 353-362.
3. Lee J. et al. Pharmacological regulation of oxidative stress in stem cells //Oxidative Medicine
and Cellular Longevity. – 2018. – Т. 2018.
4. Lyublinskaya O. G. et al. Reactive oxygen species are required for human mesenchymal stem
cells to initiate proliferation after the quiescence exit //Oxidative medicine and cellular
longevity. – 2015. – Т. 2015.
5. Olariu V., Lövkvist C., Sneppen K. Nanog, Oct4 and Tet1 interplay in establishing pluripotency
//Scientific reports. – 2016. – Т. 6. – С. 25438.
6. Rizo A. et al. Long-term maintenance of human hematopoietic stem/progenitor cells by
expression of BMI1 //Blood, The Journal of the American Society of Hematology. – 2008. – Т.
111. – №. 5. – С. 2621-2630.
7. Seymour T., Twigger A. J., Kakulas F. Pluripotency genes and their functions in the normal and
aberrant breast and brain //International journal of molecular sciences. – 2015. – Т. 16. – №.
11. – С. 27288-27301.
8. Zhang X. et al. Regulation and function of FoxO transcription factors in normal and cancer stem
cells: what have we learned? //Current drug targets. – 2011. – Т. 12. – №. 9. – С. 1267-1283.








 Биология
Биология








