Похожие презентации:
Базовые расчетные формулы
1. Базовые расчетные формулы
БАЗОВЫЕ РАСЧЕТНЫЕ ФОРМУЛЫДЛЯ РЕШЕНИЯ ЗАДАЧ ПО ХИМИИ
2. Основные физические величины, используемые при решении задач по химии
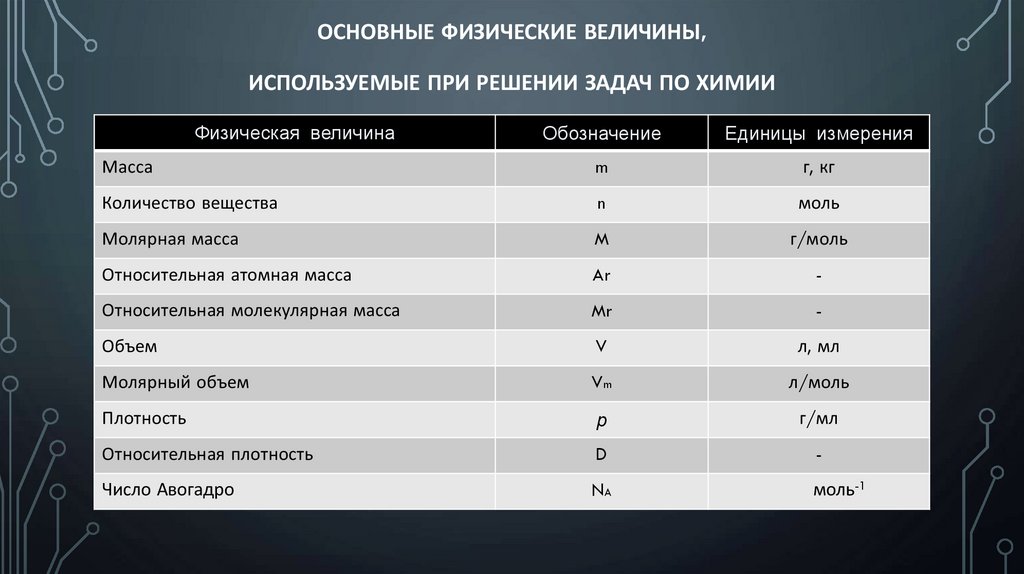
ОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ,ИСПОЛЬЗУЕМЫЕ ПРИ РЕШЕНИИ ЗАДАЧ ПО ХИМИИ
Физическая величина
Обозначение
Единицы измерения
Масса
m
г, кг
Количество вещества
n
моль
Молярная масса
M
г/моль
Относительная атомная масса
Ar
-
Относительная молекулярная масса
Mr
-
Объем
V
л, мл
Молярный объем
Vm
л/моль
Плотность
p
г/мл
Относительная плотность
D
-
Число Авогадро
NA
моль-1
3. Основные физические величины, используемые при решении задач по химии
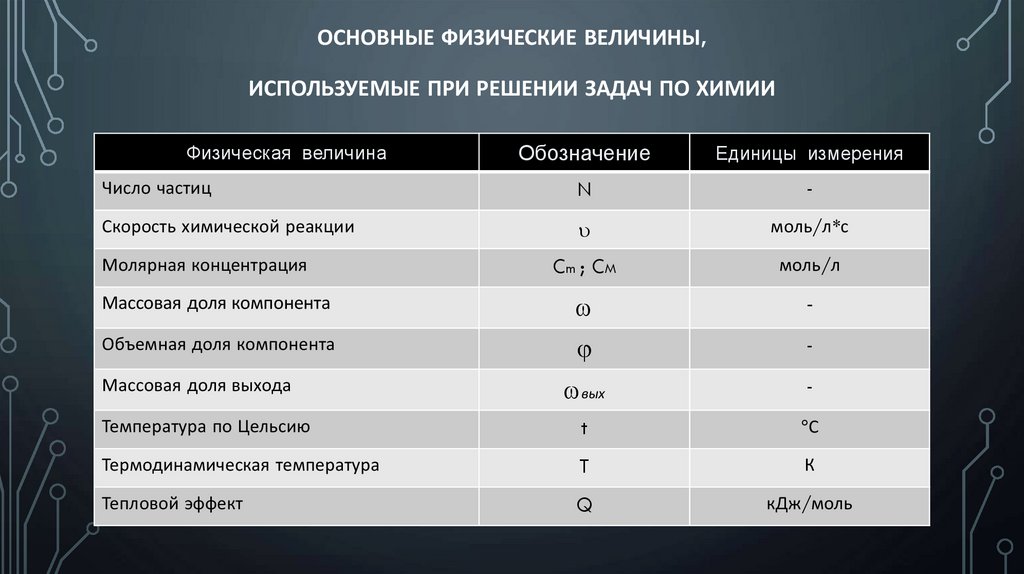
ОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ,ИСПОЛЬЗУЕМЫЕ ПРИ РЕШЕНИИ ЗАДАЧ ПО ХИМИИ
Обозначение
Единицы измерения
Число частиц
N
-
Скорость химической реакции
моль/л*с
Cm ; CM
моль/л
Массовая доля компонента
-
Объемная доля компонента
-
вых
-
Температура по Цельсию
t
С
Термодинамическая температура
T
К
Тепловой эффект
Q
кДж/моль
Физическая величина
Молярная концентрация
Массовая доля выхода
4. Основные формулы и величины, необходимые для расчетов
ОСНОВНЫЕ ФОРМУЛЫ И ВЕЛИЧИНЫ,НЕОБХОДИМЫЕ ДЛЯ РАСЧЕТОВ
• Аr – отношение массы атома элемента к 1/12 массы атома С.
Аr(x)=ma(x) / 1/12ma(C).
• Mr – отношение массы молекулы вещества к 1/12 массы атома С.
Мr(ХУ)= Ar(Х)+Ar(У)
• Масса – основная характеристика всех физических тел и частиц,
определяющая их инерционные и гравитационные свойства.
5. Основные формулы и величины, необходимые для расчетов
ОСНОВНЫЕ ФОРМУЛЫ И ВЕЛИЧИНЫ,НЕОБХОДИМЫЕ ДЛЯ РАСЧЕТОВ
Моль – количество вещества системы, содержащей столько же структурных
элементов, сколько содержится атомов в углероде массой 0,012 кг.
Молярная масса – это масса 1 моль вещества.
m=n*M; n=m/M;
M=m/n
Молярный объем – объем вещества количеством один моль.
Vm газа=22,4 л/моль
n=V/Vm; V=n*Vm;
Vm=V/n
6. Основные формулы и величины, необходимые для расчетов
ОСНОВНЫЕ ФОРМУЛЫ И ВЕЛИЧИНЫ,НЕОБХОДИМЫЕ ДЛЯ РАСЧЕТОВ
• Число структурных единиц
N=n*NA;
n=N/NA
• Плотность вещества
ρ=m/V;
m=ρ*V;
V=m/ρ
• Относительная плотность – отношение плотностей двух веществ, показывающее, во
сколько раз одно вещество тяжелее другого.
Dx (У) = M(У)/M(x) = Mr(У)/ Mr(x)
7. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 1. Найти относительную атомную массу кислорода, если масса
атома кислорода
равна 2,66*10-23г, а масса атома углерода 1,99*10-23г.
8. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 1. Найти относительную атомную массу кислорода, если масса
атома кислорода
равна 2,66*10-23г, а масса атома углерода 1,99*10-23г.
9. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 1. Найти относительную атомную массу кислорода, если масса
атома кислорода
равна 2,66*10-23г, а масса атома углерода 1,99*10-23г.
Ответ: Ar(O)=16
10. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 2. Вычислить относительную молекулярную массу K3PO4
Ответ: Mr (K3PO4)=212.
11. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ3. На весах отвесили 500г сульфата цинка. Какому количеству вещества это
соответствует?
Ответ: n(ZnSO4)=3,1моль.
4. Сколько молекул содержится в H2O массой 54г, какова масса 1 молекулы H2O?
Ответ: N=18,06*1023 молекул,
mm=(H2O)=2,99*10-23 г
5. Вычислите, какая масса углерода содержится в 90г этана C2H6 .
Ответ: m(C)= 72 г
12. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ6. Вычислите, в какой массе оксида фосфора(III) P2O3 содержится 6,2г
фосфора.
Ответ: m(P2O3)=11г
7. Вычислить, сколько молекул содержится в 36г H2O. В каком объеме метана
(н.у.) столько же молекул?
Ответ: N(H2O)=12,04*1023молекул,
V(CH4)=44,8л.
8. Сколько молей атомов углерода в 15г CH3COOH?
Ответ: n(C)=0,5моль.
9. Чему равно общее число атомов в 3г этана?
Ответ: N(атомов)=48,16*1022.
13. Задачи для самостоятельного решения:
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ:1.
Вычислите относительную молекулярную массу веществ состава: а) CO2 б) HNO3 ; в) CuSO4;
г) Cu(OH)2.
2.
Рассчитайте массу 2 моль оксида меди (II), 0,5 моль серной кислоты; 0,1 моль хлорида
натрия; 0,1 моль кислорода.
3.
На одну чашку весов поместили 0,5 моль оксида меди (II). Какое количество оксида железа
(III) необходимо поместить на другую чашку весов, чтобы они были в равновесии?
4.
Какое вещество содержит больше составных частиц: бор массой 1 г или медь массой 1 г?
Ответ подтвердите расчётами.
5.
Какой должна быть масса магния, чтобы она содержала столько же атомов, сколько их
содержится в веществе железа массой 28 г?
;
14. Задачи для самостоятельного решения:
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ:6. Сколько молекул воды содержится в воде объёмом 1мл?
7. Какое вещество содержит больше молекул: вода массой 1 г или сероводород массой 1 г?
Ответ подтвердите расчётами.
8. Одинаковое ли число молекул в 1 л воды и в 1 л серной кислоты, плотность которой 1831
кг/м ? Ответ подтвердите расчётами.
3
9. Определите объём (н.у.), который займёт при нормальных условиях газовая смесь,
содержащая водород массой 1,4 г и азот массой 5,6 г.
10. Рассчитайте массу фосфина, содержащего столько же электронов, что и 8,96 л
бромоводорода.












 Химия
Химия








