Похожие презентации:
Галогены
1.
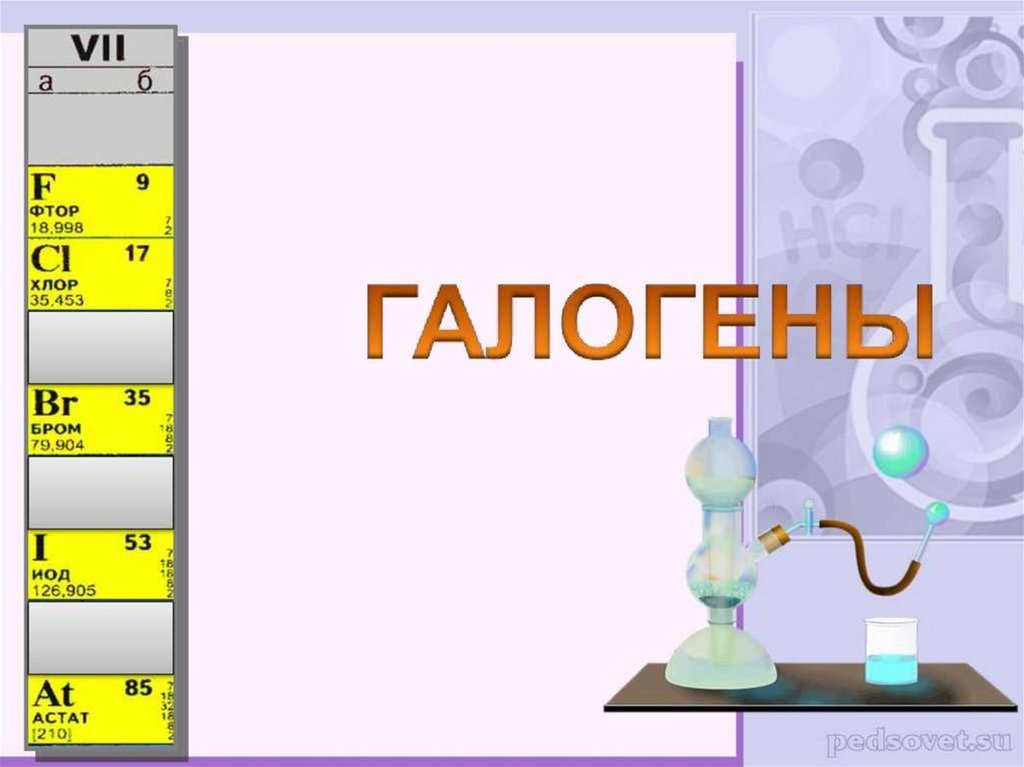
ГАЛОГЕНЫ2.
3.
4.
5.
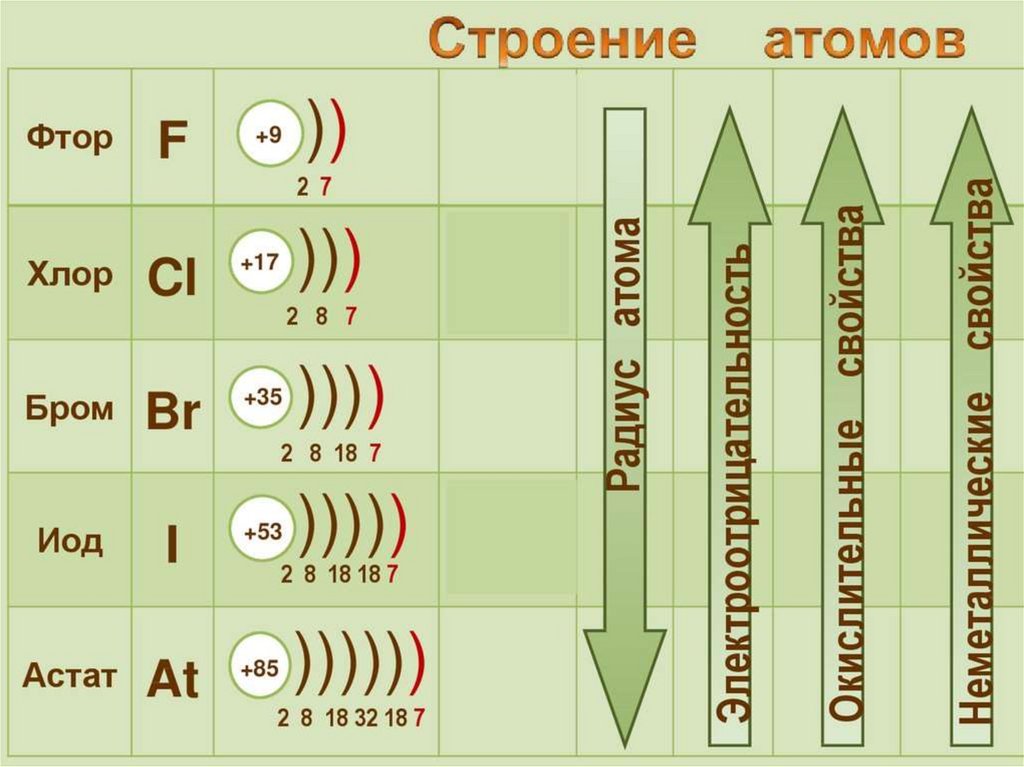
Физические свойстваF2
6.
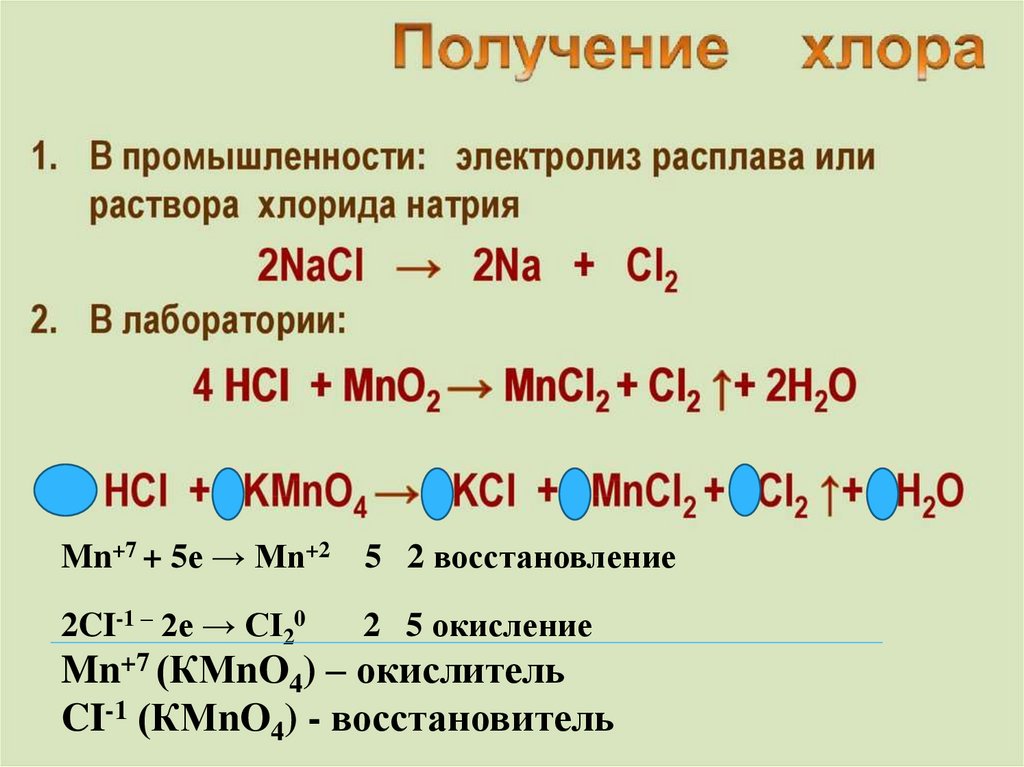
Mn+7 + 5e → Mn+25 2 восстановление
2CI-1 – 2e → CI20
2 5 окисление
Mn+7 (КМnO4) – окислитель
CI-1 (КМnO4) - восстановитель
7.
электролизNaCI + H2O =
2NaCI + 2H2O = 2NaOH + CI2↑ + H2↑
8.
9.
10.
11.
Химические свойства Cl2 -сильно реакционноспособен (искл. C, O2, N2 и
некот. др.)
С простыми веществами:
С металлами
С неметаллами
Fe + Cl2 →
H2 + Cl2 →
Cu + Cl2 →
P + Cl2 →
Со сложными веществами:
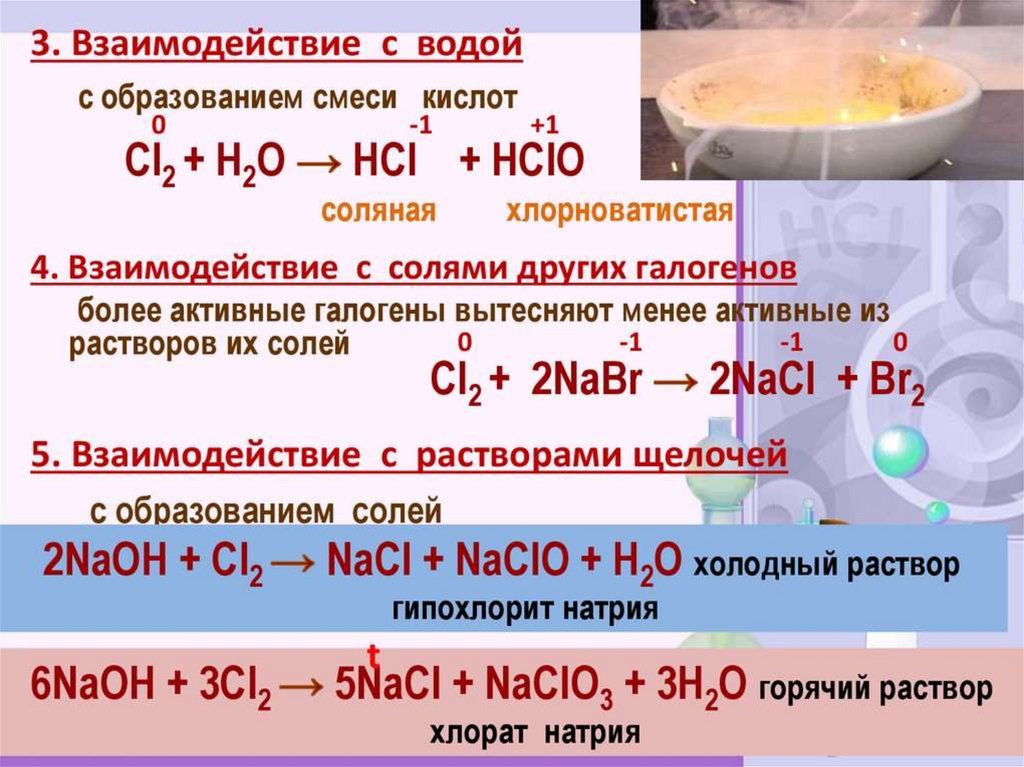
H2O + Cl2 →
NaOH + Cl2 →
KBr + Cl2 →
KI + Cl2 →
Горение железа в хлоре
12.
Химические свойства Cl2 -сильно реакционноспособен (искл. C, O2, N2 и
некот. др.)
С простыми веществами:
С металлами
С неметаллами
2Fe + 3Cl2 → 2FeCl3
H2 + Cl2 → 2HCl (tº, hυ)
Cu + Cl2 → Cu Cl2
2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO хлорная вода
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl
13.
Химические свойстваBr2 - реакционноспособен
С простыми веществами:
С металлами
С неметаллами
Al + Br2 →
H2 + Br2 →
Cu + Br2 →
P + Br2 →
Со сложными веществами:
Br2 + NaOH →
KI + Br2 →
14.
Химические свойстваBr2 - реакционноспособен
С простыми веществами:
С металлами
С неметаллами
2Al + 3Br2 → 2AlBr3
H2 + Br2 → 2HCl
Cu + Br2 → Cu Br2
2P + 5Br2 → 2PBr5
Со сложными веществами:
Br2 + 2NaOH → NaBr + NaBrO + H2O бромид и гипобромит натрия
2KI + Br2 → I2 + 2КCl
15.
Химические свойстваI2 - химически наименее активен
С простыми веществами:
С металлами
С неметаллами
Hg + I2 →
H2 + I2 →
Al + I2 →
P + Br2 →
Со сложными веществами:
I 2 + H 2O →
I2 + р-р крахмала →
Действие крахмала на йод
16.
Химические свойстваI2 - химически наименее активен
С простыми веществами:
С металлами
С неметаллами
Hg + I2 → HgI2
H2 + I2 → 2HCl (tº)
2Al + 3I2 → 2AlI3
2P + 3 I2 → 2PI3
Со сложными веществами:
3 I2 +6 NaOH →5 NaI + NaIO3+3H2O иодид и иодат натрия
I2 + р-р крахмала → темно-синее окрашивание
17.
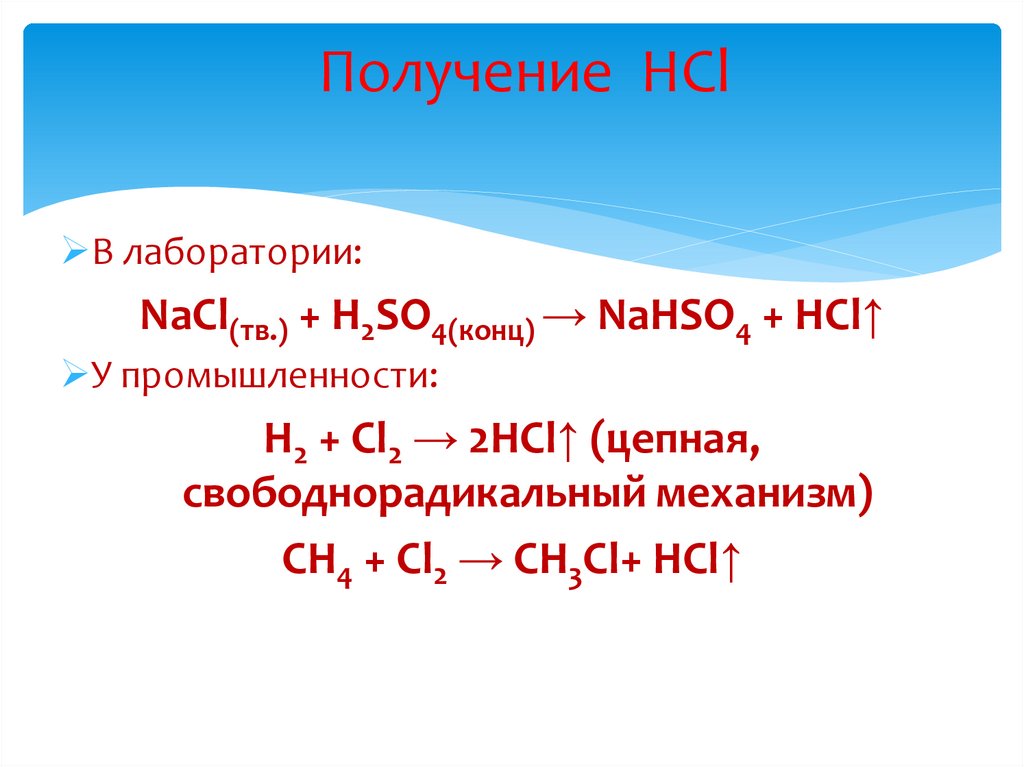
Получение HClВ лаборатории:
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl↑
У промышленности:
H2 + Cl2 → 2HCl↑ (цепная,
свободнорадикальный механизм)
CH4 + Cl2 → CH3Cl+ HCl↑
18.
19.
20.
21.
22.
23.
24.
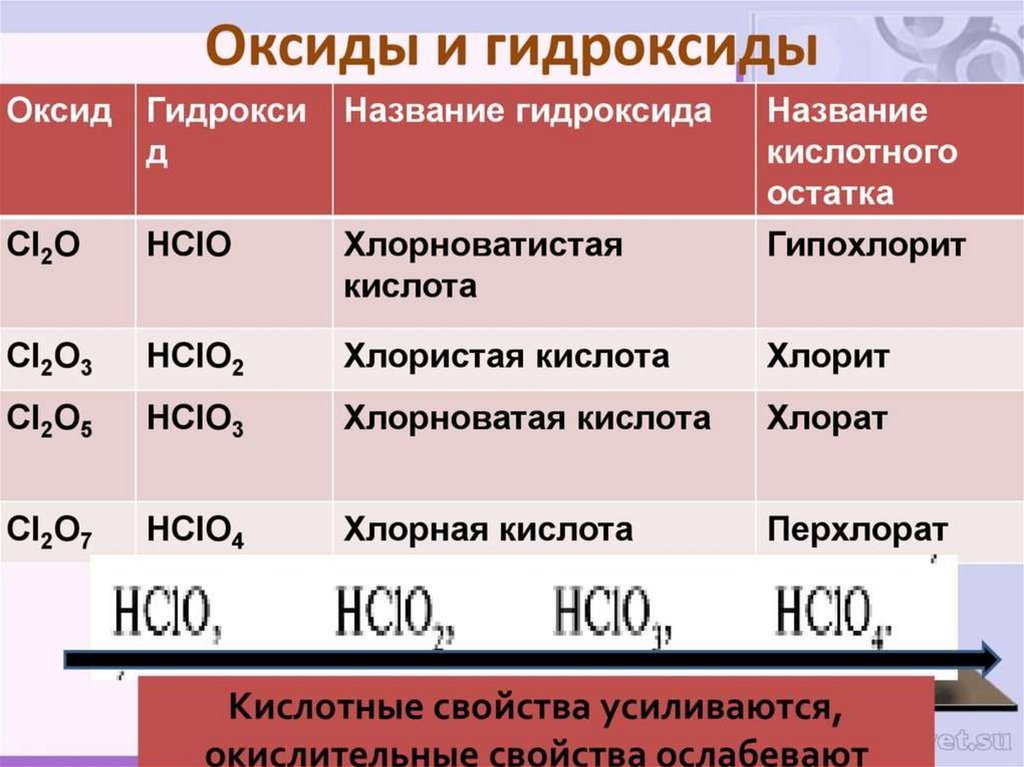
Химические свойства галогеновНайди соответствие между исходными веществами
и продуктами реакций
2H2 O + 2F2 =
2NaOH + H2 +Cl2
Xe + 2F2 =
2NaCl + I2
H2 + F2 =
2AuCl3
2Au + 3Cl2 =
XeF4
2NaCl + 2H2 O =
4 HF + O2
2NaI + Cl2 =
2HF
25.
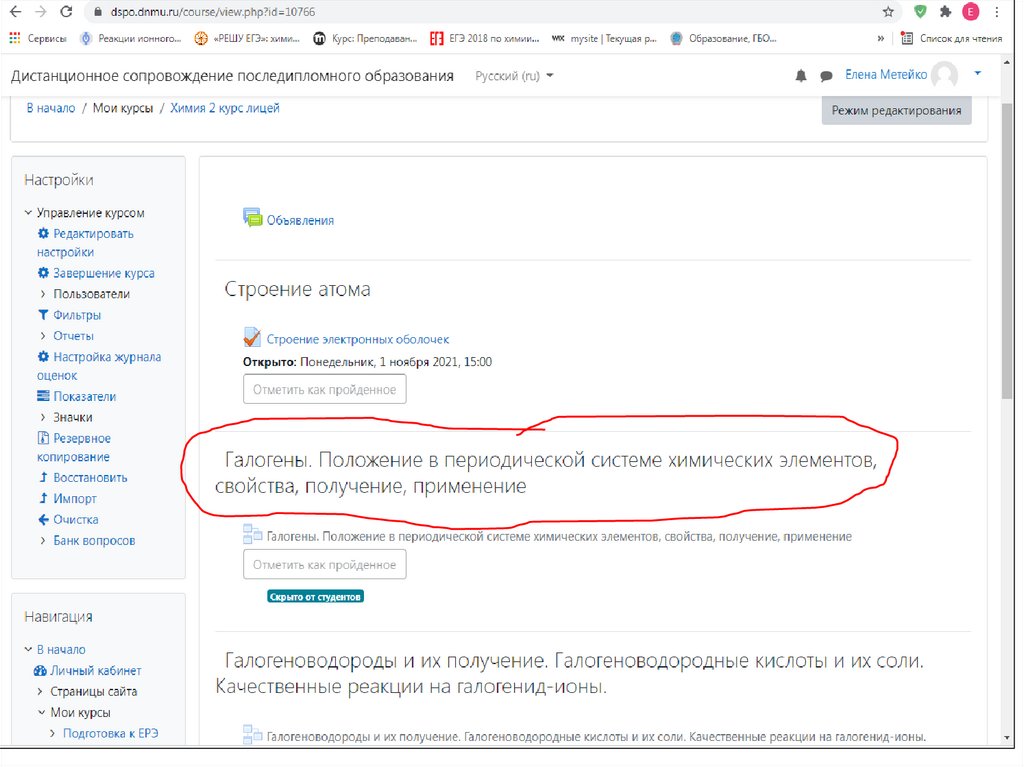
Домашнее задание:1) Пройти лекцию в ИОС (Химия. 2 курс) «Галогены.
Положение в периодической системе химических
элементов, свойства, получение, применение»
2) Закончить уравнения следующих реакций:
1) HI + MnO2 →
2) HI + H2SO4 →
3) HI + O2 →
4) HI + Br2 →
5) HBr + H2SO4 →
6) I2 + Cl2 + H2O →
7) SiO2 + HF →
8) I2 + NaOH →
9) F2 + H2O →
10) F2 + SiO2 →
26.
27.
HI + MnO2 → I2 + MnI2 + H2OHI + H2SO4 → I2 + H2S + H2O
HI + O2за
→H
2O + I2
Спасибо
внимание!
HI + Br2 → HBr + I2
HBr + H2SO4 → Br2 + SO2 + H2O
















 Химия
Химия