Похожие презентации:
Галогены. 9 класс
1.
Галогены2.
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
10
II
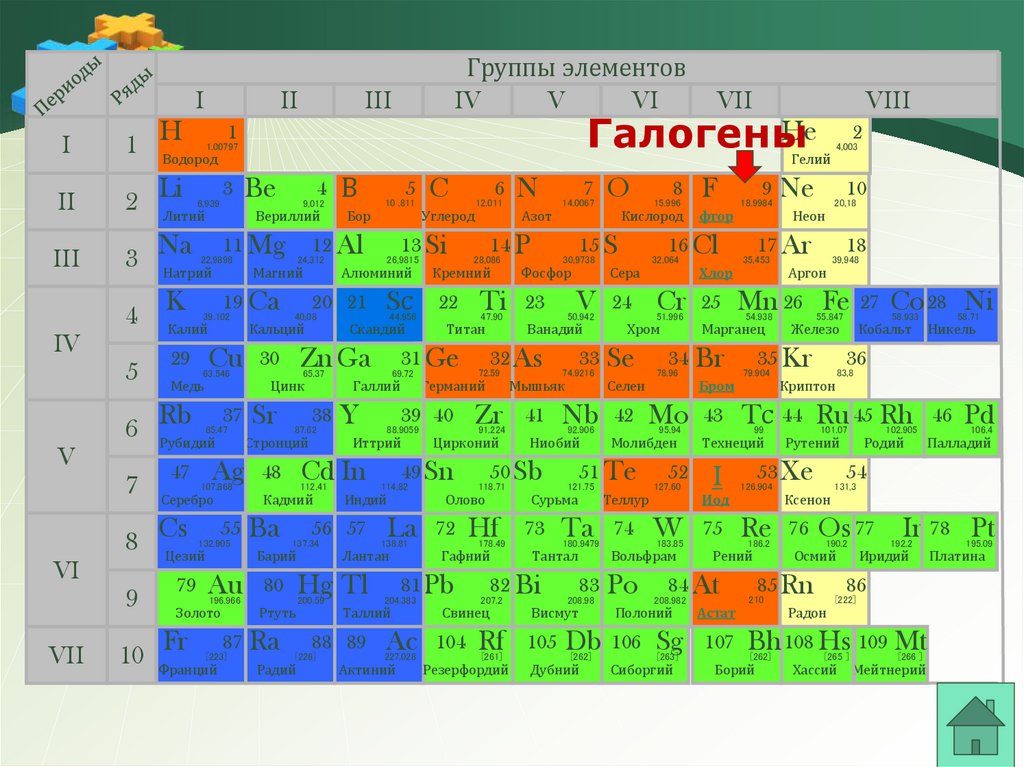
Группы элементов
IV
V
VI
III
Водород
3
Литий
Cu
63.546
Медь
Rb
37
85.47
Рубидий
47
Ag
107.868
Серебро
Cs
55
132.905
Цезий
79
Au
196.966
Золото
Fr
4
9,012
Франций
65.37
Цинк
38
87.62
Стронций
Sс
44.956
Скандий
Иттрий
112.41
Кадмий
Индий
56 57
137.34
Барий
Ртуть
200.59
Радий
Ac
227.028
Актиний
Ti
47.90
Zr
91.224
Цирконий
Hf
178.49
Гафний
Свинец
Rf
[261]
Резерфордий
O
8
15.996
Кислород
15 S
Фосфор
V
23
50.942
Ванадий
33
74.9216
Мышьяк
41
Nb
92.906
Ниобий
73
Ta
180.9479
Тантал
83
208.98
Висмут
105
Db
[262]
Дубний
F
фтор
16 Cl
32,064
Сера
Cr
24
51.996
Хром
Se
34
78.96
Селен
42
Mo
95.94
Молибден
51 Te
121.75
Сурьма
82 Bi
207.2
7
14.0067
30,9738
50 Sb
118.71
Олово
104
Азот
32 As
72.59
Германий
72
N
14 P
28,086
Титан
81 Pb
204.383
Таллий
88 89
[226]
La
138.81
Лантан
Hg Tl
80
22
49 Sn
114.82
12,011
Кремний
39 40
88.9059
6
Углерод
31 Ge
69.72
Галлий
Y
C
13 Si
26,9815
Алюминий
Cd In
48
87 Ra
[223]
5
10 .811
Zn Ga
30
Ba
Бор
20 21
40,08
Кальций
Sr
В
12 Al
24,312
Магний
19 Ca
39.102
Калий
29
Be
11 Mg
Натрий
2
Гелий
Вериллий
22,9898
VIII
He
Галогены
1
1.00797
6,939
VII
Теллур
74
52
127.60
W
183.85
Вольфрам
Po
25
Br
Бром
43
Иод
75
Sg
[263]
Сиборгий
54.938
107
Неон
18
Аргон
39,948
27
55.847
Железо
35 Kr
79.904
Co 28 Ni
58.933
Кобальт
99
36
Криптон
101.07
Re
186.2
Ксенон
76
Родий
[262]
Pd
106.4
Палладий
131,3
Os 77 Ir 78 Pt
190.2
192.2
Осмий
Иридий
86
Радон
[222]
Bh 108 Hs 109 Mt
Борий
46
54
85 Rn
210
102.905
Рутений
53 Xe
126.904
58.71
Никель
83,8
Tс 44 Ru 45 Rh
Рений
Астат
10
20,18
Mn 26 Fe
Технеций
I
Ne
17 Ar
35,453
Марганец
84 At
208.982
Полоний
106
Хлор
9
18.9984
4,003
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
3.
Химические свойстваВзаимодействие с металлами:
1. К + Cl2→ КCl
2. Fe + Cl2 → FeCl3
3. Cu + Cl2 → Cu Cl2
4. Al + Br2 → AlBr3
5. Al + I2 → AlI3
4.
Химические свойстваВзаимодействие с неметаллами:
А) с водородом
1.
2.
3.
4.
H2
H2
H2
H2
+ F2 → 2HF +Q
+ Cl2 → 2HCl +Q
+ Br2 → 2HBr +Q
+ I2 → 2HCl - Q
В) с другими неметаллами
Скорость
реакции
уменьш.
1. P + Cl2 → PCl5 ( tº, в изб.Сl2)
5.
Химические свойстваВзаимодействие со сложными веществами:
А) с водой
1.
2.
3.
4.
2H2O + F2 → 4HF + O2 (взрыв)
H2O + Cl2 → HCl + HClO хлорная вода
Br2 + H2O → HBr + HBrO бромная вода
I2 + H2O → HI + HIO
6.
Химические свойстваВзаимодействие со сложными веществами:
Б) «ряд активности» галогенов
F2 > Cl2 > Br2 > I2
1. 2KBr + Cl2 → Br2 + 2КCl
2. 2KI + Cl2 → I2 + 2КCl
3. 2KI
+ Br2 → I2 + 2КCl
В) с органическими веществами:
I2 + крахмал →
7.
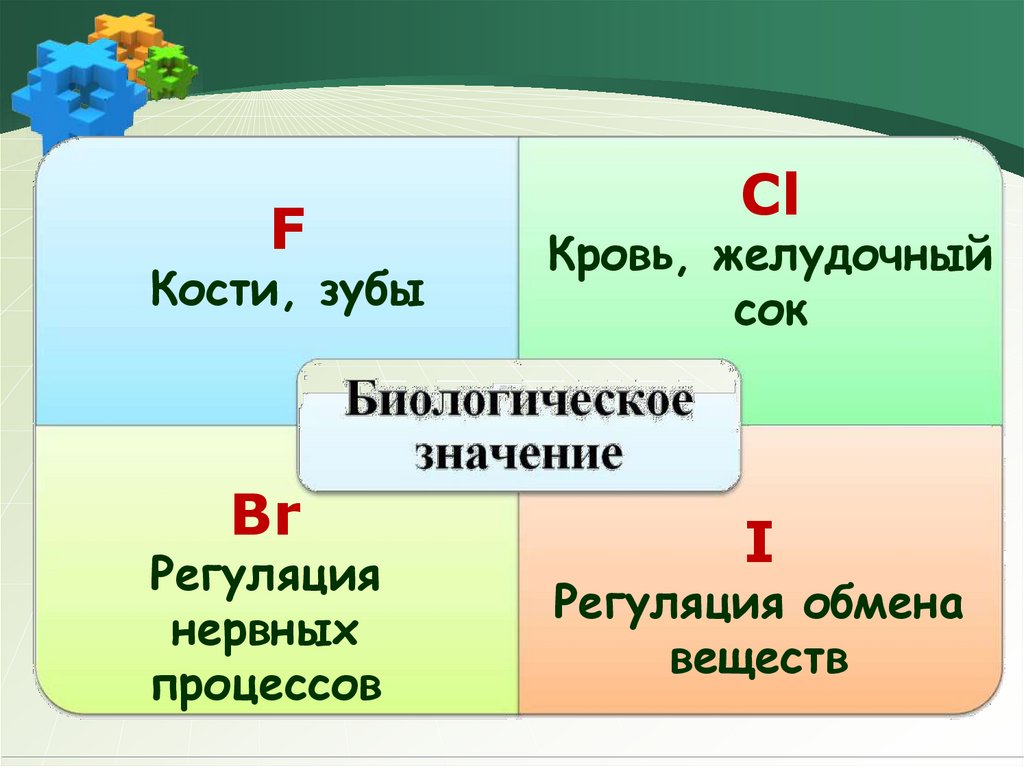
FКости, зубы
Br
Регуляция
нервных
процессов
Сl
Кровь, желудочный
сок
I
Регуляция обмена
веществ
8.
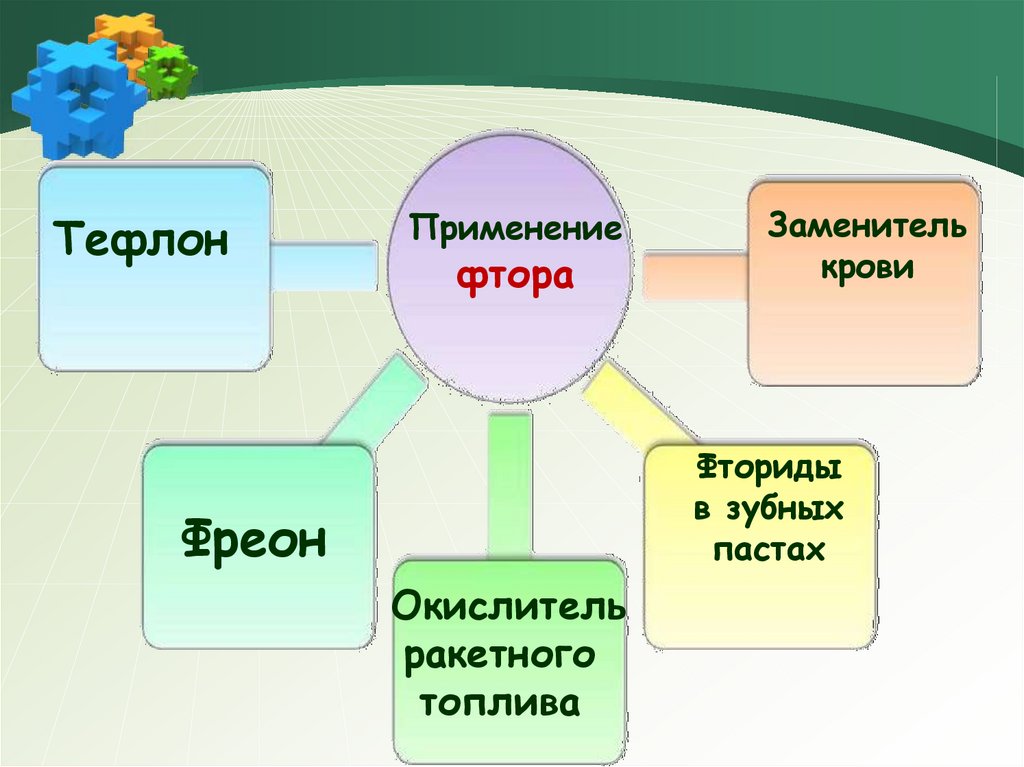
ТефлонПрименение
фтора
Заменитель
крови
Фториды
в зубных
пастах
Фреон
Окислитель
ракетного
топлива
9.
Домашнее заданиеСоставьте схемы электронного
баланса и расставьте коэффициенты:
Na + Cl2 = NaCl
S + F2 = SF6
Fe + Br2= FeBr3
P+
Cl2 = PCl5
NaI + Cl2 = NaCl + I2
F2 + H2O = HF + O2
NaBr + Cl2 = NaCl + Br2
KOH + Cl2 = KCl + KClO3 + H2O






 Химия
Химия