Похожие презентации:
Периодический закон и периодическая система Д.И. Менделеева. Самостоятельное занятие № 2
1.
Самостоятельное занятие № 2Периодический закон и
периодическая система
Д.И. Менделеева
2.
3.
4.
5.
6.
7.
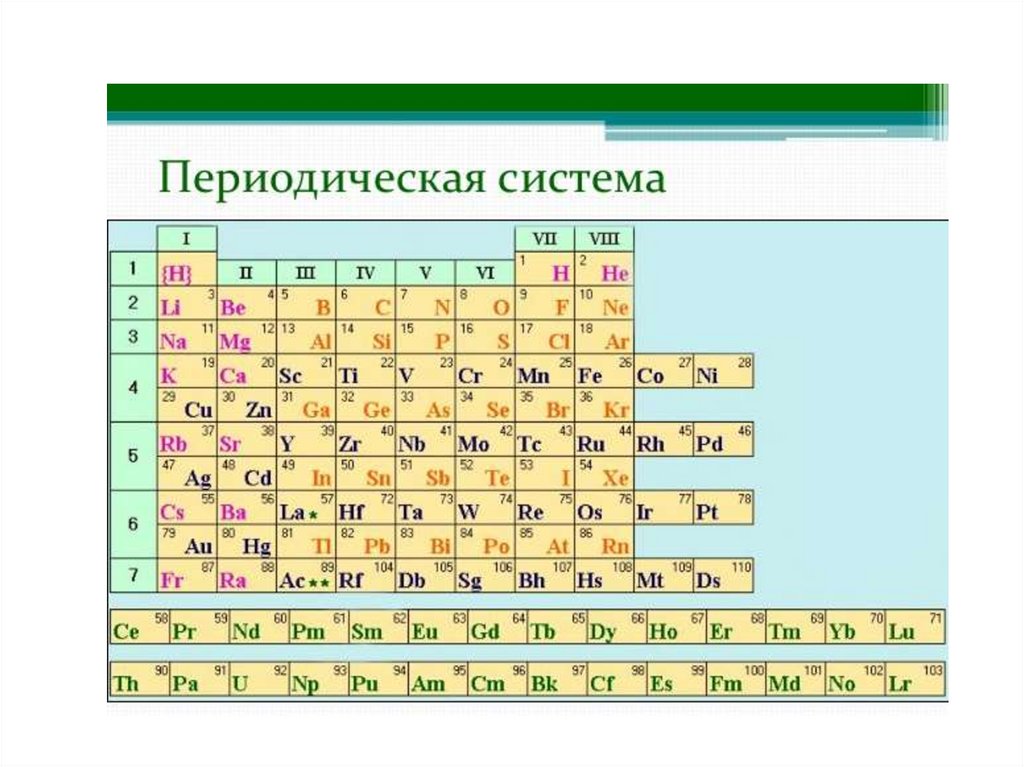
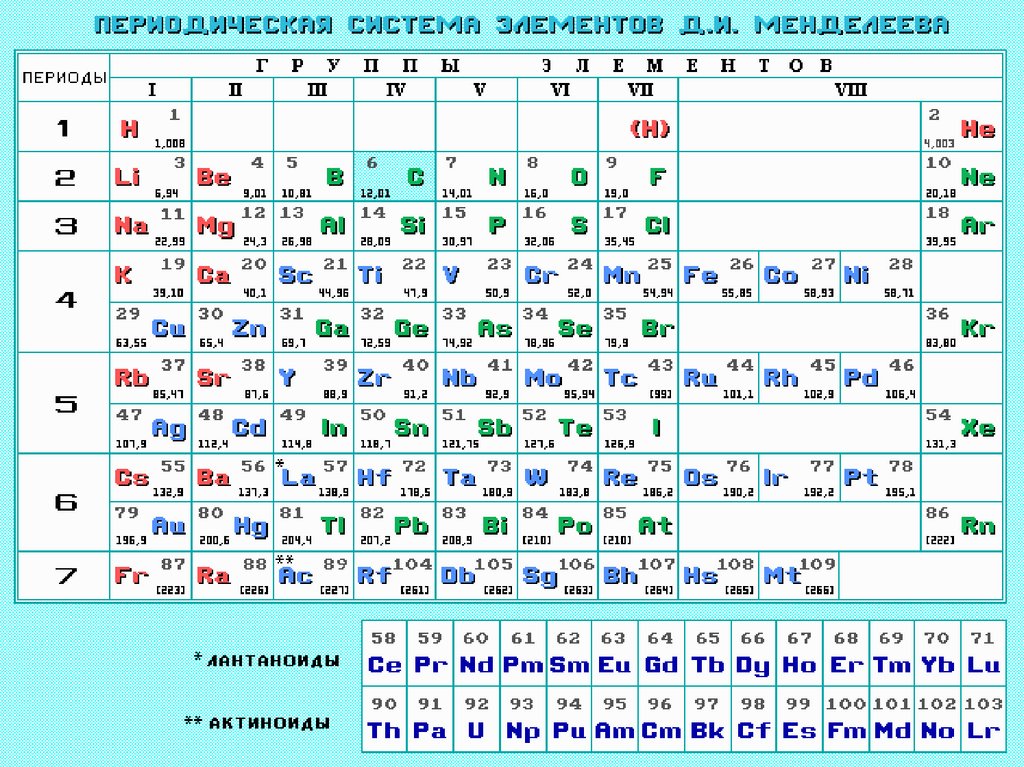
1. Периодический закон Д.И.Менделеева
• Свойства элементов и их соединений
находятся в периодической зависимости от
заряда ядра атома или порядкового номера
элемента.
• Выражением периодического закона служит
таблица, наглядно отражающая эти
закономерности и получившая название
периодической системы элементов
Менделеева.
8.
9.
ПериодПериодом называется
горизонтальная совокупность
химических элементов в атомах
которых происходит заполнение
электронами одного и того же
валентного слоя, имеется 7
периодов
10.
Группы• Группы – вертикальные столбики
химически элементов, имеющих
одинаковое число валентных
электронов, номеру группы
соответствует максимальная
валентность.
• Группы делятся на подгруппы.
11.
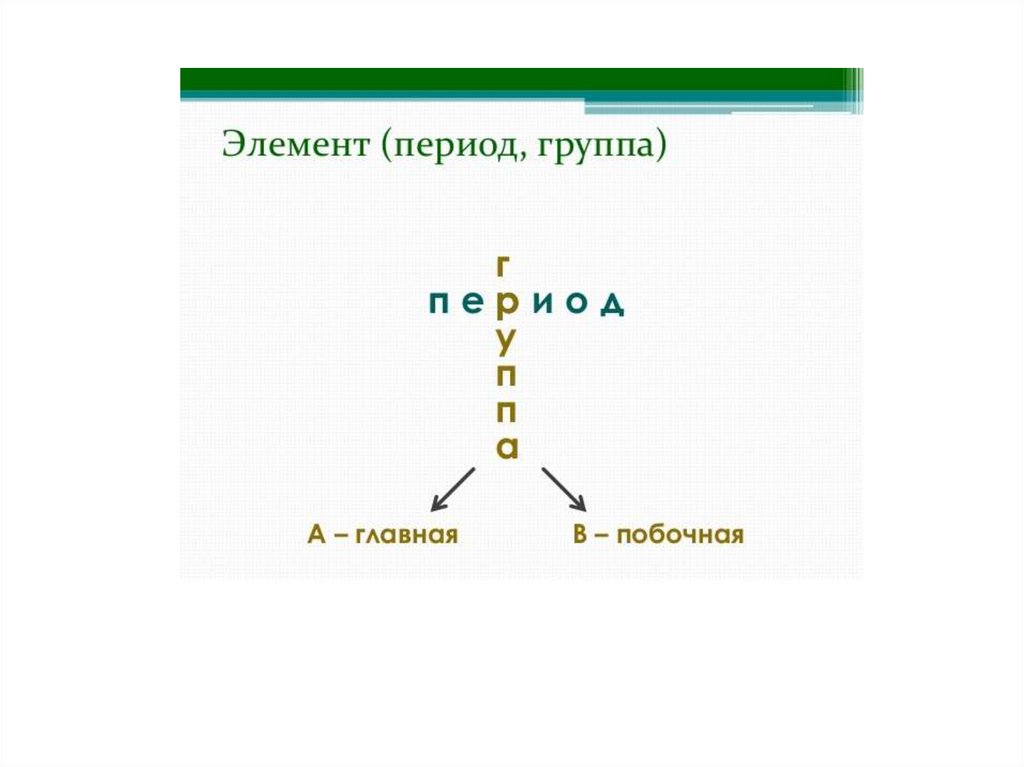
Подгруппы• Главные подгруппы - начинаются
со 2 периода, в них находятся s и p
-элементы.
• Побочные подгруппы - включают
d-элементы и начинаются с 4
периода.
12.
Электронные аналоги• Полные электронные аналоги элементы одной и той же
подгруппы
• Неполные электронные аналоги –
элементы одной группы главной и
побочной подгрупп.
13.
s-элементы:Элементы, имеющие в качестве валентных
электронов только s – электроны
например: Li (литий) – 2s1, Ca (кальций) – 4s2,
p – элементы:
элементы, имеющие в качестве валентных
электронов s и p электроны
например: N (азот) – 2s2 2p3; S (сера) – 3s2 3p4.
d-элементы:
элементы, имеющие в качестве валентных
электронов s и d электроны
например: Sc (скандий) – 4s2 3d1.
f-элементы:
элементы, имеющие в качестве валентных
электронов s и f электроны
например: La (лантан) – 6s2 4f1.
14.
S - элементы:элементы, имеющие в качестве
валентных электронов только s –
электроны
например:
1
Li (литий) – 2s
Ca (кальций) – 4s2
15.
d - элементы:элементы, имеющие в
качестве валентных
электронов s и d электроны
например:
2
1
Sc (скандий) – 4s 3d .
16.
f - элементыэлементы, имеющие в
качестве валентных
электронов s и f электроны
например:
La (лантан) – 6s2 4f1.
17.
От строения электронной оболочкиатомов зависят такие свойства, как
размер атомов, энергия ионизации,
электроотрицательность, сродство к
электрону.
18.
2. Периодичность изменениясвойств
• Атомный (ионный) радиус (R)
• Энергия ионизации (I)
• Сродство к электрону (F)
• Электроотрицательность
19.
Атомный (ионный) радиус (R)Квантово-механический характер движения
электрона в атоме не позволяет точно
определить радиус атомов (электрон может
быть обнаружен на любом расстоянии от ядра
с определенной вероятностью), поэтому
используют так называемые эффективные
радиусы атомов и ионов.
20.
Кроме того, используют такназываемые орбитальные радиусы
атомов, определяемые как
расстояние от ядра до последнего
максимума электронной плотности.
21.
Радиусы одноатомных катионов меньше,а анионов больше, чем радиус
соответствующего нейтрального атома.
R(F)= 0,64 A°, R(F-)=1,36 A°
R(Na)=1,54 A°, R(Na+)=0,95 A°
1A°=10–10 метра
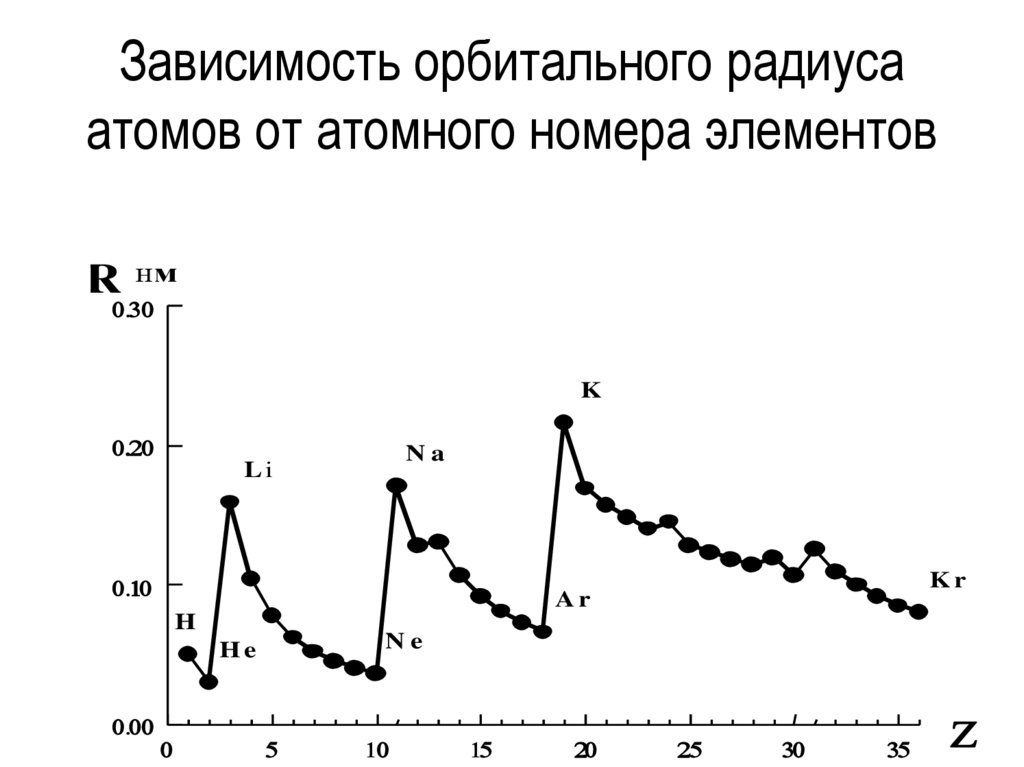
22.
а) по группе вниз эффективный радиус атома (R)увеличивается - т.к. увеличивается число
энергетических уровней, увеличиваются
металлические свойства.
б) по периоду эффективный радиус атома (R)
уменьшается, т.к. количество уровней одинаково,
а количество электронов увеличиваетсяпроисходит сжатие электронной оболочки,
металлические свойства ослабевают.
23.
Be2s2
O
N
B
C
2 4
2s22p1 2s22p2 2s22p3 2s 2p
Li - 2s1
Na- 3s1
K - 4s1
Rb - 5s1
Cs - 6s1
Fr - 7s1
Radii
Радиус decrease
уменьшается
i
nр
cа
rс
e
aт
sе
eт
24.
Зависимость орбитального радиусаатомов от атомного номера элементов
R
нм
K
Na
Li
H
Ne
He
Kr
Ar
25.
Энергия ионизации (I)это количество энергии,
необходимое для отрыва
электрона от атома
-
А+
+
I=А
+е
26.
Энергия ионизации - являетсяколичественной
характеристикой
восстановительной
способности атомов.
27.
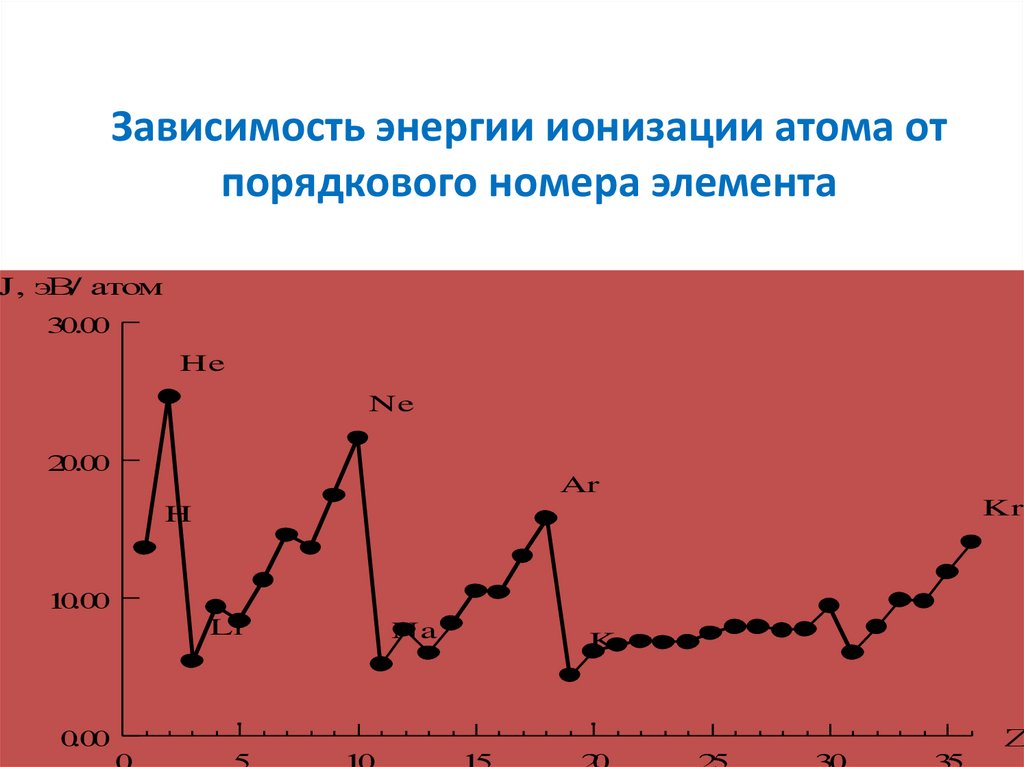
а) Энергия ионизации (I) погруппе вниз – уменьшается
в) Энергия ионизации (I) по
периоду – увеличивается
28.
Зависимость энергии ионизации атома отпорядкового номера элемента
J, эВ/ атом
He
Ne
Ar
Kr
H
Li
Na
K
29.
Сродство к электрону (F)это энергия, которая выделяется при
присоединении электрона к
нейтральному атому (кДж/моль или эВ)
или способность атома одного элемента
оттягивать на себя электроны от атомов
другого элемента
А + е = А– + F
30.
а) по группе вниз сродство кэлектрону уменьшается
б) по периоду сродство к
электрону увеличивается
31.
Сродство к электронухарактеризует
окислительную
способность атома
32.
Электроотрицательность (ЭО)Электроотрицательность
(ЭО) - это способность атома в
молекуле притягивать к себе
электроны.
33.
ЭО равна полусуммеэнергии ионизации и
сродства к электрону:
Э.О.=1/2 (F+I)
34.
Фтор (F) -самыйэлектроотрицательный элемент































 Химия
Химия








