Похожие презентации:
Кислоты. Классификация кислот
1. КИСЛОТЫ
2. Что такое кислоты?
• Сложные вещества, состоящие изатомов водорода, соединенных с
кислотным остатком
• Электролиты, диссоциирующие с
образованием катионов водорода и
анионов кислотного остатка
3. Классификация кислот
Признакиклассификации
Группы кислот
Примеры
Наличие кислорода
в кислотном остатке
А) кислородные;
Б) бескислородные
А) H3PO4, H2SO4;
,Б) HBr, H2S
Основность
А) одноосновные;
Б) многоосновные
А) HNO3, HCl;
Б) H2SO4, H3PO4
Растворимость в
воде
А) растворимые;
Б) нерастворимые
А) HNO3, HCl;
Б) H2SiO3
Летучесть
А) летучие;
Б) нелетучие
А) H2S, HNO3
Б) H2SO4, H3PO4
Степень
диссоциации
А) сильные;
Б) слабые
А) HNO3, HCl;
Б) H2SO3, H2CO3
Стабильность
А) стабильные;
Б) нестабильные
А) H2SO4, HCl
Б) H2SO3, H2CO3
4. Химические свойства кислот
• Диссоциация;• Взаимодействие с индикаторами;
• с металлами;
• с основными оксидами;
• с основаниями;
• с солями
5.
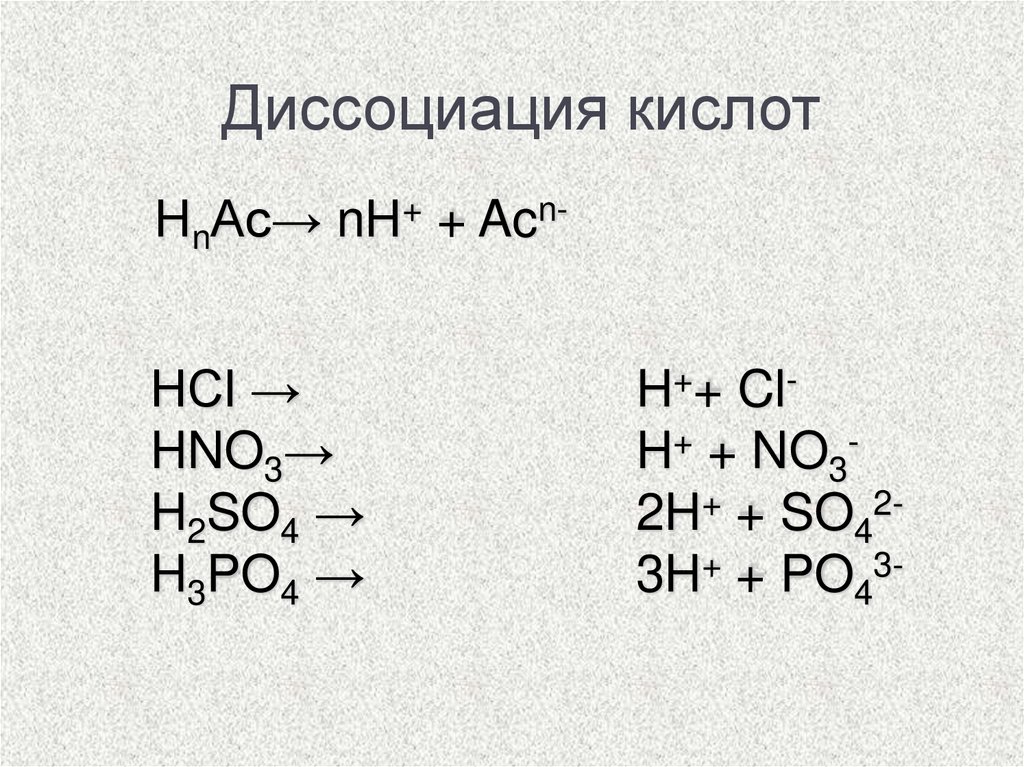
Диссоциация кислотНnАс→ nН+ + AcnHCl →
HNO3→
H2SO4 →
H3PO4 →
H++ ClH+ + NO32H+ + SO423H+ + PO43-
6. Взаимодействие с индикаторами
ИндикаторНейтральная Кислая среда
среда
Лакмус
Фиолетовый
Красный
Фенолфталеи Бесцветный
н
Бесцветный
Метиловый
оранжевый
Розовый
Оранжевый
Помни! Нерастворимые кислоты не меняют
окраску индикаторов.
7. Взаимодействие с металлами
Ме + НnAc → МеnAcm+ Н2металл + кислота→соль + водород
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2
Реакция возможна, если:
1. Металл находится в ряду активности до водорода;
2. В результате реакции получается растворимая соль;
3. Кислота растворима
8. Взаимодействие с основными оксидами
МеxOy + HnAc → МеnAcy + H2OОсновный оксид + кислота → соль + вода
MgO + 2 HCl → MgCl2 + H2O
MgO + 2H+ + 2Cl- → Mg2+ + 2Cl- + H2O
MgO + 2H+ → Mg2+ + H2O
Реакция возможна, если в результате
получается растворимая соль
9. Взаимодействие с основаниями
Ме(ОН)m + НnAc → MenAcm + H2OОснование + кислота → соль + вода
3 NaOH + H3PO4→ Na3PO4 + 3H2O
3Na+ + 3OH- + 3H+ + PO43- → 3Na+ + PO43- + 3H2O
H+ + OH- → H2O
Реакция между щелочью и кислотой с образованием
соли и воды называется реакцией нейтрализации.
10. Взаимодействие с солями
МеxAcy + HnAc → HхAc + МеnAcyСоль + кислота → новая кислота + новая соль
3 Li2CO3 + 2 H3PO4 →2 Li3PO4 + 3 H2O + 3 CO2
6Li+ + 3CO32- + 6H+ + PO43- → 6Li+ + 2PO43- + 3H2O + 3CO2
2H+ + CO32- → H2O + CO2
Реакция возможна, если в результате
образуется осадок, газ или слабый
электролит
Обратно ко всем свойствам
11. Пищевые кислоты
Лимонная кислота содержится в лимонах.
Яблочная- в яблоках.
Щавелевая - в листьях щавеля.
Муравьиная содержится в выделениях муравьев,
пчелином яде и в жгучих волосках крапивы.
• Уксусная кислота образуется при скисании
виноградного вина.
• Молочная – при скисании молока, квашении капусты
и силосовании кормов для скота.
• Аскорбиновая (витамин С) - в черной смородине,
малине, лимонах, апельсинах, томатах.
Недостаток его в пище вызывает заболевание ЦЫНГА.
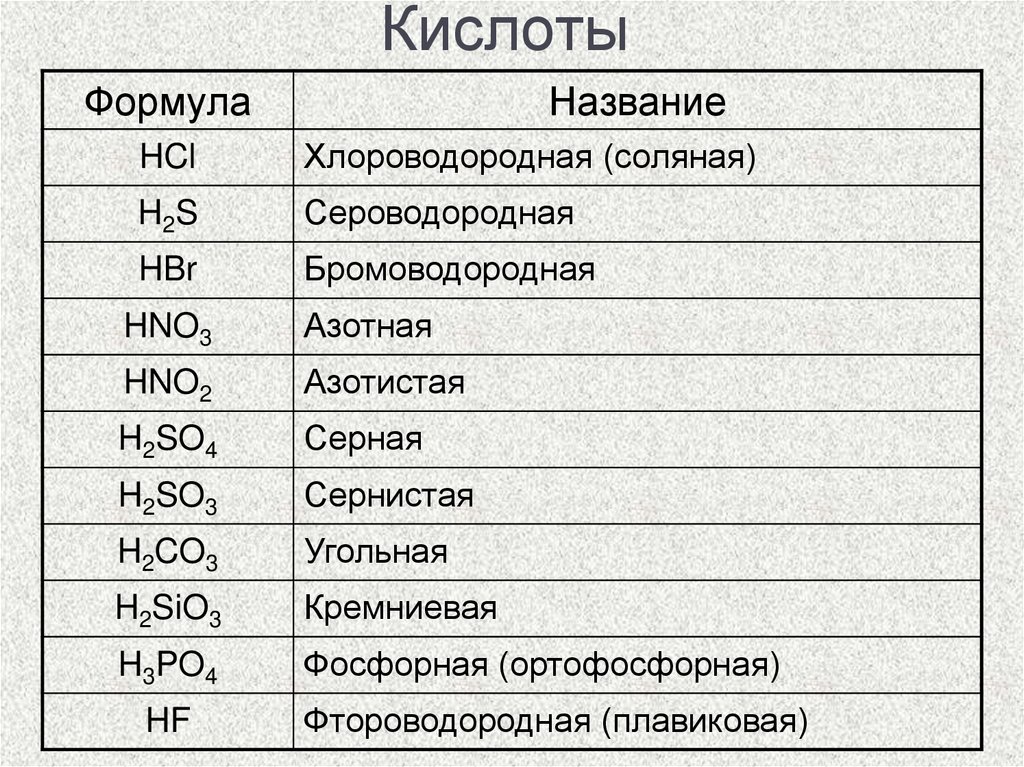
12. Кислоты
ФормулаНазвание
HCl
Хлороводородная (соляная)
H2S
Сероводородная
HBr
Бромоводородная
HNO3
Азотная
HNO2
Азотистая
H2SO4
Серная
H2SO3
Сернистая
H2CO3
Угольная
H2SiO3
Кремниевая
H3PO4
Фосфорная (ортофосфорная)
HF
Фтороводородная (плавиковая)
13. Представители кислот
• Серная кислота Н2SО4• бесцветная вязкая жидкость, без запаха ,тяжелее
воды, поглощает влагу из воздуха и других газов,
обугливает древесину, кожу, ткани, бумагу.
• Для приготовления растворов
Сначала вода, потом кислота,
• По объему производства серной кислоты можно
судить о развитии химической промышленности
страны.
• Серную кислоту называют «хлебом» химической
промышленности, ее используют практически во всех
отраслях народного хозяйства.
14. Соляная кислота НСl
• Бесцветная, дымящаяся на воздухежидкость, имеет специфический запах,
тяжелее воды.
Содержится в желудке и выполняет две
функции:
1) Уничтожает микробов, которые попадают в
желудок вместе с пищей.
2) Помогает перевариванию пищи, так как
входит в состав желудочного сока.












 Химия
Химия








