Похожие презентации:
Классификация неорганических соединений
1.
КЛАССИФИКАЦИЯНЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
2.
ПЕРВАЯ ПОПЫТКА КЛАССИФИКАЦИИНЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Антуан Лоран Лавуазье
1787 г.
• простые вещества;
• оксиды
(продукты горения простых веществ);
• кислоты и основания
(продукты взаимодействия оксидов с водой)
• соли
(продукты взаимодействия кислот и оснований)
3.
КЛАССИФИКАЦИЯПО ТИПУ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ
перенос разного рода частиц в химических превращениях
(протоны, электроны, электронные пары , части молекул)
• КИСЛОТЫ (HNO3, H2SO4, H3PO3, H3AsO4 и др.)
• ОСНОВАНИЯ (NaOH, NH3, Ca(OH)2, Fe(OH)3 и др.)
• СОЛИ (NaNO3, (NH4)2SO4, KHSO4, Na2HPO3 и др.)
• ОКИСЛИТЕЛИ (Cl2, KMnO4, H2O2, HNO3 и др.)
• ВОССТАНОВИТЕЛИ (Na, H2, CO, H2O2, K2S2O4 и др.)
• КОМПЛЕКСООБРАЗОВАТЕЛИ (Ni2+, Cu2+, Fe3+, Ti4+, Pt4+ и др.)
• ЛИГАНДЫ (NH3, OH , CO, CN и др.)
• КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ ([Cu(NH3)6]Cl2, K2[PtCl6] и др.)
• РАДИКАЛЫ (NO, NO2, O2 и др.)
• АССОЦИАТЫ (N2O4, Cl2O6 и др.)
4.
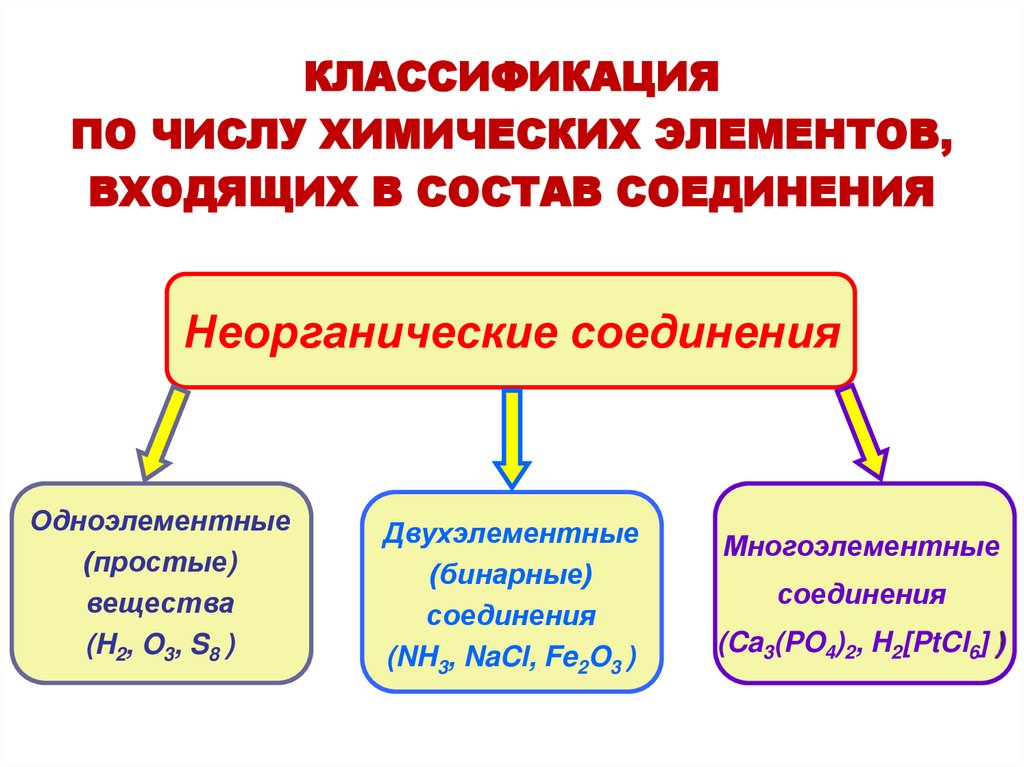
КЛАССИФИКАЦИЯПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ,
ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ
Неорганические соединения
Одноэлементные
(простые)
вещества
(H2, O3, S8 )
Двухэлементные
(бинарные)
соединения
(NH3, NaCl, Fe2O3 )
Многоэлементные
соединения
(Ca3(PO4)2, H2[PtCl6] )
5.
КЛАССИФИКАЦИЯ ПРОСТЫХ ВЕЩЕСТВ• классификация на s-, p-, d- и f-элементы
• классификация на металлы и неметаллы
Одноэлементные
(простые)
вещества
Неметаллы
Благородные
(He, Ne)
Активные
(F2, O2 )
Металлы
Среднеактивные
(N2, Si)
Активные
(Na, Ca)
Благородные
(Au, Rh)
Среднеактивные
(Fe, Ni)
6.
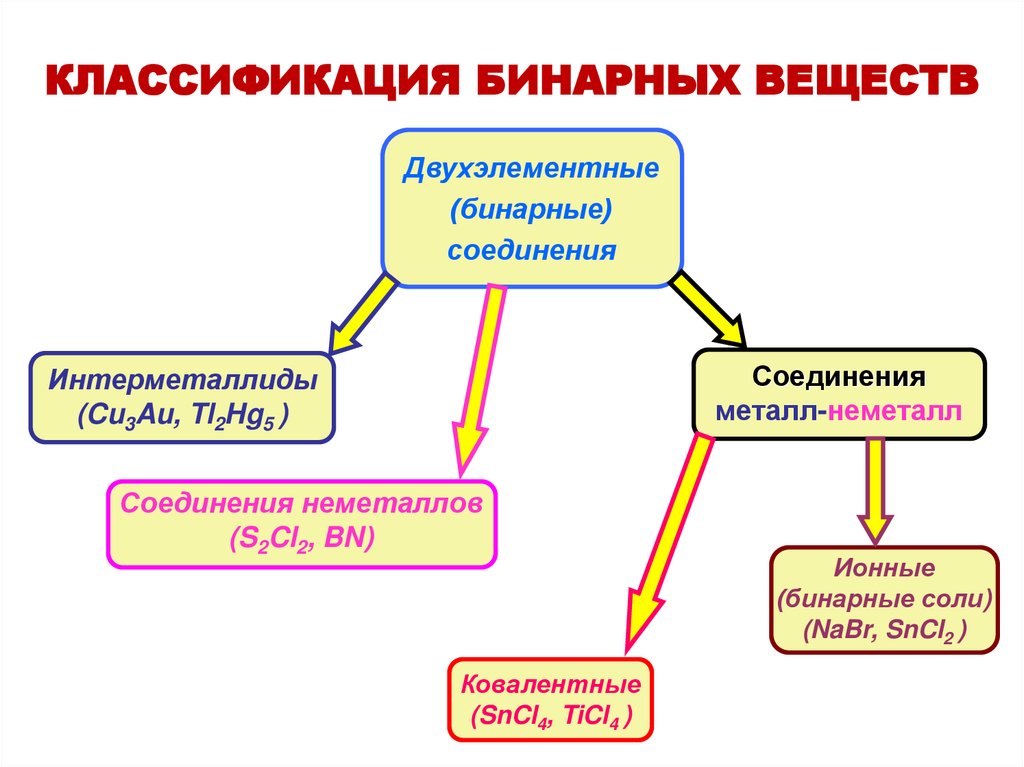
КЛАССИФИКАЦИЯ БИНАРНЫХ ВЕЩЕСТВДвухэлементные
(бинарные)
соединения
Соединения
металл-неметалл
Интерметаллиды
(Cu3Au, Tl2Hg5 )
Соединения неметаллов
(S2Cl2, BN)
Ковалентные
(SnCl4, TiCl4 )
Ионные
(бинарные соли)
(NaBr, SnCl2 )
7.
КЛАССИФИКАЦИЯ ОКСИДОВОКСИДЫ
Несолеобразующие
(безразличные)
(NO, CO, N2O)
Солеобразующие
Кислотные
(N2O5, SO2, CO2 )
Амфотерные
(Al2O3, ZnO)
Основные
(CaO, Na2O, CuO)
8.
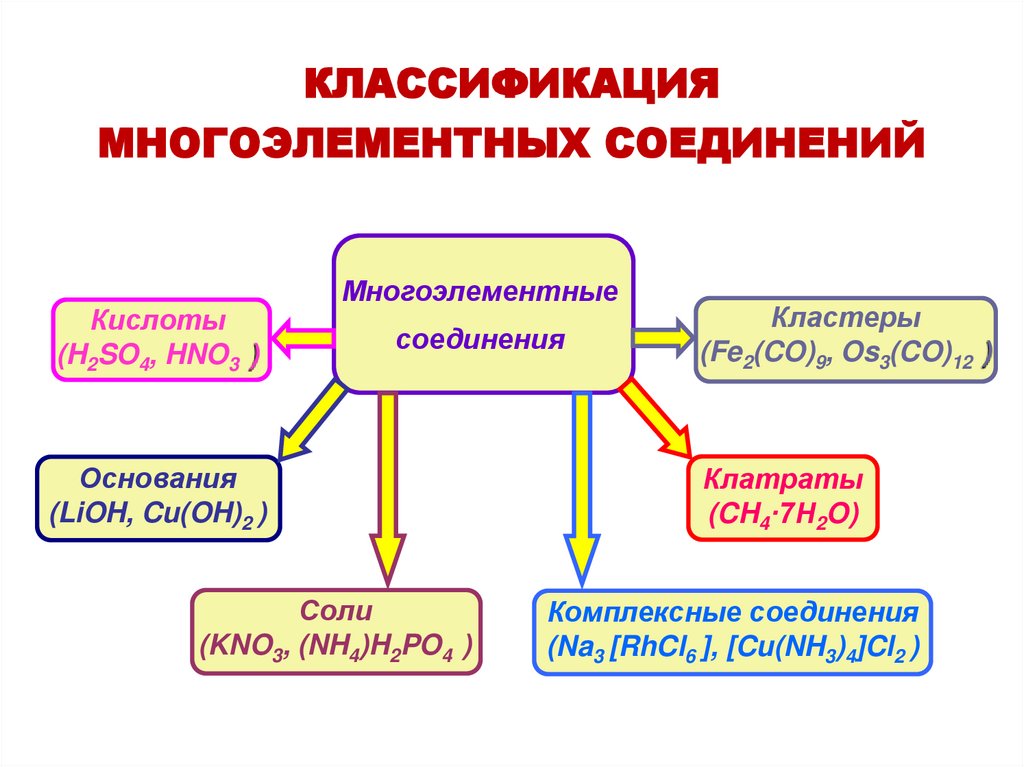
КЛАССИФИКАЦИЯМНОГОЭЛЕМЕНТНЫХ СОЕДИНЕНИЙ
Кислоты
(H2SO4, HNO3 )
Многоэлементные
соединения
Основания
(LiOH, Cu(OH)2 )
Соли
(KNO3, (NH4)H2PO4 )
Кластеры
(Fe2(CO)9, Os3(CO)12 )
Клатраты
(CH4·7H2O)
Комплексные соединения
(Na3 [RhCl6 ], [Cu(NH3)4]Cl2 )
9.
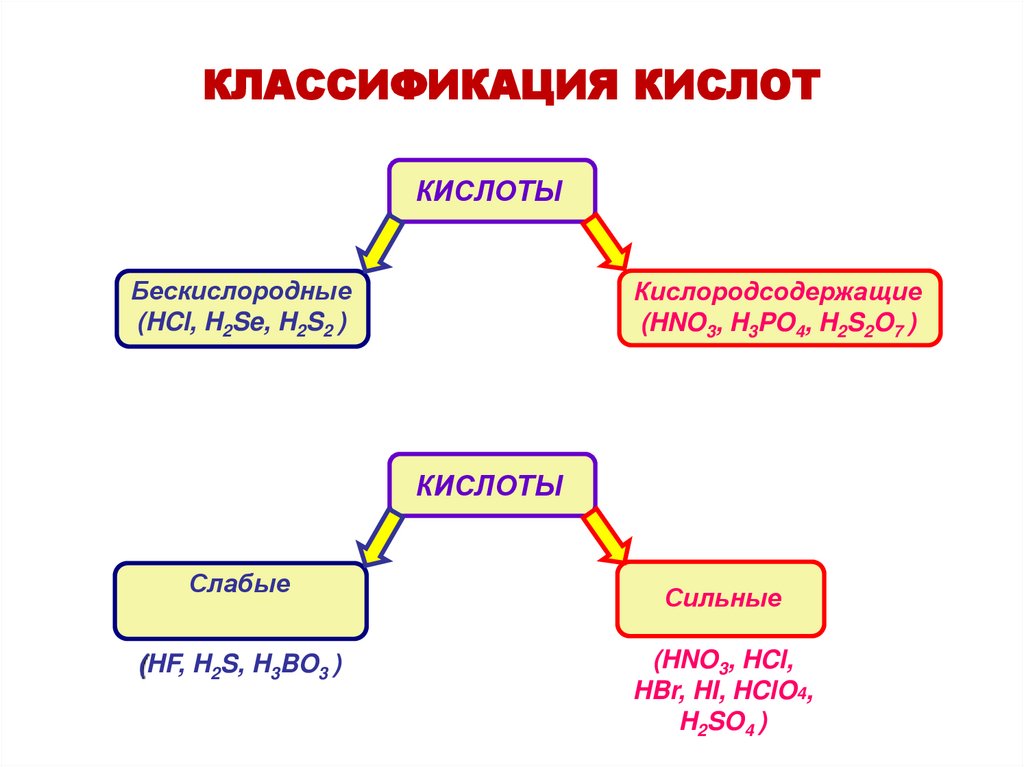
КЛАССИФИКАЦИЯ КИСЛОТКИСЛОТЫ
Бескислородные
(HCl, H2Se, H2S2 )
Кислородсодержащие
(HNO3, H3PO4, H2S2O7 )
КИСЛОТЫ
Слабые
(HF, H2S, H3BO3 )
Сильные
(HNO3, HCl,
HBr, HI, HClO4,
H2SO4 )
10.
КЛАССИФИКАЦИЯ КИСЛОТКИСЛОТЫ
Одноосновные
(HCl, HNO2, H3PO2 )
Двухосновные
(H2SO4, H2S, H3PO3 )
Многоосновные
(H4P2O7, H6TeO6 )
Трехосновные
(H3PO4, H3AsO4 )
11.
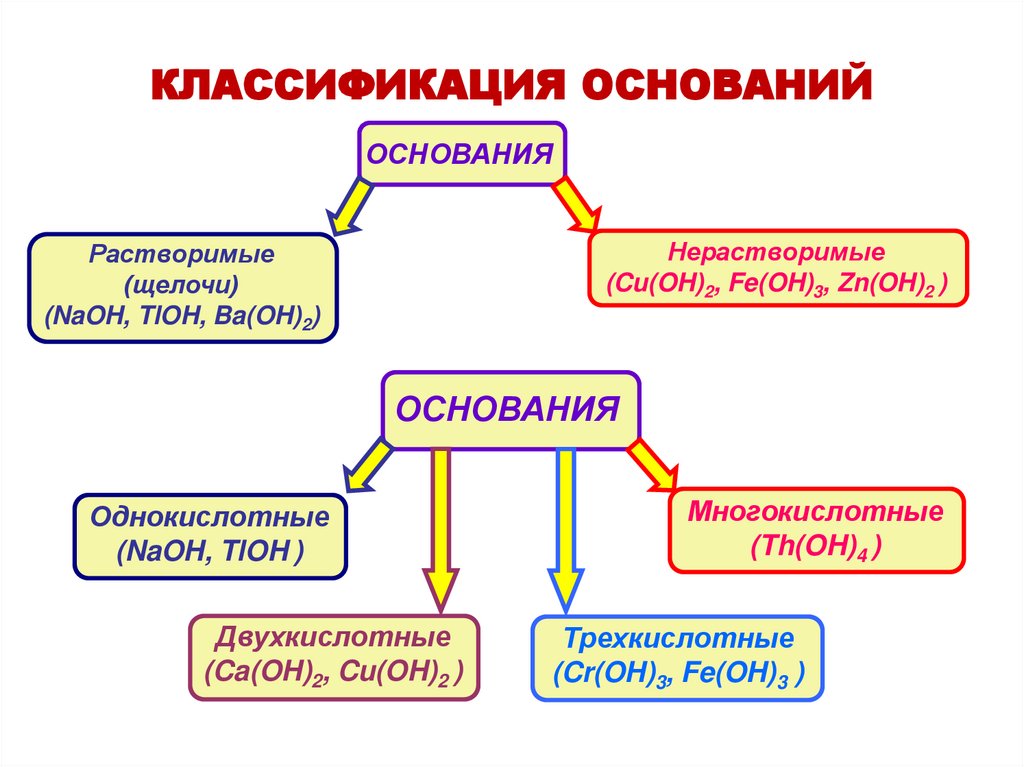
КЛАССИФИКАЦИЯ ОСНОВАНИЙОСНОВАНИЯ
Нерастворимые
(Cu(OH)2, Fe(OH)3, Zn(OH)2 )
Растворимые
(щелочи)
(NaOH, TlOH, Ba(OH)2)
ОСНОВАНИЯ
Однокислотные
(NaOH, TlOH )
Двухкислотные
(Ca(OH)2, Cu(OH)2 )
Многокислотные
(Th(OH)4 )
Трехкислотные
(Cr(OH)3, Fe(OH)3 )
12.
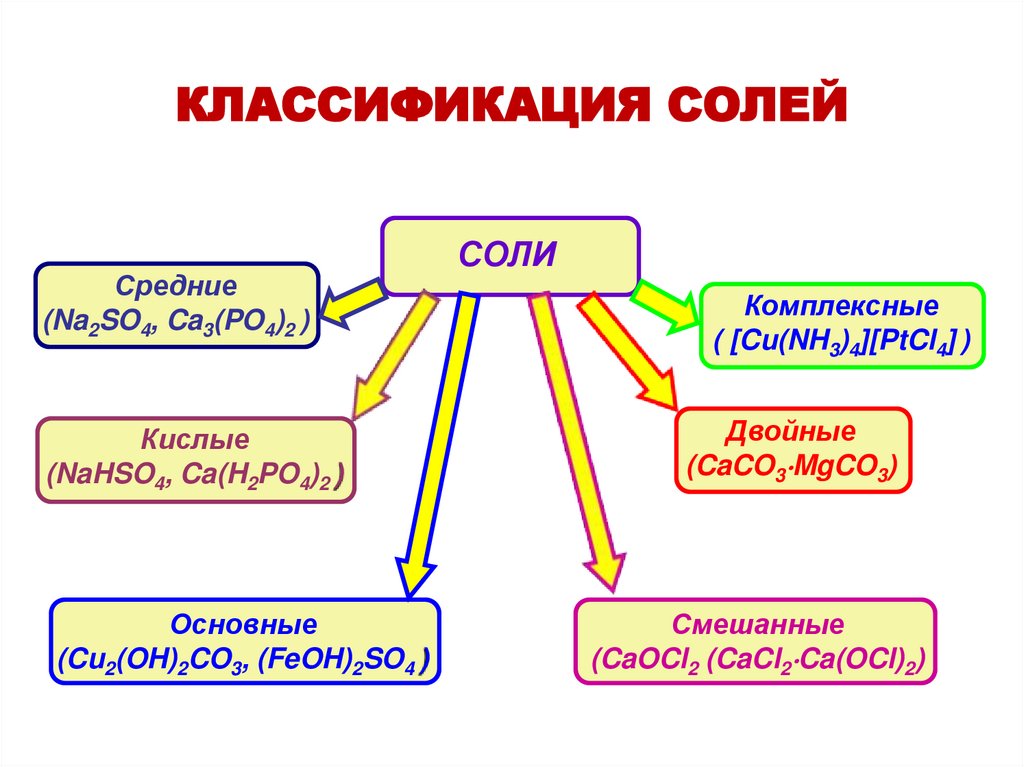
КЛАССИФИКАЦИЯ СОЛЕЙСредние
(Na2SO4, Ca3(PO4)2 )
Кислые
(NaHSO4, Ca(H2PO4)2 )
Основные
(Cu2(OH)2CO3, (FeOH)2SO4 )
СОЛИ
Комплексные
( [Cu(NH3)4][PtCl4] )
Двойные
(CaCO3 MgCO3)
Смешанные
(CaOCl2 (CaCl2 Ca(OCl)2)
13.
НОМЕНКЛАТУРАНЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
14.
ПРАВИЛА ДЛЯ СОСТАВЛЕНИЯ НАЗВАНИЙНЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
• СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА
(правила комиссии ИЮПАК)
• ТРАДИЦИОННАЯ НОМЕНКЛАТУРА
• «РУССКАЯ» НОМЕНКЛАТУРА
• НЕНОМЕНКЛАТУРНЫЕ НАЗВАНИЯ
(тривиальные, минералогические и др.)
15.
НАЗВАНИЯ И ОБОЗНАЧЕНИЯЭЛЕМЕНТОВ И ИЗОТОПОВ
• Элементы: символы и названия элементов приведены в ПС.
• Изотопы: обозначение изотопа:
массовое число
порядковый номер
32S или 32S
Э, например 16
все названия изотопов элемента (кроме водорода) имеют одно
название с указанием массового числа:
32S – изотоп серы-32
для водорода:
1Н – изотоп водорода-1, Н – протий;
2Н – изотоп водорода-2, D – дейтерий;
3Н – изотоп водорода-3, Т – тритий
16.
ЗАПИСЬ СИМВОЛОВ ИОНОВзаряд иона – надстрочный индекс справа
знак (+ или ) после цифры:
SO42 (а не SO4 2)
Fe3+ (а не Fe+3)
знак (+ или ) до цифры – обозначение степени
окисления:
Fe+2 или S 2
17.
НАЗВАНИЯ КАТИОНОВ (правила ИЮПАК)• одноэлементные одноатомные катионы:
Cu+ – катион меди(I)
Cu2+ – катион меди(II)
Ba2+ – катион бария (вместо катион бария(II))
• одноэлементные многоатомные катионы:
указывают число атомов с помощью числовых приставок
1 – моно
5 – пента
9 – нона
2 – ди
6 – гекса
10 – дека
3 – три
7 – гепта
11 – ундека
4 – тетра
8 – окта
12 – додека
вместо ст. окисления – общий заряд катиона арабскими цифрами:
Hg22+ – катион диртути(2+)
I2+ – катион дииода(1+)
S82+ – катион октасеры(2+)
Se62+ – катион гексаселена(2+)
О2+ – катион дикислорода(1+) или катион диоксигенила
18.
• многоэлементные катионы:UO2+ – катион диоксоурана(V)
(HgNO3)+ – катион нитратортути(II)
[Ti(H2O)6]3+ – катион гексаакватитана(III)
(H3SO4)+ – катион сульфатотриводорода(I)
специальные названия катионов:
• в состав катиона (м.б. условного) входит кислород: -ил
NO+ – катион нитрозила
VO2+ – катион ванадила
SO2+ – катион тионила
РO3+ – катион фосфорила
NO2+ – катион нитроила
UO22+ – катион уранила
SO22+ – катион сульфурила
CrO22+ – катион хромила
• катион образован присоединением Н+ к водородному соединению: -оний (-иний)
NН4+ – катион аммония
РН4+ – катион фосфония
AsH4+ – катион арсония
N2H5+ – катион гидразиния(1+)
NH3OH+ – катион гидроксиламиния
Н3O+ – катион оксония
N2H62+ – катион гидразиния(2+)
• "ониевые" катионы, образованные замещением атомов Н:
NF4+ – катион тетрафтораммония
As(C6Н5)4+ – катион тетрафениларсония
19.
НАЗВАНИЯ АНИОНОВ (правила ИЮПАК)• одноэлементные одноатомные анионы: -ид + -ион
Cl – хлорид-ион
H – гидрид-ион
S2 – сульфид-ион
N3 – нитрид-ион
• одноэлементные многоатомные анионы:
указывают число атомов с помощью числовых приставок
вместо ст.окисления – общий заряд аниона арабскими цифрами:
I3 – трииодид(1 )-ион
S22 – дисульфид(2 )-ион
Sn2 – полисульфид-ион
• распространенным анионам присвоены специальные названия:
C22 – ацетиленид-ион (вместо дикарбид(2 )-ион)
O3 – озонид-ион (вместо триоксид(1 )-ион)
N3 – азид-ион (вместо тринитрид(1 )-ион)
O22 – пероксид-ион (вместо диоксид(2 )-ион)
O2 – надпероксид-ион (вместо диоксид(1 )-ион)
20.
• многоэлементные анионы:SO42 – тетраоксосульфат(VI)-ион
NO3 – тринитрат(V)-ион
РO43 – тетраоксофосфат(V)-ион
RuO4 –тетраоксорутенат(VII)-ион
специальные названия катионов:
СN – цианид-ион
СN2 – цианамид-ион
NH2 – амид-ион
NH2 – имид-ион
NO – нитрозид-ион
ОН – гидроксид-ион
HS – гидросульфид-ион
НO2 – гидропероксид-ион
OCN – цианат-ион
CNO – фульминат-ион
NCS – тиоцианат-ион (роданид-ион)
21.
НАЗВАНИЯ ПРОСТЫХ ВЕЩЕСТВназвания, как правило, происходят от названий соответствующих элементов
Формула
Названия
ИЮПАК
Традиционная
H
моноводород
атомарный водород
Н2
диводород
молекулярный водород
О2
дикислород
молекулярный кислород
О3
трикислород
озон
S8
октасера
кристаллическая сера
Sn
полисера
аморфная сера
Р4
тетрафосфор
для твердых аллотропных модификаций:
белый фосфор
• -, -, - (начиная с -низкотемпературной), например:
-Sn – -олово (серое олово); -Sn – -олово (белое олово); -Sn – -олово
• специальные (устоявшиеся) названия, например:
графит,
алмаз,
фуллерен,
карбин
22.
МНОГОЭЛЕМЕНТНЫЕ СОЕДИНЕНИЯназвания дают при чтении формулы справа налево
ИНТЕРМЕТАЛЛИДЫ
запись формулы: первым (слева в формуле) записывают символ
металла, который стоит левее в длиннопериодном варианте ПС
название дают справа налево в одно слово:
Mg2Sn – оловодимагний
NaZn4 – тетрацинкнатрий
Ag5Al3 – триалюминийпентасеребро
Rb7Hg8 – октартутьгептарубидий
NiCu3Al6 – гексаалюминийтримедьникель
23.
СОЕДИНЕНИЯ ДВУХ НЕМЕТАЛЛОВ ИЛИ МЕТАЛЛ-НЕМЕТАЛЛназвание (по правилам ИЮПАК) дают справа налево в два слова:
первое слово – лат. корень названия более ЭО элемента (анион) + ид
второе слово – русское название элемента в родительном падеже,
если менее ЭО элемент (катион) имеет несколько степеней окисления,
указывают его степень окисления
или с помощью числовых приставок указывают число атомов аниона
ГАЛОГЕНИДЫ
Формула
Названия
ИЮПАК
Традиционная
«Русская»
NaF
фторид натрия
фтористый натрий
FeCl2
дихлорид железа или хлорид железа(II)
хлористое железо
FeCl3
трихлорид железа или хлорид
железа(III)
треххлористое железо
или
хлорное железо
CuCl2
дихлорид меди или хлорид меди(II)
двуххлористая медь или
хлорная медь
SiCl4
тетрахлорид кремния или хлорид
кремния(IV)
четыреххлористый
кремний
SF6
гексафторид серы или фторид серы(VI)
шестифтористая сера
24.
СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ КАТИОНАМИ ИЛИ АНИОНАМИФормула
Названия
ИЮПАК
Традиционная
«Русская»
KNaCl2
хлорид натрия-калия
хлористый натрий-калий
SnBrCl3
трихлорид-бромид олова
треххлористое-бромистое
олово
SCl2O
(обычно
SOCl2)
оксид-дихлорид серы
или хлорид тионила
хлористый тионил
SCl2 O2
(обычно
SO2Cl2)
диоксид-дихлорид серы
или хлорид сульфурила
хлористый сульфурил
25.
ПСЕВДОГАЛОГЕНИДЫпсевдогалогены – группы атомов, обладающих галогенидподобными свойствами
Формула
Названия
ИЮПАК
Традиционная
«Русская»
Fe(CN)2 цианид железа(II) или дицианид железа
цианистое железо
закисное
HOCN
цианат-О водорода
циановая кислота
HNCO
цианат-N водорода изоцианат водорода
изоциановая кислота
HCNO
цианат-C водорода фульминат водорода
гремучая кислота
цианат водорода
HSCN
тиоцианат-S
водорода
тиоцианат водорода
тиоциановая кислота
HNCS
тиоцианат-N
водорода
изотиоцианат
водорода
изотиоциановая
кислота
26.
ОКСИДЫ (O2 ), ПЕРОКСИДЫ (O22 ), НАДПЕРОКСИДЫ (O2 ), ОЗОНИДЫ (O3 ):название (по правилам ИЮПАК):
оксид + название элемента + (ст.окисления) или
или с помощью числовых приставок указывают число атомов кислорода
пероксид (надпероксид, озонид) + название элемента
Формул
а
Названия
ИЮПАК
Традиционная
«Русская»
Na2О
оксид натрия
окись натрия
Р2O5
оксид фосфора(V) или пентаоксид
дифосфора
пятиокись фосфора или
фосфорный ангидрид
FeO
оксид железа(II)
закись железа
Fe2O3
оксид железа(III) или триоксид дижелеза
окись железа
Fe3O4
оксид железа(II, III) или оксид
дижелеза(III)-железа(II)
закись-окись железа
Н2О2
пероксид водорода
перекись водорода
BaO2
пероксид бария
перекись бария
NaO2
надпероксид натрия
надперекись натрия
CsO3
озонид цезия
(FeII
Fe2III)O4)
27.
ВОДОРОДНЫЕ СОЕДИНЕНИЯ:твердые соединения металл-водород: гидрид
LiH – гидрид лития
CaH2 – гидрид кальция
(BeH2)n – поли(дигидрид бериллия)
Li4RhH5 – пентагидрид родия-тетралития
газообразные соединения Н (с одним атомом другого элемента), водные
растворы которых проявляют кислотные свойства: о + водород
HCl – хлороводород (по «Русской» номенклатуре – хлористый водород)
H2S – сероводород (по «Русской» номенклатуре – сернистый водород)
HCN – циановодород (по «Русской» номенклатуре – цианистый водород)
HN3 – азидоводород (по «Русской» номенклатуре – азотистый водород)
летучие соединения Н с одним атомом элементов 15 (V А) группы (кроме N):
лат. корень + ин: РH3 – фосфин AsH3 – арсин SbH3 – стибин BiH3 – висмутин
остальные летучие соединения Н (кроме N): лат. корень + ан
SiH4 – силан
P2H4 – дифосфан
Si2H6 – дисилан
B2H6 – диборан
PbH4 – плюмбан
H2S3 – трисульфан
собственные названия некоторых соединений водорода:
H2O – вода NH3 – аммиак N2H4 – гидразин
28.
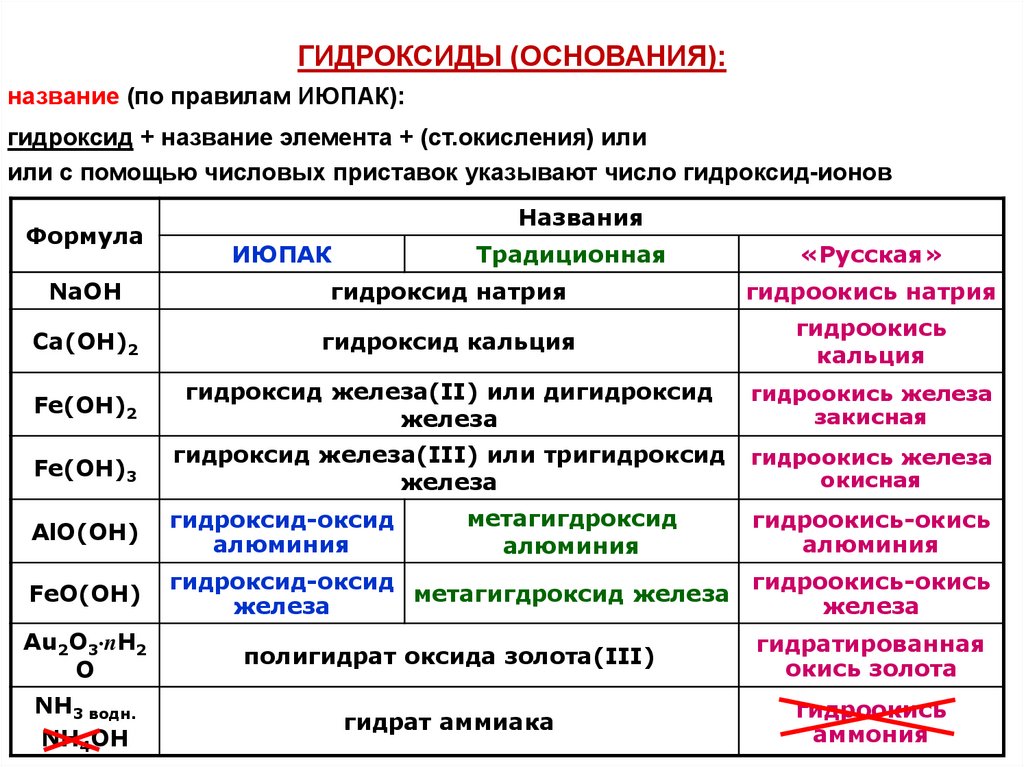
ГИДРОКСИДЫ (ОСНОВАНИЯ):название (по правилам ИЮПАК):
гидроксид + название элемента + (ст.окисления) или
или с помощью числовых приставок указывают число гидроксид-ионов
Формула
Названия
ИЮПАК
Традиционная
«Русская»
NaOH
гидроксид натрия
гидроокись натрия
Ca(OH)2
гидроксид кальция
гидроокись
кальция
Fe(OH)2
гидроксид железа(II) или дигидроксид
железа
гидроокись железа
закисная
Fe(OH)3
гидроксид железа(III) или тригидроксид
железа
гидроокись железа
окисная
AlO(OH)
гидроксид-оксид
алюминия
FeO(OH)
гидроксид-оксид
гидроокись-окись
метагигдроксид железа
железа
железа
метагигдроксид
алюминия
гидроокись-окись
алюминия
Au2O3 nH2
O
полигидрат оксида золота(III)
гидратированная
окись золота
NH3 водн.
NH4OH
гидрат аммиака
гидроокись
аммония
29.
КИСЛОТЫ:БЕСКИСЛОРОДНЫЕ КИСЛОТЫ
(водные растворы газообразных водородных соединений):
название (по правилам ИЮПАК): в два слова
первое слово – название соответствующего водородного соединения + ная
второе слово – кислота
Формул
а
Названия
ИЮПАК
Традиционная
«Русская»
HF
фтороводородная
кислота
плавиковая кислота
фтористоводородная
кислота
HCl
хлороводородная
кислота
соляная кислота
хлористоводородная
кислота
HBr
бромоводородная кислота
бромистоводородная
кислота
HI
иодоводородная кислота
иодистоводородная
кислота
H2S
сероводородная кислота
сернистоводородная
кислота
H2Sе
селеноводородная кислота
селенистоводородна
я кислота
30.
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ:название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова
первое слово – название элемента + суффикс (в зависимости от ст.окисл.) + ая
второе слово – кислота
высшая или любая единственная степень окисления: суффиксы -н-, -ов- или -евФормула
Названия
ИЮПАК
Традиционная
«Русская»
HNO3
триоксонитрат(V) водорода
азотная кислота
H2СO3
триоксокарбонат(IV) водорода
(триоксокарбонат диводорода)
угольная кислота
H2SO4
тетраоксосульфат(VI) водорода
серная кислота
H2SеO4
тетраоксоселенат(VI) водорода
селеновая кислота
HReO4
тетраоксоренат(VII) водорода
рениевая кислота
приставки мета- или орто- указывают на различное «содержание» воды:
«P2O5 1 H2O = H2P2O6» HPO3
- метафосфорная кислота;
«P2O5 3 H2O = H6P2O8» H3PO4 - ортофосфорная кислота
31.
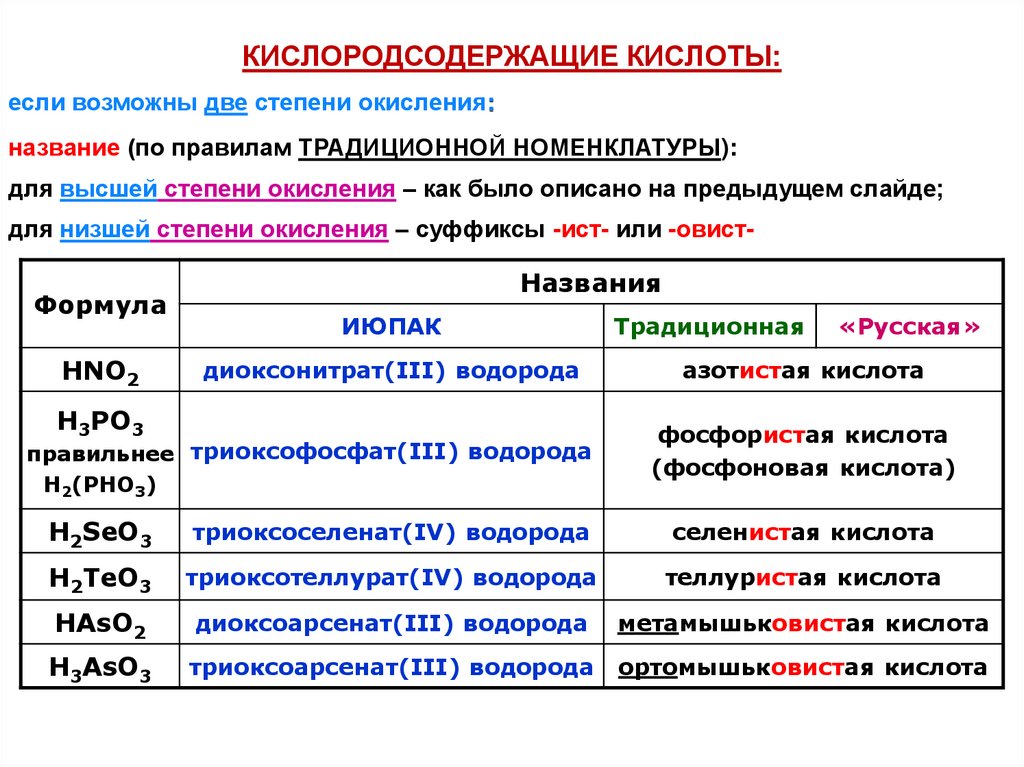
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ:если возможны две степени окисления:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
для высшей степени окисления – как было описано на предыдущем слайде;
для низшей степени окисления – суффиксы -ист- или -овист-
Формула
HNO2
Названия
ИЮПАК
диоксонитрат(III) водорода
H3РO3
правильнее триоксофосфат(III) водорода
H2(PHO3)
Традиционная
«Русская»
азотистая кислота
фосфористая кислота
(фосфоновая кислота)
H2SeO3
триоксоселенат(IV) водорода
селенистая кислота
H2TeO3
триоксотеллурат(IV) водорода
теллуристая кислота
HAsO2
диоксоарсенат(III) водорода
метамышьковистая кислота
H3AsO3
триоксоарсенат(III) водорода
ортомышьковистая кислота
32.
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ:если возможны три степени окисления:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
для высшей и средней степени окисления – как было описано ранее;
для самой низшей степени окисления (обычно +1) – суффикс -новатист-
Формула
H3РO2
правильнее
H(PH2O2)
H2N2O2
Названия
ИЮПАК
Традиционная
«Русская»
диоксофосфат(I) водорода
фосфорноватистая кислота
(фосфиновая кислота)
диоксодинитрат(I)
водорода
азотноватистая кислота
33.
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ:если возможны четыре степени окисления:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
суффиксы
-н-,
-новат-,
-ист-,
-новатист-
уменьшение степени окисления «центрального атома»
Формула
Названия
ИЮПАК
Традиционная
«Русская»
HClO4
тетраоксохлорат(VII) водорода
хлорная кислота
HClO3
триоксохлорат(V) водорода
хлорноватая кислота
HClO2
диоксохлорат(III) водорода
хлористая кислота
HClO
оксохлорат(I) водорода
хлорноватистая кислота
34.
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ:если разное количество атомов кислотообразующего элемента в одной ст.окисл.:
в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
используют числовые приставки
Формула
Названия
ИЮПАК
Традиционная «Русская»
H2S2O 5
пентаоксодисульфат(IV)
водорода
дисернистая кислота
H2S2O 7
гептаоксодисульфат(VI)
водорода
дисерная кислота
H2Cr2O7
гептаоксодихромат(VI) водорода
дихромовая кислота
H2Cr3O10 декаоксотрихромат(VI) водорода
трихромовая кислота
H4Р2O7
гептаоксодифосфат(V) водорода
дифосфорная кислота
H2В4O7
гептаоксотетраборат(III)
водорода
тетраборная кислота
35.
ЗАМЕЩЕННЫЕ КИСЛОТЫесли в молекуле оксокислоты атомы О замещены (частично или полностью):
в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
• на атомы серы: добавляют приставку тио и используют числовые приставки
• на пероксогруппу (-О-О-): добавляют приставку пероксо и используют числовые приставки
Формула
ИЮПАК
Традиционная
«Русская»
H2S2O3
правильнее
H2SO3(S)
тиотриоксосульфат(IV) водорода
тиосерная кислота
H2СS3
тритиокарбонат(IV) водорода
тритиоугольная кислота
HNO4
правильнее
HNO2(O2)
монопероксодиоксонитрат(V)
водорода
пероксоазотная кислота
H2S2O5
правильнее
H2SO3(O2)
монопероксотриоксосульфат(VI)
водорода
пероксосерная кислота
H2S2O8
правильнее
H2S2O6(O2)
монопероксогексаоксосульфат(VI)
водорода
пероксодисерная кислота
36.
ДРУГИЕ ЗАМЕЩЕННЫЕ КИСЛОТЫзамещается часть групп ОН или атомы О:
Формула
ИЮПАК
Традиционная
«Русская»
HSеO3F
фторотриоксоселенат(VI) водорода
фтороселеновая кислота
HSеOF5
пентафторотриоксоселенат(VI)
водорода
пентафтороселеновая кислота
H2РO3(NH2)
аминотриоксофосфат(V) водорода
аминофосфорная кислота
HРO2(NH2)2
диаминодиоксофосфат(V) водорода
диаминофосфорная кислота
специальные названия для замещенных серных кислот: сульфоновые кислоты (HSO3-)
Формула
ИЮПАК
Традиционная
«Русская»
HSO3F
фторотриоксосульфат(VI) водорода
фторосульфоновая кислота
HSO3Cl
хлоротриоксосульфат(VI) водорода
хлоросульфоновая кислота
HSO3(NH2)
аминотриоксосульфат(VI) водорода
аминосульфоновая кислота
H2S2O6(NH) иминогексаоксодисульфат(VI) водорода иминодисульфоновая кислота
37.
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙвысшая или любая (кроме +7) единственная степень окисления
кислотообразующего элемента:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова
первое слово – кислотный остаток: название элемента + ат
второе слово – название катиона
Формула
Названия
ИЮПАК
Традиционная
«Русская»
AgNO3
триоксонитрат(V) серебра(I)
нитрат серебра
серебро
азотнокислое
CaСO3
триоксокарбонат(IV) кальция
карбонат кальция
кальций
углекислый
(NH4)2SO4
тетраоксосульфат(VI) аммония
сульфат аммония
аммоний
сернокислый
Fe(SеO4)2
тетраоксоселенат(VI) железа(II)
селенат железа(II)
железо закисное
селенокислое
Fe(SеO4)3
тетраоксоселенат(VI) железа(III)
селенат железа(III)
железо окисное
селенокислое
38.
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙстепень окисления кислотообразующего элемента +7:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова
первое слово – кислотный остаток: приставка пер + название элемента + ат
второе слово – название катиона
Формула
Названия
ИЮПАК
Традиционная
«Русская»
NH4ReO4
тетраоксоренат(VII)
аммония
перренат аммония
аммоний
рениевокислый
Ca(MnO4)2
тетраоксоманганат(VII)
кальция
перманганат кальция
кальций
марганцевокислый
SrIO4
тетраоксоиодат(VII)
стронция
метапериодат
стронция
стронций
метаиоднокислый
Ag5IO6
гексаоксоиодат(VII)
серебра(I)
ортопериодат серебра
серебро
ортоиоднокислое
Fe(ClO4)3
тетраоксохлорат(VII)
железа(III)
перхлорат железа(III)
железо окисное
хлорнокислое
39.
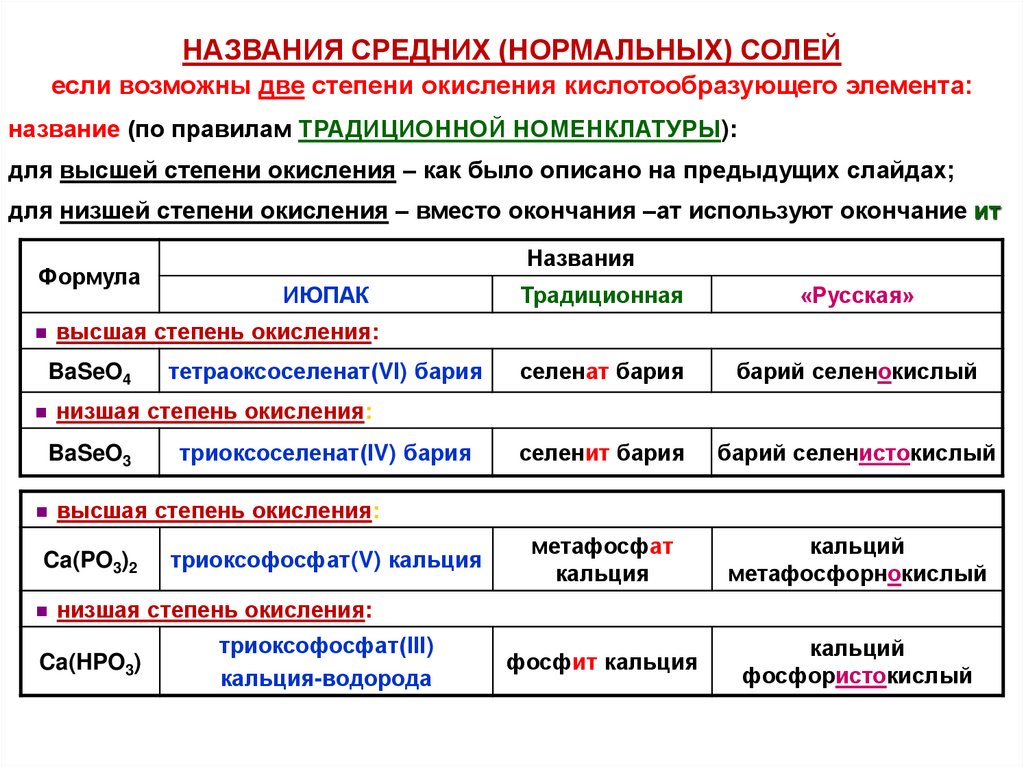
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙесли возможны две степени окисления кислотообразующего элемента:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
для высшей степени окисления – как было описано на предыдущих слайдах;
для низшей степени окисления – вместо окончания –ат используют окончание ит
Формула
Названия
ИЮПАК
Традиционная
«Русская»
селенат бария
барий селенокислый
селенит бария
барий селенистокислый
метафосфат
кальция
кальций
метафосфорнокислый
фосфит кальция
кальций
фосфористокислый
высшая степень окисления:
BaSeO4
тетраоксоселенат(VI) бария
низшая степень окисления:
BaSeO3
триоксоселенат(IV) бария
высшая степень окисления:
Ca(PO3)2
триоксофосфат(V) кальция
низшая степень окисления:
Ca(HPO3)
триоксофосфат(III)
кальция-водорода
40.
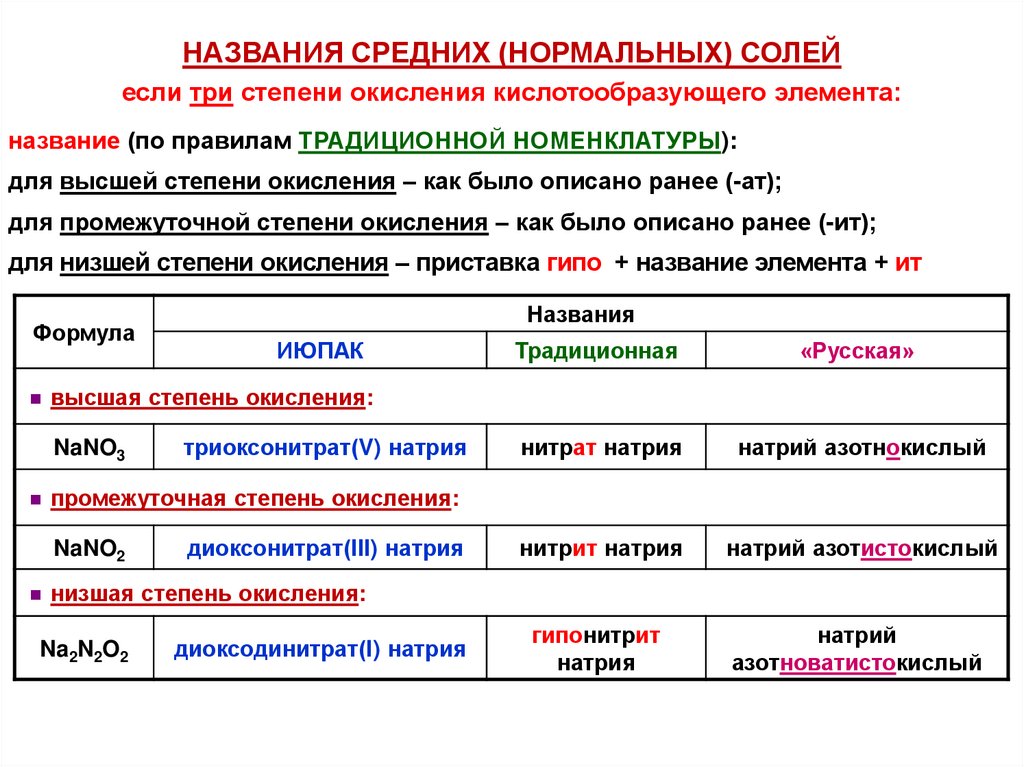
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙесли три степени окисления кислотообразующего элемента:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
для высшей степени окисления – как было описано ранее (-ат);
для промежуточной степени окисления – как было описано ранее (-ит);
для низшей степени окисления – приставка гипо + название элемента + ит
Формула
Названия
ИЮПАК
Традиционная
«Русская»
нитрат натрия
натрий азотнокислый
нитрит натрия
натрий азотистокислый
гипонитрит
натрия
натрий
азотноватистокислый
высшая степень окисления:
NaNO3
триоксонитрат(V) натрия
промежуточная степень окисления:
NaNO2
диоксонитрат(III) натрия
низшая степень окисления:
Na2N2O2
диоксодинитрат(I) натрия
41.
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙесли четыре степени окисления кислотообразующего элемента:
название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
кислотные остатки
пер…ат,
…ат,
…ит,
гипо…ит
уменьшение степени окисления «центрального атома»
Формула
Названия
ИЮПАК
Традиционная
«Русская»
перхлорат натрия
натрий хлорнокислый
высшая степень окисления:
NaClO4
тетраоксохлорат(VII) натрия
промежуточная (более высокая) степень окисления:
NaClO3
триоксохлорат(V) натрия
хлорат натрия
натрий хлорноватокислый
промежуточная (более низкая) степень окисления:
NaClO2
диоксохлорат(III) натрия
хлорит натрия
натрий хлористокислый
гипохлорит натрия
натрий
хлорноватистокислый
низшая степень окисления:
NaClO
оксохлорат(I) натрия
42.
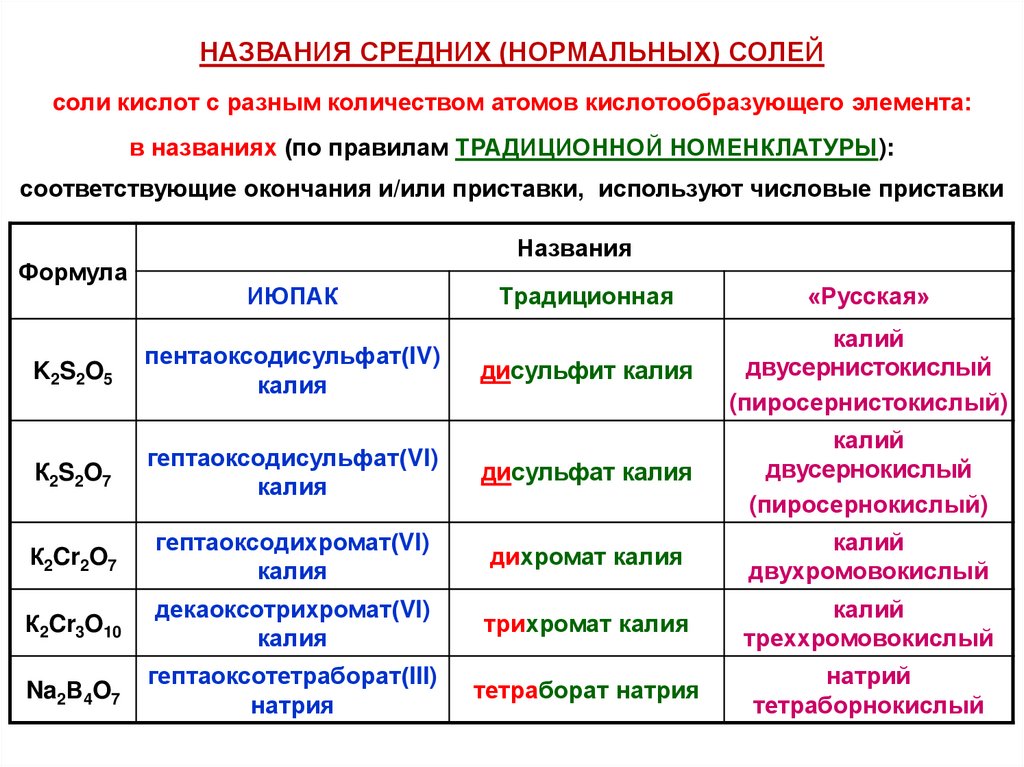
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙсоли кислот с разным количеством атомов кислотообразующего элемента:
в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
соответствующие окончания и/или приставки, используют числовые приставки
Формула
Названия
ИЮПАК
Традиционная
«Русская»
дисульфит калия
калий
двусернистокислый
(пиросернистокислый)
K2S2O5
пентаоксодисульфат(IV)
калия
К2S2O7
гептаоксодисульфат(VI)
калия
дисульфат калия
калий
двусернокислый
(пиросернокислый)
К2Cr2O7
гептаоксодихромат(VI)
калия
дихромат калия
калий
двухромовокислый
К2Cr3O10
декаоксотрихромат(VI)
калия
трихромат калия
калий
треххромовокислый
Na2В4O7
гептаоксотетраборат(III)
натрия
тетраборат натрия
натрий
тетраборнокислый
43.
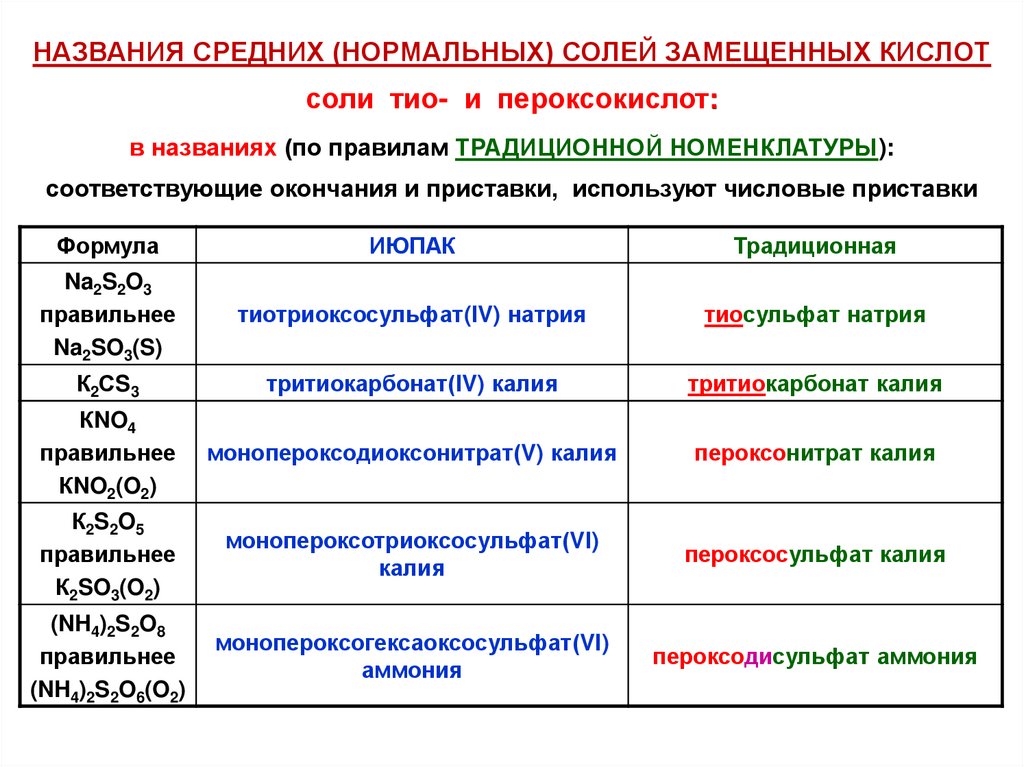
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТсоли тио- и пероксокислот:
в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
соответствующие окончания и приставки, используют числовые приставки
Формула
ИЮПАК
Традиционная
Na2S2O3
правильнее
Na2SO3(S)
тиотриоксосульфат(IV) натрия
тиосульфат натрия
К2СS3
тритиокарбонат(IV) калия
тритиокарбонат калия
КNO4
правильнее
КNO2(O2)
монопероксодиоксонитрат(V) калия
пероксонитрат калия
К2S2O5
правильнее
К2SO3(O2)
монопероксотриоксосульфат(VI)
калия
пероксосульфат калия
(NH4)2S2O8
правильнее
(NH4)2S2O6(O2)
монопероксогексаоксосульфат(VI)
аммония
пероксодисульфат аммония
44.
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТсоли других замещенных кислот:
в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
соответствующие окончания и приставки, используют числовые приставки
Формула
ИЮПАК
Традиционная
КSеO3F
фторотриоксоселенат(VI) калия
фтороселенат калия
КSеOF5
пентафторотриоксоселенат(VI) калия
пентафтороселенат калия
(NH4)РO2(NH2)2
диаминодиоксофосфат(V) аммония
диаминофосфат аммония
КSO3F
фторотриоксосульфат(VI) калия
фторосульфонат калия
LiSO3Cl
хлоротриоксосульфат(VI) лития
хлоросульфонат лития
NaSO3(NH2)
аминотриоксосульфат(VI) натрия
аминосульфонат натрия
K2S2O6(NH)
иминогексаоксодисульфат(VI) калия
иминодисульфонат калия
45.
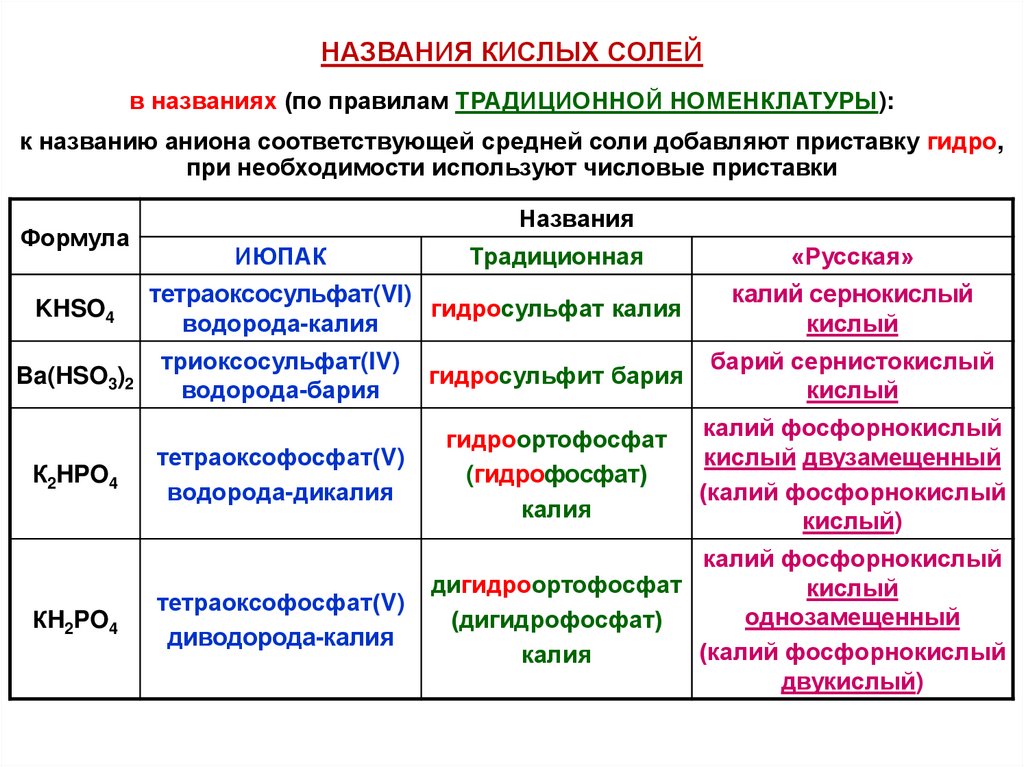
НАЗВАНИЯ КИСЛЫХ СОЛЕЙв названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
к названию аниона соответствующей средней соли добавляют приставку гидро,
при необходимости используют числовые приставки
Формула
KHSO4
Ba(HSO3)2
К2HPO4
КH2PO4
Названия
ИЮПАК
Традиционная
тетраоксосульфат(VI)
гидросульфат калия
водорода-калия
«Русская»
калий сернокислый
кислый
триоксосульфат(IV)
водорода-бария
гидросульфит бария
барий сернистокислый
кислый
тетраоксофосфат(V)
водорода-дикалия
гидроортофосфат
(гидрофосфат)
калия
калий фосфорнокислый
кислый двузамещенный
(калий фосфорнокислый
кислый)
тетраоксофосфат(V)
диводорода-калия
калий фосфорнокислый
дигидроортофосфат
кислый
однозамещенный
(дигидрофосфат)
(калий фосфорнокислый
калия
двукислый)
46.
НАЗВАНИЯ КИСЛЫХ СОЛЕЙФормула
NaH3P2O7
Na2H2P2O7
Na3HP2O7
Названия
ИЮПАК
Традиционная
«Русская»
гептаоксодифосфат(V)
триводорода-натрия
тригидродифосфат
натрия
натрий двуфосфорнокислый
кислый однозамещенный
(натрий двуфосфорнокислый
трехкислый)
гептаоксодифосфат(V)
диводорода-динатрия
дигидродифосфат
натрия
натрий двуфосфорнокислый
кислый двузамещенный
(натрий двуфосфорнокислый
двукислый)
гептаоксодифосфат(V)
водорода-тринатрия
гидродифосфат
натрия
натрий двуфосфорнокислый
кислый трехзамещенный
(натрий двуфосфорнокислый
кислый)
47.
НАЗВАНИЯ ОСНόВНЫХ СОЛЕЙв названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
к названию аниона соответствующей средней соли добавляют приставку
гидроксо, при необходимости используют числовые приставки
Формула
Названия
ИЮПАК
Традиционная
«Русская»
(FeOH)NO3
триоксонитрат(V)
гидроксожелеза(II)
гидроксонитрат
железа(II)
железо основное
азотнокислое закисное
Cu2CO3(OH)2
дигидроксидкарбонат димеди
дигидроксокарбонат
меди(II)
медь основная
углекислая окисная
Ca5(PO4)3(OH)
гидроксид
трис-(фосфат)
пентакальция
гидроксотрис(ортофосфат)
кальция
кальций основный
фосфорнокислый
если в названии уже есть приставка или необходимо избежать
двусмысленности, применяют умножающие приставки
(для сложносоставных группировок):
бис- два;
трис- три;
тетракис- четыре;
пентакис- пять
и
т.д.
48.
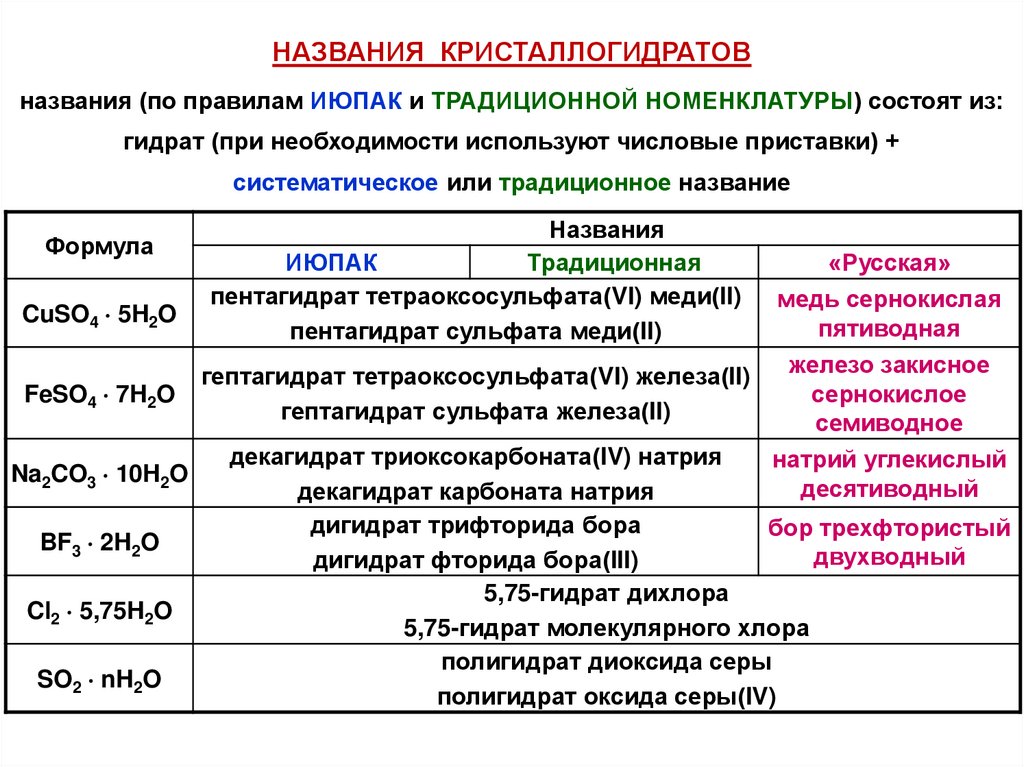
НАЗВАНИЯ КРИСТАЛЛОГИДРАТОВназвания (по правилам ИЮПАК и ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ) состоят из:
гидрат (при необходимости используют числовые приставки) +
систематическое или традиционное название
Формула
Названия
ИЮПАК
Традиционная
пентагидрат тетраоксосульфата(VI) меди(II)
пентагидрат сульфата меди(II)
«Русская»
медь сернокислая
CuSO4 5H2O
пятиводная
железо закисное
гептагидрат тетраоксосульфата(VI) железа(II)
FeSO4 7H2O
сернокислое
гептагидрат сульфата железа(II)
семиводное
декагидрат триоксокарбоната(IV) натрия
натрий углекислый
Na2CO3 10H2O
десятиводный
декагидрат карбоната натрия
дигидрат трифторида бора
бор трехфтористый
BF3 2H2O
двухводный
дигидрат фторида бора(III)
5,75-гидрат дихлора
Cl2 5,75H2O
5,75-гидрат молекулярного хлора
полигидрат диоксида серы
SO2 nH2O
полигидрат оксида серы(IV)
49.
КВАСЦЫ и ШЁНИТЫквасцы: двойные сульфаты с общей формулой MI MIII (SO4)2 · 12H2O
MI = Na+, K+, Rb+, Cs+, Tl+, NH4+;
MIII = Al3+, Ga3+, In3+, Tl3+, Ti3+, V3+, Cr3+, Mn3+, Fe3+, Co3+, Rh3+, Ir3+.
шёниты: двойные сульфаты с общей формулой M2I MII (SO4)2 · 6H2O
MI = K+, Rb+, Cs+, Tl+, NH4+;
MIII = Mg2+, V2+, Cr2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+.
НЕКОТОРЫЕ ПРИМЕРЫ
Формула
Название (по традиционной номенклатуре)
KAl(SO4)2·12H2O
додекагидрат сульфата алюминия-калия
(алюмокалиевые квасцы)
Rb2Zn(SO4)2·6H2O
гексагидрат сульфата цинка-рубидия
(NH4)Fe(SO4)2·12H2O
гексагидрат сульфата железа(III)-аммония
(железоаммонийные квасцы)
(NH4)2Fe(SO4)2·6H2O
гексагидрат сульфата железа(II)-аммония
50.
ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯНЕКОТОРЫЕ ПРИМЕРЫ
(знание этих названий НЕ ОБЯЗАТЕЛЬНО)
Формула
Название (по традиционной номенклатуре)
СОЕДИНЕНИЯ ГАЛОГЕНОВ
NaCl
поваренная соль, каменная соль, галит
KCl·NaCl
сильвинит
KCl·MgCl2·6H2O
карналлит
CaF2
плавиковый шпат, флюорит
51.
ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯНЕКОТОРЫЕ ПРИМЕРЫ
(знание этих названий НЕ ОБЯЗАТЕЛЬНО)
Формула
Название (по традиционной номенклатуре)
СОЕДИНЕНИЯ СЕРЫ
FeS2
железный колчедан, пирит
CuFeS2
медный колчедан, халькопирит
ZnS
цинковая обманка, вюрцит или сфалерит
CaSO4.0,5H2O
алебастр
CaSO4.2H2O
гипс
Na2SO4·10H2O
глауберова соль, мирабилит
(NH4)2Fe(SO4)2·6H2O
соль Мора
52.
ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯНЕКОТОРЫЕ ПРИМЕРЫ
(знание этих названий НЕ ОБЯЗАТЕЛЬНО)
Формула
Название (по традиционной номенклатуре)
СОЕДИНЕНИЯ АЗОТА
NaNO3
чилийская селитра
KNO3
индийская селитра
NH4NO3
аммиачная селитра, аммонийная селитра
Ca(NO3)2
норвежская селитра
NH4Cl
нашатырь
NH3 водн.
нашатырный спирт
N2O
веселящий газ
NO2
бурый газ, "лисий хвост"






































 Химия
Химия








