Похожие презентации:
Химическая кинетика и химическое равновесие
1. Химическая кинетика и химическое равновесие
12.
Химическаякинетика
- учение о скорости
химических реакций и зависимости ее от различных факторов природы и концентрации реагирующих веществ, давления,
температуры, катализаторов.
2
3.
Скорость реакции - изменение концентрации реагирующихвеществ в единицу времени .
Средняя скорость:
C
Vср
t
Моль/л·сек
За промежуток времени Δt = t2 - t1 концентрация
реагирующих веществ уменьшается на - ΔС = С1 - С2
3
4.
Мгновенная ( истинная ) скоростьреакции
в данный момент принято выражать отношением бесконечно
малого изменения концентрации dC к бесконечно малому
отрезку времени dt, в течение которого произошло изменение
концентрации:
dC
v
dt
Моль/л·сек
4
5.
Классификация химических реакций1.Молекулярность:
Мономолекулярные - в элементарном акте взаимодействия
участвует одна молекула
I2 2I
226
222
4
Ra
Rn
He
88
86
2
Бимолекулярные
- в элементарном акте взаимодействия
встречаются две молекулы.
H 2 I2 2HI
5
6.
Тримолекулярные –в элементарном акте взаимодействия участвуют
три молекулы.
2NO O2 2NO 2
Одновременная встреча в элементарном акте
трех молекул случается довольно редко.
6
7.
Классификация химических реакций по механизмуПоследовательные - идущие через
несколько различных промежуточных
стадий
(А В С D ...)
фотосинтез
биологическое окисление глюкозы
Сопряженные - идущие через общую
промежуточную стадию:
- окисление углеводов и липидов вызывает синтез
аденозинфосфорной кислоты (С), которая индуцирует
биосинтез белков и нуклеиновых кислот
7
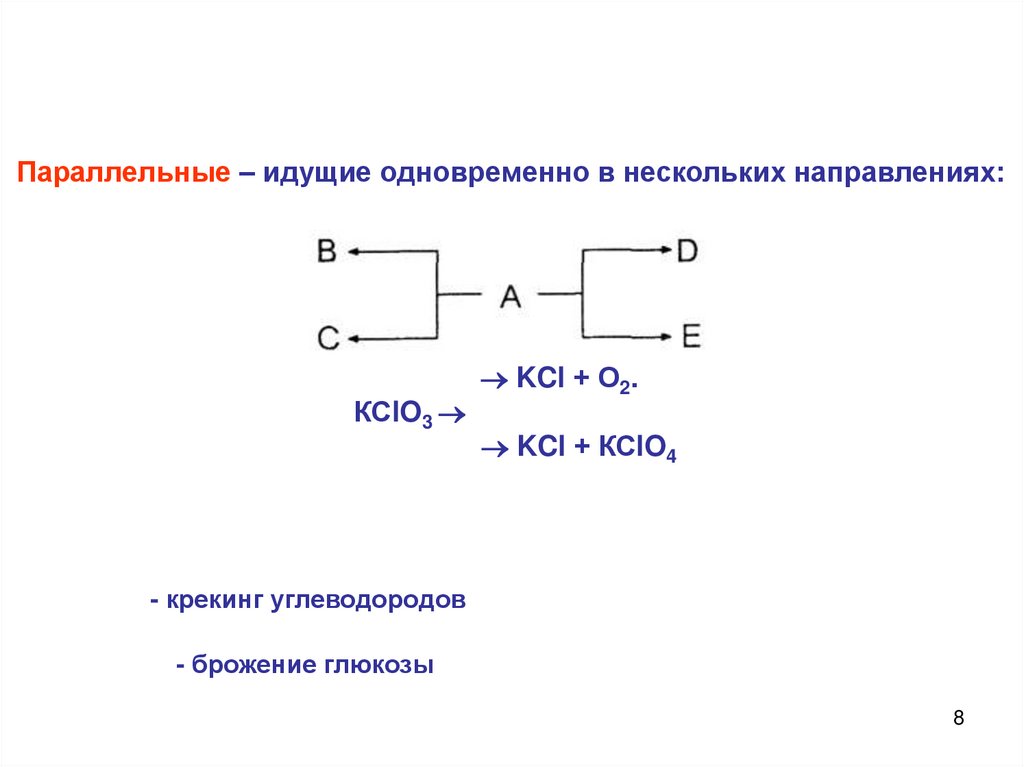
8.
Параллельные – идущие одновременно в нескольких направлениях:КСlO3
KCl + О2.
KCl + КСlO4
- крекинг углеводородов
- брожение глюкозы
8
9.
Цепные - стадии превращенияисходных соединений в продукты
многократно повторяются:
Cl2 Cl Cl
Cl H 2 HCl H
H Cl2 HCl Cl
Cl Cl Cl2 (обрыв цепи)
H H H 2 (обрыв цепи)
9
10.
2. Порядок реакцииПорядок реакции - сумма показателей
степеней, с которыми концентрации
реагентов входят в экспериментально
найденное кинетическое уравнение
n1A n 2B n 3C n 4 D
n = n1 + n2
10
11.
Если скорости стадий сопоставимы,реакции может быть дробным.
n=0
n=1
порядок
сложной
n=2
11
12.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬГОМОГЕННЫХ РЕАКЦИЙ
природа реагирующих веществ
концентрация реагентов
температура
катализатор
12
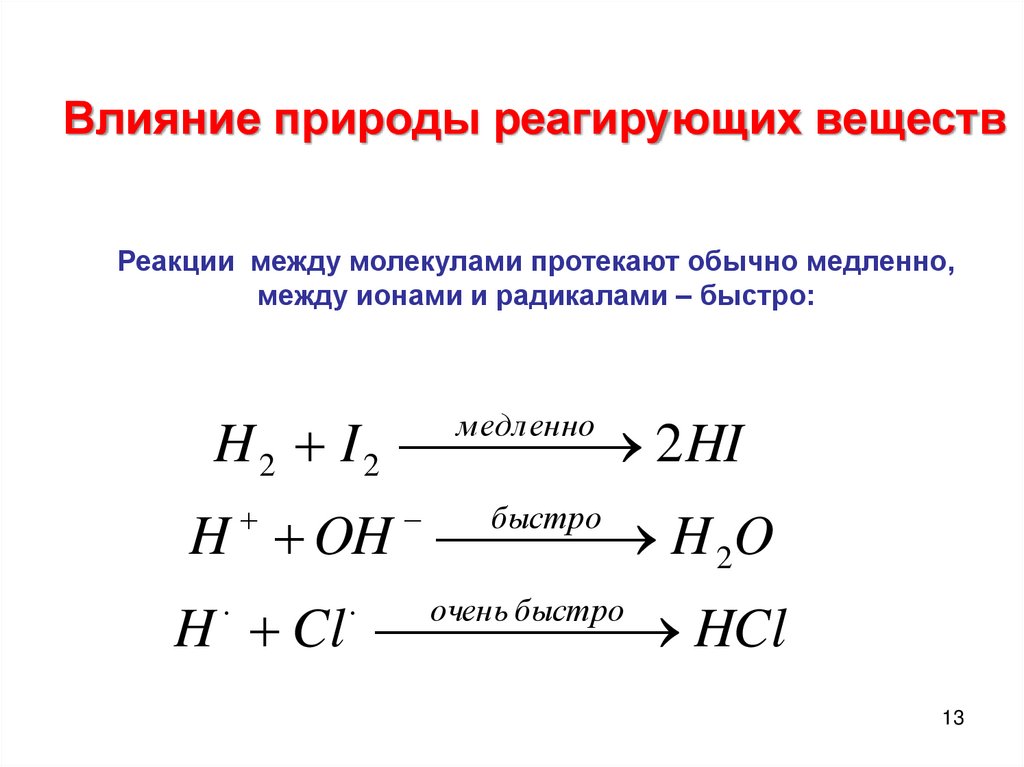
13.
Влияние природы реагирующих веществРеакции между молекулами протекают обычно медленно,
между ионами и радикалами – быстро:
H 2 I 2
2 HI
м едленно
H OH H 2O
быстро
H Cl
HCl
очень быстро
13
14.
Влияние концентрацииреагентов
Чем выше концентрация, тем больше
скорость реакции, что связано с
увеличением
числа
эффективных
соударений молекул.
14
15.
Закон действия масс(ЗДМ)
Скорость гомогенной реакции при постоянной температуре
пропорциональна
произведению
молярных
концентраций
реагирующих веществ, возведенных в степени, численно равные
их стехиометрическим коэффициентам.
aA bB dD fF
v k[A] [B]
a
b
k - константа скорости
химической реакции
15
16.
v k[A] [B]a
b
k - константа скорости химической
реакции
(удельная скорость реакции) численно
равна скорости химической реакции
при концентрациях всех реагирующих
веществ, равных 1 моль/л .
Она зависит от:
природы реагирующих веществ
температуры
катализатора
k не зависит от концентрации реагирующих веществ!
16
17.
Концентрации твердых веществ в гетерогенныхсистемах не входят в выражение константы химического
равновесия, так как они учитываются величинами
константы скорости гетерогенной реакции:
CaCO3 (тв)
СaO(тв) CO2 (г)
v k
- реакция нулевого порядка
v k[CO2 ]
- реакция первого порядка
17
18.
Закон Вант-ГоффаПри повышении температуры на 10°
скорость химической реакции возрастает в двачетыре раза.
v 2 v1 ·
T2 T1
10
Температурный коэффициент
изменяется от 2 до 4.
Для биохимических реакций = 7-9.
Если повысить температуру на 100°, то
скорость реакции увеличится в 1024 раза:
v 2 v1 · 2 1024
10
18
19.
Уравнение АррениусаK Аo ·e
E
RT
E — энергия активации
К — константа скорости
реакции при обычных условиях
Ао — число эффективных
столкновений за 1 сек в единице
объема
19
20.
Графический способ нахождения Ea и Ao из уравнения АррениусаK Аo ·e
E
RT
E
ln K ln А o
RT
B lnАo
E
tgα
R
Математический способ нахождения Ea из уравнения Аррениуса
Ea 1 1
k2
ln
k1
R T2 T1
20
21.
Влияние катализатораКатализаторы - вещества, увеличивающие
скорость химических реакций
Ингибиторы - вещества, замедляющие скорость
химических реакций
Положительный катализатор ускоряет
реакцию, отрицательный замедляет ее.
21
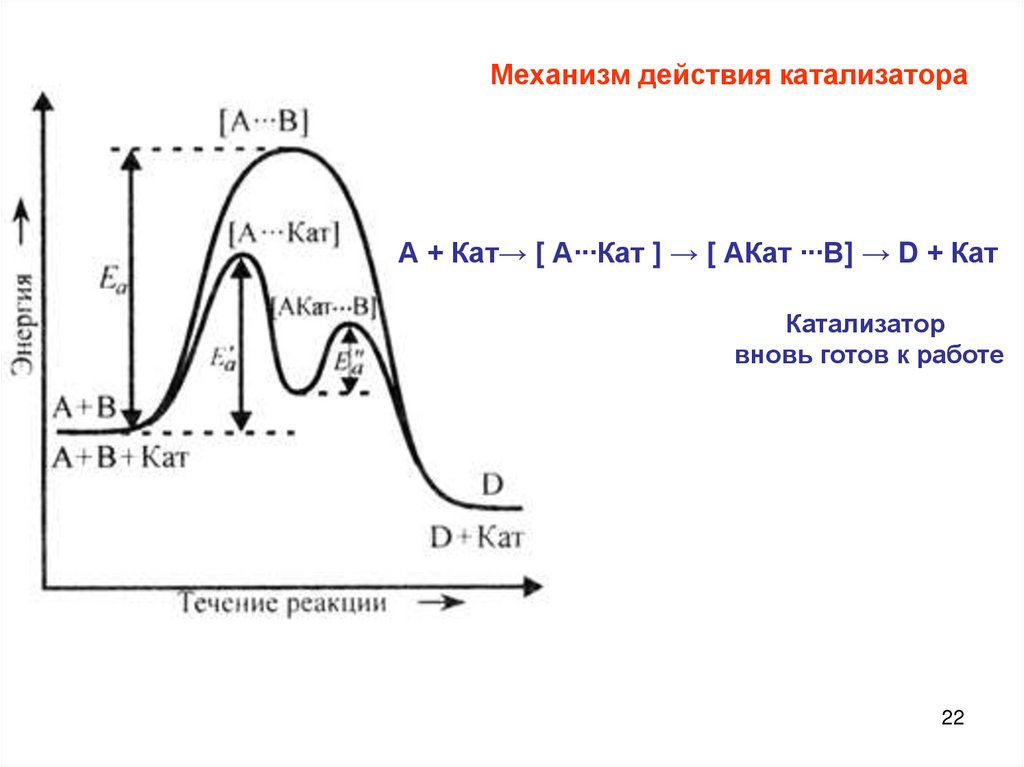
22.
Механизм действия катализатораА + Кат→ [ А∙∙∙Кат ] → [ АКат ∙∙∙В] → D + Кат
Катализатор
вновь готов к работе
22
23.
Ферментативный катализФерменты (энзимы) –
белковые молекулы, которые катализируют химические
реакции в живых системах
Отличия от химического катализа
1. Высокая каталитическая активность, в миллионы раз
превосходящая активность химических катализаторов:
1 г пепсина расщепляет 50 кг яичного белка
1 г кристаллического ренина свертывает 72 т молока
1 г пероксидазы проявляет активность при разбавлении в
500 000 кг
воды.
23
24.
2. Высокая химическая специфичность.Каждый из ферментов действует лишь на строго определенную
реакцию или группу реакций, протекающих в организме:
уреаза
- катализирует только гидролиз мочевины
пепсин
- расщепляет только белки
каталаза
- действует только на перекись водорода
24
25.
Влияние кислотности среды25
26.
Влияние температуры на скорость ферментативных реакций26
27.
Влияние концентрации фермента на скорость реакцийСхема ферментативного процесса
E S
k1
k2
ES
E P
k3
Е – фермент (энзим)
S – субстрат
ES – фермент-субстратный комплекс
P – продукт реакции
k1 , k2 , k3 – константы скоростей
реакций
27
28.
Уравнение Михаэлиса и МентенVmax ·[S ]
V
K m [S ]
Кm - константа Михаэлиса
- численно равна концентрации субстрата, при которой скорость
реакции составляет половину от максимальной
k2 k3
Km
k1
Кm- зависит от рН, температуры и природы субстрата.
28
29.
Vmax ·[S]V
K m [S]
Vmax
При [ S ] = Кm V
2
Vmax ·[S]
При [ S ]<< Кm V
Km
При [ S ] >> Кm
V0 Vmax
Vmax соответствует концентрации субстрата, когда активные центры
всех молекул фермента насыщены молекулами субстрата. 29
30.
Физический смысл константы МихаэлисаКонстанта Михаэлиса – Кm характеризует сродство фермента к
субстрату!
Высокое сродство достигается, когда k1>>k2, при этом
Кm – минимальна, а скорость реакции наибольшая.
Сравнивая значения Кm, можно определить, какой тип молекул
наиболее прочно связывается с ферментом.
30
31.
Значение ферментативных реакцийПрименение
препаратов;
ферментов
в
качестве
лекарственных
Разработка методов диагностики с помощью ферментов;
Производство антибиотиков;
Синтез окси- и аминокислот, гидролиз крахмала;
Изготовление
кисломолочных
продуктов,
сыра,
алкогольных напитков, обработка фруктов и овощей;
31
32.
Химическое равновесие32
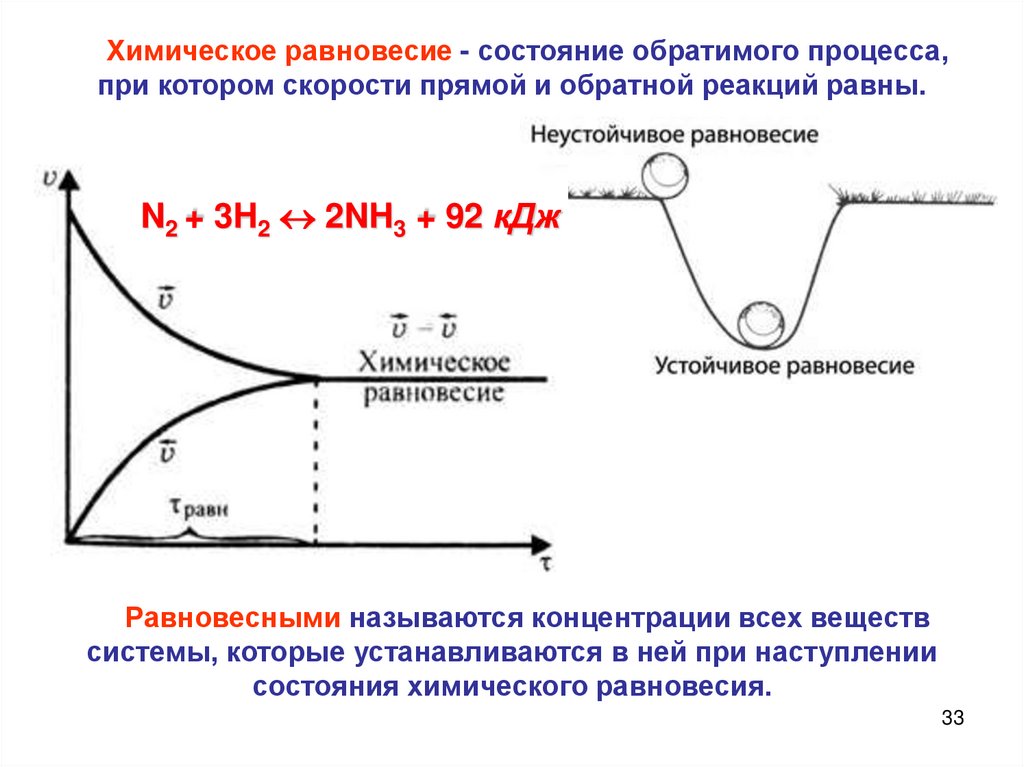
33.
Химическое равновесие - состояние обратимого процесса,при котором скорости прямой и обратной реакций равны.
N2 + 3H2 2NH3 + 92 кДж
Равновесными называются концентрации всех веществ
системы, которые устанавливаются в ней при наступлении
состояния химического равновесия.
33
34.
Вывод константы химического равновесияaA bB dD fF
В состоянии химического равновесия:
v v
a b d f
k[A] [B] k[D] [F]
d
f
k [D] [F]
K равн
a
b
k [A] [B]
34
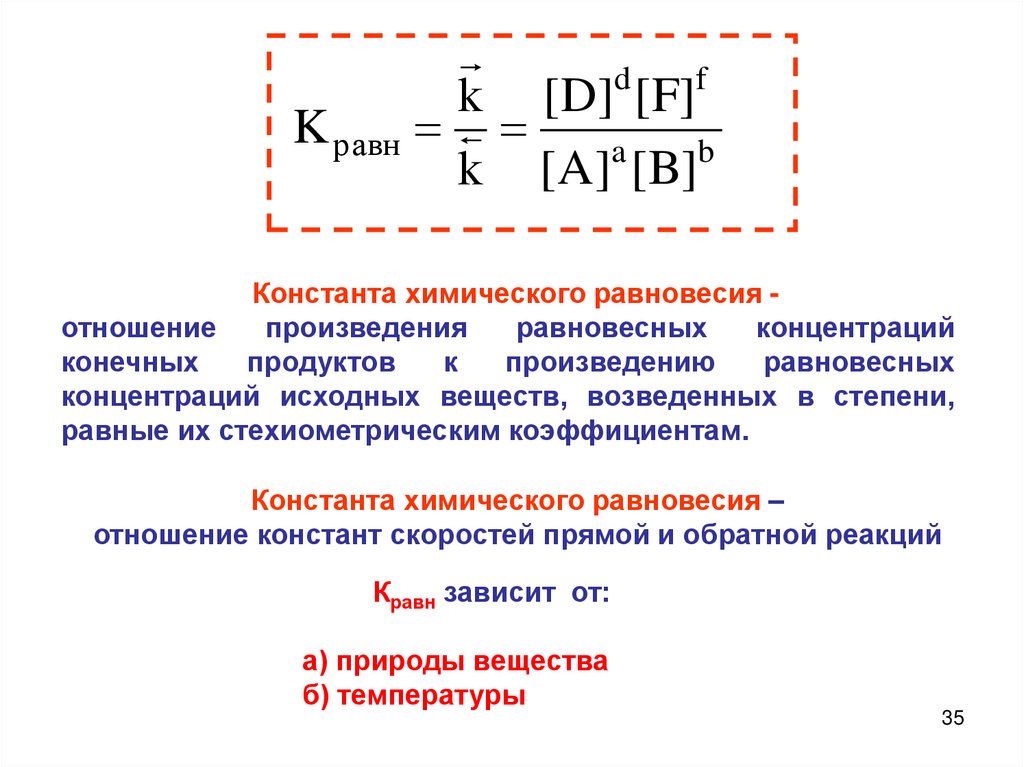
35.
df
k [D] [F]
K равн
a
b
k [A] [B]
Константа химического равновесия отношение
произведения
равновесных
концентраций
конечных
продуктов
к
произведению
равновесных
концентраций исходных веществ, возведенных в степени,
равные их стехиометрическим коэффициентам.
Константа химического равновесия –
отношение констант скоростей прямой и обратной реакций
Кравн зависит от:
а) природы вещества
б) температуры
35
36.
Смещение химического равновесия.Принцип Ле Шателье
Если на систему, находящуюся
в состоянии равновесия
оказывается внешнее воздействие, равновесие смещается в
таком направлении, чтобы свести к минимуму влияние этого
воздействия.
36
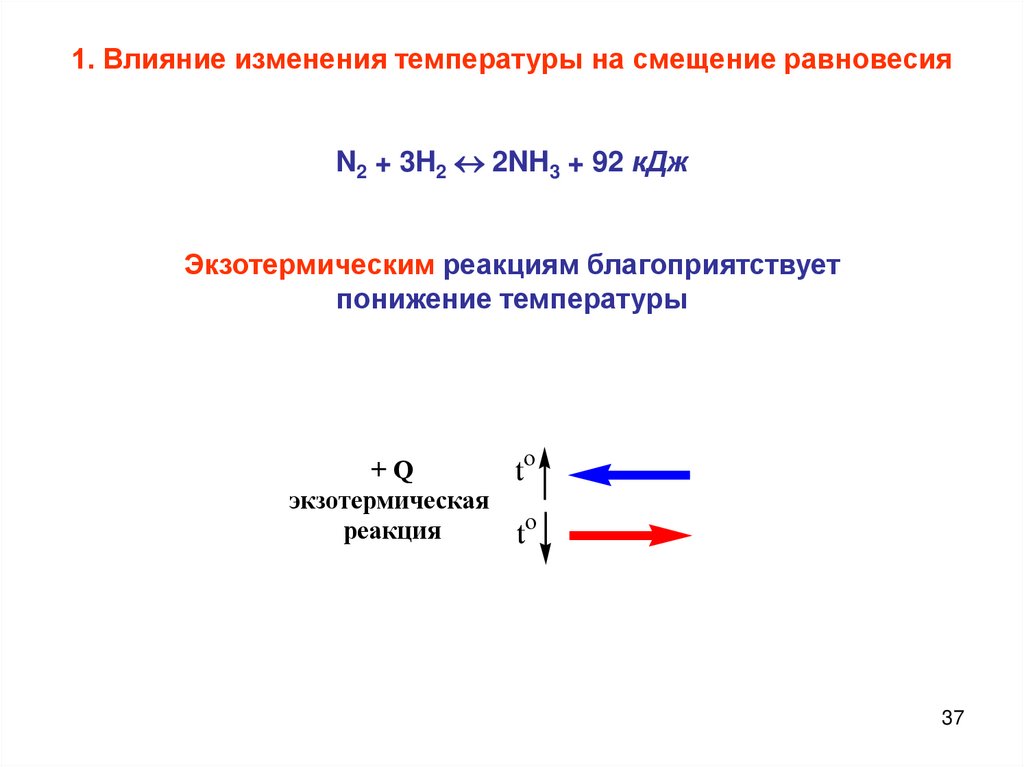
37.
1. Влияние изменения температуры на смещение равновесияN2 + 3H2 2NH3 + 92 кДж
Экзотермическим реакциям благоприятствует
понижение температуры
+Q
экзотермическая
реакция
to
to
37
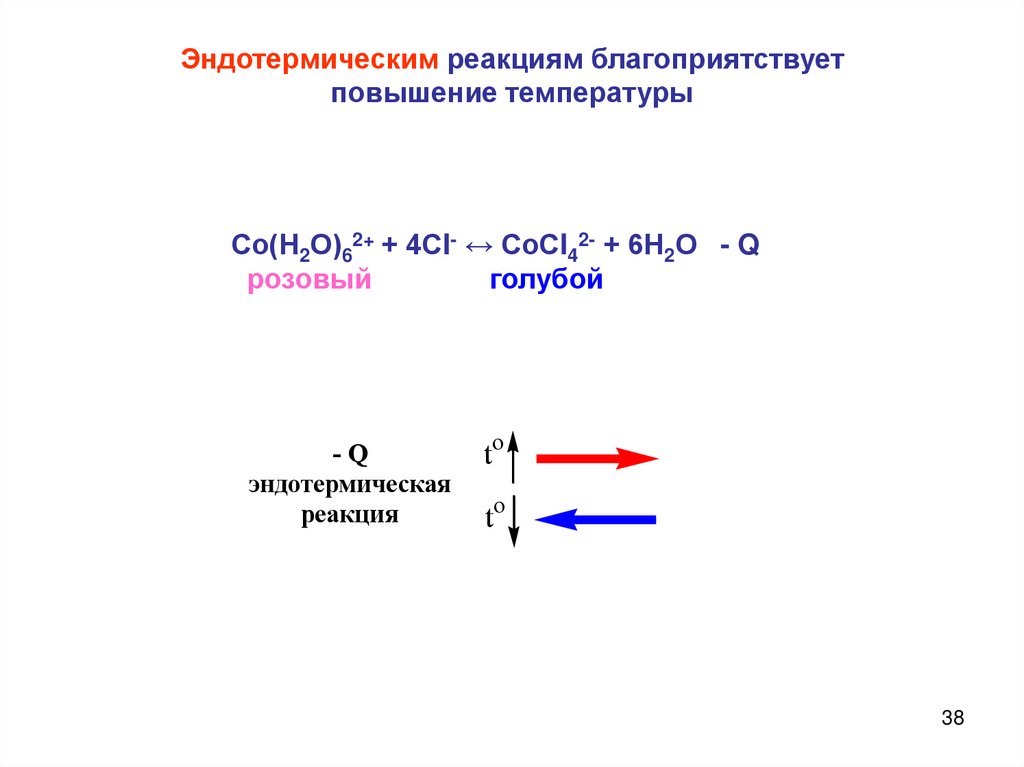
38.
Эндотермическим реакциям благоприятствуетповышение температуры
Со(Н2О)62+ + 4СI- ↔ СоСI42- + 6Н2О - Q
розовый
голубой
-Q
эндотермическая
реакция
to
to
38
39.
2. Влияние изменения концентрации.2СО + О2 2СО2
C исх
C конечн
C исх
C конечн
39
40.
3. Влияние изменения давления.N2+3H2 2NH3
Влияние давления для равновесных газовых реакций
определяется числом моль до и после реакции :
P
n исх > n прод
P
nпрод > n исх
P
n кон=n исх - не влияет
P
40
41.
4. Влияние кислотности среды на примере гидролиза:NH 4 H 2O
NH 4OH H
: OH
: H
+
H
кислая среда
+HCl
+NaOH
OH
-
щелочная среда
+HCl
+NaOH
41



































 Химия
Химия








