Похожие презентации:
Химическая кинетика
1. Химическая кинетика
Скоростьхимических реакций.
Химическое
равновесие
2. Основные понятия
Кинетика– наука о скоростях
и механизмах процессов
Химическая кинетика
изучает скорости и механизмы
химических реакций
3. Скорость химической реакции
Под скоростью химической реакциипонимается число элементарных
актов взаимодействия реагентов в
единицу времени (сек., мин., час) в
единице объема (мл, литр, м3) для
гомогенных реакций или на единице
поверхности для гетерогенных
реакций.
4. Скорость химической реакции
На практике скорость химическойреакции выражается изменением
концентрации реагентов или продуктов
в единицу времени.
aA + bB = cC + dD
-DC A
-DC B DCC DC D
V=
==
=
=
Dt
Dt
Dt
Dt
5.
6.
7.
8. Классификация химических реакций
а) Гомогенные- реакции в которыхреагенты находятся в одном агрегатном
состоянии
2SOО
2( газ) +
SO
Þ2
2( газ)
3( газ )
б) Гетерогенные- реакции в которых
реагенты находятся в различных агрегатных
состояниях.
Fe2OН
+
3
3(тв)
Fe
Þ
3
Н
О
+
3
2(газ)
(тв)
2 (газ)
9. Влияние концентраций реагирующих веществ на скорость реакций
ВЛИЯНИЕ КОНЦЕНТРАЦИЙРЕАГИРУЮЩИХ ВЕЩЕСТВ
В
НА СКОРОСТЬ РЕАКЦИЙ
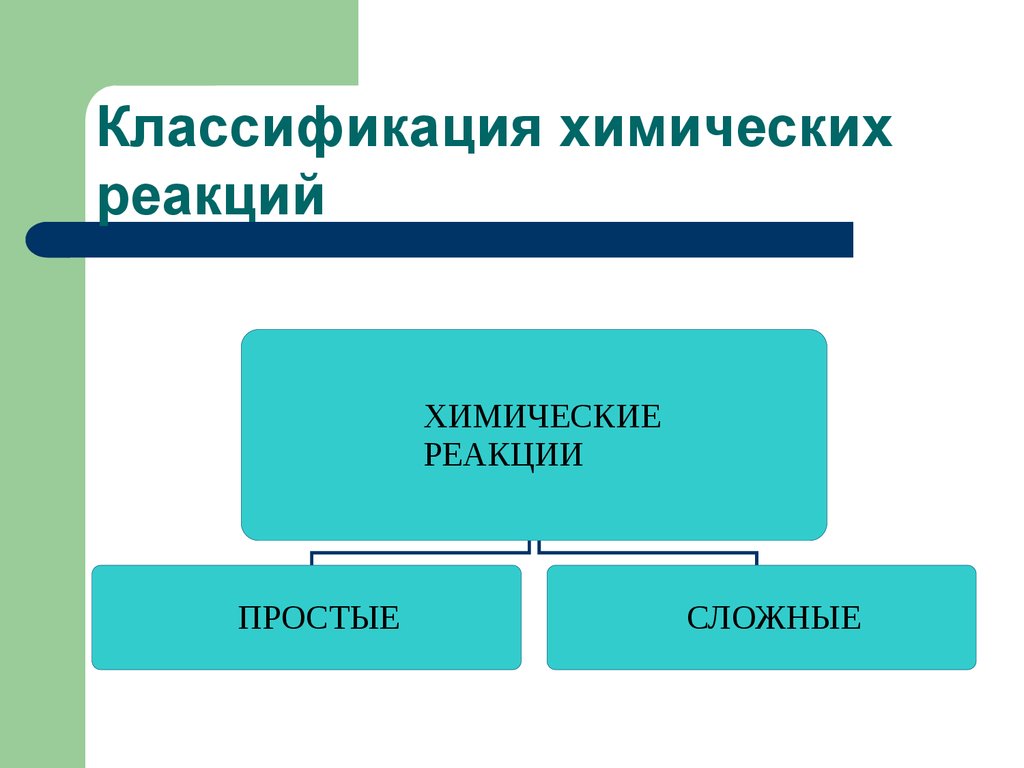
10. Классификация химических реакций
ХИМИЧЕСКИЕРЕАКЦИИ
ПРОСТЫЕ
СЛОЖНЫЕ
11. Простые химические реакции
Простая или элементарная реакцияпротекает в одну стадию, без
образования промежуточных веществ.
Простые реакции делятся на:
мономолекулярные
бимолекулярные
трехмолекулярные
12.
13. Мономолекулярная реакция
– в элементарном актеучаствует одна молекула
(разложение)
СаСО3 СаО + СО2
14. Бимолекулярная реакция
- в элементарном актеучаствуют 2 молекулы
(столкновение двух молекул)
H 2 + I 2 2 HI
2 HI H 2 + I 2
15. Трехмолекулярная реакция
в элементарном акте участвуют тримолекулы, вероятность их
столкновения мала
2NO + Cl2 2NOCl
16. Сложные реакции
Сложные реакции протекают внесколько стадий с образованием
промежуточных продуктов. Сложные
реакции бывают:
последовательные
параллельные реакции
цепные реакции
17. Последовательные реакции
C H 4 + 4 C l2 = C C l4 + 4 H C lи ли
C H 4 + C l2 = C H 3C l + H C l
C H 3 C l + C l 2 = CН 2C l 2 + H C l
C H 2 C l 2 + C l 2 = C H C l3 + H C l
C H C l3 + C l 2 = C C l 4 + H C l
18. Параллельные реакции
Me + HNO3Me(NO3 )n +
+[ NH4 NO3 , N2 , NO, NO2 ] + H2O
19. Цепные реакции
H2 +Cl2 = 2HClCl2 + hv= 2Cl
Cl +H2 = HCl+ H
H +Cl2 = HCl+Cl
20. Закон действующих масс (Гульдберг и Вааге)
Скорость химической реакциипропорциональна концентрации
реагирующих веществ.
aA + bB cC + dD
a
b
V = k CA CB
21. Где:
СА,СВ – молярные концентрации реагентов в
любой момент времени моль/л,
k – константа скорости химической реакции,
a,
b – стехиометрические коэффициенты,
а – порядок реакции по веществу А,
b – порядок реакции по веществу В,
а + b –общий кинетический порядок реакции.
Общий порядок простой реакции совпадает с ее
молекулярностью.
22. ПРИМЕР:
N2O + H 2 N2 + H 2Oпо N2O первый порядок,
по Н2 первый порядок, суммарный - второй.
Для простой реакции общий порядок равен
сумме частных порядков.
V = k C N 2O C H 2
23. Порядок реакции
Если реакция сложная, то происходитряд промежуточных превращений и
порядок реакции равен порядку
реакции лимитирующей стадии.
В сложных реакциях порядок реакции не
совпадает с ее молекулярностью.
Молекулярность - это число
одновременно сталкивающихся
молекул.
24. ПРИМЕР:
Реакция образования воды, сложнаяцепная реакция:
2Н2 + О2 = 2Н2О
Н2 + О2 = ОН• + ОН
ОН• + Н2 = Н2О + Н
Н• + О2= ОН• + О
О• + Н = ОН• + Н
25. ПРИМЕР:
V =k0,4
CH
2
0 ,3
CO
2
порядок по водороду - 0,4
порядок по кислороду – 0,3
сумма равна 0,7
порядок реакции не совпадает со
стехиометрическими коэффициентами.
Молекулярность равна трем.
26. Графическое определение порядка реакции в координатах (C; t)
Если построить зависимостьв координатах концентрация
от времени, то можно
определить как порядок
реакции, так и константу.
27. Графическое определение порядка реакции
а) n=0б) n=1
в) n>1
28. Влияние температуры на скорость химической реакции
Чем выше температура, тем большескорость химической реакции.
Почему?
При повышении температуры
увеличивается скорость движения
молекул, возрастает число
столкновений между ними и,
соответственно этому доля
активных молекул.
29. Влияние температуры на скорость химической реакции
Осуществить синтез воды2Н2 + О2 = 2Н2О,
при t = 20оС - практически осуществить
невозможно. Чтобы реакция прошла на
15% потребуется 54 миллиарда лет.
При t = 500оС - необходимо всего 50
минут.
При t = 700оС - реакция происходит
мгновенно.
30. Влияние температуры на скорость химической реакции
Правило Вант-Гоффа:При
увеличении температуры
на каждые 100 скорость
химической реакции
увеличивается в 2-4 раза.
31. Температурный коэффициент
V2=g
V1
Где
T2 -T1
10
Т2 > Т 1
γ – температурный
коэффициент ВантГоффа, показывает
во сколько раз
возросла скорость
химической
реакции.
32. Пример:
Во сколько раз увеличитсяскорость химической
реакции при повышении Т от
200 до 500 ºС, если
температурный
коэффициент γ= 2?
33. Решение:
V2=g
V1
T2 - T1
10
V2
=g
V1
T2 - T1
10
=2
500 - 200
10
=2
30
34. Пример:
При 100 ºС реакция идетза 16 минут , сколько
времени надо при 140 ºС,
температурный
коэффициент равен 2?
35. Решение:
V2= g
V1
T 2 - T1
10
V2
= g
V1
T 2 - T1
10
= 2
1 4 0 -1 0 0
10
= 24 = 16
DС
DС
V1 =
;V 2 =
;
16
Х
V2
DС DС
DС 16
16
=
:
=
=
= 1 6;
VХ1
1 6Х
С DХ
Х = 1м ин.
36. Теория активации
Увеличение скорости реакции сповышением температуры значительно
больше, чем увеличение скорости
движения молекул.
Разъясняет действие другой причины
увеличения скорости реакции с
повышением температуры теория
активации.
37. Теория активации
Во взаимодействие вступают толькоактивные молекулы, энергия которых
превышает среднюю энергию молекул
данного вещества. Для активации
остальных молекул им необходимо
придать дополнительную энергию, что и
может быть достигнуто повышением
температуры.
38. Энергия активации
Энергия, которую надо придать молекуламреагирующих веществ, для того, чтобы
сделать их активными, называется энергией
активации Еа. Она зависит от природы
реагирующих веществ и является
характеристикой любой реакции и обычно
выражается в кДж/моль.
Чем больше энергия активации, тем меньше
активных молекул при данной температуре и
тем медленнее идет реакция.
39. Важно!
Энергияактивации
характеристика реакции в целом,
а не для вещества.
Энергия активации - это
наименьшая энергия необходимая
для того, чтобы молекула
прореагировала.
40.
Реакция начинается только между теми частицами,которые обладают повышенной энергией. Такие
частицы при столкновении сначала образуют
активированный комплекс - промежуточное
соединение, существующее в течение очень короткого
времени. Затем активированный комплекс
разрушается с образованием продуктов реакции.
Образование активированного комплекса более
энергетически выгодно, чем предварительный полный
распад молекул, вступающих в реакцию.
41. Образование активированного комплекса
А2 + В2 = 2АВ42. Пример: Н2 + J2 = 2HJ
Электронные облака не дают взаимодействоватьмолекулам, избыточная энергия нужна для разрыва
связей и атомы взаимодействуют:
1. Н2 → 2H
E=434 кДж/моль - атомизация
2. J2 → 2J
E=100 кДж/моль
3. Н + J → НJ
E= 530 ÷ 550 кДж/моль - теоретическая, а
экспериментальная энергия активации – 198 кДж/моль.
Почему такая разница? Как идет этот процесс?
Атомизация на самом деле не идет. Молекулы
образуют промежуточные активированные комплексы
Н2 + J2 → H2……J2 → 2HJ
Для обратимых реакций активированный комплекс
одинаков для прямой и обратной реакции.
43. Образование активированного комплекса
44. Образование активированного комплекса
В активированном комплексепроисходит перераспределение
электронной плотности между
атомами: связи А-В начинают
образовываться одновременно с
разрывом связей А-А и В-В.
Активированный комплекс
существует очень короткое время
(порядка 10-13сек).
45. Распределение молекул газа по кинетической энергии (Т2 > Т1) 1 - Т1, 2 - Т2.
Распределение молекул газа покинетической энергии (Т2 > Т1)
1 - Т1, 2 - Т2.
46. Уравнение Аррениуса
k = A e- Ea
RT
К – константа скорости реакции,
е – основание натурального логарифма,
Т – температура, в К,
R – молярная газовая постоянная 8,31 Дж/моль*К
Еа – энергия активации, Дж/моль,
А – предэкспоненциальный множитель, показывает общее число
столкновений.
47.
Из уравнения Аррениуса видно, чтопоскольку Т входит в показатель
степени, скорость химической реакции
очень чувствительна к изменению
температуры. Например, при
повышении температуры на 100оС
скорость реакци
H2(г) + I2(г) = 2HI (г)
возрастает примерно в 1000 раз.
48. Графический метод определения энергии активации
Строят график варрениусовских
координатах (ln k – 1/T)
ln k = ln A – Eа/RT
и из графика находят k и Еа
49.
Скорость химической реакции взначительной мере зависит от энергии
активации. Для подавляющего
большинства реакций она лежит в
пределах от 50 до 250 кДж/моль. Реакции
для которых Еа >150 кДж/моль при
комнатной температуре практически не
протекают.
50. Пример:
Энергия активации некоторой реакции при500 К равна 80 кДж/моль. Определить
долю активных молекул.
Решение:
e
- Ea
RT
= 2, 7
80000
8,31 500
= 2, 7
-40
» 3 10
- 18
51. Влияние давления на скорость химической реакции
Если в реакции участвуют газообразныевещества, то повышение давления равносильно
сжатию газа, т.е. увеличению его концентрации.
При увеличении концентрации газообразного
компонента скорость реакции в соответствии с
законом действующих масс возрастает.
При понижении давления газ расширяется, и его
концентрация в системе падает, это вызывает
уменьшение скорости реакции.
52.
↑ давления →↑ конц-ции
газа → ↑ v х.р.
↓ давления →
газа → ↓ v х.р.
↓ конц-ции
53. Пример: 2NOгаз + 2H2газ → N2 + 2H2O
Какизменится скорость
химической реакции при
увеличении давления в 2 раза?
Как изменится скорость
химической реакции при
уменьшении давления в 3 раза?
54. Решение: 2NOгаз + 2H2газ → N2 + 2H2O
1) V1 = k · РNO2 · РH22V2 = k · (2РNO)2 · (2РH2)2 = 16 · k · РNO2 · РH22
V2 / V1 = 16 .
Ответ: скорость реакции возрастёт в 16 раз.
2) V1 = k · РNO2 · РH22
V2 = k · (1/3 РNO)2 · (1/3 РH2)2 = 1/81 · k · РNO2 ·
РH22
V2 / V1 = 1/81.
Ответ: скорость реакции уменьшится в 81 раз.
55. КАТАЛИЗ
56. Катализ
это один из наиболеераспространенных в
химической практике
методов ускорения
химических реакций
-
57. Катализаторы
– это вещества, которые ускоряютхимические реакции за счет
участия в образовании
промежуточных соединений, в
состав продуктов они не входят и,
следовательно, в реакции не
расходуются.
58.
В присутствии катализаторавозникают другие активированные
комплексы.
Для их образования требуется
меньше энергии, чем для
образования активированных
комплексов возникающих без
катализатора.
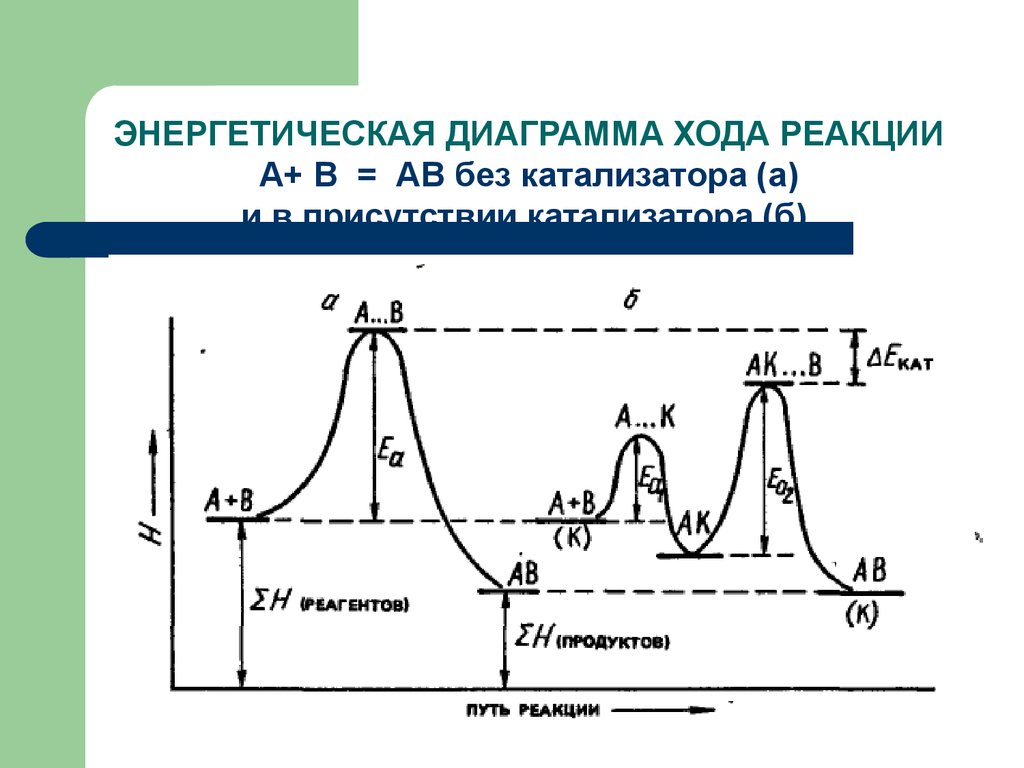
59. ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА ХОДА РЕАКЦИИ А+ В = АВ без катализатора (а) и в присутствии катализатора (б)
60.
Т.о., в присутствии
катализаторов энергия
активации реакции понижается.
Уменьшение энергии
активации приводит к
увеличению скорости реакции.
61. Пример
Платина снижает значениеЕа реакции
Н2 + J2 = 2HJ
от Еа =198 кДж/моль до
Еа =109кДж/молью
62. Пример
Влияние катализатора на снижение энергииактивации процесса Еа можно показать на следующих
данных для реакции распада иодида водорода
2 HJ = H2 + J2
Еа ,
кДж/моль
без катализатора
катализатор Au
168
105
63.
КАТАЛИЗГомогенный
катализатор
и реагент
образуют
одну фазу
Гетерогенный
катализатор
и реагент
находятся
в разных фазах
64. Пример гомогенного катализа
" нитрозный " способNO + NO 2
2 SO 2 + O 2
2 SO 3
65. Пример гомогенного катализа
H2O(г)CO(г) + О2(г)
→
CO2
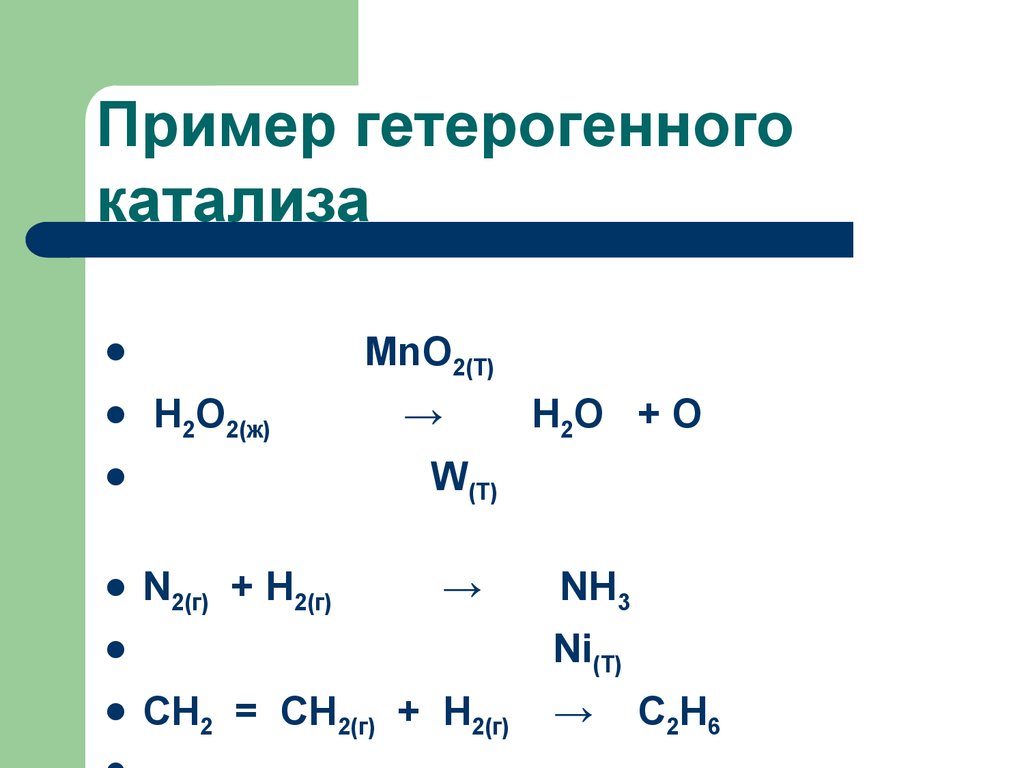
66. Пример гетерогенного катализа
" контактный " способ2 SO 2 + O2 2 SO3
V2 O5 илиPt
67. Пример гетерогенного катализа
MnO2(T)Н2О2(ж)
N2(г) + H2(г)
→
NH3
Ni(T)
Н2О + О
W(T)
→
CH2 = CH2(г) + Н2(г)
→
C2H6
68.
Эффективность гетерогенных катализаторовобычно намного больше чем гомогенных.
Скорость реакций в случае гомогенного
катализатора зависит от его концентрации, а в
случае гетерогенного - от его удельной
поверхности: чем она больше, тем больше
скорость. Потому что каталитическая реакция
идет на поверхности катализатора и включает
в себя стадии адсорбции молекул реагентов
на поверхности.
69.
Сорбция - поглощениегаза или жидкого
вещества твердым
веществом сорбентом.
70.
Различают:Адсорбция – поглощение поверхностью
Абсорбция – поглощение всем
объемом, поглощение газа жидкостью,
или твердым веществом.
На процессе сорбции основано создание
противогаза с активированным углем.
71. Пример
Выводы:1. Скорость химической реакции зависит от
температуры, концентрации реагирующих
веществ, их природы и наличия катализатора.
2. Зависимость скорости реакции от
концентрации реагирующих веществ
представляется законом действующих масс,
концентрация твердых веществ не
записывается.
3. Зависимость скорости химической реакции от
температуры выражается правилом ВантГоффа и уравнением Аррениуса.
72. Выводы:
Химическое равновесие иконстанта равновесия





































































 Химия
Химия








