Похожие презентации:
Химическая кинетика
1. Химическая кинетика
2. Химическая кинетика – раздел химии, изучающий закономерности протекания химических процессов во времени
Основное понятие химической кинетики – скоростьхимической реакции.
Химическая кинетика дает ключ к управлению процессами
3. Основные понятия химической кинетики
Химическая кинетика изучает скорости и механизмы химическихпроцессов, а также факторы, влияющие на них
Скорость реакции равна числу элементарных актов взаимодействия,
происходящих за единицу времени в единице реакционного
пространства
Элементарный акт - каждое непосредственное взаимодействие
частиц, приводящее к изменению их химического строения
Элементарная стадия химического превращения - сумма всех
однотипных элементарных актов
Механизм химической реакции - совокупность элементарных стадий,
из которых складывается данная реакция
4. Типы химических реакций
• I.
-
Элементарные реакции
(одностадийные, простые)
протекают в одну стадию:
2NO + O2 → 2NO2
Уравнение таких реакций
отражает механизм их
протекания.
В природе насчитывается 4-6
элементарных реакций.
Сложные реакции протекают в
несколько стадий:
4Fe +3O2 = 2Fe2O3
Fe → Fe2+ =2eO2 +2H2O+4e- → 4OHFe2+ +2OH- → Fe(OH)2
4Fe(OH)2+O2+2H2O →4Fe(OH)3
2Fe(OH)3 →Fe2O3+3H2O
Уравнение таких реакций
представляет собой
суммарный результат
нескольких элементарных
процессов и не отражает их
реальных механизм.
Большинство химических процессов
в природе - сложные реакции
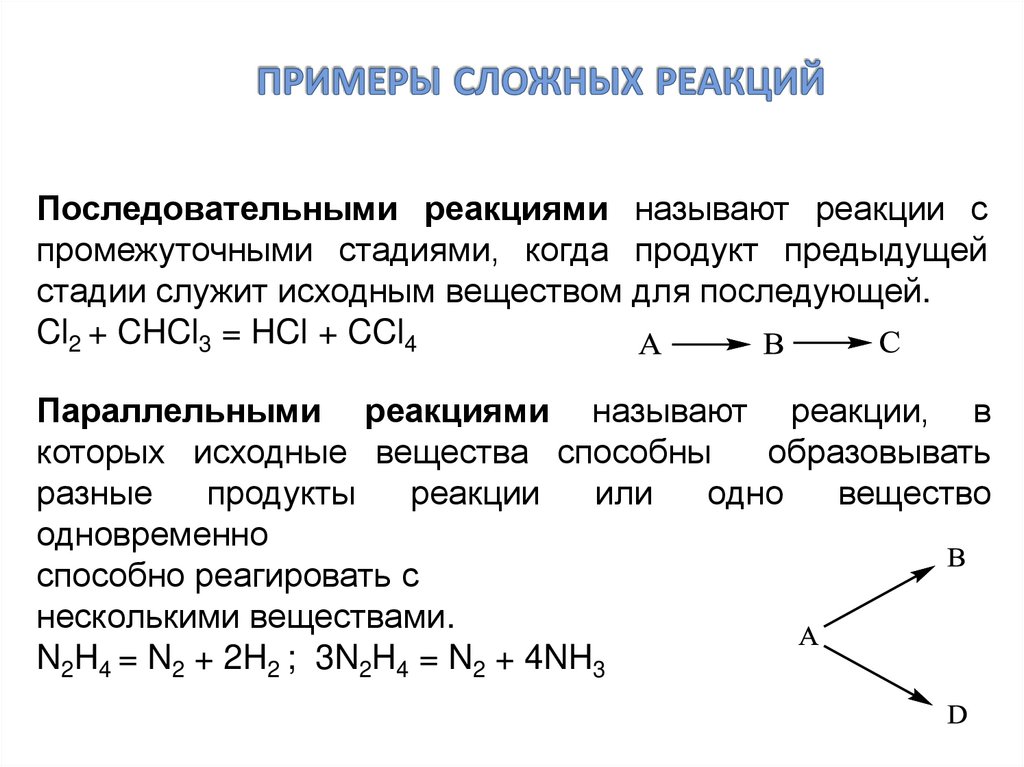
5. примеры сложных реакций
Последовательными реакциями называют реакции спромежуточными стадиями, когда продукт предыдущей
стадии служит исходным веществом для последующей.
Cl2 + CHCl3 = HCl + CCl4
Параллельными реакциями называют реакции, в
которых исходные вещества способны
образовывать
разные
продукты
реакции
или
одно
вещество
одновременно
способно реагировать с
несколькими веществами.
N2H4 = N2 + 2H2 ; 3N2H4 = N2 + 4NH3
6. II
Гомогенные реакции – протекают вобъеме одной фазы:
NaOH (раствор)+ НCl (раствор) =
= NaCl (раствор)+H2O
Гетерогенные реакции –
протекают на границе раздела
фаз:
СaH2 (тв) +2H2O(ж) →
2H2(г) + Ca(OH)2(раствор)
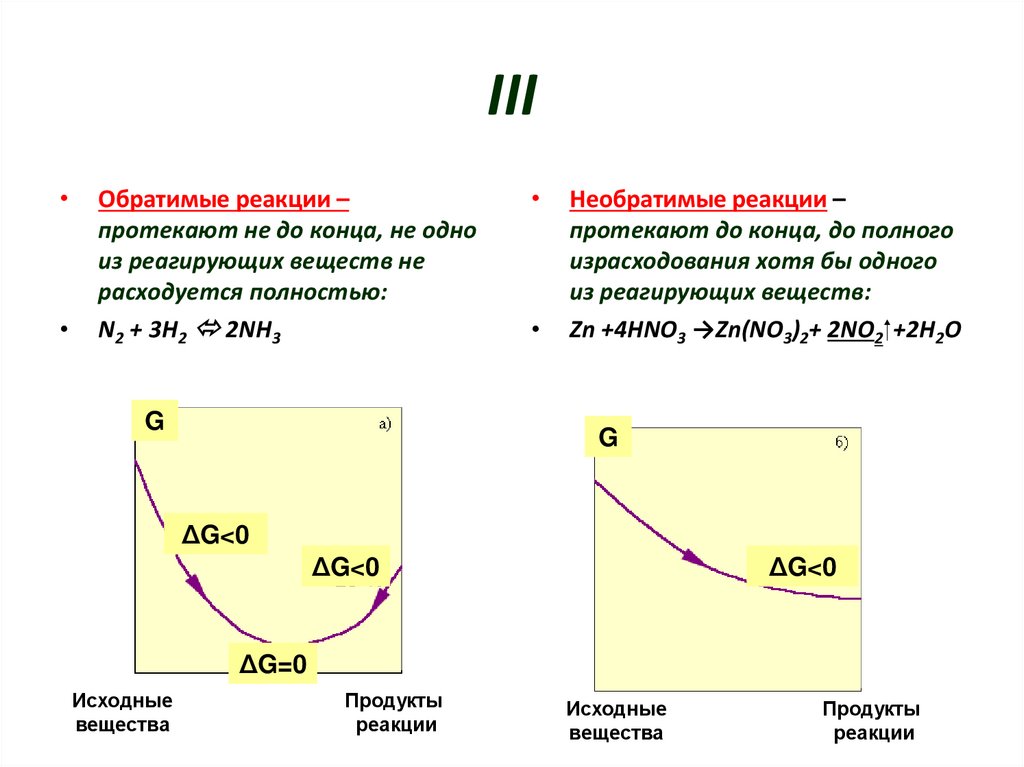
7. III
Обратимые реакции –
протекают не до конца, не одно
из реагирующих веществ не
расходуется полностью:
N2 + 3H2 2NH3
G
Необратимые реакции –
протекают до конца, до полного
израсходования хотя бы одного
из реагирующих веществ:
Zn +4HNO3 →Zn(NO3)2+ 2NO2 +2H2O
G
ΔG<0
ΔG<0
ΔG<0
ΔG=0
Исходные
вещества
Продукты
реакции
Исходные
вещества
Продукты
реакции
8. Молекулярность реакции
определяется числом молекул, одновременнымвзаимодействием между которыми осуществляется
элементарный химический акт
Мономолекулярная реакция:
N2O5 = NO + NO2 + O2
Бимолекулярная реакция:
2Н = Н2,
Тримолекулярная реакция:
Cl2 + 2NO = 2NOCl
Реакции с молекулярностью выше трех неизвестны
9. скорость химической реакции
Подскоростью
гомогенной
химической реакции ( ) понимают vгомоген
изменение количества вещества (∆n) за
единицу времени ( ) в единице объема
системы (V)
Скоростью
химической
реакции
называют
изменение
концентрации
реагирующих веществ в единицу времени.
Под
скоростью
гетерогенной
химической реакции ( ) понимают
изменение количества вещества (∆n)
за единицу времени ( ) на единице
поверхности раздела фаз (S)
n
V
с
v
n
vгетероген
S
10. Скорость реакции в гомогенных системах
ΔΔC
гом
VΔ
Δ
гом
– средняя скорость реакции в интервале
времени
, Δ моль /( л с )
Δ – изменение количества вещества, моль
V – объем системы, л
С – концентрация вещества, моль/л
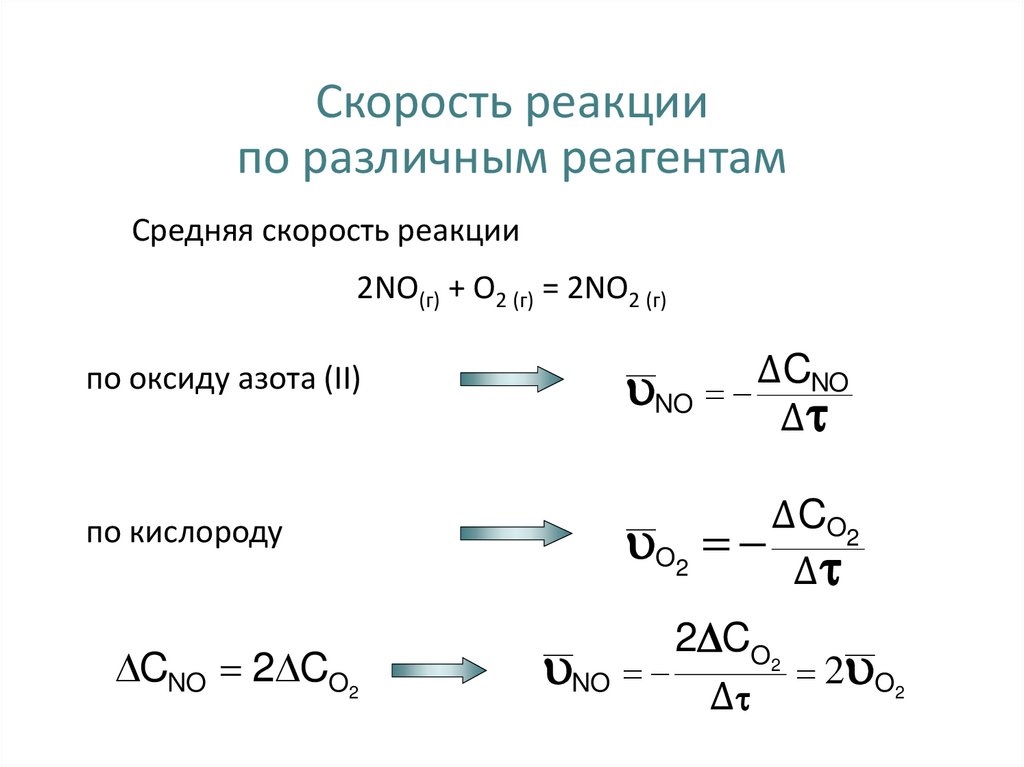
11. Cкорость реакции по различным реагентам
Средняя скорость реакции2NO(г) + O2 (г) = 2NO2 (г)
по оксиду азота (II)
Δ CNO
NO
Δ
по кислороду
Δ CO2
O2
Δ
CNO 2 CO2
2 CO2
NO
2 O2
Δ
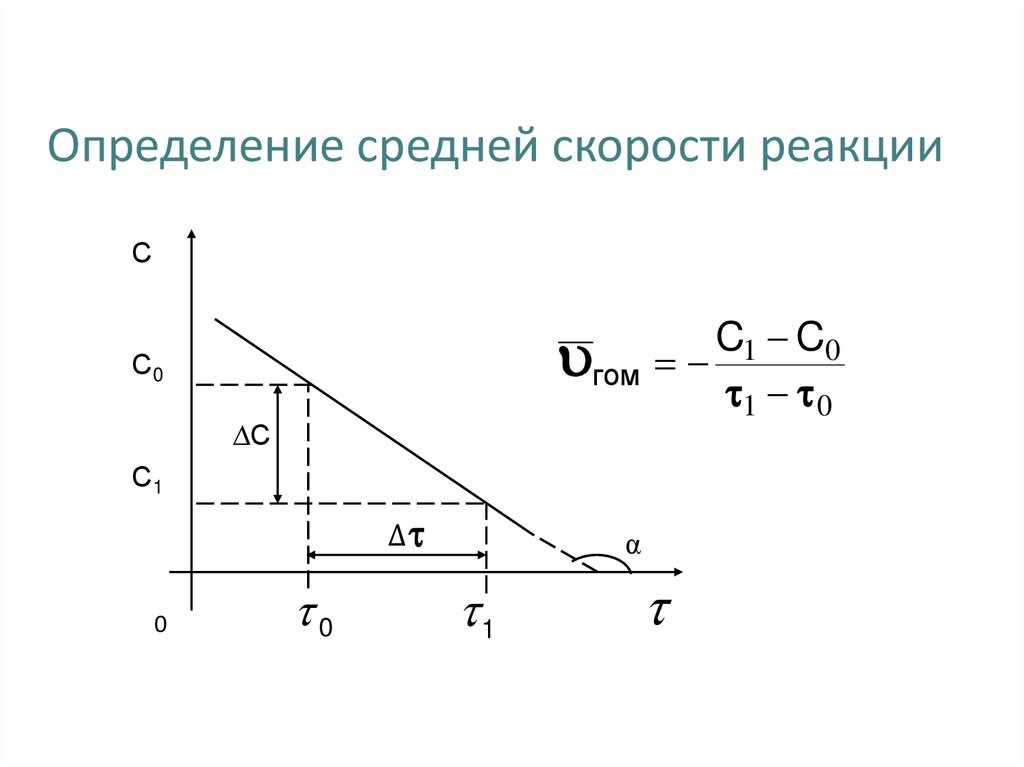
12. Определение средней скорости реакции
СC1 C0
гом
1 0
С0
∆С
С1
Δ
0
0
α
1
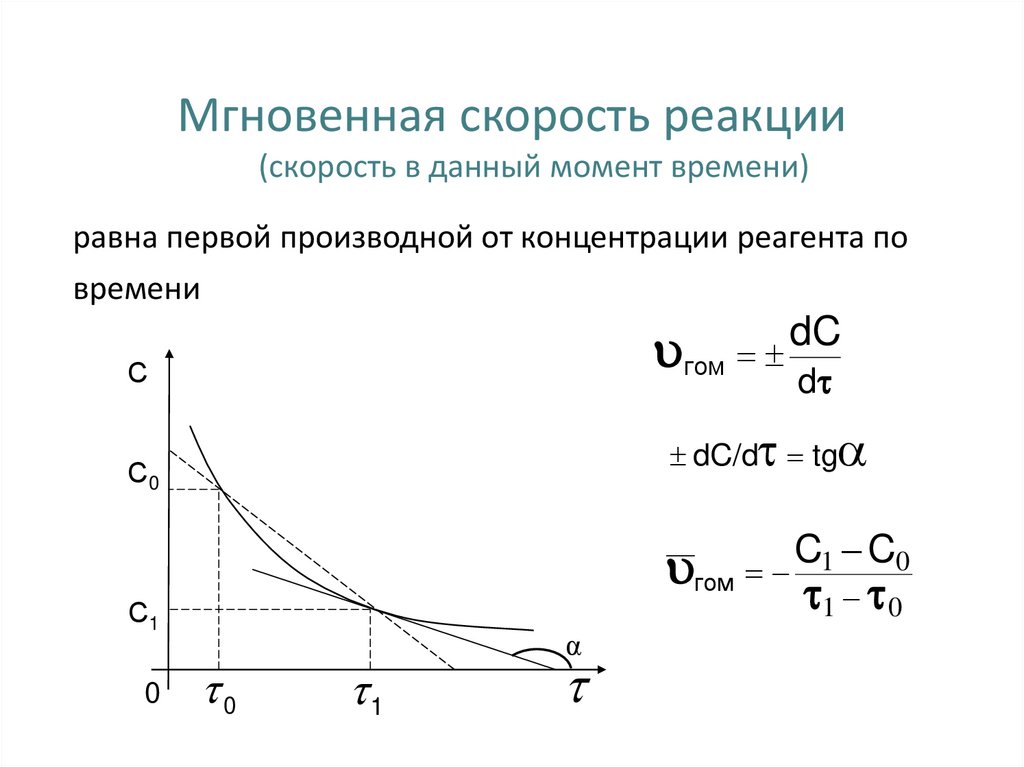
13. Мгновенная скорость реакции
(скорость в данный момент времени)равна первой производной от концентрации реагента по
времени
гом
С
dC
dC/d tg
С0
гом
С1
0
d
0
1
α
C1 C0
1 0
14. Скорость реакции в гетерогенных системах
В гетерогенной системе взаимодействие компонентовпроисходит на поверхности раздела фаз
Δ
гетер
SΔ
d 1
гетер
d S
S - площадь поверхности раздела фаз, м2
Размерность скорости реакции в гетерогенных
системах моль/(м2 с).
15.
16. Зависимость скорости от концентрации Закон действующих масс (П.Вааге, К.М.Гульдберг, 1864 г.)
Закон: Скорость химической реакции прямопропорциональна произведению концентраций реагирующих
веществ в степенях их стехиометрических коэффициентов.
aA + bB cC +dD
V=k[A]a[B]b
- кинетическое уравнение
V – скорость химической реакции,
k – константа скорости химической реакции
[A], [B] – молярные концентрации веществ А и В
соответственно
В приведенном виде закон действующих масс справедлив лишь
для гомогенных процессов
17. константа скорости реакции
k – коэффициент пропорциональности,константой скорости реакции
называемый
физический смысл
Константа скорости численно равна скорости реакции, при
концентрации реагирующих веществ равной единице
Константа скорости реакции зависит от природы
реагирующих веществ, температуры и присутствия
катализаторов, но не зависит от концентрации веществ
18. кинетические уравнения
Кинетическое уравнение – это математическоевыражение,
связывающие
скорость
реакции
с
концентрацией реагирующих веществ.
vпр k1 A B
a
b
vобр k 2 C D
c
d
Для гомогенной реакции: 3H2(г) + N2(г) = 2NH3(г)
=k [H2]3 [N2]
Для гетерогенной реакции: С(к) + O2(г) = СО2(г)
=k [O2]
19. Порядок реакции
Показатель степени при концентрациикаждого из реагирующих веществ в
кинетическом уравнении химической
реакции есть частный порядок реакции по
данному компоненту. Сумма показателей
степени в кинетическом уравнении
химической реакции представляет собой
общий порядок реакции. Порядок реакции
определяется экспериментально.
20.
21.
22.
23. Особенности гетерогенных реакций
Стадии гетерогенных реакций :подвод вещества к реакционной поверхности
химическое взаимодействие
отвод продукта реакции от поверхности
Для реакции C + O2 = CO2
лимитирующая стадия - подвод вещества
Скорость реакции CaCO3 + 2HCl = CaCl2 + H2O + CO2
определяется скоростью химического взаимодействия
I стадия:
CaCO3 + H+ = Ca2+ + HCO3-
II стадия:
kC
HCO3- + H+ = H2O + CO2
Н
I стадия лимитирующая
24. Влияние давления на скорость химической реакции
Влияние давления существенно для реакций с участиемгазообразных веществ, так как концентрация реагентов
меняется пропорционально давлению (T = const)
Пример. Реакции 2NO(г) + 2H2(г) = N2(г) + 2Н2О(г)
соответствует кинетическое уравнение
2
kCNO
CH
2
При увеличении давления в 3 раза константа скорости не
изменяется, а концентрации реагирующих веществ
увеличиваются в 3 раза
2
2 k(3CNO )2 3CH 27kCNO
CH 27 1
2
скорость увеличивается в 27 раз
2
25. Зависимость скорости от температуры Правило Вант-Гоффа
При повышении температуры на каждые 100 скоростьбольшинства реакций увеличивается в 2 4 раза:
T2 T1 (T2 -T1)/10
1 и 2 - скорость реакции при температурах
Т1 и Т2 (Т2 > Т1)
- температурный коэффициент
скорости, равный 2 4
Например, при повышении температуры с 20 до 400С
скорость реакции (γ = 2) увеличивается в 4 раза:
Т2 4010 20 2
2
2 4
Т1
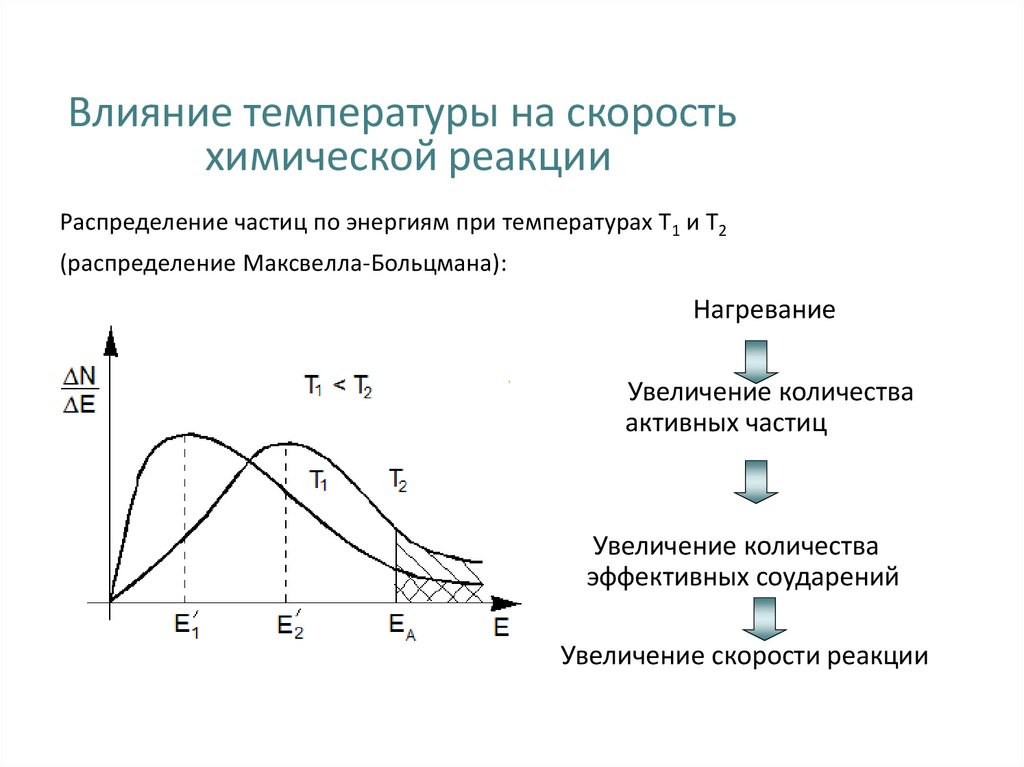
26. Влияние температуры на скорость химической реакции Распределение частиц по энергиям при температурах Т1 и Т2 (распределение
Максвелла-Больцмана):Нагревание
E Ea
Увеличение количества
активных частиц
Увеличение количества
эффективных соударений
Увеличение скорости реакции
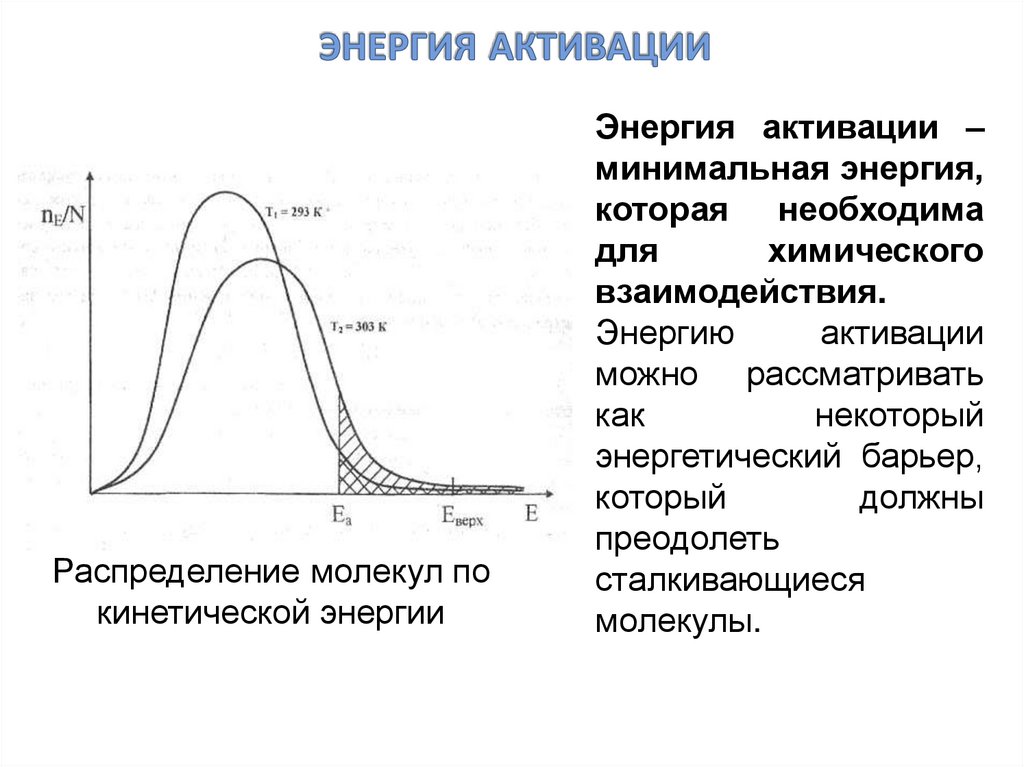
27. энергия активации
Распределение молекул покинетической энергии
Энергия активации –
минимальная энергия,
которая необходима
для
химического
взаимодействия.
Энергию
активации
можно рассматривать
как
некоторый
энергетический барьер,
который
должны
преодолеть
сталкивающиеся
молекулы.
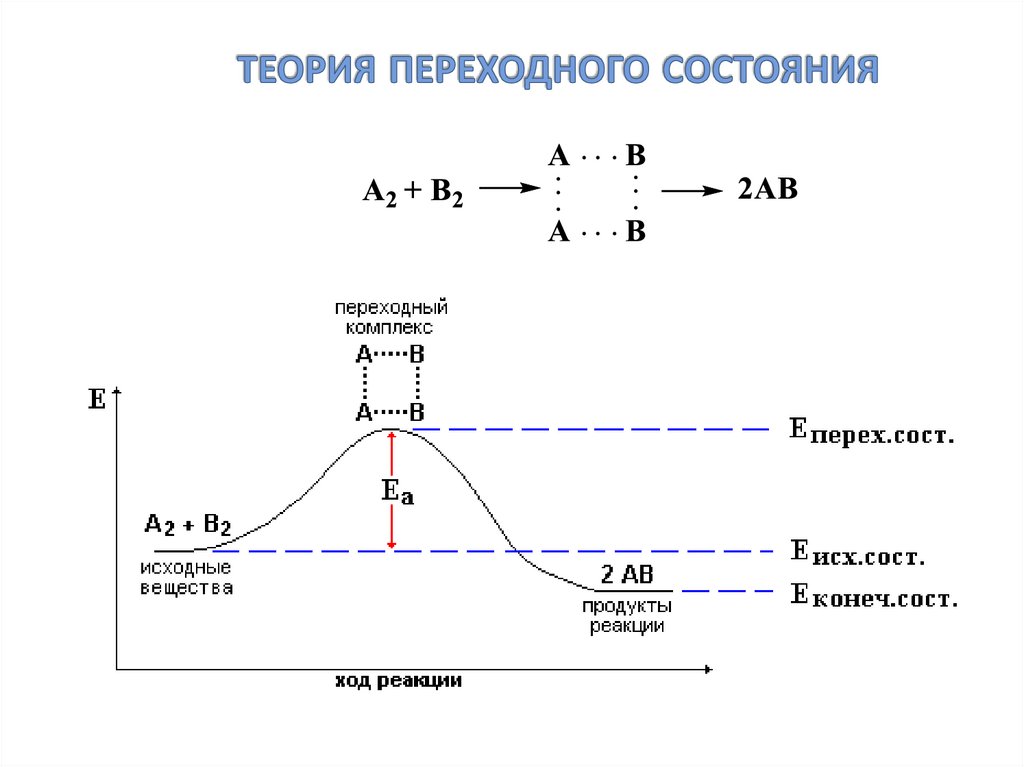
28. теория переходного состояния
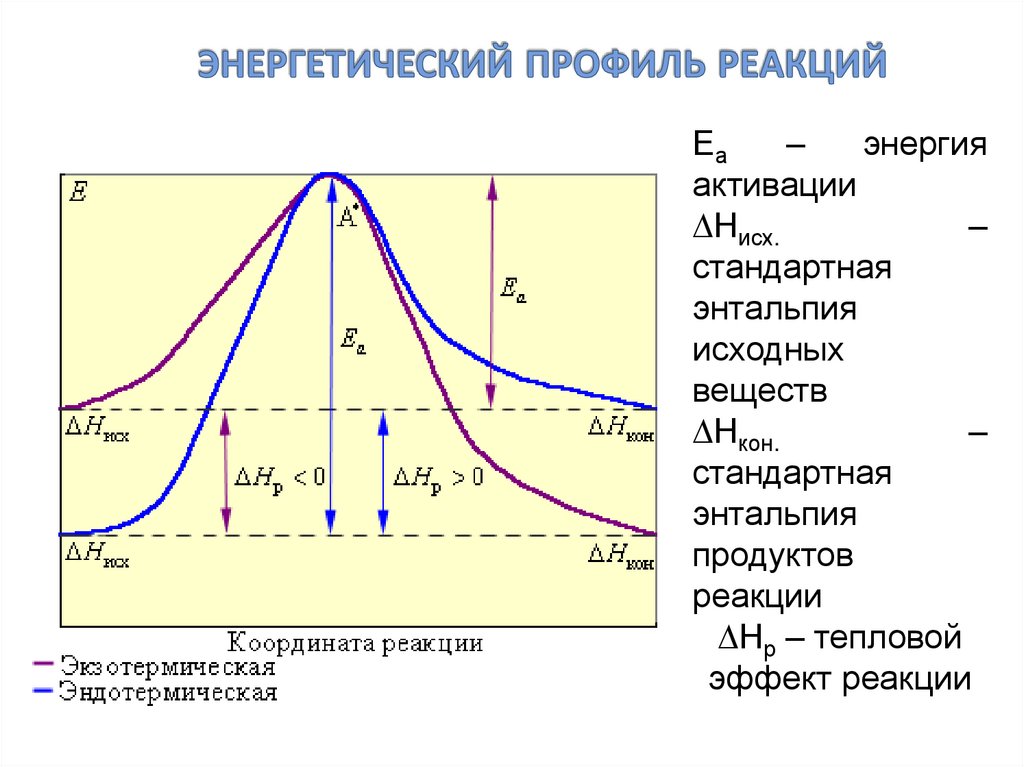
29. энергетический профиль реакций
Еа–
энергия
активации
Нисх.
–
стандартная
энтальпия
исходных
веществ
Нкон.
–
стандартная
энтальпия
продуктов
реакции
Нр – тепловой
эффект реакции
30. Зависимость константы скорости от температуры
Уравнение АррениусаE
RT
- а
k Ae
Еа - энергия активации, кДж/моль
R - универсальная газовая постоянная, равная
8,31∙10-3 кДж /(моль К )
Т - абсолютная температура, К
А - коэффициент пропорциональности, отражающий
вероятность столкновения активных частиц;
величина постоянная для данной реакции
31. катализатор
Вещества, не расходующиеся в результате протеканияреакции, но влияющие на ее скорость называются
катализаторами.
Явление изменения скорости реакции под действием
катализаторов называют катализом.
1 стадия:
2 стадия:
Механизм действия катализатора:
А + К → А … К → АК
акт. комп.
АК + В → В … АК → АВ + К
акт. комп.
В ходе реакции катализатор не расходуется
Катализатор изменяет путь реакции и тем самым влияет
на энергию активации
32. влияние катализатора на энергию активации
33.
34. Примеры катализа
Гомогенный катализI-
схема реакции:
2H2O2 2H2O+O2
1. H2O2 + I- H2O + IO2. IO- + H2O2 H2O + I- + O2
Гетерогенный катализ
Pt
CO + 1/2 O2 CO2
схема реакции:
1. CO (г) + s CO (адс.)
2. O2 (г) + s 2O(адс.)
3. CO (адс.) + O (адс.) CO2(адс.)
4. CO2(адс.) CO2(г)
Ферментативный катализ – катализатором являются
сложные белковые молекулы (энзимы)
35. Химическое равновесие
ХИМИЧЕСКОЕ РАВНОВЕСИЕ36. обратимые и необратимые реакции
Обратимые реакции - это реакции, которые при одних и техже условиях протекают в прямом и обратном направлении.
Необратимыми реакциями называются реакции, которые
протекают только в одном направлении, т.е. продукты этих
реакций не взаимодействуют друг с другом с образованием
исходных веществ.
37. химическое равновесие
Состояние обратимой реакции, при котором скоростьпрямой реакции равна скорости обратной реакции,
называется химическим равновесием.
vпр kпр A B
a
b
vобр kобр C D
c
d
kпр A B kобр C D
a
b
c
d
38.
39. константа химического равновесия
Константа химического равновесия - это отношениепроизведения равновесных концентраций продуктов
реакции к произведению равновесных концентраций
исходных веществ, при чем все вещества находятся в
степенях численно равных их стехиометрическим
коэффициентам.
c
d
C
D
kпр
p
p
Kс
a
b
kобр
A p B p
Для гомогенных реакций:
2SO2(г)+ O2(г) = 2SO3(г)
Для гетерогенных реакций:
ZnO(тв)+H2(г)=Zn(тв)+H2O(г)
2
SO3
Kс
SO2 2 O2
Kс
H 2O
H 2
40. Константы равновесия некоторых реакций
Уравнение реакцииВыражение для
константы
равновесия
Значение
константы
равновесия при
25oС
2NO N2O2
[ N 2O2 ]
Kс
[ NO]2
1,15
H2S H++HS-
[ H ][ HS ]
Kс
[H 2S ]
6 •10-8
AgI Ag++I-
Kс [ Ag ][ I ]
10 -16
41.
Анри ЛуиЛе Шателье (1884)
42. факторы, влияющие на смещение химического равновесия
1. Концентрация. При увеличении концентрацииисходных веществ химическое равновесие смещается
вправо. При увеличении концентрации продуктов – влево.
2. Давление. При увеличении давления равновесие
смещается в сторону уменьшения объёма газов. При
понижении давления – в сторону увеличения объёма
газов
3. Температура. Повышение температуры приводит к
смещению
химического
равновесия
в
сторону
эндотермической реакции. Понижение температуры – в
сторону экзотемической реакции
43. N2O4(г) 2NO2(г); Δ H = +57,2 кДж бесцвет коричнев
[ NO2 ]2Kс
[ N 2O4 ]
N2O4(г) 2NO2(г); Δ H = +57,2 кДж
бесцвет
Равновесие
[N2O4]
[NO2]
t
P
коричнев
Равновесие
нарушено
Равновесие
восстановле
но
увел
увел
→
←
повыш
повыш
→
←
t=50oC
t=0oC


































 Химия
Химия








